化学人教版(2019)必修第一册2.1.2钠的氧化物 课件(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.2钠的氧化物 课件(共26张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 26.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-07 00:00:00 | ||
图片预览








文档简介
(共26张PPT)
第二章 海水中重要的元素
——钠和氯
第一节 钠及其化合物
第2 课时 钠的氧化物
1. 了解氧化钠与过氧化钠的物理性质。
2. 对比学习氧化钠和过氧化钠的化学性质。
3. 掌握Na2O2与H2O、CO2的反应及其规律。
4. 了解Na2O2的制取及用途。
教学引入:神奇的呼吸面具
氧化钠与过氧化钠
性质对比
1
回忆上节课内容,描述氧化钠和过氧化钠的颜色、状态。
1.1
氧化钠与过氧化钠的物理性质
化学式 Na2O Na2O2
颜色
状态
氧元素化合价
阴阳离子个数比
是否为碱性氧化物
白色
淡黄色
固体
固体
-2
-1
O2-:Na+=1:2
O22-:Na+=1:2
是
否
氧化钠属于_______氧化物,具有碱性氧化物的通性。
(1)与水反应:
(2)与酸性氧化物(如CO2)反应:
(3)与酸(如HCl)反应:
Na2O+2HCl===2NaCl+H2O
碱性
Na2O+H2O===2NaOH
Na2O+CO2===Na2CO3
1.2
氧化钠的碱性氧化物通性
1.3
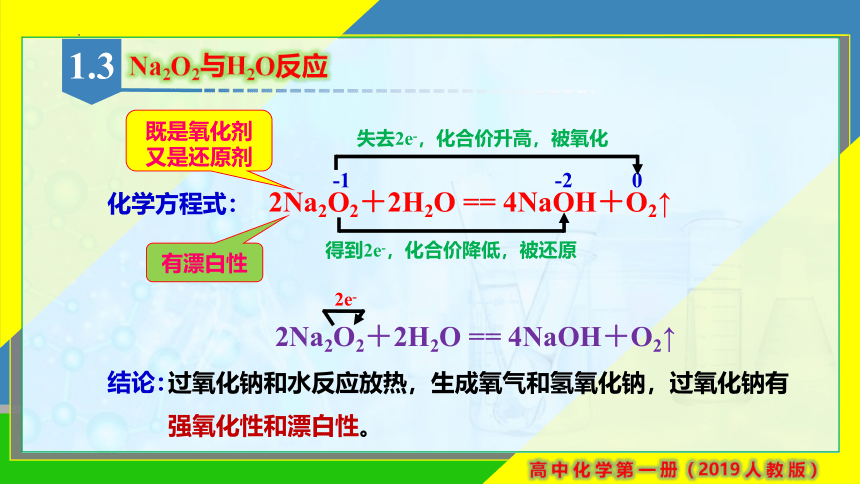
Na2O2与H2O反应
实验2-3
将1~2mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?用pH试纸检验溶液的酸碱性。
实验现象:剧烈反应,产生大量气泡,带火星的木条复燃;用手轻轻触摸试管外壁发烫;滴入无色酚酞溶液,并振荡试管,先变红后褪色。
1.3
Na2O2与H2O反应
结论:
过氧化钠和水反应放热,生成氧气和氢氧化钠,过氧化钠有强氧化性和漂白性。
2e-
2Na2O2+2H2O == 4NaOH+O2↑
-1 -2 0
化学方程式:
2Na2O2+2H2O == 4NaOH+O2↑
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂
又是还原剂
有漂白性
1.4
Na2O2与CO2反应
潜水艇中通常用过氧化钠作为供氧剂,你知道这是为什么吗?
1.4
Na2O2与CO2反应
实验
取1~2 g Na2O2于棉花上, 用棉花将Na2O2包住,将棉团放入坩埚中,用一支玻璃导管对棉团吹气,注意观察实验现象并记录。
现象:棉花燃烧
1.4
Na2O2与CO2反应
-1 -2 0
化学方程式:
2Na2O2+2CO2 == 2Na2CO3+O2
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂
又是还原剂
结论:
过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠。
用途:Na2O2可作供氧剂,在呼吸面具和潜水艇中应用。
呼吸面具
1.5
Na2O2与HCl反应
2Na2O2+4HCl == 4NaCl+2H2O+O2 ↑
Na2O2是不是碱性氧化物?为什么?
1.6
氧化钠与过氧化钠稳定性比较
氧化钠与过氧化钠稳定性谁更好?为什么?
2Na2O+O2 == 2Na2O2
Δ
过氧化钠稳定性更好
过氧化钠Na2O2 氧化钠Na2O
色 态
氧元素化合价
所属物质类别
生成条件
与水反应方程式
与CO2反应方程式
与酸反应
保存 密封、远离易燃物 密封
淡黄色固体
白色固体
-2
-1
过氧化物
碱性氧化物
2Na2O2+2H2O=4NaOH+O2↑
Na2O+H2O=2NaOH
2Na2O2+2CO2=2Na2CO3+O2
Na2O+CO2=Na2CO3
钠在空气中氧化
钠在空气中加热
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2 ↑
Na2O+HCl=NaCl+H2O
小结:氧化钠与过氧化钠的物理性质
1.用如图所示装置进行实验,证明过氧化钠(Na2O2)可在呼吸面具和潜水艇中做供氧剂。
请回答:(1)装置B的作用是______________________________。
(2)装置C中Na2O2与CO2反应的化学方程式是 。
(3)装置D中盛放的试剂是_____________________。
(4)当装置内气流平稳后开始用试管收集气体,该气体是______。
除去二氧化碳气体中的氯化氢
2Na2O2+2CO2=2Na2CO3+O2
氢氧化钠溶液
O2
课堂检测
Na2O2与H2O、CO2反应的规律
2
2.1
Na2O2与H2O、CO2反应的先后规律
Na2O2
CO2、H2O(g)
视作Na2O2先与CO2反应,待CO2完全反应后,Na2O2再与H2O(g)发生反应
先
后
2.2
Na2O2与H2O的反应的定量关系
2Na2O2 + 2H2O = 4NaOH+O2 ↑
2Na2O2
2H2O
O2
H2O
Na2O2
增重2H2
增重H2
水蒸气与足量的Na2O2反应时,
固体相当于吸收了水蒸气中的“H2”。
微点拨
2.3
Na2O2与CO2的反应的定量关系
2Na2O2 + 2CO2 = 2Na2CO3+O2
2Na2O2
2CO2
O2
CO2
Na2O2
增重2CO
增重CO
CO2与足量的Na2O2反应时,
固体相当于吸收了CO2中的“CO”。
微点拨
凡分子组成符合(CO)m (H2)n,的物质,mg该物质在O2中完全燃烧,将其产物(CO2和水蒸气)通过足量Na2O2后,固体增重必为mg。
无机化合物:H2、CO及H2和CO的混合气体。
有机化合物:CH3OH(甲醇)、HCHO(甲醛)、
CH3COOH(乙酸)、HCOOCH3(甲酸甲酯)、
C6H12O6(葡萄糖)等。
小结:增重量等于可燃物质量的规律
2.一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是( )
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH
A.全部 B.仅④⑤ C.仅①②③ D.除⑤以外
课堂检测
D
Na2O2的特殊性质
3
Na2O2+SO2 == Na2SO4
4Na2O2+4Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+
Na2O2+H2S===S↓+2NaOH
(1)Na2O2与SO2反应
(2)Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊
(3)Na2O2投入FeCl2溶液中,可将Fe2+氧化Fe3+,同时生成Fe(OH)3沉淀
(4)Na2O2能使酚酞试液先变红后褪色
3.1
Na2O2的强氧化性
漂白剂
3.2
Na2O2的还原性
Na2O2遇到KMnO4等强氧化剂时,表现出还原性,氧化产物为O2。
3.有关Na2O2性质实验如下:
已知:①Na2O2与水反应经历了Na2O2+2H2O =2NaOH+H2O2;②酚酞褪色原因与溶液的强碱性或强氧化性有关。根据上述实验可以得出的结论是:( )
A.双氧水能使酚酞褪色
B.浓氢氧化钠能使酚酞褪色
C.双氧水和浓氢氧化钠都能使酚酞褪色
D.可利用二氧化锰和水来完善实验方案
课堂检测
D
颜色状态
化合价
阴阳离子个数比
Na2O和Na2O2的物理性质
与H2O反应
与CO2反应
与盐酸反应
稳定性
Na2O和Na2O2的化学性质
与SO2反应
与H2S反应与Fe3+反应
Na2O2
的特殊性质
漂白剂
供氧剂
强氧化剂
Na2O2
的用途
钠的氧化物
课堂总结
第二章 海水中重要的元素
——钠和氯
第一节 钠及其化合物
第2 课时 钠的氧化物
1. 了解氧化钠与过氧化钠的物理性质。
2. 对比学习氧化钠和过氧化钠的化学性质。
3. 掌握Na2O2与H2O、CO2的反应及其规律。
4. 了解Na2O2的制取及用途。
教学引入:神奇的呼吸面具
氧化钠与过氧化钠
性质对比
1
回忆上节课内容,描述氧化钠和过氧化钠的颜色、状态。
1.1
氧化钠与过氧化钠的物理性质
化学式 Na2O Na2O2
颜色
状态
氧元素化合价
阴阳离子个数比
是否为碱性氧化物
白色
淡黄色
固体
固体
-2
-1
O2-:Na+=1:2
O22-:Na+=1:2
是
否
氧化钠属于_______氧化物,具有碱性氧化物的通性。
(1)与水反应:
(2)与酸性氧化物(如CO2)反应:
(3)与酸(如HCl)反应:
Na2O+2HCl===2NaCl+H2O
碱性
Na2O+H2O===2NaOH
Na2O+CO2===Na2CO3
1.2
氧化钠的碱性氧化物通性
1.3
Na2O2与H2O反应
实验2-3
将1~2mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?用pH试纸检验溶液的酸碱性。
实验现象:剧烈反应,产生大量气泡,带火星的木条复燃;用手轻轻触摸试管外壁发烫;滴入无色酚酞溶液,并振荡试管,先变红后褪色。
1.3
Na2O2与H2O反应
结论:
过氧化钠和水反应放热,生成氧气和氢氧化钠,过氧化钠有强氧化性和漂白性。
2e-
2Na2O2+2H2O == 4NaOH+O2↑
-1 -2 0
化学方程式:
2Na2O2+2H2O == 4NaOH+O2↑
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂
又是还原剂
有漂白性
1.4
Na2O2与CO2反应
潜水艇中通常用过氧化钠作为供氧剂,你知道这是为什么吗?
1.4
Na2O2与CO2反应
实验
取1~2 g Na2O2于棉花上, 用棉花将Na2O2包住,将棉团放入坩埚中,用一支玻璃导管对棉团吹气,注意观察实验现象并记录。
现象:棉花燃烧
1.4
Na2O2与CO2反应
-1 -2 0
化学方程式:
2Na2O2+2CO2 == 2Na2CO3+O2
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
既是氧化剂
又是还原剂
结论:
过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠。
用途:Na2O2可作供氧剂,在呼吸面具和潜水艇中应用。
呼吸面具
1.5
Na2O2与HCl反应
2Na2O2+4HCl == 4NaCl+2H2O+O2 ↑
Na2O2是不是碱性氧化物?为什么?
1.6
氧化钠与过氧化钠稳定性比较
氧化钠与过氧化钠稳定性谁更好?为什么?
2Na2O+O2 == 2Na2O2
Δ
过氧化钠稳定性更好
过氧化钠Na2O2 氧化钠Na2O
色 态
氧元素化合价
所属物质类别
生成条件
与水反应方程式
与CO2反应方程式
与酸反应
保存 密封、远离易燃物 密封
淡黄色固体
白色固体
-2
-1
过氧化物
碱性氧化物
2Na2O2+2H2O=4NaOH+O2↑
Na2O+H2O=2NaOH
2Na2O2+2CO2=2Na2CO3+O2
Na2O+CO2=Na2CO3
钠在空气中氧化
钠在空气中加热
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2 ↑
Na2O+HCl=NaCl+H2O
小结:氧化钠与过氧化钠的物理性质
1.用如图所示装置进行实验,证明过氧化钠(Na2O2)可在呼吸面具和潜水艇中做供氧剂。
请回答:(1)装置B的作用是______________________________。
(2)装置C中Na2O2与CO2反应的化学方程式是 。
(3)装置D中盛放的试剂是_____________________。
(4)当装置内气流平稳后开始用试管收集气体,该气体是______。
除去二氧化碳气体中的氯化氢
2Na2O2+2CO2=2Na2CO3+O2
氢氧化钠溶液
O2
课堂检测
Na2O2与H2O、CO2反应的规律
2
2.1
Na2O2与H2O、CO2反应的先后规律
Na2O2
CO2、H2O(g)
视作Na2O2先与CO2反应,待CO2完全反应后,Na2O2再与H2O(g)发生反应
先
后
2.2
Na2O2与H2O的反应的定量关系
2Na2O2 + 2H2O = 4NaOH+O2 ↑
2Na2O2
2H2O
O2
H2O
Na2O2
增重2H2
增重H2
水蒸气与足量的Na2O2反应时,
固体相当于吸收了水蒸气中的“H2”。
微点拨
2.3
Na2O2与CO2的反应的定量关系
2Na2O2 + 2CO2 = 2Na2CO3+O2
2Na2O2
2CO2
O2
CO2
Na2O2
增重2CO
增重CO
CO2与足量的Na2O2反应时,
固体相当于吸收了CO2中的“CO”。
微点拨
凡分子组成符合(CO)m (H2)n,的物质,mg该物质在O2中完全燃烧,将其产物(CO2和水蒸气)通过足量Na2O2后,固体增重必为mg。
无机化合物:H2、CO及H2和CO的混合气体。
有机化合物:CH3OH(甲醇)、HCHO(甲醛)、
CH3COOH(乙酸)、HCOOCH3(甲酸甲酯)、
C6H12O6(葡萄糖)等。
小结:增重量等于可燃物质量的规律
2.一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是( )
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH
A.全部 B.仅④⑤ C.仅①②③ D.除⑤以外
课堂检测
D
Na2O2的特殊性质
3
Na2O2+SO2 == Na2SO4
4Na2O2+4Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+
Na2O2+H2S===S↓+2NaOH
(1)Na2O2与SO2反应
(2)Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊
(3)Na2O2投入FeCl2溶液中,可将Fe2+氧化Fe3+,同时生成Fe(OH)3沉淀
(4)Na2O2能使酚酞试液先变红后褪色
3.1
Na2O2的强氧化性
漂白剂
3.2
Na2O2的还原性
Na2O2遇到KMnO4等强氧化剂时,表现出还原性,氧化产物为O2。
3.有关Na2O2性质实验如下:
已知:①Na2O2与水反应经历了Na2O2+2H2O =2NaOH+H2O2;②酚酞褪色原因与溶液的强碱性或强氧化性有关。根据上述实验可以得出的结论是:( )
A.双氧水能使酚酞褪色
B.浓氢氧化钠能使酚酞褪色
C.双氧水和浓氢氧化钠都能使酚酞褪色
D.可利用二氧化锰和水来完善实验方案
课堂检测
D
颜色状态
化合价
阴阳离子个数比
Na2O和Na2O2的物理性质
与H2O反应
与CO2反应
与盐酸反应
稳定性
Na2O和Na2O2的化学性质
与SO2反应
与H2S反应与Fe3+反应
Na2O2
的特殊性质
漂白剂
供氧剂
强氧化剂
Na2O2
的用途
钠的氧化物
课堂总结
