化学人教版(2019)必修第一册2.1.3钠盐与焰色试验 课件(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.3钠盐与焰色试验 课件(共30张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 46.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-07 00:00:00 | ||
图片预览











文档简介
(共30张PPT)
第二章 海水中重要的元素
——钠和氯
第一节 钠及其化合物
第3 课时 钠盐与焰色试验
1. 从物质类别和生活实际,归纳碳酸钠和碳酸氢钠的性质,构建两者间的转化关系。
2. 设计探究方案,鉴别和提纯碳酸钠和碳酸氢钠。
3. 了解焰色试验的本质及应用。
4. 通过学习碳酸钠和碳酸氢钠在生产生活中的应用,感受化学的魅力,发展社会参与意识。
。
教学引入:侯氏制碱法的创始人——侯德榜
Na2CO3
碳酸钠与碳酸氢钠
1
1.1
Na2CO3与NaHCO3的用途对比
纯碱
苏打、
小苏打
1.2
Na2CO3与NaHCO3的水溶性及酸碱性的实验探究
实验2-4
在两只试管中分别加入少量碳酸钠和碳酸氢钠固体(各约1g),完成实验,并将实验现象填表。
1.2
Na2CO3与NaHCO3的水溶性及酸碱性的实验探究
盐 Na2CO3 NaHCO3
(1)
(2)
(3)
(4)
初步结论 ①相同温度下,水中的溶解度:Na2CO3>NaHCO3
②水溶液碱性:Na2CO3>NaHCO3
白色粉末
白色细小晶体
全部溶解
部分溶解
溶液变得较红
溶液变得微红
加水结块成晶体,溶解放热
加水部分溶解,溶解吸热
Na2CO3+xH2O = Na2CO3·xH2O(密封保存)
1.2
Na2CO3与NaHCO3的水溶性及酸碱性的实验探究
风化
碳酸钠粉末遇水生成含有结晶水的碳酸钠晶体--水合碳酸钠( Na2CO3·xH2O)。碳酸钠晶体在干燥空气里逐渐失去结晶水变成碳酸钠粉末,这个过程称为风化。
1.3
Na2CO3与NaHCO3的稳定性对比实验
实验2-5
分别加热Na2CO3和NaHCO3固体,观察现象,比较二者稳定性。
实验操作 实验现象 化学方程式及结论
刚加热时,石灰水中有气泡,之后无气泡,澄清石灰水_____________
石灰水中有气泡,澄清石灰水 ,试管口有 ____________
Na2CO3很稳定,
受热不易发生分解
小液滴出现。
NaHCO3不稳定,
受热容易分解,化学方程式为
1.3
Na2CO3与NaHCO3的稳定性对比实验
无明显变化
变浑浊
2NaHCO3 == Na2CO3+H2O+CO2↑
Δ
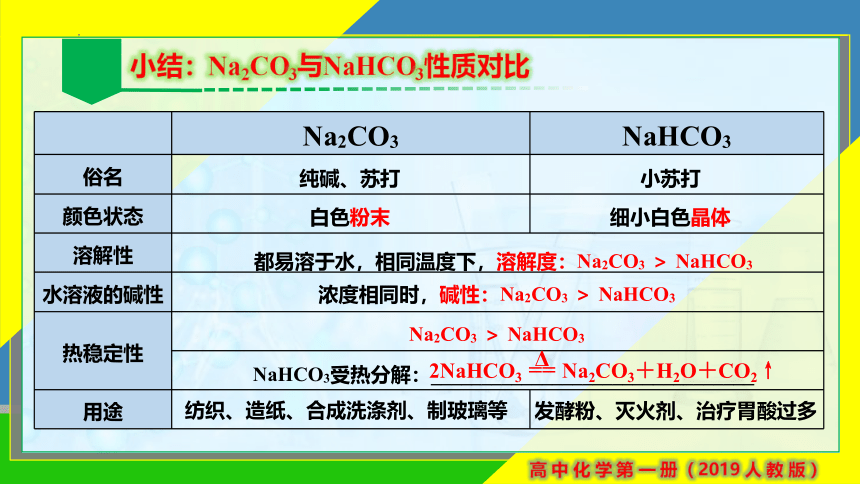
Na2CO3 NaHCO3
俗名
颜色状态
溶解性 水溶液的碱性 热稳定性 用途
纯碱、苏打
小苏打
白色粉末
细小白色晶体
都易溶于水,相同温度下,溶解度:Na2CO3 > NaHCO3
浓度相同时,碱性:Na2CO3 > NaHCO3
Na2CO3 > NaHCO3
NaHCO3受热分解:________________________________
纺织、造纸、合成洗涤剂、制玻璃等
发酵粉、灭火剂、治疗胃酸过多
小结:Na2CO3与NaHCO3性质对比
2NaHCO3 == Na2CO3+H2O+CO2↑
Δ
1.下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中正确的是:( )
A.甲为苏打,乙为小苏打
B.要证明碳酸氢钠受热能产生水,
可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.加热一段时间,B烧杯的石灰水仍然澄清
D.加热过程中A烧杯中始终无气泡产生
B
课堂检测
1.4
Na2CO3、NaHCO3与酸反应
实验
在两支试管中分别加入等质量NaHCO3和Na2CO3,滴加等体积的稀盐酸,观察现象。
Na2CO3+HCl(少) = NaCl+NaHCO3
NaHCO3+HCl=NaCl+H2O+CO2 ↑
Na2CO3+2HCl(过) = 2NaCl+H2O+CO2 ↑
Na2CO3现象:过一小段时间才产生气泡,速率较慢。
NaHCO3现象:立即产生气泡,速率较快。
向溶液中逐滴滴入稀盐酸,可以鉴别Na2CO3和NaHCO3溶液。
1.4
Na2CO3、NaHCO3与酸反应
胃酸的主要成分为盐酸,治疗胃酸过多采用碳酸氢钠,而不用碳酸钠是为什么?
Na2CO3碱性较强,反应速率较慢,不适宜做胃药。
NaHCO3碱性较 强,反应速率快,可以治疗用于治疗胃酸过多。
温馨提示:胃痛类型很多,胃溃疡不能吃含有小苏打的药物进行治疗,反而会加重病情!
1.5
Na2CO3、NaHCO3与Ca(OH)2反应
Na2CO3:
Na2CO3 + Ca(OH)2 === CaCO3↓+ 2NaOH
CO32- + Ca2+ = CaCO3↓
NaHCO3少量:______________________________________
NaHCO3过量:_______________________________________________
NaHCO3 :
Ca2++OH-+HCO3- ===CaCO3↓+H2O
Ca2++2OH-+2HCO3- ===CaCO3↓+2H2O+CO32-
少量定一
2.书写Ba(OH)2与NaHSO3反应的离子方程式。
课堂检测
NaHSO3少量:______________________________________
NaHSO3过量:_______________________________________________
Ba2++OH-+HSO3- ===BaSO3↓+H2O
Ba2++2OH-+2HSO3- ===BaSO3↓+2H2O+SO32-
3.书写Ba(OH)2与NaHSO4反应的离子方程式。
NaHSO4少量:______________________________________
NaHSO4过量:_______________________________________________
Ba2++OH-+H+ + SO42- ===BaSO4↓+H2O
Ba2++2OH-+2H+ + SO42- ===BaSO4↓+2H2O
1.6
Na2CO3与CO2的反应
Na2CO3 + CO2 + H2O = 2NaHCO3
CO32- + CO2 + H2O = 2HCO3-
【思考】向澄清石灰水中持续通入CO2,发现澄清石灰水先变浑浊然后又变清,你知道为什么吗?
CaCO3+CO2+H2O = Ca(HCO3)2
Ca(OH)2+CO2 = CaCO3↓+H2O
【类比】若将澄清石灰水换成饱和碳酸钠,会有什么现象呢?
现象:溶液变浑浊或有晶体析出
Na2CO3+CO2+H2O=2NaHCO3
NaHCO3溶解度比Na2CO3小,所以会析出碳酸氢钠晶体
该反应常用于
除去NaHCO3溶液中的Na2CO3 。
1.7
Na2CO3与BaCl2的反应
该反应常用于鉴别NaHCO3与Na2CO3 。
Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl
CO32- + Ba2+ = BaCO3↓
小结:Na2CO3与NaHCO3的相互转化
Na2CO3
NaHCO3
①CO2 + H2O
②NaOH
②HCl(少量)
①
依据 方法
加热,有气体产生的是NaHCO3,无变化的是Na2CO3
有沉淀生成的是Na2CO3,无变化的是NaHCO3
生成气体剧烈的是NaHCO3相对不剧烈的是Na2CO3
立即产生气体的是NaHCO3,开始不产生气体,滴加一会才产生气体的是Na2CO3
热稳定性
CaCl2(BaCl2)
固体与盐酸反应的剧烈程度
溶液中逐滴滴加盐酸
1.8
Na2CO3与NaHCO3的鉴别
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3) 加热
通入足量CO2气体
滴加适量NaOH溶液
1.9
Na2CO3与NaHCO3提纯
4.下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
课堂检测
C
粗盐水
(含MgCl2、CaCl2)
沉 淀
过量Ca(OH)2
过量Na2CO3
操作a
流程Ⅰ
氨化
碳酸化
过滤
NH3
CO2
流程Ⅱ
煅烧碳酸氢钠
CO2和H2O
纯碱
Mg(OH)2、CaCO3
原理:(1)NH3+H2O+CO2 +NaCl=NaHCO3↓ +NH4Cl
(2)2NaHCO3 == Na2CO3+H2O+CO2↑
科学史话:侯德榜与侯氏制碱法
先通NH3,使溶液呈碱性,再通入足量CO2气体,可增大CO2溶解量,生成更多NaHCO3。滤液中的NH4Cl可作化肥。
焰色试验
2
2.1
焰色试验
1.定义:很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
2.操作
盐酸
原火焰颜色相同
试样
火焰的颜色
2.1
焰色试验
实验2-6
把熔嵌在玻璃棒上的铂丝(或光洁无锈的铁丝)放在酒精灯(最好用煤气灯)外焰上灼烧,至与原来的火焰颜色相同为止。用铂丝(或铁丝)蘸取碳酸钠溶液,在外焰上灼烧,观察火焰的颜色。
焰色试验几个疑问
1.每次试验完后,为什么都要用盐酸洗净铂,并灼烧至无色?
2.除金属的化合物之外,单质能不能有同样的现象呢?
因为金属氯化物灼烧时易气化而挥发,灼烧至无色后能除去能起焰色反应的少量杂质。
能,因为焰色反应是金属元素的性质,无论化合物还是单质,只要含有某种金属元素,这种物质就具有这种金属元素的焰色反应。
3.焰色反应是物质的物理性质还是化学性质?
物理性质,属元素性质,与价态无关
4.进行钾及钾的化合物发生焰色反应实验时,为什么要透过蓝色钴玻璃去观察?
因钾及钾的化合物中可能混有钠元素,而钠的黄色火焰能掩盖钾的浅紫色火焰,而蓝色钴玻璃能滤去黄色的光,这样可以避免钾与钾的化合物中混有钠元素所造成的干扰。
5.下述对焰色反应实验操作注意事项的说明,正确的是( )
① 钾的火焰颜色要透过蓝色钴玻璃观察
② 先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③ 每次实验后,要将铂丝用盐酸洗净
④ 实验时最好选择本身颜色较浅的火焰
⑤ 没有铂丝时,也可以用光洁无锈的铁丝代替
A.仅有③不正确 B.仅有④不正确
C.仅有⑤不正确 D.全正确
D
课堂检测
颜色状态
水溶性
Na2CO3与NaHCO3
的物理性质
稳定性
与盐酸反应
与Ca(OH)2反应
与BaCl2反应
与CO2反应
Na2CO3与NaHCO3
的化学性质
金属元素的性质
物理性质
钾及钾的化合物
焰色试验
钠盐与焰色试验
课堂总结
第二章 海水中的重要元素——钠和氯
第一节 钠及其化合物
第3课时 钠盐及焰色试验
第二章 海水中重要的元素
——钠和氯
第一节 钠及其化合物
第3 课时 钠盐与焰色试验
1. 从物质类别和生活实际,归纳碳酸钠和碳酸氢钠的性质,构建两者间的转化关系。
2. 设计探究方案,鉴别和提纯碳酸钠和碳酸氢钠。
3. 了解焰色试验的本质及应用。
4. 通过学习碳酸钠和碳酸氢钠在生产生活中的应用,感受化学的魅力,发展社会参与意识。
。
教学引入:侯氏制碱法的创始人——侯德榜
Na2CO3
碳酸钠与碳酸氢钠
1
1.1
Na2CO3与NaHCO3的用途对比
纯碱
苏打、
小苏打
1.2
Na2CO3与NaHCO3的水溶性及酸碱性的实验探究
实验2-4
在两只试管中分别加入少量碳酸钠和碳酸氢钠固体(各约1g),完成实验,并将实验现象填表。
1.2
Na2CO3与NaHCO3的水溶性及酸碱性的实验探究
盐 Na2CO3 NaHCO3
(1)
(2)
(3)
(4)
初步结论 ①相同温度下,水中的溶解度:Na2CO3>NaHCO3
②水溶液碱性:Na2CO3>NaHCO3
白色粉末
白色细小晶体
全部溶解
部分溶解
溶液变得较红
溶液变得微红
加水结块成晶体,溶解放热
加水部分溶解,溶解吸热
Na2CO3+xH2O = Na2CO3·xH2O(密封保存)
1.2
Na2CO3与NaHCO3的水溶性及酸碱性的实验探究
风化
碳酸钠粉末遇水生成含有结晶水的碳酸钠晶体--水合碳酸钠( Na2CO3·xH2O)。碳酸钠晶体在干燥空气里逐渐失去结晶水变成碳酸钠粉末,这个过程称为风化。
1.3
Na2CO3与NaHCO3的稳定性对比实验
实验2-5
分别加热Na2CO3和NaHCO3固体,观察现象,比较二者稳定性。
实验操作 实验现象 化学方程式及结论
刚加热时,石灰水中有气泡,之后无气泡,澄清石灰水_____________
石灰水中有气泡,澄清石灰水 ,试管口有 ____________
Na2CO3很稳定,
受热不易发生分解
小液滴出现。
NaHCO3不稳定,
受热容易分解,化学方程式为
1.3
Na2CO3与NaHCO3的稳定性对比实验
无明显变化
变浑浊
2NaHCO3 == Na2CO3+H2O+CO2↑
Δ
Na2CO3 NaHCO3
俗名
颜色状态
溶解性 水溶液的碱性 热稳定性 用途
纯碱、苏打
小苏打
白色粉末
细小白色晶体
都易溶于水,相同温度下,溶解度:Na2CO3 > NaHCO3
浓度相同时,碱性:Na2CO3 > NaHCO3
Na2CO3 > NaHCO3
NaHCO3受热分解:________________________________
纺织、造纸、合成洗涤剂、制玻璃等
发酵粉、灭火剂、治疗胃酸过多
小结:Na2CO3与NaHCO3性质对比
2NaHCO3 == Na2CO3+H2O+CO2↑
Δ
1.下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中正确的是:( )
A.甲为苏打,乙为小苏打
B.要证明碳酸氢钠受热能产生水,
可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.加热一段时间,B烧杯的石灰水仍然澄清
D.加热过程中A烧杯中始终无气泡产生
B
课堂检测
1.4
Na2CO3、NaHCO3与酸反应
实验
在两支试管中分别加入等质量NaHCO3和Na2CO3,滴加等体积的稀盐酸,观察现象。
Na2CO3+HCl(少) = NaCl+NaHCO3
NaHCO3+HCl=NaCl+H2O+CO2 ↑
Na2CO3+2HCl(过) = 2NaCl+H2O+CO2 ↑
Na2CO3现象:过一小段时间才产生气泡,速率较慢。
NaHCO3现象:立即产生气泡,速率较快。
向溶液中逐滴滴入稀盐酸,可以鉴别Na2CO3和NaHCO3溶液。
1.4
Na2CO3、NaHCO3与酸反应
胃酸的主要成分为盐酸,治疗胃酸过多采用碳酸氢钠,而不用碳酸钠是为什么?
Na2CO3碱性较强,反应速率较慢,不适宜做胃药。
NaHCO3碱性较 强,反应速率快,可以治疗用于治疗胃酸过多。
温馨提示:胃痛类型很多,胃溃疡不能吃含有小苏打的药物进行治疗,反而会加重病情!
1.5
Na2CO3、NaHCO3与Ca(OH)2反应
Na2CO3:
Na2CO3 + Ca(OH)2 === CaCO3↓+ 2NaOH
CO32- + Ca2+ = CaCO3↓
NaHCO3少量:______________________________________
NaHCO3过量:_______________________________________________
NaHCO3 :
Ca2++OH-+HCO3- ===CaCO3↓+H2O
Ca2++2OH-+2HCO3- ===CaCO3↓+2H2O+CO32-
少量定一
2.书写Ba(OH)2与NaHSO3反应的离子方程式。
课堂检测
NaHSO3少量:______________________________________
NaHSO3过量:_______________________________________________
Ba2++OH-+HSO3- ===BaSO3↓+H2O
Ba2++2OH-+2HSO3- ===BaSO3↓+2H2O+SO32-
3.书写Ba(OH)2与NaHSO4反应的离子方程式。
NaHSO4少量:______________________________________
NaHSO4过量:_______________________________________________
Ba2++OH-+H+ + SO42- ===BaSO4↓+H2O
Ba2++2OH-+2H+ + SO42- ===BaSO4↓+2H2O
1.6
Na2CO3与CO2的反应
Na2CO3 + CO2 + H2O = 2NaHCO3
CO32- + CO2 + H2O = 2HCO3-
【思考】向澄清石灰水中持续通入CO2,发现澄清石灰水先变浑浊然后又变清,你知道为什么吗?
CaCO3+CO2+H2O = Ca(HCO3)2
Ca(OH)2+CO2 = CaCO3↓+H2O
【类比】若将澄清石灰水换成饱和碳酸钠,会有什么现象呢?
现象:溶液变浑浊或有晶体析出
Na2CO3+CO2+H2O=2NaHCO3
NaHCO3溶解度比Na2CO3小,所以会析出碳酸氢钠晶体
该反应常用于
除去NaHCO3溶液中的Na2CO3 。
1.7
Na2CO3与BaCl2的反应
该反应常用于鉴别NaHCO3与Na2CO3 。
Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl
CO32- + Ba2+ = BaCO3↓
小结:Na2CO3与NaHCO3的相互转化
Na2CO3
NaHCO3
①CO2 + H2O
②NaOH
②HCl(少量)
①
依据 方法
加热,有气体产生的是NaHCO3,无变化的是Na2CO3
有沉淀生成的是Na2CO3,无变化的是NaHCO3
生成气体剧烈的是NaHCO3相对不剧烈的是Na2CO3
立即产生气体的是NaHCO3,开始不产生气体,滴加一会才产生气体的是Na2CO3
热稳定性
CaCl2(BaCl2)
固体与盐酸反应的剧烈程度
溶液中逐滴滴加盐酸
1.8
Na2CO3与NaHCO3的鉴别
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3) 加热
通入足量CO2气体
滴加适量NaOH溶液
1.9
Na2CO3与NaHCO3提纯
4.下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
课堂检测
C
粗盐水
(含MgCl2、CaCl2)
沉 淀
过量Ca(OH)2
过量Na2CO3
操作a
流程Ⅰ
氨化
碳酸化
过滤
NH3
CO2
流程Ⅱ
煅烧碳酸氢钠
CO2和H2O
纯碱
Mg(OH)2、CaCO3
原理:(1)NH3+H2O+CO2 +NaCl=NaHCO3↓ +NH4Cl
(2)2NaHCO3 == Na2CO3+H2O+CO2↑
科学史话:侯德榜与侯氏制碱法
先通NH3,使溶液呈碱性,再通入足量CO2气体,可增大CO2溶解量,生成更多NaHCO3。滤液中的NH4Cl可作化肥。
焰色试验
2
2.1
焰色试验
1.定义:很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
2.操作
盐酸
原火焰颜色相同
试样
火焰的颜色
2.1
焰色试验
实验2-6
把熔嵌在玻璃棒上的铂丝(或光洁无锈的铁丝)放在酒精灯(最好用煤气灯)外焰上灼烧,至与原来的火焰颜色相同为止。用铂丝(或铁丝)蘸取碳酸钠溶液,在外焰上灼烧,观察火焰的颜色。
焰色试验几个疑问
1.每次试验完后,为什么都要用盐酸洗净铂,并灼烧至无色?
2.除金属的化合物之外,单质能不能有同样的现象呢?
因为金属氯化物灼烧时易气化而挥发,灼烧至无色后能除去能起焰色反应的少量杂质。
能,因为焰色反应是金属元素的性质,无论化合物还是单质,只要含有某种金属元素,这种物质就具有这种金属元素的焰色反应。
3.焰色反应是物质的物理性质还是化学性质?
物理性质,属元素性质,与价态无关
4.进行钾及钾的化合物发生焰色反应实验时,为什么要透过蓝色钴玻璃去观察?
因钾及钾的化合物中可能混有钠元素,而钠的黄色火焰能掩盖钾的浅紫色火焰,而蓝色钴玻璃能滤去黄色的光,这样可以避免钾与钾的化合物中混有钠元素所造成的干扰。
5.下述对焰色反应实验操作注意事项的说明,正确的是( )
① 钾的火焰颜色要透过蓝色钴玻璃观察
② 先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③ 每次实验后,要将铂丝用盐酸洗净
④ 实验时最好选择本身颜色较浅的火焰
⑤ 没有铂丝时,也可以用光洁无锈的铁丝代替
A.仅有③不正确 B.仅有④不正确
C.仅有⑤不正确 D.全正确
D
课堂检测
颜色状态
水溶性
Na2CO3与NaHCO3
的物理性质
稳定性
与盐酸反应
与Ca(OH)2反应
与BaCl2反应
与CO2反应
Na2CO3与NaHCO3
的化学性质
金属元素的性质
物理性质
钾及钾的化合物
焰色试验
钠盐与焰色试验
课堂总结
第二章 海水中的重要元素——钠和氯
第一节 钠及其化合物
第3课时 钠盐及焰色试验
