化学人教版(2019)必修第二册8.1自然资源的开发利用 课件(共54张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册8.1自然资源的开发利用 课件(共54张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-07 15:56:02 | ||
图片预览










文档简介
(共54张PPT)
第八章 化学与可持续发展
第一节 自然资源的开发利用
课程学习目标
1
熟知金属冶炼的方法及其原理。
2
掌握铝热反应的原理和实验。
3
熟知从海水中提取溴的原理。
4
了解煤、石油和天然气的组成及综合利用。
新课导入
食品:糖类、油脂、蛋白质……
药物:阿司匹林、布洛芬……
我们的身边离不开自然资源,无论是汽车、飞机、轮船还是我们身上的衣服、鞋子、帽子,以及我们的食物,都是从自然界中得到的,那么这些资源都是怎么进入我们的生活的,我们就简单的来了解一下吧。
新课导入
食品:糖类、油脂、蛋白质……
药物:阿司匹林、布洛芬……
1
金属矿物的开发利用
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
黄铜矿
赤铁矿
铝矿
锰矿
钨矿
1、金属元素的存在
(1) 极少数的不活泼金属(金、铂等)以游离态的形式存在。
(2) 绝大多数金属以化合物的形式存在。
(3) 在地壳中,含量最高的金属元素是铝,其次是铁。
1
金属矿物的开发利用
2、金属的冶炼实质
冶炼金属的实质是用还原的方法使金属化合物中的金属离子得到电子变成金属单质。
(化合态)M n+
得电子
M(游离态)
(被还原)
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性逐渐减弱
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性不同,还原方法一样吗?金属活动顺序与金属冶炼有关系吗?
1
金属矿物的开发利用
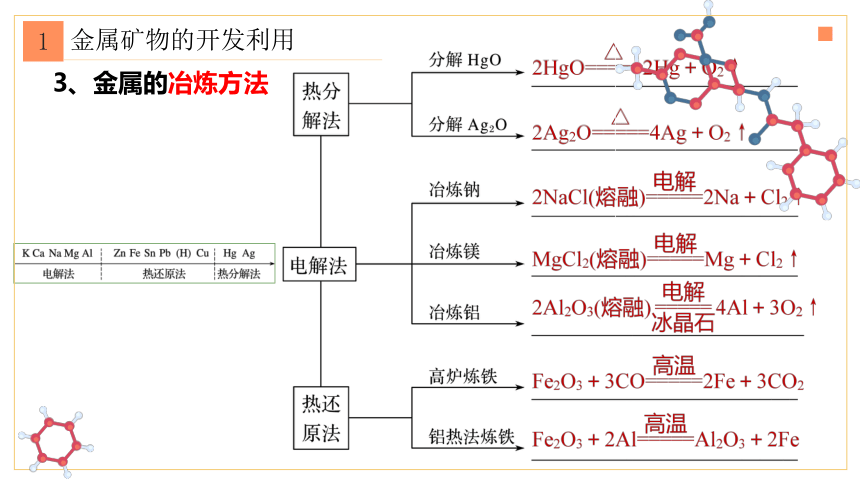
① 物理提取法:适用于极不活泼的金属的冶炼。Pt Au
② 热 分 解 法:适用于金属活动性顺序表中氢以后的金属冶炼。 Hg Ag
③ 热 还 原 法:适用于金属活动性顺序表中部的金属冶炼。 Zn Fe Sn Pb Cu
④ 电 解 法:适用于钾、钠、钙、铝等活泼金属的冶炼。 K Ca Na Mg Al
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
3、金属的冶炼方法
1
金属矿物的开发利用
3、金属的冶炼方法
1
金属矿物的开发利用
3、金属的冶炼方法
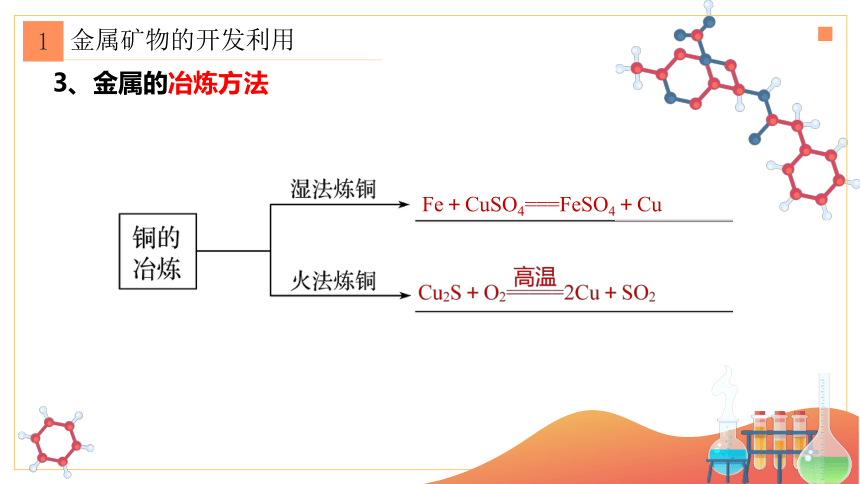
Fe+CuSO4===FeSO4+Cu
1
金属矿物的开发利用
(1)开发环保高效的冶炼方法
(2)防止金属腐蚀;
(3)加强废旧金属回收;
(4)寻找金属替代品。
4、合理开发和利用矿物资源的途径
1
金属矿物的开发利用
思
考
与
交
流
?
1. 为什么冶炼镁时电解MgCl2而不是MgO,冶炼铝时电解Al2O3而不是AlCl3?(已知:MgO的熔点为2 852 ℃,MgCl2的熔点为118 ℃)
2.为什么越活泼的金属被人类利用越晚?
1. 为什么冶炼镁时电解MgCl2而不是MgO,冶炼铝时电解Al2O3而不是AlCl3?(已知:MgO的熔点为2 852 ℃,MgCl2的熔点为118 ℃)
工业上采用电解法冶炼铝的材料是Al2O3,而不是AlCl3,这是因为AlCl3是共价化合物,熔融时无法电离出自由移动的离子,不能导电;工业上采用电解法冶炼镁的材料是MgCl2,而不是MgO,这是因为MgO虽是离子化合物,但其熔点太高,熔融时会消耗大量热能,成本较高。
2.为什么越活泼的金属被人类利用越晚?
因为金属越活泼,其离子的氧化性越弱,就越难被还原,故制取和利用的时间越晚。
金属的活泼性与冶炼方法的关系
金属单质还原性、失电子能力依次减弱
金属阳离子氧化性、得电子能力依次增强
【归纳总结】
2
铝热反应的原理
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
Fe2O3+ 2Al = 2Fe + Al2O3
高温
现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。
铝
热
剂
大部分金属的冶炼都是通过在高温下发生的氧化还原反应来完成的,常用的还原剂有焦炭、一氧化碳、氢气等。一些活泼的金属也可以作为还原剂,将相对不活泼的金属从其化合物中置换出来,如铝热反应。
3MnO2 + 4Al = 3Mn + 2Al2O3
高温
Cr2O3 + 2Al = 2Cr + Al2O3
高温
思
考
与
交
流
?
1、铝热反应需要高温条件,是否还需要持续加热?
2、实验中,镁条、氯酸钾的作用是什么?引发反应的操作是什么?
3、蒸发皿中铺少量细沙的作用是什么?
1、铝热反应需要高温条件,是否还需要持续加热?
铝热反应为放热反应,放出的热可以维持反应继续进行,因此不需要持续加热。
2、实验中,镁条、氯酸钾的作用是什么?引发反应的操作是什么?
镁条是引燃剂,氯酸钾为助燃剂,点燃镁条,促使氯酸钾分解,释放出氧气,使镁条更剧烈燃烧,单位时间内放出更多热量,从而引发Al和Fe2O3发生反应。
3、蒸发皿中铺少量细沙的作用是什么?
一是防止蒸发皿炸裂,二是防止生成的熔融物溅出。
铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等等高熔点金属。
1
铝热反应的原理
计算表明,生产1 mol 铝消耗的电能至少为1.8 ×106J,回收铝质饮料罐得到铝与从铝土矿制铝相比,前者的能耗仅为后者的3%~5%。通过对上述数据的分析和对比,你想到了什么?请将你的想法和同学交流。
试从能源消耗和环境污染两个角度分析加强废旧金属回收利用的重要性。
用铝土矿生产铝,能耗高,资源消耗量大,在生产过程中会产生大量的废气、废液及废渣,对大气水体及土壤会产生很大污染;而用废旧饮料罐生产铝,能耗低,资源消耗量小,对环境污染很小,变废为宝,既可以减少废旧金属对环境的污染还可以提高矿物有效利用率,是可持续发展的必然要求。
【资料卡片】
自然资源与可持续发展
自然资源是人类社会发展不可或铸的自然物质基础,包括土地与土壕资源、矿产资源、生物资源、水资源、能源资源、环境资源等,根据其能否再生可以分为可再生资源和不可再生资源。可持续发展的目标是在满足人类需要的同时,强调人类的行为要受到自然界的制约,强调人类代际之间、人类与其他生物种群之间、不同国家和不同地区之间的公平。它包括经济可椅续发展、社会可持续发展、资源可持续发展、环境可持续发展等方面。
自然资源
3
海水资源的开发利用
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
1. 海水水资源的利用方法
海水水资源的利用
海水淡化
目的:从海水中提取淡水
方法:蒸馏法、离子交换法、电渗析法
海水循环冷却
蒸馏法的历史最久。
1
海水资源的开发利用
2. 海水的蒸馏
(1) 主要仪器:A: ;B:直形冷凝管;C: 。
(2) 冷凝水的流向: 口进, 口出。
(3) A中加入碎瓷片的目的是 。
蒸馏烧瓶
锥形瓶
a
b
防止液体暴沸
1
海水资源的开发利用
三种海水淡化方法的原理
方法 原理
蒸馏法 将海水加热至沸腾汽化,然后将蒸气冷凝而得到蒸馏水
电渗 析法 在外加直流电场的作用下,利用阴、阳离子交换膜对水中阴、阳离子的选择透过性,使水中的一部分离子转移到另一部分水中而达到除盐的目的
离子 交换法 用阳离子交换树脂和阴离子交换树脂除去海水中的阴离子、阳离子,得到去离子水
【资料卡片】
海水中的化学元素
由于与岩石、大气和生物的相互作用,海水中溶解和悬浮着大量的无机物和有机物。海水中含量最多的O、H两种元素,加上Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F等11种元素,其总含量超过99%,其他元素为微量。虽然海水中元素的种类很多,总储量很大,但许多元素的富集程度却很低。例如,海水中金元素的总储量约为5×106 t,而1t海水中金元素的含量仅为4×10-6g。海洋还是一个远未充分开发的巨大化学资源宝库。
提问:如何在海水中提取溴?
3. 从海水中提取溴
1
海水资源的开发利用
工业规模提取溴的常用方法是空气吹出法,工艺过程为:
(1)浓缩:海水晒盐和海水淡化过程中的副产物Br-得到浓缩。
(2)氧化:向酸化的浓缩海水中通入适量的氯气,使溴离子转化为溴单质,化学方程式为 。
(3)富集:向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的,方程式为 。
(4)提取:向吸收塔内的溶液中通入适量的氯气,方程式为 。
2NaBr+Cl2==2NaCl+Br2
Br2+SO2+2H2O=2HBr+H2SO4
2HBr+Cl2=2HCl+Br2
3. 从海水中提取溴
1
海水资源的开发利用
1
海水资源的开发利用
4
煤、石油和天然气的综合利用
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
煤
分类:无烟煤、烟煤、褐煤、泥煤等
物质组成:有机物和少量无机物
元素组成:主要含碳元素,还含少量 等元素
氢、氧、氮、硫
提问:煤石油和天然气是人类主要的能源,如何实现化石燃料的综合利用,提高利用率,减少化学燃料燃烧所造成的环境污染问题呢?
1. 煤的综合利用
(1) 煤的分类与组成
1
煤、石油和天然气的综合利用
(2) 煤的综合利用方式
1
煤、石油和天然气的综合利用
(3) 煤综合利用的意义
① 减少煤燃烧产生的大量SO2、NOx、碳的氧化物和粉尘等污染物的排放。
② 提高煤燃烧的效率——煤的气化、液化都是使煤变成清洁能源的有效途径,煤的燃烧效率也有很大的提高。
③ 生产基本化工原料——通过煤的干馏,获得大量的基本化工原料。
1
煤、石油和天然气的综合利用
【思考与交流】
煤的气化、液化是物质三态(气、液、固)之间的变化吗?为什么?
不是,物质三态之间的变化是物理变化,煤的气化、液化是化学变化。
2. 天然气的综合利用
(1)天然气的主要成分:甲烷
(2)天然气的用途:
1
煤、石油和天然气的综合利用
3. 石油的综合利用
(1) 石油的组成
石油是由 组成的混合物,没有固定的熔、沸点,只能在一定温度范围内熔化或汽化。
多种碳氢化合物
1
煤、石油和天然气的综合利用
(2) 石油的综合利用途径
:利用石油中各组分 不同进行分离
①
分馏
原理
产品
常压:石油气、 、 、 、重油
减压:柴油、燃料油、石蜡、润滑油、沥青
沸点
汽油 煤油 柴油
②
裂化
目的:提高 的产量
原理:
汽油
C16H34
十六烷
C8H18
辛烷
+
C8H16
辛烯
1
煤、石油和天然气的综合利用
(2) 石油的综合利用途径
目的:生产 等气态化工原料
③
裂解
原理:
乙烯
C8H18
辛烷
C4H10
丁烷
+
C4H8
丁烯
C4H10
丁烷
C2H6
乙烷
+
C2H4
乙烯
C4H10
丁烷
CH4
甲烷
+
C3H6
丙烯
④
催化重整
目的:使 转化为_______
产品: 或 等化工原料
链状烃
环状烃
苯
甲苯
1
煤、石油和天然气的综合利用
1、石油的分馏、裂化和裂解有什么区别?
方法 原理 原料 目的
分馏 常压 利用加热和冷凝,把石油分成不同沸点范围的蒸馏产物 原油 得到不同沸点范围的蒸馏产品
减压 重油
裂化 热裂化 在一定条件下,把相对分子质量大、沸点高的烃断裂为相对分子质量小、沸点低的烃 重油 提高汽油的产量
催化裂化
裂解(深度裂化) 在高温下,把长链分子的烃断裂为各种短链的气态烃和液态烃 含直链烷烃的石油分馏产品 获得短链不饱
和烃
【思考与交流】
2、生活中汽车的车用燃料一般为裂化汽油。这种汽油和直馏汽油有何区别?
直馏汽油主要是饱和烃的混合物,裂化汽油中含不饱和烃;可用溴的四氯化碳溶液区别它们。
【思考与交流】
3、目前,多数石油产品仍作为燃料使用,如把石油产品来合成高分子材料,其价值将成倍提升,试写出用汽油(主要成分为辛烷C8H18)为原料,生成聚乙烯塑料的合成原理?
3. 煤、石油、天然气为原料生产合成材料
三大合成材料: 、 、 。
塑料 合成橡胶 合成纤维
1
煤、石油和天然气的综合利用
【科学·技术·社会】
生物质资源的利用
人类对生物质资源的开发利用具有悠久的历史。古代人类在长期实践中学会了种植农作物、用薪柴生火、酿酒、造醋、制作饴糖、植物药用,等等。现代科技的发展为开发利用生物质资源奠定了更加坚实的基础。人们利用物理、化学和生物方法将生物质资源转化为材料(如木材、纸张)、燃料(如生物乙醇、生物柴油),以及基本化工原料(如木炭、乙醇、甲醇、甲烷)等。目前,我国可供开发利用的生物质资源主要有农业、林业产品的废弃物(如农作物秸秆、林木加工余料),生产和生活的废弃物(如厨余垃圾、畜禽粪便)等。随着科技和社会的发展,以来自生物质的纤维素、淀粉和油脂等为原料的化工生产路线,替代以煤、石油和天然气为原料的路线,将是一条绿色的可持续发展途径。
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
课堂练习
1.工业上冶炼金属一般用热分解法、热还原法和电解法。你认为选择方法的主要依据是( )
A.金属在自然界的存在形式
B.金属元素在地壳中的含量
C.金属熔点高低
D.金属阳离子得电子的能力
D
2.已知一些金属的发现和使用与其金属活动性有着必然的联系。据此推测,下列事件发生在铁器时代之前的是( )
A.金属钠的使用 B.青铜器的大量使用
C.海水提镁 D.铝热法制铬
B
3.冶炼金属一般有下列四种方法:①焦炭法 ②水煤气(或氢气或一氧化碳)法 ③活泼金属置换法 ④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁,对它们的冶炼方法的分析不正确的是( )
A.(Ⅰ)用① B.(Ⅱ)用②
C.(Ⅲ)用③ D.(Ⅳ)用④
B
4、海洋中蕴藏着巨大的化学资源,下列有关海水综合利用的说法正确的是( )
A.蒸发海水可以生产单质碘
B.蒸馏海水可以得到淡水
C.电解海水可以得到单质镁
D.电解海水可以制得金属钠
B
5、从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,需要消耗Cl2 44.8 L
D.步骤Ⅳ包含萃取、分液和蒸馏
C
6、海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图所示:
(1) 步骤①反应的离子方程式是________________________。
(2) 步骤③反应的化学方程式是_______________________________。
(3) 从理论上考虑,下列物质也能充分吸收Br2的是_____(填字母)。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
2Br-+Cl2===Br2+2Cl-
SO2+Br2+2H2O===H2SO4+2HBr
ABC
(4)步骤⑤蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,若温度过高,大量水蒸气随溴排出,溴蒸气中水分增加;若温度过低,则___________
______________。
溴不能完全
蒸出,产率低
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
小结
知道常见物质的冶炼方法
二、海洋资源的开发利用
一、金属矿物的开发利用
知道海洋中常见物质的提取
了解煤、石油、天然气基本的化工生产原理
三、煤、石油、天然气的开发利用
THANK YOU FOR WATCHING
谢谢欣赏
第八章 化学与可持续发展
第一节 自然资源的开发利用
课程学习目标
1
熟知金属冶炼的方法及其原理。
2
掌握铝热反应的原理和实验。
3
熟知从海水中提取溴的原理。
4
了解煤、石油和天然气的组成及综合利用。
新课导入
食品:糖类、油脂、蛋白质……
药物:阿司匹林、布洛芬……
我们的身边离不开自然资源,无论是汽车、飞机、轮船还是我们身上的衣服、鞋子、帽子,以及我们的食物,都是从自然界中得到的,那么这些资源都是怎么进入我们的生活的,我们就简单的来了解一下吧。
新课导入
食品:糖类、油脂、蛋白质……
药物:阿司匹林、布洛芬……
1
金属矿物的开发利用
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
黄铜矿
赤铁矿
铝矿
锰矿
钨矿
1、金属元素的存在
(1) 极少数的不活泼金属(金、铂等)以游离态的形式存在。
(2) 绝大多数金属以化合物的形式存在。
(3) 在地壳中,含量最高的金属元素是铝,其次是铁。
1
金属矿物的开发利用
2、金属的冶炼实质
冶炼金属的实质是用还原的方法使金属化合物中的金属离子得到电子变成金属单质。
(化合态)M n+
得电子
M(游离态)
(被还原)
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性逐渐减弱
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性不同,还原方法一样吗?金属活动顺序与金属冶炼有关系吗?
1
金属矿物的开发利用
① 物理提取法:适用于极不活泼的金属的冶炼。Pt Au
② 热 分 解 法:适用于金属活动性顺序表中氢以后的金属冶炼。 Hg Ag
③ 热 还 原 法:适用于金属活动性顺序表中部的金属冶炼。 Zn Fe Sn Pb Cu
④ 电 解 法:适用于钾、钠、钙、铝等活泼金属的冶炼。 K Ca Na Mg Al
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
3、金属的冶炼方法
1
金属矿物的开发利用
3、金属的冶炼方法
1
金属矿物的开发利用
3、金属的冶炼方法
Fe+CuSO4===FeSO4+Cu
1
金属矿物的开发利用
(1)开发环保高效的冶炼方法
(2)防止金属腐蚀;
(3)加强废旧金属回收;
(4)寻找金属替代品。
4、合理开发和利用矿物资源的途径
1
金属矿物的开发利用
思
考
与
交
流
?
1. 为什么冶炼镁时电解MgCl2而不是MgO,冶炼铝时电解Al2O3而不是AlCl3?(已知:MgO的熔点为2 852 ℃,MgCl2的熔点为118 ℃)
2.为什么越活泼的金属被人类利用越晚?
1. 为什么冶炼镁时电解MgCl2而不是MgO,冶炼铝时电解Al2O3而不是AlCl3?(已知:MgO的熔点为2 852 ℃,MgCl2的熔点为118 ℃)
工业上采用电解法冶炼铝的材料是Al2O3,而不是AlCl3,这是因为AlCl3是共价化合物,熔融时无法电离出自由移动的离子,不能导电;工业上采用电解法冶炼镁的材料是MgCl2,而不是MgO,这是因为MgO虽是离子化合物,但其熔点太高,熔融时会消耗大量热能,成本较高。
2.为什么越活泼的金属被人类利用越晚?
因为金属越活泼,其离子的氧化性越弱,就越难被还原,故制取和利用的时间越晚。
金属的活泼性与冶炼方法的关系
金属单质还原性、失电子能力依次减弱
金属阳离子氧化性、得电子能力依次增强
【归纳总结】
2
铝热反应的原理
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
Fe2O3+ 2Al = 2Fe + Al2O3
高温
现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。
铝
热
剂
大部分金属的冶炼都是通过在高温下发生的氧化还原反应来完成的,常用的还原剂有焦炭、一氧化碳、氢气等。一些活泼的金属也可以作为还原剂,将相对不活泼的金属从其化合物中置换出来,如铝热反应。
3MnO2 + 4Al = 3Mn + 2Al2O3
高温
Cr2O3 + 2Al = 2Cr + Al2O3
高温
思
考
与
交
流
?
1、铝热反应需要高温条件,是否还需要持续加热?
2、实验中,镁条、氯酸钾的作用是什么?引发反应的操作是什么?
3、蒸发皿中铺少量细沙的作用是什么?
1、铝热反应需要高温条件,是否还需要持续加热?
铝热反应为放热反应,放出的热可以维持反应继续进行,因此不需要持续加热。
2、实验中,镁条、氯酸钾的作用是什么?引发反应的操作是什么?
镁条是引燃剂,氯酸钾为助燃剂,点燃镁条,促使氯酸钾分解,释放出氧气,使镁条更剧烈燃烧,单位时间内放出更多热量,从而引发Al和Fe2O3发生反应。
3、蒸发皿中铺少量细沙的作用是什么?
一是防止蒸发皿炸裂,二是防止生成的熔融物溅出。
铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等等高熔点金属。
1
铝热反应的原理
计算表明,生产1 mol 铝消耗的电能至少为1.8 ×106J,回收铝质饮料罐得到铝与从铝土矿制铝相比,前者的能耗仅为后者的3%~5%。通过对上述数据的分析和对比,你想到了什么?请将你的想法和同学交流。
试从能源消耗和环境污染两个角度分析加强废旧金属回收利用的重要性。
用铝土矿生产铝,能耗高,资源消耗量大,在生产过程中会产生大量的废气、废液及废渣,对大气水体及土壤会产生很大污染;而用废旧饮料罐生产铝,能耗低,资源消耗量小,对环境污染很小,变废为宝,既可以减少废旧金属对环境的污染还可以提高矿物有效利用率,是可持续发展的必然要求。
【资料卡片】
自然资源与可持续发展
自然资源是人类社会发展不可或铸的自然物质基础,包括土地与土壕资源、矿产资源、生物资源、水资源、能源资源、环境资源等,根据其能否再生可以分为可再生资源和不可再生资源。可持续发展的目标是在满足人类需要的同时,强调人类的行为要受到自然界的制约,强调人类代际之间、人类与其他生物种群之间、不同国家和不同地区之间的公平。它包括经济可椅续发展、社会可持续发展、资源可持续发展、环境可持续发展等方面。
自然资源
3
海水资源的开发利用
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
1. 海水水资源的利用方法
海水水资源的利用
海水淡化
目的:从海水中提取淡水
方法:蒸馏法、离子交换法、电渗析法
海水循环冷却
蒸馏法的历史最久。
1
海水资源的开发利用
2. 海水的蒸馏
(1) 主要仪器:A: ;B:直形冷凝管;C: 。
(2) 冷凝水的流向: 口进, 口出。
(3) A中加入碎瓷片的目的是 。
蒸馏烧瓶
锥形瓶
a
b
防止液体暴沸
1
海水资源的开发利用
三种海水淡化方法的原理
方法 原理
蒸馏法 将海水加热至沸腾汽化,然后将蒸气冷凝而得到蒸馏水
电渗 析法 在外加直流电场的作用下,利用阴、阳离子交换膜对水中阴、阳离子的选择透过性,使水中的一部分离子转移到另一部分水中而达到除盐的目的
离子 交换法 用阳离子交换树脂和阴离子交换树脂除去海水中的阴离子、阳离子,得到去离子水
【资料卡片】
海水中的化学元素
由于与岩石、大气和生物的相互作用,海水中溶解和悬浮着大量的无机物和有机物。海水中含量最多的O、H两种元素,加上Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F等11种元素,其总含量超过99%,其他元素为微量。虽然海水中元素的种类很多,总储量很大,但许多元素的富集程度却很低。例如,海水中金元素的总储量约为5×106 t,而1t海水中金元素的含量仅为4×10-6g。海洋还是一个远未充分开发的巨大化学资源宝库。
提问:如何在海水中提取溴?
3. 从海水中提取溴
1
海水资源的开发利用
工业规模提取溴的常用方法是空气吹出法,工艺过程为:
(1)浓缩:海水晒盐和海水淡化过程中的副产物Br-得到浓缩。
(2)氧化:向酸化的浓缩海水中通入适量的氯气,使溴离子转化为溴单质,化学方程式为 。
(3)富集:向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的,方程式为 。
(4)提取:向吸收塔内的溶液中通入适量的氯气,方程式为 。
2NaBr+Cl2==2NaCl+Br2
Br2+SO2+2H2O=2HBr+H2SO4
2HBr+Cl2=2HCl+Br2
3. 从海水中提取溴
1
海水资源的开发利用
1
海水资源的开发利用
4
煤、石油和天然气的综合利用
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
煤
分类:无烟煤、烟煤、褐煤、泥煤等
物质组成:有机物和少量无机物
元素组成:主要含碳元素,还含少量 等元素
氢、氧、氮、硫
提问:煤石油和天然气是人类主要的能源,如何实现化石燃料的综合利用,提高利用率,减少化学燃料燃烧所造成的环境污染问题呢?
1. 煤的综合利用
(1) 煤的分类与组成
1
煤、石油和天然气的综合利用
(2) 煤的综合利用方式
1
煤、石油和天然气的综合利用
(3) 煤综合利用的意义
① 减少煤燃烧产生的大量SO2、NOx、碳的氧化物和粉尘等污染物的排放。
② 提高煤燃烧的效率——煤的气化、液化都是使煤变成清洁能源的有效途径,煤的燃烧效率也有很大的提高。
③ 生产基本化工原料——通过煤的干馏,获得大量的基本化工原料。
1
煤、石油和天然气的综合利用
【思考与交流】
煤的气化、液化是物质三态(气、液、固)之间的变化吗?为什么?
不是,物质三态之间的变化是物理变化,煤的气化、液化是化学变化。
2. 天然气的综合利用
(1)天然气的主要成分:甲烷
(2)天然气的用途:
1
煤、石油和天然气的综合利用
3. 石油的综合利用
(1) 石油的组成
石油是由 组成的混合物,没有固定的熔、沸点,只能在一定温度范围内熔化或汽化。
多种碳氢化合物
1
煤、石油和天然气的综合利用
(2) 石油的综合利用途径
:利用石油中各组分 不同进行分离
①
分馏
原理
产品
常压:石油气、 、 、 、重油
减压:柴油、燃料油、石蜡、润滑油、沥青
沸点
汽油 煤油 柴油
②
裂化
目的:提高 的产量
原理:
汽油
C16H34
十六烷
C8H18
辛烷
+
C8H16
辛烯
1
煤、石油和天然气的综合利用
(2) 石油的综合利用途径
目的:生产 等气态化工原料
③
裂解
原理:
乙烯
C8H18
辛烷
C4H10
丁烷
+
C4H8
丁烯
C4H10
丁烷
C2H6
乙烷
+
C2H4
乙烯
C4H10
丁烷
CH4
甲烷
+
C3H6
丙烯
④
催化重整
目的:使 转化为_______
产品: 或 等化工原料
链状烃
环状烃
苯
甲苯
1
煤、石油和天然气的综合利用
1、石油的分馏、裂化和裂解有什么区别?
方法 原理 原料 目的
分馏 常压 利用加热和冷凝,把石油分成不同沸点范围的蒸馏产物 原油 得到不同沸点范围的蒸馏产品
减压 重油
裂化 热裂化 在一定条件下,把相对分子质量大、沸点高的烃断裂为相对分子质量小、沸点低的烃 重油 提高汽油的产量
催化裂化
裂解(深度裂化) 在高温下,把长链分子的烃断裂为各种短链的气态烃和液态烃 含直链烷烃的石油分馏产品 获得短链不饱
和烃
【思考与交流】
2、生活中汽车的车用燃料一般为裂化汽油。这种汽油和直馏汽油有何区别?
直馏汽油主要是饱和烃的混合物,裂化汽油中含不饱和烃;可用溴的四氯化碳溶液区别它们。
【思考与交流】
3、目前,多数石油产品仍作为燃料使用,如把石油产品来合成高分子材料,其价值将成倍提升,试写出用汽油(主要成分为辛烷C8H18)为原料,生成聚乙烯塑料的合成原理?
3. 煤、石油、天然气为原料生产合成材料
三大合成材料: 、 、 。
塑料 合成橡胶 合成纤维
1
煤、石油和天然气的综合利用
【科学·技术·社会】
生物质资源的利用
人类对生物质资源的开发利用具有悠久的历史。古代人类在长期实践中学会了种植农作物、用薪柴生火、酿酒、造醋、制作饴糖、植物药用,等等。现代科技的发展为开发利用生物质资源奠定了更加坚实的基础。人们利用物理、化学和生物方法将生物质资源转化为材料(如木材、纸张)、燃料(如生物乙醇、生物柴油),以及基本化工原料(如木炭、乙醇、甲醇、甲烷)等。目前,我国可供开发利用的生物质资源主要有农业、林业产品的废弃物(如农作物秸秆、林木加工余料),生产和生活的废弃物(如厨余垃圾、畜禽粪便)等。随着科技和社会的发展,以来自生物质的纤维素、淀粉和油脂等为原料的化工生产路线,替代以煤、石油和天然气为原料的路线,将是一条绿色的可持续发展途径。
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
课堂练习
1.工业上冶炼金属一般用热分解法、热还原法和电解法。你认为选择方法的主要依据是( )
A.金属在自然界的存在形式
B.金属元素在地壳中的含量
C.金属熔点高低
D.金属阳离子得电子的能力
D
2.已知一些金属的发现和使用与其金属活动性有着必然的联系。据此推测,下列事件发生在铁器时代之前的是( )
A.金属钠的使用 B.青铜器的大量使用
C.海水提镁 D.铝热法制铬
B
3.冶炼金属一般有下列四种方法:①焦炭法 ②水煤气(或氢气或一氧化碳)法 ③活泼金属置换法 ④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁,对它们的冶炼方法的分析不正确的是( )
A.(Ⅰ)用① B.(Ⅱ)用②
C.(Ⅲ)用③ D.(Ⅳ)用④
B
4、海洋中蕴藏着巨大的化学资源,下列有关海水综合利用的说法正确的是( )
A.蒸发海水可以生产单质碘
B.蒸馏海水可以得到淡水
C.电解海水可以得到单质镁
D.电解海水可以制得金属钠
B
5、从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,需要消耗Cl2 44.8 L
D.步骤Ⅳ包含萃取、分液和蒸馏
C
6、海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图所示:
(1) 步骤①反应的离子方程式是________________________。
(2) 步骤③反应的化学方程式是_______________________________。
(3) 从理论上考虑,下列物质也能充分吸收Br2的是_____(填字母)。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
2Br-+Cl2===Br2+2Cl-
SO2+Br2+2H2O===H2SO4+2HBr
ABC
(4)步骤⑤蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,若温度过高,大量水蒸气随溴排出,溴蒸气中水分增加;若温度过低,则___________
______________。
溴不能完全
蒸出,产率低
LOREM IPSUM DOLOR SIT AMET CONSECTETUER
小结
知道常见物质的冶炼方法
二、海洋资源的开发利用
一、金属矿物的开发利用
知道海洋中常见物质的提取
了解煤、石油、天然气基本的化工生产原理
三、煤、石油、天然气的开发利用
THANK YOU FOR WATCHING
谢谢欣赏
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
