专题1 化学反应与能量变化 单元检测题 (含解析)高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题1 化学反应与能量变化 单元检测题 (含解析)高二上学期化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-07 16:29:11 | ||
图片预览

文档简介
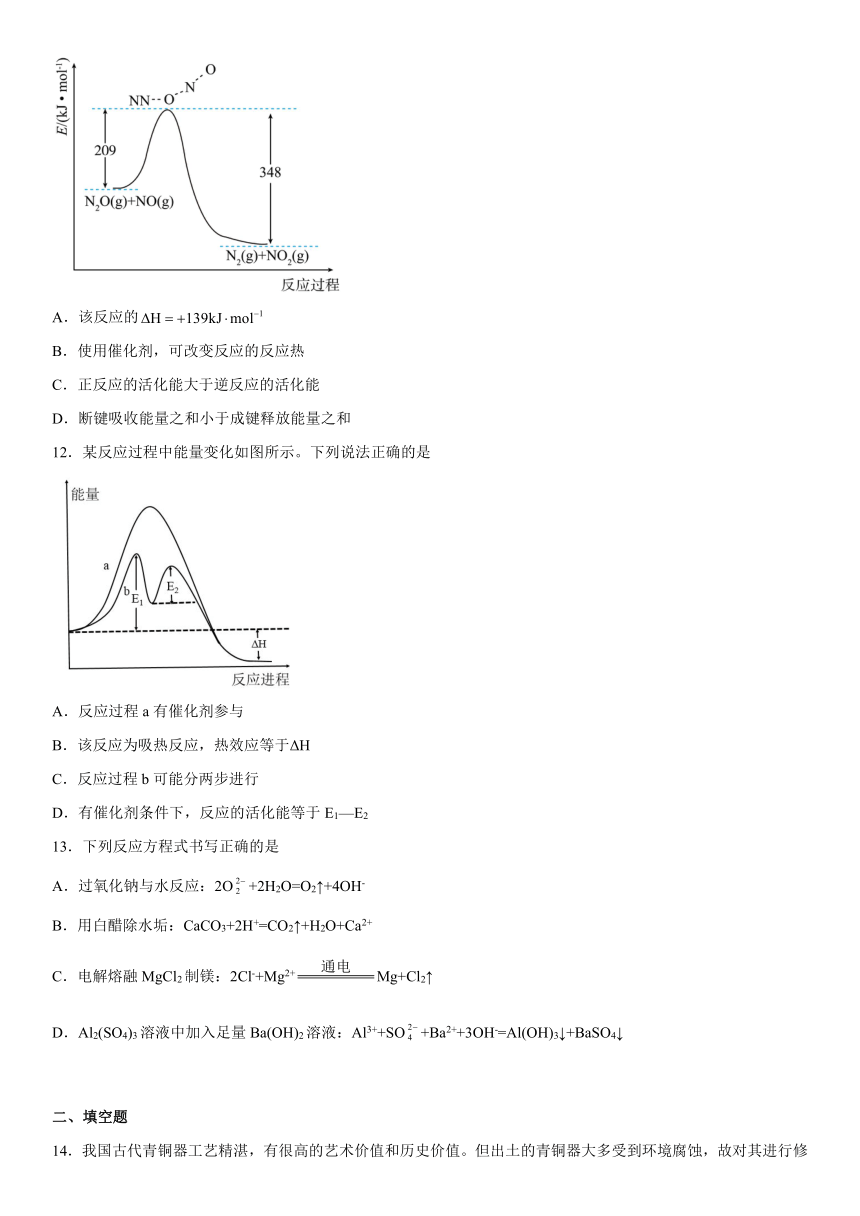
专题1《化学反应与能量变化》单元检测题
一、单选题
1.中科院研制出了双碳双离子电池,以石墨(Cn)和中间相炭微粒球(MCMB)为电极,电解质溶液为含有KPF6的有机溶液,其充电示意图如下。下列说法错误的是
A.固态KPF6为离子晶体
B.放电时MCMB电极为负极
C.充电时,若正极增重39g,则负极增重145g
D.充电时,阳极发生反应为Cn+xPF6--xe-=Cn(PF6)x
2.1,3-丁二烯在环己烷溶液中与溴发生加成反应时,会生成两种产物M和N(不考虑立体异构),其反应机理如图1所示;室温下,M可以缓慢转化为N,能量变化如图2所示。下列关于该过程的叙述正确的是
A.室温下,M的稳定性强于N
B. H= (E2-E1)kJ mol-1
C.N存在顺反异构体
D.有机物M的核磁共振氢谱中有四组峰,峰面积之比为2:1:2:2
3.下列化学反应的能量变化与如图不符合的是
A.2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O B.2Al+Fe2O32Fe+Al2O3
C.Mg+2HCl=MgCl2+H2↑ D.C+O2CO2
4.关于如图所示转化关系,下列说法正确的是
A.△H2>0
B.△H1>△H3
C.△H3 =△H1+△H2
D.△H1=△H2+△H3
5.“天朗气清,惠风和畅。”研究表明,利用Ir+可催化消除大气污染物N2O和CO,简化中间反应进程后,相对能量变化如图所示。已知CO(g)的燃烧热 H = -283 kJ·mol-1,则2N2O(g)=2N2(g) + O2(g)的反应热 H (kJ·mol-1)为
A.-152 B.-76 C.+76 D.+152
6.如图所示的装置,通电较长时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.64g某金属。下列说法中正确的是
A.甲池是b电极上析出金属银,乙池是c电极上析出某金属
B.甲池是a电极上析出金属银,乙池是d电极上析出某金属
C.该盐溶液可能是CuSO4溶液
D.该盐溶液可能是Mg(NO3)2溶液
7.游泳池水质普遍存在尿素超标现象,一种电化学除游泳池中尿素的实验装置如下图所示(样品溶液成分见图示),其中钌钛常用作析氯电极,不参与电解。已知:,下列说法正确的是
A.电解过程中不锈钢电极会缓慢发生腐蚀
B.电解过程中钌钛电极上发生反应为
C.电解过程中不锈钢电极附近pH降低
D.电解过程中每逸出22.4LN2,电路中至少通过6mol电子
8.下面四种燃料电池中正极的反应产物为水的是
A B C D
固体氧化物燃料电池 碱性燃料电池 质子交换膜燃料电池 熔融盐燃料电池
A.A B.B C.C D.D
9.分别取50 mL0.50 mol/L盐酸与50 mL0.55 mol/L氢氧化钠溶液混合进行中和热的测定,下列说法不正确的是
A.仪器A的名称是环形玻璃搅拌棒
B.用稍过量的氢氧化钠可确保盐酸完全反应
C.为减少热量损失,酸碱混合时需将量筒中NaOH溶液快速倒入小烧杯中
D.用稀硫酸和Ba(OH)2代替盐酸和NaOH溶液进行反应,结果也正确
10.科学家采用如图所示方法,可持续合成氨,跟氮气和氢气高温高压合成氨相比,反应条件更加温和。下列说法正确的是
A.该过程中Li和H2O作催化剂
B.三步反应都是氧化还原反应
C.反应Ⅲ可能是对LiOH溶液进行了电解
D.反应过程中每生成1mol NH3,同时生成0.75mol O2
11.一定温度和压强下,实验研究的化学反应能量变化如图所示。下列说法正确的是
A.该反应的
B.使用催化剂,可改变反应的反应热
C.正反应的活化能大于逆反应的活化能
D.断键吸收能量之和小于成键释放能量之和
12.某反应过程中能量变化如图所示。下列说法正确的是
A.反应过程a有催化剂参与
B.该反应为吸热反应,热效应等于ΔH
C.反应过程b可能分两步进行
D.有催化剂条件下,反应的活化能等于E1—E2
13.下列反应方程式书写正确的是
A.过氧化钠与水反应:2O+2H2O=O2↑+4OH-
B.用白醋除水垢:CaCO3+2H+=CO2↑+H2O+Ca2+
C.电解熔融MgCl2制镁:2Cl-+Mg2+Mg+Cl2↑
D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:Al3++SO+Ba2++3OH-=Al(OH)3↓+BaSO4↓
二、填空题
14.我国古代青铜器工艺精湛,有很高的艺术价值和历史价值。但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为_______。
(2)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为_______。
(3)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是_______(填“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉铜锈Cu2(OH)3Cl,其离子方程式为_______;
③若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为_______L(标准状况)。
15.某课外活动小组进行电解饱和食盐水的实验(如图)。请回答下列问题。
(1)通电一段时间后,可观察到___________电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为___________。
(2)该溶液电解反应的化学方程式为___________。
(3)若开始时改用铁棒做阳极,阳极的电极反应式为___________。
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。其中a是___极(填“正”或“负”),b极的电极反应式为___________。
16.如下图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
(1)电源电极X的名称为_______。
(2)pH变化:A_______(填“增大”、“减小”或“不变),B_______,C_______。
(3)写出A中电解的总反应的离子方程式_______。
(4)写出C中Ag电极的电极反应式_______。
(5)通电5min后,B中共收集224mL气体(标准状况),溶液体积为200mL,则通电前溶液的物质的量浓度为_______(设电解前后溶液体积无变化)。
17.城镇地面下常埋有纵横交错的多种金属管道,地面上还铺有铁轨等。当金属管道或铁轨在潮湿土壤中形成电流回路时,就会引起这些金属制品的腐蚀。为了防止这类腐蚀的发生,某同学设计了如图所示的装置,请分析其工作的原理_______。
三、计算题
18.根据要求,回答下列问题:
(1)已知甲烷的燃烧热为, 。写出CO燃烧的热化学方程式:_______,若、键的键能分别为、,则使1molCO转化为相应的原子时需要的能量是_______;1mol按上述方式燃烧时损失的热能是_______(保留1位小数)。
(2)煤的气化反应之一为
已知:①
②
③
则上述煤的生成的气化反应的_______。实际生产中该气化反应需要加入催化剂,其主要原因是_______(填“速率问题”或“平衡问题”)。
19.2022年2月,第24届冬奥会在中国北京、张家口两地成功举办。中国绿色碳汇基金会发起“我们的冬奥碳汇林”众筹项目。碳汇,是指通过植树造林、森林管理、植被恢复等措施,利用植物光合作用吸收大气中的二氧化碳,并将其固定在植被和土壤中,从而减少温室气体在大气中浓度的过程、活动或机制。已知利用植物的光合作用每吸收1 mol CO2需要吸收的能量约为470 kJ。请回答下列问题:
(1)碳汇过程中能量的转化形式为_______;有资料表明,某块林木通过光合作用大约吸收了1.88×107 kJ能量,则吸收的CO2为_______kg;葡萄糖完全燃烧生成液态水的热化学方程式为_______。
(2)工业废气中的CO2可用碱液吸收。已知:
①CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-a kJ/mol;
②CO2(g)+NaOH(aq)=NaHCO3(aq) △H =-bkJ/mol。
反应CO2(g)+Na2CO3(aq)+H2O(l)=2NaHCO3(aq)的△H=_______kJ/mol (用含a、b的代数式表示)。
(3)生产液晶显示器的过程中使用的化学清洗剂NF3和CO2一样,也是一种温室气体,其在大气中能够稳定存在数百年。下表是几种化学键的键能:
化学键 N≡N F-F N-F
键能/kJ/mol 946.0 157.0 283.0
①关于反应,△H=_______。
②NF3对半导体硅进行蚀刻时,在蚀刻物表面不留任何残留物,试写出蚀刻反应方程式_______。
四、实验题
20.某探究性学习小组为测量中和反应反应热,向20mL1.5mol·L-1NaOH溶液中逐滴滴加某浓度的H2SO4溶液,搅拌均匀后并迅速记录溶液温度,实验过程操作规范正确,测量的简易装置如图甲所示,根据实验数据绘制的曲线如图乙(已知水的比热容是4.2kJ kg-1 ℃-1)。
回答下列问题:
(1)仪器b的名称为____,若仪器a用环形铜制搅拌器代替环形玻璃搅拌器,则实验结果____(填“偏高”“偏低”或“不变”),图甲装置中碎泡沫塑料及泡沫塑料板的作用是_____。
(2)由图乙可知该实验环境温度是____,c(H2SO4)=____mol·L-1。
(3)依据图乙所示实验数据计算,该实验测得的中和反应反应热△H=____;若用浓硫酸代替稀硫酸,M点将_____(填“向左上方移动”“向右上方移动”或“不移动”)。
21.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体___g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):___。
名称 托盘天平(带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒
仪器
序号 a b c d e f
Ⅱ.中和热的测定:
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(3)仪器a的名称为___,实验中还需要用到的玻璃仪器是___。
(4)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 实验次数 起始温度t1/℃ 终止温度t2/℃ 温度差平均值(t2-t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1 ___
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.配制0.50mol/LNaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
(5)实验中改用30mL0.50mol/L的硫酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”),所求中和热的数值会___(填“相等”或“不相等”)。
参考答案:
1.C
【解析】A.由图可知,固态KPF6能电离生成PF和K+,则固态KPF6为离子晶体,故A正确;
B.根据放电时离子的移动方向可知充电时石墨电极为阳极、MCMB电极为阴极,则放电时石墨电极为正极、MCMB电极为负极,故B正确;
C.充电时,PF移向阳极、K+移向阴极,二者所带电荷数值相等,则移向阳极的PF和移向阴极的K+数目相等,即n(PF)=n(K+)=39g÷39g/mol=1mol,n(PF)=nM=1mol×145g/mol=145g,即充电时,若负极增重39g,则正极增重145g,故C错误;
D.充电时,阳极发生失去电子的氧化反应,即反应为Cn+xPF6--xe-=Cn(PF6)x,故D正确;
故选C。
2.C
【解析】A.能量越低,物质越稳定,由图2可看出,N的能量低于M的,故稳定性N强于M,A错误;
B.该反应为放热反应, H=生成物的总能量-反应物的总能量,即 H=( E1- E2 )kJ mol-1=-(E2-E1)kJ mol-1,该反应的热化学方程式为: H=-(E2-E1)kJ mol-1,B错误;
C.N中碳碳双键连接两种不同基团,存在顺反异构,顺式:,反式:,C正确;
D.有机物M结构简式:,核磁共振氢谱中有四组峰,峰面积之比为2:1:1:2,D错误;
故选C。
3.A
【解析】图示中,反应物的总能量大于生成物的总能量,为放热反应。
【解析】A.2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O,铵盐与碱反应吸热,故选A;
B.2Al+Fe2O32Fe+Al2O3,铝热反应放热,故不选B;
C.Mg+2HCl=MgCl2+H2↑,金属与酸反应放热,故不选C;
D.C+O2CO2,燃烧反应放热,故不选D;
选A。
4.D
【解析】A.CO(g)+O2(g)=CO2(g)为CO的燃烧,放出热量,△H2<0,故A错误;
B.C不充分燃烧生成CO,充分燃烧生成CO2,充分燃烧放出的热量大于不充分燃烧,焓变为负值,则△H1<△H3,故B错误;
C.根据①C(s)+O2(g)=CO2(g)△H1,②CO(g)+O2(g)=CO2(g)△H2,③C(s)+O2(g)=CO(g)△H3,结合盖斯定律③=①-②,则△H3 =△H1-△H2,故C错误;
D.根据①C(s)+O2(g)=CO2(g)△H1,②CO(g)+O2(g)=CO2(g)△H2,③C(s)+O2(g)=CO(g)△H3,结合盖斯定律①=②+③,则△H1=△H2+△H3,故D正确;
故选D。
5.A
【解析】已知CO(g)的燃烧热 H = -283 kJ·mol-1,可得①,由图可得N2O(g)+CO(g)=N2(g)+CO2(g) H=-330+123-229+77=-359kJ/mol②,由盖斯定律,(反应②-①)×2可得反应2N2O(g)=2N2(g) + O2(g),反应热 H =( -359+283)×2 =-152kJ·mol-1,故选:A。
6.C
【解析】甲池中a极与电源负极相连为阴极,电极上银离子得电子析出银单质,b电极为阳极,水电离出的氢氧根放电产生氧气,同时产生氢离子;乙池中c为阴极,d为阳极,乙池电极析出0.64g金属,金属应在c极析出,说明乙池中含有氧化性比氢离子强的金属阳离子。
【解析】A.甲池a极上析出金属银,乙池c极上析出某金属,故A错误;
B.甲池a极上析出金属银,乙池c极上析出某金属,故B错误;
C.甲池的a极银离子得电子析出银单质,2.16gAg的物质的量为,由Ag++e-=Ag,可知转移0.02mol电子,乙池电极析出0.64g金属,说明乙池中含有氧化性比氢离子强的金属阳离子,Cu2+氧化性强于氢离子,会先于氢离子放电,由Cu2++2e-=Cu,转移0.02mol电子生成0.01molCu,质量为m=n M=0.01mol×64g/mol=0.64g,则某盐溶液可能是CuSO4溶液,故C正确;
D.Mg2+氧化性弱于H+,电解时在溶液中不能得电子析出金属,所以某盐溶液不能是Mg(NO3)2溶液,故D错误;
故答案为C。
7.B
【解析】A.根据投料及电极的性能可知,a为电源负极,b为电源正极,钢电极做电解池阴极,相当于外接电流的阴极保护,不发生腐蚀,A项错误;
B.钌钛电极上氯离子失电子生成氯气,发生的电极反应式为,B项正确;
C.电解过程中不锈钢电极上水得电子生成氢气和氢氧根,发生的电极反应式为,其附近pH升高,C项错误;
D.未强调标准状况下,无法计算,D项错误;
故选B。
8.C
【解析】A.电解质为能够传导氧离子的固体氧化物,正极氧气得电子生成氧离子,故A不选;
B.电解质溶液是氢氧化钾,正极上氧气得电子与水反应生成氢氧根离子,故B不选;
C.存在质子交换膜,正极上氧气得电子和氢离子反应生成水,故C选;
D.电解质为熔融碳酸盐,正极氧气得电子结合二氧化碳生成碳酸根离子,故D不选;
故选C。
9.D
【解析】A.根据装置图可知:仪器A的名称是环形玻璃搅拌棒,A正确;
B.HCl与NaOH发生中和反应,反应方程式为:HCl+NaOH=NaCl+H2O,可见二者反应的物质的量的比是1:1。由于任何反应都具有一定的可逆性,为保证盐酸完全反应,加入的NaOH溶液中溶质的物质的量稍微过量,B正确;
C.为减少酸碱中和反应过程的热量损失,酸碱混合时需将量筒中NaOH溶液一次性快速倒入小烧杯中,C正确;
D.若用稀硫酸和Ba(OH)2代替盐酸和NaOH溶液进行反应,由于此时除H+与OH-反应产生H2O放出热量,还有Ba2+与结合形成BaSO4沉淀也放出热量,因此会导致实验结果不准确,D错误;
故合理选项是D。
10.D
【解析】A.从图中可以看出,该反应中Li参加了反应,最终又生成了Li,所以Li是催化剂。虽然在第二步水也参加了反应,第三步生成了水,但总反应为2N2+6H2O=3O2+4NH3,所以水为反应物,故A错误;
B.第二步反应是Li3N和水反应生成LiOH和NH3,没有化合价变化,不是氧化还原反应,故B错误;
C.电解LiOH溶液时,在阴极不可能是Li+得电子生成Li,故C错误;
D.根据总反应方程式:2N2+6H2O=3O2+4NH3,每生成1mol NH3,同时生成0.75mol O2,故D正确;
故选D。
11.D
【解析】A.根据图中数据,该反应的,A错误;
B.使用催化剂只能改变反应的速率,不能改变反应的反应热,B错误;
C.正反应的活化能为209,逆反应的活化能为348,正反应的活化能小于逆反应的活化能,C错误;
D.如图所示反应物到过渡态需要吸收能量为209,过渡态到产物放出能量为348,故断键吸收的能量小于成键放出的能量,D正确;
故选D。
12.C
【解析】A.催化剂能降低反应的活化能,则b中使用了催化剂,A说法错误;
B.反应物能量高于生成物,为放热反应, H=生成物能量-反应物能量,B说法错误;
C.根据图象可知,反应过程b可能分两步进行,C说法正确;
D.E1、E2表示反应过程中不同步反应的活化能,整个反应的活化能为能量较高的E1,D说法错误;
故选C。
13.C
【解析】A.过氧化钠和水反应生成氢氧化钠和氧气,离子方程式为:,A错误;
B.白醋可除去水壶中的水垢,白醋为弱酸,不可拆成离子形式,离子方程式为:,B错误;
C.工业上电解熔融的氯化镁制金属镁,发生反应的离子方程式为:2Cl-+Mg2+Mg+Cl2↑,C正确;
D.Ba(OH)2足量,最终会得到偏铝酸根,D错误;
故选C。
14.(1)10∶1
(2)Ag2O+2CuCl=2AgCl+Cu2O
(3) c 2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ 0.448
【解析】(1)
根据N=×NA,青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子数目之比为:=10:1;
(2)
复分解反应为相互交换成分的反应,因此该反应的化学方程式为Ag2O+2CuCl=2AgCl+Cu2O;
(3)
①负极发生失电子的反应,铜作负极失电子,因此负极为c,其中负极反应:Cu-2e-=Cu2+,正极反应:O2+2H2O+4e-=4OH-;
②正极产物为OH-,负极产物为Cu2+,两者与Cl-反应生成Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
③4.29 g Cu2(OH)3Cl的物质的量为0.02 mol,由Cu元素守恒知,发生电化学腐蚀失电子的Cu单质的物质的量为0.04 mol,失去电子0.08 mol,根据电子守恒可得,消耗O2的物质的量为=0.02 mol,所以理论上消耗氧气的体积为0.448 L(标准状况)。
15. 阴极 2H++2e-=H2↑ 2NaCl+2H2OCl2↑+H2↑+2NaOH Fe-2e-═Fe2+ 负 O2+2H2O+4e-→4OH-
【解析】(1)阴极氢离子放电产生氢氧根离子使附近溶液颜色先变红,电极反应方程式为:2H++2e-=H2↑,故答案为阴极;2H++2e-=H2↑;
(2)阳极是还原性强的氯离子放电生成氯气,阴极是氢离子放电生成氢气,所以电解反应的化学方程式为2NaCl+2H2OCl2↑+H2↑+2NaOH;
(3)金属作阳极,阳极是活泼金属铁本身放电,电极反应方程式为:Fe-2e-═Fe2+;
(4)通氢气的一极发生氧化反应是负极;b极氧气发生还原反应是正极,故答案为负;O2+2H2O+4e-═4OH-。
16.(1)负极
(2) 增大 减小 不变
(3)
(4)
(5)
【解析】该装置为电解池,通电5min后,铜电极质量增加2.16g,则说明铜电极为阴极,溶液中的Ag+在铜电极上得到电子生成银:Ag++e-=Ag,2.16gAg的物质的量为0.02mol,所以电路中转移电子为0.02mol。
【解析】(1)铜为阴极,则电源电极X为负极;
(2)A装置中阳极是Cl-失去电子变为氯气,阴极是水电离出来的H+得到电子生成氢气,水电离出H+的同时会电离出OH-,导致溶液中OH-浓度增大,溶液pH增大;B装置阴极是Cu2+得到电子生成铜,阳极是水电离出来的OH-失去电子生成氧气,水电离出OH-的同时还电离出H+,导致溶液中H+浓度增大,溶液的pH减小;C装置阳极是电极材料Ag失去电子生成Ag+,同时溶液中的Ag+在阴极得到电子变为Ag析出,溶液的pH不变;
(3)A中放电的是Cl-和水电离的H+,生成氢气、NaOH和氯气,电解总反应的离子方程式为:;
(4)C中银为阳极,在阳极,银失去电子变为Ag+,电极反应式为:;
(5)B中收集到的224mL气体的物质的量为0.01mol。在B中,阳极始终是水电离出来的OH-失去电子生成氧气:2H2O-4e-=O2↑+4H+,通电5min,电路中转移电子为0.02mol,则生成的氧气为0.005mol,所以在阴极还有0.005molH2生成,即阴极开始时是溶液中的Cu2+得到电子生成Cu,当Cu2+消耗结束时,溶液中的H+得到电子生成H2:2H++2e-=H2↑,生成0.005molH2,转移0.01mol电子,则铜离子生成铜转移0.001mol电子,根据电极反应式:Cu2++2e-=Cu可知,溶液中的Cu2+为0.005mol,所以通电前CuSO4溶液的物质的量浓度为0.005mol÷0.2L=0.025mol/L。
17.钢铁输水管与镁块相连形成原电池,镁作负极,发生氧化反应被腐蚀,钢铁输水管作正极,受到保护
【解析】根据牺牲阳极的阴极保护法分析解答。
【解析】镁比铁活泼,根据图示,钢铁输水管与镁块相连形成原电池,镁作负极,发生氧化反应被腐蚀,钢铁输水管作正极,受到保护,避免了钢铁输水管的腐蚀,故答案为:钢铁输水管与镁块相连形成原电池,镁作负极,发生氧化反应被腐蚀,钢铁输水管作正极,受到保护。
18.(1) 188.7kJ
(2) 速率问题
【解析】(1)题中已知①
已知甲烷的燃烧热为,可写出热化学方程式
②
由方程式(②×3-①) × 可得CO燃烧的热化学方程式
;
根据=反应物总键能-生成物总键能,键能+×-2×=,求得键能为,则使1molCO转化为相应的原子时需要的能量是;
1mol按上述方式燃烧时放出热量为kJ≈701.3 kJ,损失的热能是890kJ -701.3kJ=188.7kJ;
(2)根据盖斯定律,方程式①×2+③×2-②,可得 ==;催化剂能加快反应速率,但不影响平衡状态,实际生产中该气化反应需要加入催化剂,其主要原因是速率问题。
19.(1) 太阳能转化为化学能 1760 C6H12O6(s)+6CO2(g)=6CO2(g) +6H2O(l) △H= - 2820 kJ/ mol
(2)-(2b-a)
(3) -281.0 kJ/mol 4NF3+3Si=2N2↑+3SiF4↑
【解析】(1)碳汇过程中,利用植物的光合作用每吸收l mol CO2需要吸收的能量约为470 kJ,能量的转化形式为太阳能转化为化学能;每吸收l mol CO2需要吸收的能量约为470 kJ,某块林木通过光合作用大约吸收了1.88×107 kJ能量,则其吸收的CO2物质的量为n(CO2)=,其吸收CO2气体的质量为m(CO2)=4×104 mol×44g/ mol=1.76×106 g=1760 kg;
碳汇过程中,利用植物的光合作用每吸收l mol CO2需要吸收的能量约为470 kJ,则吸收6 mol CO2反应产生1 mol葡萄糖C6H12O6时吸收能量Q=6 mol×470 kJ/mol=2820 kJ,因此1 mol葡萄糖完全燃烧生成液态水放出热量为2820 kJ,因此葡萄糖完全燃烧生成液态水的热化学方程式为:C6H12O6(s)+6CO2(g)=6CO2(g)+6H2O(l) △H= - 2820 kJ/ mol;
(2)①CO2(g)+2NaOH(aq) =Na2CO3(aq)+H2O(l) △H=-a kJ/mol;②CO2(g)+NaOH(aq) =NaHCO3(aq) △H =-bkJ/mol,根据盖斯定律②×2-①得CO2(g)+Na2CO3(aq)+H2O(l)=2NaHCO3(aq) △H=-(2b-a) kJ/mol;
(3)①反应热等于反应物总键能与生成物总键能的差,则N2(g)+3F2(g)=2NF3(g)的反应热△H=(946.0+3×157.0)kJ/mol-(6×283.0)kJ/mol=-281.0 kJ/mol;
②NF3对半导体硅进行蚀刻时,生成N2和SiF4,根据原子守恒、电子守恒,可得其反应的化学方程式为:4NF3+3Si=2N2↑+3SiF4↑。
20.(1) 温度计 偏低 起到保温隔热的作用,防止热量散失
(2) 21℃ 0.5
(3) —49kJ/mol 向左上方移动
【解析】(1)
由实验装置图可知,仪器b为温度计;金属铜会传递热量,若仪器a用环形铜制搅拌器代替环形玻璃搅拌器会造成热量散失,导致实验结果偏低;装置中碎泡沫塑料及泡沫塑料板能起到保温隔热的作用,减少实验过程中热量的散失,故答案为:温度计;偏低;起到保温隔热的作用,防止热量散失;
(2)
由图可知,未加入稀硫酸时,溶液温度为21℃,说明实验环境温度是21℃;加入30mL硫酸时,溶液温度最高,说明酸碱恰好完全反应,则稀硫酸的浓度为=0.5mol/L,故答案为:21℃;0.5;
(3)
由图可知,氢氧化钠溶液完全反应时生成0.03mol水,溶液温度升高△t= (28—21) ℃=7℃,则反应放出的热量Q=mc△t= (20+30)mL×1g/mL×10—3kg/g×4.2kJ kg-1 ℃-1×7℃=1.47kJ,则中和反应反应热△H=—=-49kJ/mol;若用浓硫酸代替稀硫酸,浓硫酸稀释时会放出热量,使反应后溶液的温度升高,且与氢氧化钠溶液反应消耗硫酸的体积会减小,所以M点将向左上方移动,故答案为:-49;左上方移动。
21. 5.0 abe 玻璃搅拌器 量筒 4.0 -53.5kJ/mol acd 不相等 相等
【解析】Ⅰ.(1)没有245mL的容量瓶,只能用250mL的容量瓶,需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g;
(2)氢氧化钠要在小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、烧杯和药匙,即答案为a b e;
Ⅱ.(3)仪器A为玻璃搅拌器。实验中还需要用量筒量取酸和碱溶液的体积。
(4)第一次测定温度差为:(30.1-26.1)℃=4.0℃,第二次测定的温度差为:(33.3-27.2)℃=6.1℃,第三次测定的温度差为:(29.8-25.9)℃=3.9℃,第四次测定的温度差为:(30.4-26.3)℃=4.1℃,实验2的误差太大要舍去,三次温度差的平均值为4.0℃;50mL 0.50mol/L氢氧化钠与30mL 0.50mol/L硫酸溶液进行中和反应,硫酸是过量的,生成水的物质的量和氢氧化钠的物质的量相等。所以生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80mL×1g/mL=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为:Q=m c △T=80g×4.18J/(g ℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热△H=-1.3376kJ÷0.025mol=-53.5kJ/mol,此数值比57.3kJ/mol小。
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a选;
b.配制0.50mol/LNaOH溶液时俯视刻度线读数,加入的水不够,溶液体积偏小,使NaOH溶液浓度偏大,和硫酸中和时放热多,使中和热数值偏大,故b不选;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c选;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,导致温度计上残留的碱液与稀硫酸反应,起始温度偏高,测量值偏小,故d选;
e.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故e不选;
故答案选acd。
(5)实验中改用30mL0.5mol/L硫酸跟50mL0.55mol/L氢氧化钠进行反应,与上述实验相比,生成的水不同,所放出的热量不相等;由于中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,与酸碱用量无关,因此所求的中和热数值不变。
一、单选题
1.中科院研制出了双碳双离子电池,以石墨(Cn)和中间相炭微粒球(MCMB)为电极,电解质溶液为含有KPF6的有机溶液,其充电示意图如下。下列说法错误的是
A.固态KPF6为离子晶体
B.放电时MCMB电极为负极
C.充电时,若正极增重39g,则负极增重145g
D.充电时,阳极发生反应为Cn+xPF6--xe-=Cn(PF6)x
2.1,3-丁二烯在环己烷溶液中与溴发生加成反应时,会生成两种产物M和N(不考虑立体异构),其反应机理如图1所示;室温下,M可以缓慢转化为N,能量变化如图2所示。下列关于该过程的叙述正确的是
A.室温下,M的稳定性强于N
B. H= (E2-E1)kJ mol-1
C.N存在顺反异构体
D.有机物M的核磁共振氢谱中有四组峰,峰面积之比为2:1:2:2
3.下列化学反应的能量变化与如图不符合的是
A.2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O B.2Al+Fe2O32Fe+Al2O3
C.Mg+2HCl=MgCl2+H2↑ D.C+O2CO2
4.关于如图所示转化关系,下列说法正确的是
A.△H2>0
B.△H1>△H3
C.△H3 =△H1+△H2
D.△H1=△H2+△H3
5.“天朗气清,惠风和畅。”研究表明,利用Ir+可催化消除大气污染物N2O和CO,简化中间反应进程后,相对能量变化如图所示。已知CO(g)的燃烧热 H = -283 kJ·mol-1,则2N2O(g)=2N2(g) + O2(g)的反应热 H (kJ·mol-1)为
A.-152 B.-76 C.+76 D.+152
6.如图所示的装置,通电较长时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.64g某金属。下列说法中正确的是
A.甲池是b电极上析出金属银,乙池是c电极上析出某金属
B.甲池是a电极上析出金属银,乙池是d电极上析出某金属
C.该盐溶液可能是CuSO4溶液
D.该盐溶液可能是Mg(NO3)2溶液
7.游泳池水质普遍存在尿素超标现象,一种电化学除游泳池中尿素的实验装置如下图所示(样品溶液成分见图示),其中钌钛常用作析氯电极,不参与电解。已知:,下列说法正确的是
A.电解过程中不锈钢电极会缓慢发生腐蚀
B.电解过程中钌钛电极上发生反应为
C.电解过程中不锈钢电极附近pH降低
D.电解过程中每逸出22.4LN2,电路中至少通过6mol电子
8.下面四种燃料电池中正极的反应产物为水的是
A B C D
固体氧化物燃料电池 碱性燃料电池 质子交换膜燃料电池 熔融盐燃料电池
A.A B.B C.C D.D
9.分别取50 mL0.50 mol/L盐酸与50 mL0.55 mol/L氢氧化钠溶液混合进行中和热的测定,下列说法不正确的是
A.仪器A的名称是环形玻璃搅拌棒
B.用稍过量的氢氧化钠可确保盐酸完全反应
C.为减少热量损失,酸碱混合时需将量筒中NaOH溶液快速倒入小烧杯中
D.用稀硫酸和Ba(OH)2代替盐酸和NaOH溶液进行反应,结果也正确
10.科学家采用如图所示方法,可持续合成氨,跟氮气和氢气高温高压合成氨相比,反应条件更加温和。下列说法正确的是
A.该过程中Li和H2O作催化剂
B.三步反应都是氧化还原反应
C.反应Ⅲ可能是对LiOH溶液进行了电解
D.反应过程中每生成1mol NH3,同时生成0.75mol O2
11.一定温度和压强下,实验研究的化学反应能量变化如图所示。下列说法正确的是
A.该反应的
B.使用催化剂,可改变反应的反应热
C.正反应的活化能大于逆反应的活化能
D.断键吸收能量之和小于成键释放能量之和
12.某反应过程中能量变化如图所示。下列说法正确的是
A.反应过程a有催化剂参与
B.该反应为吸热反应,热效应等于ΔH
C.反应过程b可能分两步进行
D.有催化剂条件下,反应的活化能等于E1—E2
13.下列反应方程式书写正确的是
A.过氧化钠与水反应:2O+2H2O=O2↑+4OH-
B.用白醋除水垢:CaCO3+2H+=CO2↑+H2O+Ca2+
C.电解熔融MgCl2制镁:2Cl-+Mg2+Mg+Cl2↑
D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:Al3++SO+Ba2++3OH-=Al(OH)3↓+BaSO4↓
二、填空题
14.我国古代青铜器工艺精湛,有很高的艺术价值和历史价值。但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为_______。
(2)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为_______。
(3)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是_______(填“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉铜锈Cu2(OH)3Cl,其离子方程式为_______;
③若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为_______L(标准状况)。
15.某课外活动小组进行电解饱和食盐水的实验(如图)。请回答下列问题。
(1)通电一段时间后,可观察到___________电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为___________。
(2)该溶液电解反应的化学方程式为___________。
(3)若开始时改用铁棒做阳极,阳极的电极反应式为___________。
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。其中a是___极(填“正”或“负”),b极的电极反应式为___________。
16.如下图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
(1)电源电极X的名称为_______。
(2)pH变化:A_______(填“增大”、“减小”或“不变),B_______,C_______。
(3)写出A中电解的总反应的离子方程式_______。
(4)写出C中Ag电极的电极反应式_______。
(5)通电5min后,B中共收集224mL气体(标准状况),溶液体积为200mL,则通电前溶液的物质的量浓度为_______(设电解前后溶液体积无变化)。
17.城镇地面下常埋有纵横交错的多种金属管道,地面上还铺有铁轨等。当金属管道或铁轨在潮湿土壤中形成电流回路时,就会引起这些金属制品的腐蚀。为了防止这类腐蚀的发生,某同学设计了如图所示的装置,请分析其工作的原理_______。
三、计算题
18.根据要求,回答下列问题:
(1)已知甲烷的燃烧热为, 。写出CO燃烧的热化学方程式:_______,若、键的键能分别为、,则使1molCO转化为相应的原子时需要的能量是_______;1mol按上述方式燃烧时损失的热能是_______(保留1位小数)。
(2)煤的气化反应之一为
已知:①
②
③
则上述煤的生成的气化反应的_______。实际生产中该气化反应需要加入催化剂,其主要原因是_______(填“速率问题”或“平衡问题”)。
19.2022年2月,第24届冬奥会在中国北京、张家口两地成功举办。中国绿色碳汇基金会发起“我们的冬奥碳汇林”众筹项目。碳汇,是指通过植树造林、森林管理、植被恢复等措施,利用植物光合作用吸收大气中的二氧化碳,并将其固定在植被和土壤中,从而减少温室气体在大气中浓度的过程、活动或机制。已知利用植物的光合作用每吸收1 mol CO2需要吸收的能量约为470 kJ。请回答下列问题:
(1)碳汇过程中能量的转化形式为_______;有资料表明,某块林木通过光合作用大约吸收了1.88×107 kJ能量,则吸收的CO2为_______kg;葡萄糖完全燃烧生成液态水的热化学方程式为_______。
(2)工业废气中的CO2可用碱液吸收。已知:
①CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-a kJ/mol;
②CO2(g)+NaOH(aq)=NaHCO3(aq) △H =-bkJ/mol。
反应CO2(g)+Na2CO3(aq)+H2O(l)=2NaHCO3(aq)的△H=_______kJ/mol (用含a、b的代数式表示)。
(3)生产液晶显示器的过程中使用的化学清洗剂NF3和CO2一样,也是一种温室气体,其在大气中能够稳定存在数百年。下表是几种化学键的键能:
化学键 N≡N F-F N-F
键能/kJ/mol 946.0 157.0 283.0
①关于反应,△H=_______。
②NF3对半导体硅进行蚀刻时,在蚀刻物表面不留任何残留物,试写出蚀刻反应方程式_______。
四、实验题
20.某探究性学习小组为测量中和反应反应热,向20mL1.5mol·L-1NaOH溶液中逐滴滴加某浓度的H2SO4溶液,搅拌均匀后并迅速记录溶液温度,实验过程操作规范正确,测量的简易装置如图甲所示,根据实验数据绘制的曲线如图乙(已知水的比热容是4.2kJ kg-1 ℃-1)。
回答下列问题:
(1)仪器b的名称为____,若仪器a用环形铜制搅拌器代替环形玻璃搅拌器,则实验结果____(填“偏高”“偏低”或“不变”),图甲装置中碎泡沫塑料及泡沫塑料板的作用是_____。
(2)由图乙可知该实验环境温度是____,c(H2SO4)=____mol·L-1。
(3)依据图乙所示实验数据计算,该实验测得的中和反应反应热△H=____;若用浓硫酸代替稀硫酸,M点将_____(填“向左上方移动”“向右上方移动”或“不移动”)。
21.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体___g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):___。
名称 托盘天平(带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒
仪器
序号 a b c d e f
Ⅱ.中和热的测定:
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(3)仪器a的名称为___,实验中还需要用到的玻璃仪器是___。
(4)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 实验次数 起始温度t1/℃ 终止温度t2/℃ 温度差平均值(t2-t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1 ___
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.配制0.50mol/LNaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
(5)实验中改用30mL0.50mol/L的硫酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”),所求中和热的数值会___(填“相等”或“不相等”)。
参考答案:
1.C
【解析】A.由图可知,固态KPF6能电离生成PF和K+,则固态KPF6为离子晶体,故A正确;
B.根据放电时离子的移动方向可知充电时石墨电极为阳极、MCMB电极为阴极,则放电时石墨电极为正极、MCMB电极为负极,故B正确;
C.充电时,PF移向阳极、K+移向阴极,二者所带电荷数值相等,则移向阳极的PF和移向阴极的K+数目相等,即n(PF)=n(K+)=39g÷39g/mol=1mol,n(PF)=nM=1mol×145g/mol=145g,即充电时,若负极增重39g,则正极增重145g,故C错误;
D.充电时,阳极发生失去电子的氧化反应,即反应为Cn+xPF6--xe-=Cn(PF6)x,故D正确;
故选C。
2.C
【解析】A.能量越低,物质越稳定,由图2可看出,N的能量低于M的,故稳定性N强于M,A错误;
B.该反应为放热反应, H=生成物的总能量-反应物的总能量,即 H=( E1- E2 )kJ mol-1=-(E2-E1)kJ mol-1,该反应的热化学方程式为: H=-(E2-E1)kJ mol-1,B错误;
C.N中碳碳双键连接两种不同基团,存在顺反异构,顺式:,反式:,C正确;
D.有机物M结构简式:,核磁共振氢谱中有四组峰,峰面积之比为2:1:1:2,D错误;
故选C。
3.A
【解析】图示中,反应物的总能量大于生成物的总能量,为放热反应。
【解析】A.2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O,铵盐与碱反应吸热,故选A;
B.2Al+Fe2O32Fe+Al2O3,铝热反应放热,故不选B;
C.Mg+2HCl=MgCl2+H2↑,金属与酸反应放热,故不选C;
D.C+O2CO2,燃烧反应放热,故不选D;
选A。
4.D
【解析】A.CO(g)+O2(g)=CO2(g)为CO的燃烧,放出热量,△H2<0,故A错误;
B.C不充分燃烧生成CO,充分燃烧生成CO2,充分燃烧放出的热量大于不充分燃烧,焓变为负值,则△H1<△H3,故B错误;
C.根据①C(s)+O2(g)=CO2(g)△H1,②CO(g)+O2(g)=CO2(g)△H2,③C(s)+O2(g)=CO(g)△H3,结合盖斯定律③=①-②,则△H3 =△H1-△H2,故C错误;
D.根据①C(s)+O2(g)=CO2(g)△H1,②CO(g)+O2(g)=CO2(g)△H2,③C(s)+O2(g)=CO(g)△H3,结合盖斯定律①=②+③,则△H1=△H2+△H3,故D正确;
故选D。
5.A
【解析】已知CO(g)的燃烧热 H = -283 kJ·mol-1,可得①,由图可得N2O(g)+CO(g)=N2(g)+CO2(g) H=-330+123-229+77=-359kJ/mol②,由盖斯定律,(反应②-①)×2可得反应2N2O(g)=2N2(g) + O2(g),反应热 H =( -359+283)×2 =-152kJ·mol-1,故选:A。
6.C
【解析】甲池中a极与电源负极相连为阴极,电极上银离子得电子析出银单质,b电极为阳极,水电离出的氢氧根放电产生氧气,同时产生氢离子;乙池中c为阴极,d为阳极,乙池电极析出0.64g金属,金属应在c极析出,说明乙池中含有氧化性比氢离子强的金属阳离子。
【解析】A.甲池a极上析出金属银,乙池c极上析出某金属,故A错误;
B.甲池a极上析出金属银,乙池c极上析出某金属,故B错误;
C.甲池的a极银离子得电子析出银单质,2.16gAg的物质的量为,由Ag++e-=Ag,可知转移0.02mol电子,乙池电极析出0.64g金属,说明乙池中含有氧化性比氢离子强的金属阳离子,Cu2+氧化性强于氢离子,会先于氢离子放电,由Cu2++2e-=Cu,转移0.02mol电子生成0.01molCu,质量为m=n M=0.01mol×64g/mol=0.64g,则某盐溶液可能是CuSO4溶液,故C正确;
D.Mg2+氧化性弱于H+,电解时在溶液中不能得电子析出金属,所以某盐溶液不能是Mg(NO3)2溶液,故D错误;
故答案为C。
7.B
【解析】A.根据投料及电极的性能可知,a为电源负极,b为电源正极,钢电极做电解池阴极,相当于外接电流的阴极保护,不发生腐蚀,A项错误;
B.钌钛电极上氯离子失电子生成氯气,发生的电极反应式为,B项正确;
C.电解过程中不锈钢电极上水得电子生成氢气和氢氧根,发生的电极反应式为,其附近pH升高,C项错误;
D.未强调标准状况下,无法计算,D项错误;
故选B。
8.C
【解析】A.电解质为能够传导氧离子的固体氧化物,正极氧气得电子生成氧离子,故A不选;
B.电解质溶液是氢氧化钾,正极上氧气得电子与水反应生成氢氧根离子,故B不选;
C.存在质子交换膜,正极上氧气得电子和氢离子反应生成水,故C选;
D.电解质为熔融碳酸盐,正极氧气得电子结合二氧化碳生成碳酸根离子,故D不选;
故选C。
9.D
【解析】A.根据装置图可知:仪器A的名称是环形玻璃搅拌棒,A正确;
B.HCl与NaOH发生中和反应,反应方程式为:HCl+NaOH=NaCl+H2O,可见二者反应的物质的量的比是1:1。由于任何反应都具有一定的可逆性,为保证盐酸完全反应,加入的NaOH溶液中溶质的物质的量稍微过量,B正确;
C.为减少酸碱中和反应过程的热量损失,酸碱混合时需将量筒中NaOH溶液一次性快速倒入小烧杯中,C正确;
D.若用稀硫酸和Ba(OH)2代替盐酸和NaOH溶液进行反应,由于此时除H+与OH-反应产生H2O放出热量,还有Ba2+与结合形成BaSO4沉淀也放出热量,因此会导致实验结果不准确,D错误;
故合理选项是D。
10.D
【解析】A.从图中可以看出,该反应中Li参加了反应,最终又生成了Li,所以Li是催化剂。虽然在第二步水也参加了反应,第三步生成了水,但总反应为2N2+6H2O=3O2+4NH3,所以水为反应物,故A错误;
B.第二步反应是Li3N和水反应生成LiOH和NH3,没有化合价变化,不是氧化还原反应,故B错误;
C.电解LiOH溶液时,在阴极不可能是Li+得电子生成Li,故C错误;
D.根据总反应方程式:2N2+6H2O=3O2+4NH3,每生成1mol NH3,同时生成0.75mol O2,故D正确;
故选D。
11.D
【解析】A.根据图中数据,该反应的,A错误;
B.使用催化剂只能改变反应的速率,不能改变反应的反应热,B错误;
C.正反应的活化能为209,逆反应的活化能为348,正反应的活化能小于逆反应的活化能,C错误;
D.如图所示反应物到过渡态需要吸收能量为209,过渡态到产物放出能量为348,故断键吸收的能量小于成键放出的能量,D正确;
故选D。
12.C
【解析】A.催化剂能降低反应的活化能,则b中使用了催化剂,A说法错误;
B.反应物能量高于生成物,为放热反应, H=生成物能量-反应物能量,B说法错误;
C.根据图象可知,反应过程b可能分两步进行,C说法正确;
D.E1、E2表示反应过程中不同步反应的活化能,整个反应的活化能为能量较高的E1,D说法错误;
故选C。
13.C
【解析】A.过氧化钠和水反应生成氢氧化钠和氧气,离子方程式为:,A错误;
B.白醋可除去水壶中的水垢,白醋为弱酸,不可拆成离子形式,离子方程式为:,B错误;
C.工业上电解熔融的氯化镁制金属镁,发生反应的离子方程式为:2Cl-+Mg2+Mg+Cl2↑,C正确;
D.Ba(OH)2足量,最终会得到偏铝酸根,D错误;
故选C。
14.(1)10∶1
(2)Ag2O+2CuCl=2AgCl+Cu2O
(3) c 2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ 0.448
【解析】(1)
根据N=×NA,青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子数目之比为:=10:1;
(2)
复分解反应为相互交换成分的反应,因此该反应的化学方程式为Ag2O+2CuCl=2AgCl+Cu2O;
(3)
①负极发生失电子的反应,铜作负极失电子,因此负极为c,其中负极反应:Cu-2e-=Cu2+,正极反应:O2+2H2O+4e-=4OH-;
②正极产物为OH-,负极产物为Cu2+,两者与Cl-反应生成Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
③4.29 g Cu2(OH)3Cl的物质的量为0.02 mol,由Cu元素守恒知,发生电化学腐蚀失电子的Cu单质的物质的量为0.04 mol,失去电子0.08 mol,根据电子守恒可得,消耗O2的物质的量为=0.02 mol,所以理论上消耗氧气的体积为0.448 L(标准状况)。
15. 阴极 2H++2e-=H2↑ 2NaCl+2H2OCl2↑+H2↑+2NaOH Fe-2e-═Fe2+ 负 O2+2H2O+4e-→4OH-
【解析】(1)阴极氢离子放电产生氢氧根离子使附近溶液颜色先变红,电极反应方程式为:2H++2e-=H2↑,故答案为阴极;2H++2e-=H2↑;
(2)阳极是还原性强的氯离子放电生成氯气,阴极是氢离子放电生成氢气,所以电解反应的化学方程式为2NaCl+2H2OCl2↑+H2↑+2NaOH;
(3)金属作阳极,阳极是活泼金属铁本身放电,电极反应方程式为:Fe-2e-═Fe2+;
(4)通氢气的一极发生氧化反应是负极;b极氧气发生还原反应是正极,故答案为负;O2+2H2O+4e-═4OH-。
16.(1)负极
(2) 增大 减小 不变
(3)
(4)
(5)
【解析】该装置为电解池,通电5min后,铜电极质量增加2.16g,则说明铜电极为阴极,溶液中的Ag+在铜电极上得到电子生成银:Ag++e-=Ag,2.16gAg的物质的量为0.02mol,所以电路中转移电子为0.02mol。
【解析】(1)铜为阴极,则电源电极X为负极;
(2)A装置中阳极是Cl-失去电子变为氯气,阴极是水电离出来的H+得到电子生成氢气,水电离出H+的同时会电离出OH-,导致溶液中OH-浓度增大,溶液pH增大;B装置阴极是Cu2+得到电子生成铜,阳极是水电离出来的OH-失去电子生成氧气,水电离出OH-的同时还电离出H+,导致溶液中H+浓度增大,溶液的pH减小;C装置阳极是电极材料Ag失去电子生成Ag+,同时溶液中的Ag+在阴极得到电子变为Ag析出,溶液的pH不变;
(3)A中放电的是Cl-和水电离的H+,生成氢气、NaOH和氯气,电解总反应的离子方程式为:;
(4)C中银为阳极,在阳极,银失去电子变为Ag+,电极反应式为:;
(5)B中收集到的224mL气体的物质的量为0.01mol。在B中,阳极始终是水电离出来的OH-失去电子生成氧气:2H2O-4e-=O2↑+4H+,通电5min,电路中转移电子为0.02mol,则生成的氧气为0.005mol,所以在阴极还有0.005molH2生成,即阴极开始时是溶液中的Cu2+得到电子生成Cu,当Cu2+消耗结束时,溶液中的H+得到电子生成H2:2H++2e-=H2↑,生成0.005molH2,转移0.01mol电子,则铜离子生成铜转移0.001mol电子,根据电极反应式:Cu2++2e-=Cu可知,溶液中的Cu2+为0.005mol,所以通电前CuSO4溶液的物质的量浓度为0.005mol÷0.2L=0.025mol/L。
17.钢铁输水管与镁块相连形成原电池,镁作负极,发生氧化反应被腐蚀,钢铁输水管作正极,受到保护
【解析】根据牺牲阳极的阴极保护法分析解答。
【解析】镁比铁活泼,根据图示,钢铁输水管与镁块相连形成原电池,镁作负极,发生氧化反应被腐蚀,钢铁输水管作正极,受到保护,避免了钢铁输水管的腐蚀,故答案为:钢铁输水管与镁块相连形成原电池,镁作负极,发生氧化反应被腐蚀,钢铁输水管作正极,受到保护。
18.(1) 188.7kJ
(2) 速率问题
【解析】(1)题中已知①
已知甲烷的燃烧热为,可写出热化学方程式
②
由方程式(②×3-①) × 可得CO燃烧的热化学方程式
;
根据=反应物总键能-生成物总键能,键能+×-2×=,求得键能为,则使1molCO转化为相应的原子时需要的能量是;
1mol按上述方式燃烧时放出热量为kJ≈701.3 kJ,损失的热能是890kJ -701.3kJ=188.7kJ;
(2)根据盖斯定律,方程式①×2+③×2-②,可得 ==;催化剂能加快反应速率,但不影响平衡状态,实际生产中该气化反应需要加入催化剂,其主要原因是速率问题。
19.(1) 太阳能转化为化学能 1760 C6H12O6(s)+6CO2(g)=6CO2(g) +6H2O(l) △H= - 2820 kJ/ mol
(2)-(2b-a)
(3) -281.0 kJ/mol 4NF3+3Si=2N2↑+3SiF4↑
【解析】(1)碳汇过程中,利用植物的光合作用每吸收l mol CO2需要吸收的能量约为470 kJ,能量的转化形式为太阳能转化为化学能;每吸收l mol CO2需要吸收的能量约为470 kJ,某块林木通过光合作用大约吸收了1.88×107 kJ能量,则其吸收的CO2物质的量为n(CO2)=,其吸收CO2气体的质量为m(CO2)=4×104 mol×44g/ mol=1.76×106 g=1760 kg;
碳汇过程中,利用植物的光合作用每吸收l mol CO2需要吸收的能量约为470 kJ,则吸收6 mol CO2反应产生1 mol葡萄糖C6H12O6时吸收能量Q=6 mol×470 kJ/mol=2820 kJ,因此1 mol葡萄糖完全燃烧生成液态水放出热量为2820 kJ,因此葡萄糖完全燃烧生成液态水的热化学方程式为:C6H12O6(s)+6CO2(g)=6CO2(g)+6H2O(l) △H= - 2820 kJ/ mol;
(2)①CO2(g)+2NaOH(aq) =Na2CO3(aq)+H2O(l) △H=-a kJ/mol;②CO2(g)+NaOH(aq) =NaHCO3(aq) △H =-bkJ/mol,根据盖斯定律②×2-①得CO2(g)+Na2CO3(aq)+H2O(l)=2NaHCO3(aq) △H=-(2b-a) kJ/mol;
(3)①反应热等于反应物总键能与生成物总键能的差,则N2(g)+3F2(g)=2NF3(g)的反应热△H=(946.0+3×157.0)kJ/mol-(6×283.0)kJ/mol=-281.0 kJ/mol;
②NF3对半导体硅进行蚀刻时,生成N2和SiF4,根据原子守恒、电子守恒,可得其反应的化学方程式为:4NF3+3Si=2N2↑+3SiF4↑。
20.(1) 温度计 偏低 起到保温隔热的作用,防止热量散失
(2) 21℃ 0.5
(3) —49kJ/mol 向左上方移动
【解析】(1)
由实验装置图可知,仪器b为温度计;金属铜会传递热量,若仪器a用环形铜制搅拌器代替环形玻璃搅拌器会造成热量散失,导致实验结果偏低;装置中碎泡沫塑料及泡沫塑料板能起到保温隔热的作用,减少实验过程中热量的散失,故答案为:温度计;偏低;起到保温隔热的作用,防止热量散失;
(2)
由图可知,未加入稀硫酸时,溶液温度为21℃,说明实验环境温度是21℃;加入30mL硫酸时,溶液温度最高,说明酸碱恰好完全反应,则稀硫酸的浓度为=0.5mol/L,故答案为:21℃;0.5;
(3)
由图可知,氢氧化钠溶液完全反应时生成0.03mol水,溶液温度升高△t= (28—21) ℃=7℃,则反应放出的热量Q=mc△t= (20+30)mL×1g/mL×10—3kg/g×4.2kJ kg-1 ℃-1×7℃=1.47kJ,则中和反应反应热△H=—=-49kJ/mol;若用浓硫酸代替稀硫酸,浓硫酸稀释时会放出热量,使反应后溶液的温度升高,且与氢氧化钠溶液反应消耗硫酸的体积会减小,所以M点将向左上方移动,故答案为:-49;左上方移动。
21. 5.0 abe 玻璃搅拌器 量筒 4.0 -53.5kJ/mol acd 不相等 相等
【解析】Ⅰ.(1)没有245mL的容量瓶,只能用250mL的容量瓶,需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g;
(2)氢氧化钠要在小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、烧杯和药匙,即答案为a b e;
Ⅱ.(3)仪器A为玻璃搅拌器。实验中还需要用量筒量取酸和碱溶液的体积。
(4)第一次测定温度差为:(30.1-26.1)℃=4.0℃,第二次测定的温度差为:(33.3-27.2)℃=6.1℃,第三次测定的温度差为:(29.8-25.9)℃=3.9℃,第四次测定的温度差为:(30.4-26.3)℃=4.1℃,实验2的误差太大要舍去,三次温度差的平均值为4.0℃;50mL 0.50mol/L氢氧化钠与30mL 0.50mol/L硫酸溶液进行中和反应,硫酸是过量的,生成水的物质的量和氢氧化钠的物质的量相等。所以生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80mL×1g/mL=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为:Q=m c △T=80g×4.18J/(g ℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热△H=-1.3376kJ÷0.025mol=-53.5kJ/mol,此数值比57.3kJ/mol小。
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a选;
b.配制0.50mol/LNaOH溶液时俯视刻度线读数,加入的水不够,溶液体积偏小,使NaOH溶液浓度偏大,和硫酸中和时放热多,使中和热数值偏大,故b不选;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c选;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,导致温度计上残留的碱液与稀硫酸反应,起始温度偏高,测量值偏小,故d选;
e.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故e不选;
故答案选acd。
(5)实验中改用30mL0.5mol/L硫酸跟50mL0.55mol/L氢氧化钠进行反应,与上述实验相比,生成的水不同,所放出的热量不相等;由于中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,与酸碱用量无关,因此所求的中和热数值不变。
