专题4分子空间结构与物质性质检测题(含解析)高二下学期化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4分子空间结构与物质性质检测题(含解析)高二下学期化学苏教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-07 20:01:38 | ||
图片预览



文档简介
专题4《分子空间结构与物质性质》检测题
一、单选题
1.下列说法正确的是
A.有机物CH2=CH—CH3中C原子的杂化类型有sp3和sp2,分子中含有2个π键和7个σ键
B.CO和N2的原子总数、价电子总数均相等,故二者的性质完全相同
C.COCl2分子中所有原子的最外层都不满足8电子稳定结构
D.已知Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,则[ZnCl4]2-的空间结构为正四面体形
2.六氟化硫分子,性质稳定,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是
A.SF6易燃烧生成二氧化硫 B.SF6中各原子均达到 8 电子稳定结构
C.价层电子对数为6,正六面体结构 D.SF6是由极性键构成的非极性分子
3.关于价层电子对互斥理论说法错误的是
A.价层电子对包括σ键电子对和中心原子上的孤电子对
B.分子中键角越大,价层电子对相互排斥力越小,分子越稳定
C.用该理论预测H2S和BF3的空间结构为V形和平面三角形
D.该理论一定能预测出多中心原子的分子、离子或原子团的空间构型
4.冠醚是一种超分子,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6与K+形成的螯合离子的结构如图所示。下列说法错误的是
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
15-冠-5 170-220 Na+(204)
18-冠-6 260-320 K+(276)Rb+(304)
21-冠-7 340-430 Cs+(334)
A.6个O原子与K+可能在同一平面上
B.二苯并-18-冠-6也能适配Li+
C.该冠醚分子中碳原子杂化方式有2种
D.一个螯合离子中配位键的数目为6
5.分析下表数据,有关说法错误的是
化学键 O-O O=O N-N N=N N≡N
键能 142 497.3 193 418 948
化学键 C-C C=C C≡C C-H H-H
键能 347.7 615 812 413.4 436
A.不能发生加成反应是因为其中的π键比σ键更稳定
B.
C.O存在,N存在;同样,C可能存在
D.键长:;同样的:
6.1-乙基-3-甲基咪唑四氟硼酸盐是一种常见的离子液体(结构如图),其环状结构中存在类似苯的大键。下列说法正确的是
A.的VSEPR模型为平面正方形
B.形成大键的电子由C原子和N原子共同提供
C.第二周期中第一电离能介于B和N之间的元素有2种
D.离子液体中B原子和C原子的杂化方式完全相同
7.过氧乙酸是一种绿色生态杀菌剂,,结构简式为下列说法不正确的是
A.分子中2个碳原子的杂化方式不相同 B.其熔点主要取决于所含化学键的键能
C.过氧乙酸中含有极性共价键和非极性共价键 D.过氧乙酸易溶于水
8.下列说法不正确的是(为阿伏加德罗常数)
A.离子中含有的键为
B.18g冰中含有氢键数目为
C.(结构如图),含有S—S键的个数为
D.(结构如图),中含有的N—N键个数为
9.下列说法不正确的是
A.烷烃分子中碳原子间以单键结合,碳原子剩余价键全部与氢原子结合
B.分子组成符合CnH2n+2的烃一定是烷烃
C.正丁烷分子中的4个碳原子在一条直线上
D.有机化合物中的三键含有一个σ键和两个π键
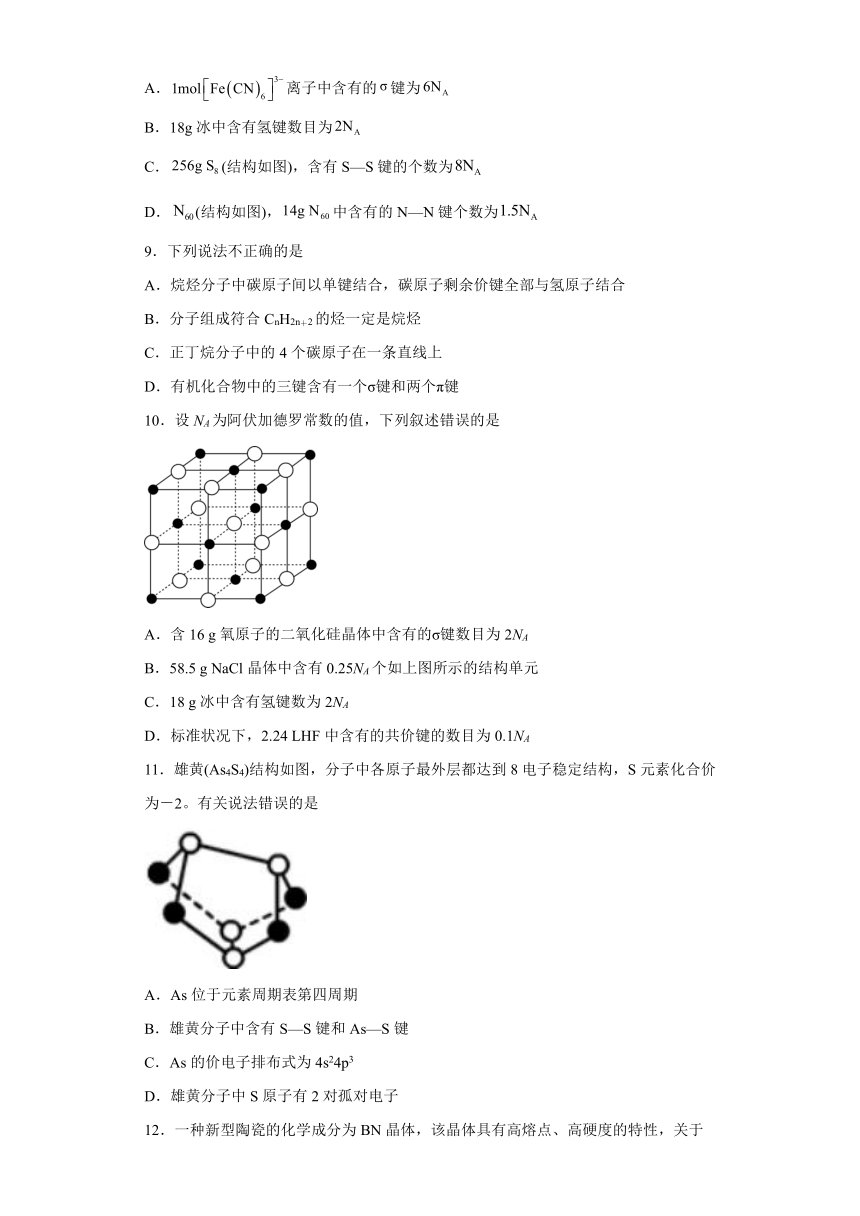
10.设NA为阿伏加德罗常数的值,下列叙述错误的是
A.含16 g氧原子的二氧化硅晶体中含有的σ键数目为2NA
B.58.5 g NaCl晶体中含有0.25NA个如上图所示的结构单元
C.18 g冰中含有氢键数为2NA
D.标准状况下,2.24 LHF中含有的共价键的数目为0.1NA
11.雄黄(As4S4)结构如图,分子中各原子最外层都达到8电子稳定结构,S元素化合价为-2。有关说法错误的是
A.As位于元素周期表第四周期
B.雄黄分子中含有S—S键和As—S键
C.As的价电子排布式为4s24p3
D.雄黄分子中S原子有2对孤对电子
12.一种新型陶瓷的化学成分为BN晶体,该晶体具有高熔点、高硬度的特性,关于BN晶体的说法不正确的是( )
A.该晶体为原子晶体,具有金刚石的结构特征
B.该晶体中B的杂化类型是sp2杂化
C.该晶体中存在配位键
D.该晶体可作耐高温、耐磨材料
13.科学家发现铂的两种化合物a和b,它们的化学式都为PtCl2(NH3)2. 。实验测得a和 b具有不同的特性:a具有抗癌作用,而b没有。则下列关于ab的叙述正确的是
A.a和b属于同一种物质 B.a和b 互为同分异构体
C.a和b的空间构型一定是四面体型 D.a在实际中有用,b没有用
14.下列叙述正确的是
A.由非金属原子形成的化合物一定是共价化合物
B.离子化合物里可以存在共价键
C.离子键、共价键、氢键均属于化学键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
15.下列化学用语表示正确的是
A.的结构示意图:
B.基态S原子的电子排布式:
C.中子数为10的氧原子:
D.的立体构型:(表示四个原子位于同一平面)
二、填空题
16.按要求完成下列问题:
(1)写出基态铁原子的电子排布式和Mg2+的电子排布式:_______、_______。
(2)H2O分子内的O-H键、分子间的范德华力和H2O分子之间的氢键从强到弱的顺序为_______。的沸点比高的原因是_______。
(3)写出CCl4分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:_______、_______、_______。
(4)下列分子若是手性分子,请用“*”标出其手性碳原子。______、_____
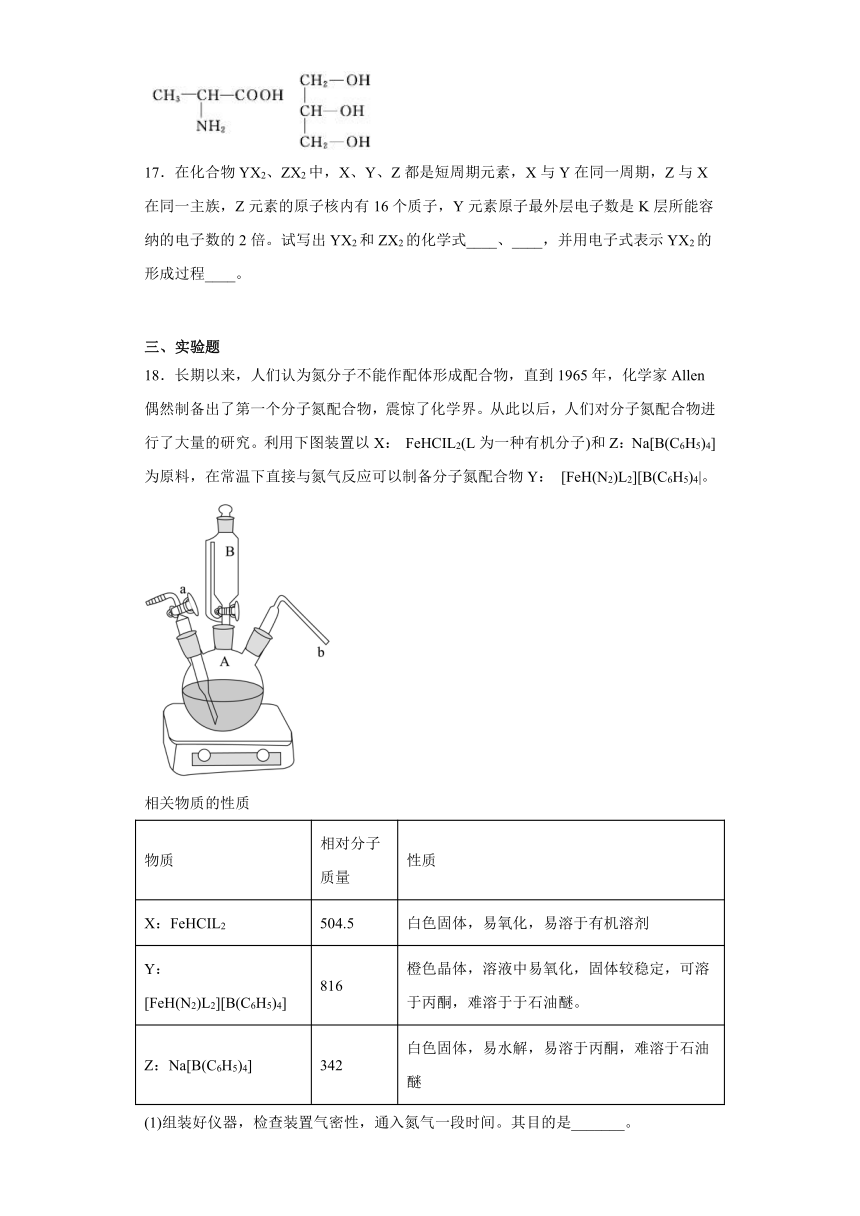
17.在化合物YX2、ZX2中,X、Y、Z都是短周期元素,X与Y在同一周期,Z与X在同一主族,Z元素的原子核内有16个质子,Y元素原子最外层电子数是K层所能容纳的电子数的2倍。试写出YX2和ZX2的化学式____、____,并用电子式表示YX2的形成过程____。
三、实验题
18.长期以来,人们认为氮分子不能作配体形成配合物,直到1965年,化学家Allen偶然制备出了第一个分子氮配合物,震惊了化学界。从此以后,人们对分子氮配合物进行了大量的研究。利用下图装置以X: FeHCIL2(L为一种有机分子)和Z:Na[B(C6H5)4]为原料,在常温下直接与氮气反应可以制备分子氮配合物Y: [FeH(N2)L2][B(C6H5)4|。
相关物质的性质
物质 相对分子质量 性质
X:FeHCIL2 504.5 白色固体,易氧化,易溶于有机溶剂
Y:[FeH(N2)L2][B(C6H5)4] 816 橙色晶体,溶液中易氧化,固体较稳定,可溶于丙酮,难溶于于石油醚。
Z:Na[B(C6H5)4] 342 白色固体,易水解,易溶于丙酮,难溶于石油醚
(1)组装好仪器,检查装置气密性,通入氮气一段时间。其目的是_______。
(2)向A中加入含X1.5g的120mL的丙酮溶液,B中加入含Z1.5g的50mL的丙酮溶液。仪器A的容积应为_______ mL(填 250或500)。仪器B的名称为_______。
(3)继续通入氮气,慢慢将B中液体滴入到A中,打开磁力搅拌器搅拌30分钟,停止通气,冰水浴冷却,析出大量橙色晶体,快速过滤,洗涤,干燥得到粗产品。写出生成产品的化学方程式_______。
(4)将粗产品溶于丙酮,过滤;将滤液真空蒸发得橙色固体,用_______洗涤橙色固体,干燥、称量得到产品1.5g。计算本实验的产率_______ (用百分数表示, 保留1位小数)。
(5)人们之所以对分子氮配合物感兴趣,是因为某些分子氮配合物可以在常温常压下被还原为NH3。简述该过程的意义_______。
19.某同学所做的有关铜元素的实验流程如图:
(1)写出基态铜原子的价电子排布式________________________,向深蓝色溶液中加入适量乙醇,会析出深蓝色晶体,该晶体中存在的化学键的类型有________________________。
(2)写出反应④的离子方程式________________________。
(3)铜能与类卤素(SCN) 2反应生成Cu(SCN) 2,1 mol (SCN)2分子中含有的δ键数目为类卤素(SCN)2 对应的酸有两种,理论推测硫氰酸(H-S-CN)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__________________;写出一种与SCN-互为等电子体的分子_________________(用化学式表示)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为____________________。
(5)铜晶胞中,其晶体的堆积方式为_______________,一个晶胞中铜原子的数目为__________,空间利用率为____________(写出计算过程)。
四、计算题
20.铁、钴、镍的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
钴的一种化合物晶胞结构如下图所示。
①已知a点的原子坐标参数为(0,0,0),b点为(,,0),c点为(1,,),则d点的原子坐标参数为___________。
②已知该晶体的密度为ρ g·cm-3,则晶胞参数a=___________nm(用含ρ、NA的代数式表示)。
21.铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式为_______。
(2)成多种配合物,如与乙二胺可形成如图所示配离子。
①与乙二胺所形成的配离子内部粒子间的作用力类型有_______。
A.配位键 B.极性键 C.离子键 D.非极性键 F.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为_______,C、N、H三种元素的电负性由大到小顺序是_______。
(3)乙二胺和三甲胺 []均属于胺,乙二胺的沸点比三甲胺高很多,原因是_______。在水溶液中以形式存在,向含的溶液中加入足量氨水,可生成更稳定的,其原因是_______。
(4)Cu和S形成某种晶体的晶胞如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为_______
②已知该晶体的密度为,和的半径分别为和,阿伏加德罗常数值为_______。列式表示该晶体中原子的空间利用率_______。
参考答案:
1.D
【详解】A.双键两端的C原子均采取sp2杂化,甲基中的C采取sp3杂化,CH2=CH—CH3中有8个σ键、1个π键,,A错误;
B.虽然CO和N2的原子总数相同,价电子总数相等,但二者性质有差异,N2无毒,CO有毒,B错误;
C.Cl原子最外层有7个电子,O原子最外层有6个电子、C原子最外层有4个电子,由结构可知,COCl2中含有2个C-Cl键、 1个C=O双键,所有原子的最外层都满足8电子稳定结构,C错误;
D.联想CH4的空间结构可判断[ZnCl4]2-的空间结构为正四面体形,D正确;
故选D。
2.D
【详解】A. SF6分子中S与F的化合价分别是+6和-1,S的化合价已达到最高价,不会再升高,而F的氧化性比O强,所以SF6不易燃烧生成二氧化硫,选项A错误;
B. SF6分子中硫原子并不是8电子稳定结构,F原子均达到 8 电子稳定结构,选项B错误;
C.SF6分子中只有S-F极性共价单键,均为键,具有正八面体结构,选项C错误;
D. SF6子中只有S-F极性共价单键,均为键,具有正八面体立体构型的SF6是由极性键构成的非极性分子,选项D正确。
答案选D。
3.D
【详解】A.价层电子对包括σ键电子对和中心原子上的孤电子对,不包含π键中的电子对,A正确;
B.分子中键角越大,价层电子对之间的距离越小,相互排斥力越小,则分子越稳定,B正确;
C.H2S中S原子价层电子对数为:2+=4,且含有2个孤电子对,分子呈V形结构;BF3中B原子价层电子对数为:3+=3,且不含孤电子对,分子呈平面三角形结构,C正确;
D.该理论不能预测所有分子或离子的空间构型,如:许多过渡金属化合物的几何构型不能用VSEPR模型理论解释,D错误;
故合理选项是D。
4.A
【详解】A.该螯合离子中,O原子形成3个键,还有1对孤对电子,采用sp3杂化,空间构型为四面体形,所以6个O原子与K+不可能在同一平面上,A选项错误;
B.Li+半径小于K+半径,Li+能够置于二苯并-18-冠-6的空腔中,B选项正确;
C.该冠醚分子中的碳碳单键上的碳原子采用sp3杂化,苯环上的碳原子采用sp2杂化,C选项正确;
D.由图可知,一个螯合离子中含6和“O→K+”配位键,D选项正确;
故选:A。
5.A
【详解】A.σ键重叠程度大于π键,氮气分子中依然是σ键更稳定,只是2个π键的存在压缩σ键的键长,使π键键能大大提升不容易断裂,所以氮气难以发生加成反应,但N2不是不能发生加成反应,在一定条件下,N2也能发生加成反应,故A错误;
B.在反应CH2=CH2(g)+H2=CH3CH3(g)中,可以用反应物的总键能减去生成物的总键能计算反应热,即ΔH=4×413.4kJ/mol+615kJ/mol+436kJ/mol-6×413.4kJ/mol-347.7kJ/mol=-123.5kJ/mol,故B正确;
C.O最外层有6个电子,共用两对电子后达到8电子稳定结构,即存在 O=O ,同样,N最外层有5个电子,共用三对电子后达到8电子稳定结构,存在 N≡N ;C最外层有4个电子,可能存在CC ,C原子进行sp杂化,每个碳原子都形成1个C-Cσ键和1个C-Hσ键,两个碳原子间还有2个π键,故C正确;
D.键能越大,键长越短,所以键长:C-C>C=C>C≡C ;同样的: N-N>N=N>N≡N,故D正确;
故选A。
6.B
【详解】A.的中心原子B的价层电子对数为4+=4,而且没有孤电子对,所以VSEPR模型为正四面体形,故A错误;
B.每个C提供一个pz电子,N提供一对pz电子,C原子和N原子形成大π键,故B正确;
C.同周期,从左到右,元素的第一电离能逐渐增大,其中第IIA族的Be和第VA族的N的第一电离能均高于其相邻的元素,故第二周期中第一电离能介于B与N之间的元素有Be、C、O,共3种,故C错误;
D.甲基上的C原子只形成单键,为sp3杂化,杂环上的C原子形成了C=N双键,为sp2杂化,B原子的价电子对数为4+=4,因此B原子采取sp3杂化,故D错误;
故选:B。
7.B
【详解】A.过氧乙酸分子中含有单键碳原子和双键碳原子,碳原子的杂化方式不相同,分别为sp3杂化和sp2杂化,故A正确;
B.过氧乙酸为分子晶体,分子晶体的熔点取决于分子间作用力的强弱,与共价键的键能大小无关,故B错误;
C.过氧乙酸分子中含有碳氢、碳氧、氢氧极性共价键和碳碳、氧氧非极性共价键,故C正确;
D.过氧乙酸分子是能与水分子形成氢键的极性分子,在水中的溶解度大,易溶于水,故D正确;
故选B。
8.A
【详解】A.中配位键属于σ键,CN-中也有1根σ键,1mol离子中含有的σ键为12mol,即12NA ,A错误;
B.依据计算物质的量,氢键是分子间作用力,每个水分子形成两个氢键,18g冰中含有的氢键数目为2NA,B正确;
C.256g单质的物质的量为,而1mol中含8molS—S键,单质中含有8molS—S键,即8NA个,C正确;
D.依据计算物质的量,1mol形成的N—N键为,则形成N—N键个数为1.5 NA,D正确;
故选A。
9.C
【详解】A.烷烃分子中碳原子间均以单键结合成链状,碳原子剩余价键全部与氢原子结合,故A正确;
B.烷烃分子中碳原子间均以单键结合成链状,碳原子剩余价键全部与氢原子结合,烷烃的通式为CnH2n+2,则分子组成符合CnH2n+2的烃一定是烷烃,故B正确;
C.正丁烷分子中碳原子为饱和碳原子,空间构型为四面体形,所以分子中4个碳原子不在一条直线上,故C错误;
D.有机化合物中的三键含有一个头碰头的σ键和两个肩并肩的π键,故D正确;
故选C。
10.D
【详解】A.在SiO2晶体中每个O原子与2个Si原子形成共价键。含16 g氧原子的二氧化硅晶体中O原子的物质的量是1 mol,则其中含有的σ键数目为2NA,A正确;
B.58.5 g NaCl的物质的量是1 mol,NaCl是离子晶体,Na+、Cl-的配位数都是6,在图示晶体结构单元中含有Na+:8×+6×=4;含有Cl-数目是:1+12×=4,所以该图示是4个NaCl,则58.5 g NaCl晶体中含有0.25NA个如上图所示的结构单元,B正确;
C.18 g冰中含有H2O的物质的量是1 mol,由于每个H2O与相邻4个H2O形成氢键,每个氢键是相邻的2个H2O分子形成的,故含有1 mol冰中的氢键数为2NA,C正确;
D.标准状况下HF不是气体,因此不能使用气体摩尔体积计算其中所含共价键数目,D错误;
故合理选项是D。
11.B
【分析】根据元素在周期表中的位置判断其电子排布式,或根据价电子排布式判断元素所在周期表中的位置,利用结构图中的化学键判断成键及电子特点;
【详解】A.根据As位于元素周期表位置直接判断,在第四周期,故A正确;
B.根据硫和砷的成键特点判断,硫形成两个化学键,砷形成3个化学键,故白点是砷,黑点是硫,根据结构图中判断含有As—As键和As—S键,故B错误;
C.根据砷的位置或者电子排布式判断:As的价电子排布式为4s24p3,故C正确;
D.根据硫原子形成两个化学键,提出2个电子后,还剩余4个电子,故2对孤对电子,故D正确;
故选答案B。
【点睛】注意8电子稳定就结构根据原子最外层电子数判断,需要得到几个电子达到8电子稳定结构就能行成几个化学键。
12.B
【详解】A.由题中信息可知,BN晶体具有高熔点、高硬度的特性,所以其为原子晶体,其结构应与金刚石相似,A正确;
B.结构与金刚石相似,则每个原子均采用sp3杂化,B错误;
C.由于B最外层只有3个电子,故其原子的最外层有空轨道,而N原子有孤电子对,故两者可形成配位键,C正确;
D.由题中信息可知,BN晶体具有高熔点、高硬度的特性,因此该晶体可作耐高温、耐磨材料;
答案选B。
13.B
【详解】A.因为a和b具有不同的特性,所以a和b一定不是同一种物质,故A错误;
B.性质不同说明结构不同,而a与b的分子式是相同的,所以a和b互为同分异构体,故B正确;
C.根据分子的空间构型,a中正、负电荷重心重合,为非极性分子,b中正、负电荷重心不重合,为极性分子。a和b的空间构型若是四面体形,两个氯原子就不存在相邻和相间之分,因此a与b的空间构型只能是平面四边形,故C错误;
D.此题干中仅说明a具有抗癌作用,而b没有,但不能说明b在其他领域没有应用,故D错误;
故答案选B。
14.B
【详解】A.由非金属原子形成的化合物可能是离子化合物如NH4Cl,也可能是共价化合物如HCl,因此由非金属原子形成的化合物不一定是共价化合物,A错误;
B.离子化合物中一定存在离子键,可能存在共价键,例如NaOH中含有离子键和共价键,B正确;
C.离子键、共价键均属于化学键,氢键不是化学键,属于分子间作用力,C错误;
D.H2O是一种非常稳定的化合物,这是由于H2O分子中的H-O化学键所致,氢键不属于化学键,不能影响物质的稳定性,一般是影响其物理性质,如影响物质的熔沸点逆密度大小,D错误;
故合理选项是B。
15.A
【详解】A.的质子数为13,核外电子数为10,故结构示意图为 ,故A正确;
B.基态S原子的电子排布式,故B错误;
C.中子数为10的氧原子:,故C错误;
D.的立体构型为三角锥形,不是平面型,故D错误;
故选A。
16.(1) 1s22s22p63s23p63d64s2或[Ar]3d64s2 1s22s22p6
(2) 分子内的O-H键>H2O分子之间的氢键>分子间的范德华力 可形成分子间氢键,使其沸点升高,形成分子内氢键,使其沸点降低
(3) 正四面体 sp3 109°28′
(4) 不是手性分子
【详解】(1)Fe为26号元素,根据构造原理可知,基态铁原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,Mg为12号元素,根据构造原理可知,Mg2+的电子排布式为1s22s22p6。
(2)化学键比分子间作用力强的多,氢键是一种特殊的分子间作用力,比分子间的范德华力强,故H2O分子内的O-H键、分子间的范德华力和H2O分子之间的氢键从强到弱的顺序为分子内的O-H键>H2O分子之间的氢键>分子间的范德华力。的沸点比高的原因是可形成分子间氢键,使其沸点升高,形成分子内氢键,使其沸点降低。
(3)CCl4分子的中心原子C原子的σ键电子对数为4,孤电子对数为,则其空间构型为正四面体,中心原子成键时采取的杂化轨道类型为sp3,分子中共价键的键角为109°28′。
(4)手性碳原子是指连接四个不一样的原子或原子团的碳原子,为手性分子,手性碳原子如图所示。不含有手性碳原子,不是手性分子。
17. CO2 SO2
【详解】Z元素的原子核内有16个质子,故Z为S,而X与Z同一主族且为短周期元素,故X为O,则ZX2为SO2;X与Y在同一周期,故Y的核外有2个电子层,且Y元素原子最外层电子数是K层所能容纳的电子数的2倍,故Y的L层有4个电子,故为C,则YX2为CO2, 用电子式表示CO2的形成过程为: 。
18.(1)排尽装置内的空气
(2) 500 恒压滴液漏斗
(3)FeHClL2+Na[B(C6H5)4]+N2=NaCl+[FeH(N2)L2][B(C6H5)4]
(4) 石油醚 61.8%
(5)可以实现常温常压合成氨气
【详解】(1)由表格内容可知,反应物X与产物Y均易被氧化,通氮气可排出装置中的空气,防止X和Y被氧化;
(2)三颈瓶中加入的液体体积为120mL+50mL=170mL,瓶中的液体不能超过容积的一半,因此三颈瓶应选用500mL的;由仪器的外观可知,B是恒压滴液漏斗;
(3)FeHClL2和Na[B(C6H5)4]与N2反应生成[FeH(N2)L2][B(C6H5)4]和NaCl,方程式为FeHClL2+Na[B(C6H5)4]+N2=NaCl+[FeH(N2)L2][B(C6H5)4];
(4)产物Y难溶于石油醚,可以用石油醚洗涤;n(X)= ≈0.002973mol,n(Y)=n(X)=0.002973mol,m(Y)=0.002973mol×816g/mol=2.426g,产率=×100%≈61.8%;
(5)该过程不需要传统合成氨的高温高压条件,实现了在常温常压条件下合成氨气。
19.(1)3d104s1 离子键、共价键、配位键 (2)Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
(3)5NA 异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键 CO2
(4)sp3、sp2 (5)面心立方最密堆积 4 设Cu原子半径为r,则晶胞中Cu原子总体积为4×4/3πr3,晶胞棱长为4r×=2r,则晶胞体积为(2r)3 ="16" r3,空间利用率为≈74%。
【详解】试题分析:(1)基态铜原子的价电子排布式为3d104s1;向深蓝色溶液中加入适量乙醇,会析出深蓝色晶体,其化学式为[Cu(NH3)4]Cl2·H2O,存在的化学键的类型有:离子键、共价键、配位键。 (2)反应④的离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-。(3)(SCN)2的结构式为,根据(SCN)2的结构可知1个分子中有3个单键和2个碳氮叁键,单键为δ键,1个叁键含有1个δ键、2 个π键,1 个(SCN)2分子含有5个δ键,故 1mol(SCN)2分子中含有δ键的数目为5NA;由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H—S—CN)的沸点低于异硫氰酸的;与SCN-互为等电子体的分子有CO2等,原子数相同,价电子数均为16。(4)分子中连接氨基的C原子形成2个C—H键、1个C—N键、1个C—C键,没有孤电子对,杂化轨道数目为4,采取sp3杂化,而碳氧双键中的C原子形成3个δ键和 1 个π键,没有孤电子对,杂化轨道数目为3,采取sp2杂化。(5)Cu晶胞中,其晶体的堆积方式为面心立方最密堆积;一个晶胞中铜原子数为8×1/8+6×1/2=4个;设Cu原子半径为r,则晶胞中Cu原子总体积为4×4/3πr3,晶胞棱长为4r×=2r,则晶胞体积为(2r)3 ="16" r3,空间利用率为≈74%。
考点:考查物质结构与性质,涉及电子排布、杂化理论、晶胞结构分析与计算等。
20. (,1,)
【详解】①根据图示可知d点在后面的面心上,则d点的坐标为(,1,);
②根据图示可知:在一个晶胞中含有Ti原子个数为8×=1,含有Co原子数为1;含有O原子数为6×=3,所以晶胞质量,所以a=nm。
21.(1)3d10 4s1
(2) ABD sp3 N>C>H
(3) 乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键; N 元素电负性更小,更易给出孤对电子形成配位键;
(4) (,,)
【详解】(1)铜元素基态原子中3d、4s能级上电子为其价电子,3d能级上有10个电子、4s能级上有1个电子,其价电子排布式为3d10 4s1;
故答案为3d10 4s1;
(2)①Cu2+与乙二胺所形成的配离子内部粒子间含有C N、C H、N H、C C和N Cu键,C N、C H和N H为极性键,C C非极性键,N Cu之间的化学键是配位键;
故答案为ABD;
②乙二胺分子中氮原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断N原子的杂化轨道类型为 sp3,元素的非金属性越强,其电负性越大,电负性大小顺序是N>C>H;
故答案为sp3;N>C>H;
(3)乙二胺分子中N原子上连接有氢原子,可形成氢键,而三甲胺分子中氮原子上没有连接氢原子,不能形成氢键,故乙二胺的沸点比三甲胺高很多;向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,是因为N 元素电负性更小,更易给出孤对电子形成配位键;
故答案为乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键;N 元素电负性更小,更易给出孤对电子形成配位键;
(4)①C点位于体对角线的处,根据A点和B点的晶胞参数,容易写出C的晶胞参数为(,,);
故答案为(,,);
②阿伏加德罗常数值为;该晶胞是面心立方最密堆积,每个面上对角线上的3个Cu原子紧密相连,则晶胞棱长=, 晶胞体积=,该晶胞中Cu原子个数=,S原子个数是4,所有原子体积=,该晶体中原子的空间利用率=;
故答案为,。
一、单选题
1.下列说法正确的是
A.有机物CH2=CH—CH3中C原子的杂化类型有sp3和sp2,分子中含有2个π键和7个σ键
B.CO和N2的原子总数、价电子总数均相等,故二者的性质完全相同
C.COCl2分子中所有原子的最外层都不满足8电子稳定结构
D.已知Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,则[ZnCl4]2-的空间结构为正四面体形
2.六氟化硫分子,性质稳定,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是
A.SF6易燃烧生成二氧化硫 B.SF6中各原子均达到 8 电子稳定结构
C.价层电子对数为6,正六面体结构 D.SF6是由极性键构成的非极性分子
3.关于价层电子对互斥理论说法错误的是
A.价层电子对包括σ键电子对和中心原子上的孤电子对
B.分子中键角越大,价层电子对相互排斥力越小,分子越稳定
C.用该理论预测H2S和BF3的空间结构为V形和平面三角形
D.该理论一定能预测出多中心原子的分子、离子或原子团的空间构型
4.冠醚是一种超分子,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6与K+形成的螯合离子的结构如图所示。下列说法错误的是
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
15-冠-5 170-220 Na+(204)
18-冠-6 260-320 K+(276)Rb+(304)
21-冠-7 340-430 Cs+(334)
A.6个O原子与K+可能在同一平面上
B.二苯并-18-冠-6也能适配Li+
C.该冠醚分子中碳原子杂化方式有2种
D.一个螯合离子中配位键的数目为6
5.分析下表数据,有关说法错误的是
化学键 O-O O=O N-N N=N N≡N
键能 142 497.3 193 418 948
化学键 C-C C=C C≡C C-H H-H
键能 347.7 615 812 413.4 436
A.不能发生加成反应是因为其中的π键比σ键更稳定
B.
C.O存在,N存在;同样,C可能存在
D.键长:;同样的:
6.1-乙基-3-甲基咪唑四氟硼酸盐是一种常见的离子液体(结构如图),其环状结构中存在类似苯的大键。下列说法正确的是
A.的VSEPR模型为平面正方形
B.形成大键的电子由C原子和N原子共同提供
C.第二周期中第一电离能介于B和N之间的元素有2种
D.离子液体中B原子和C原子的杂化方式完全相同
7.过氧乙酸是一种绿色生态杀菌剂,,结构简式为下列说法不正确的是
A.分子中2个碳原子的杂化方式不相同 B.其熔点主要取决于所含化学键的键能
C.过氧乙酸中含有极性共价键和非极性共价键 D.过氧乙酸易溶于水
8.下列说法不正确的是(为阿伏加德罗常数)
A.离子中含有的键为
B.18g冰中含有氢键数目为
C.(结构如图),含有S—S键的个数为
D.(结构如图),中含有的N—N键个数为
9.下列说法不正确的是
A.烷烃分子中碳原子间以单键结合,碳原子剩余价键全部与氢原子结合
B.分子组成符合CnH2n+2的烃一定是烷烃
C.正丁烷分子中的4个碳原子在一条直线上
D.有机化合物中的三键含有一个σ键和两个π键
10.设NA为阿伏加德罗常数的值,下列叙述错误的是
A.含16 g氧原子的二氧化硅晶体中含有的σ键数目为2NA
B.58.5 g NaCl晶体中含有0.25NA个如上图所示的结构单元
C.18 g冰中含有氢键数为2NA
D.标准状况下,2.24 LHF中含有的共价键的数目为0.1NA
11.雄黄(As4S4)结构如图,分子中各原子最外层都达到8电子稳定结构,S元素化合价为-2。有关说法错误的是
A.As位于元素周期表第四周期
B.雄黄分子中含有S—S键和As—S键
C.As的价电子排布式为4s24p3
D.雄黄分子中S原子有2对孤对电子
12.一种新型陶瓷的化学成分为BN晶体,该晶体具有高熔点、高硬度的特性,关于BN晶体的说法不正确的是( )
A.该晶体为原子晶体,具有金刚石的结构特征
B.该晶体中B的杂化类型是sp2杂化
C.该晶体中存在配位键
D.该晶体可作耐高温、耐磨材料
13.科学家发现铂的两种化合物a和b,它们的化学式都为PtCl2(NH3)2. 。实验测得a和 b具有不同的特性:a具有抗癌作用,而b没有。则下列关于ab的叙述正确的是
A.a和b属于同一种物质 B.a和b 互为同分异构体
C.a和b的空间构型一定是四面体型 D.a在实际中有用,b没有用
14.下列叙述正确的是
A.由非金属原子形成的化合物一定是共价化合物
B.离子化合物里可以存在共价键
C.离子键、共价键、氢键均属于化学键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
15.下列化学用语表示正确的是
A.的结构示意图:
B.基态S原子的电子排布式:
C.中子数为10的氧原子:
D.的立体构型:(表示四个原子位于同一平面)
二、填空题
16.按要求完成下列问题:
(1)写出基态铁原子的电子排布式和Mg2+的电子排布式:_______、_______。
(2)H2O分子内的O-H键、分子间的范德华力和H2O分子之间的氢键从强到弱的顺序为_______。的沸点比高的原因是_______。
(3)写出CCl4分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:_______、_______、_______。
(4)下列分子若是手性分子,请用“*”标出其手性碳原子。______、_____
17.在化合物YX2、ZX2中,X、Y、Z都是短周期元素,X与Y在同一周期,Z与X在同一主族,Z元素的原子核内有16个质子,Y元素原子最外层电子数是K层所能容纳的电子数的2倍。试写出YX2和ZX2的化学式____、____,并用电子式表示YX2的形成过程____。
三、实验题
18.长期以来,人们认为氮分子不能作配体形成配合物,直到1965年,化学家Allen偶然制备出了第一个分子氮配合物,震惊了化学界。从此以后,人们对分子氮配合物进行了大量的研究。利用下图装置以X: FeHCIL2(L为一种有机分子)和Z:Na[B(C6H5)4]为原料,在常温下直接与氮气反应可以制备分子氮配合物Y: [FeH(N2)L2][B(C6H5)4|。
相关物质的性质
物质 相对分子质量 性质
X:FeHCIL2 504.5 白色固体,易氧化,易溶于有机溶剂
Y:[FeH(N2)L2][B(C6H5)4] 816 橙色晶体,溶液中易氧化,固体较稳定,可溶于丙酮,难溶于于石油醚。
Z:Na[B(C6H5)4] 342 白色固体,易水解,易溶于丙酮,难溶于石油醚
(1)组装好仪器,检查装置气密性,通入氮气一段时间。其目的是_______。
(2)向A中加入含X1.5g的120mL的丙酮溶液,B中加入含Z1.5g的50mL的丙酮溶液。仪器A的容积应为_______ mL(填 250或500)。仪器B的名称为_______。
(3)继续通入氮气,慢慢将B中液体滴入到A中,打开磁力搅拌器搅拌30分钟,停止通气,冰水浴冷却,析出大量橙色晶体,快速过滤,洗涤,干燥得到粗产品。写出生成产品的化学方程式_______。
(4)将粗产品溶于丙酮,过滤;将滤液真空蒸发得橙色固体,用_______洗涤橙色固体,干燥、称量得到产品1.5g。计算本实验的产率_______ (用百分数表示, 保留1位小数)。
(5)人们之所以对分子氮配合物感兴趣,是因为某些分子氮配合物可以在常温常压下被还原为NH3。简述该过程的意义_______。
19.某同学所做的有关铜元素的实验流程如图:
(1)写出基态铜原子的价电子排布式________________________,向深蓝色溶液中加入适量乙醇,会析出深蓝色晶体,该晶体中存在的化学键的类型有________________________。
(2)写出反应④的离子方程式________________________。
(3)铜能与类卤素(SCN) 2反应生成Cu(SCN) 2,1 mol (SCN)2分子中含有的δ键数目为类卤素(SCN)2 对应的酸有两种,理论推测硫氰酸(H-S-CN)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__________________;写出一种与SCN-互为等电子体的分子_________________(用化学式表示)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为____________________。
(5)铜晶胞中,其晶体的堆积方式为_______________,一个晶胞中铜原子的数目为__________,空间利用率为____________(写出计算过程)。
四、计算题
20.铁、钴、镍的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
钴的一种化合物晶胞结构如下图所示。
①已知a点的原子坐标参数为(0,0,0),b点为(,,0),c点为(1,,),则d点的原子坐标参数为___________。
②已知该晶体的密度为ρ g·cm-3,则晶胞参数a=___________nm(用含ρ、NA的代数式表示)。
21.铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式为_______。
(2)成多种配合物,如与乙二胺可形成如图所示配离子。
①与乙二胺所形成的配离子内部粒子间的作用力类型有_______。
A.配位键 B.极性键 C.离子键 D.非极性键 F.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为_______,C、N、H三种元素的电负性由大到小顺序是_______。
(3)乙二胺和三甲胺 []均属于胺,乙二胺的沸点比三甲胺高很多,原因是_______。在水溶液中以形式存在,向含的溶液中加入足量氨水,可生成更稳定的,其原因是_______。
(4)Cu和S形成某种晶体的晶胞如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为_______
②已知该晶体的密度为,和的半径分别为和,阿伏加德罗常数值为_______。列式表示该晶体中原子的空间利用率_______。
参考答案:
1.D
【详解】A.双键两端的C原子均采取sp2杂化,甲基中的C采取sp3杂化,CH2=CH—CH3中有8个σ键、1个π键,,A错误;
B.虽然CO和N2的原子总数相同,价电子总数相等,但二者性质有差异,N2无毒,CO有毒,B错误;
C.Cl原子最外层有7个电子,O原子最外层有6个电子、C原子最外层有4个电子,由结构可知,COCl2中含有2个C-Cl键、 1个C=O双键,所有原子的最外层都满足8电子稳定结构,C错误;
D.联想CH4的空间结构可判断[ZnCl4]2-的空间结构为正四面体形,D正确;
故选D。
2.D
【详解】A. SF6分子中S与F的化合价分别是+6和-1,S的化合价已达到最高价,不会再升高,而F的氧化性比O强,所以SF6不易燃烧生成二氧化硫,选项A错误;
B. SF6分子中硫原子并不是8电子稳定结构,F原子均达到 8 电子稳定结构,选项B错误;
C.SF6分子中只有S-F极性共价单键,均为键,具有正八面体结构,选项C错误;
D. SF6子中只有S-F极性共价单键,均为键,具有正八面体立体构型的SF6是由极性键构成的非极性分子,选项D正确。
答案选D。
3.D
【详解】A.价层电子对包括σ键电子对和中心原子上的孤电子对,不包含π键中的电子对,A正确;
B.分子中键角越大,价层电子对之间的距离越小,相互排斥力越小,则分子越稳定,B正确;
C.H2S中S原子价层电子对数为:2+=4,且含有2个孤电子对,分子呈V形结构;BF3中B原子价层电子对数为:3+=3,且不含孤电子对,分子呈平面三角形结构,C正确;
D.该理论不能预测所有分子或离子的空间构型,如:许多过渡金属化合物的几何构型不能用VSEPR模型理论解释,D错误;
故合理选项是D。
4.A
【详解】A.该螯合离子中,O原子形成3个键,还有1对孤对电子,采用sp3杂化,空间构型为四面体形,所以6个O原子与K+不可能在同一平面上,A选项错误;
B.Li+半径小于K+半径,Li+能够置于二苯并-18-冠-6的空腔中,B选项正确;
C.该冠醚分子中的碳碳单键上的碳原子采用sp3杂化,苯环上的碳原子采用sp2杂化,C选项正确;
D.由图可知,一个螯合离子中含6和“O→K+”配位键,D选项正确;
故选:A。
5.A
【详解】A.σ键重叠程度大于π键,氮气分子中依然是σ键更稳定,只是2个π键的存在压缩σ键的键长,使π键键能大大提升不容易断裂,所以氮气难以发生加成反应,但N2不是不能发生加成反应,在一定条件下,N2也能发生加成反应,故A错误;
B.在反应CH2=CH2(g)+H2=CH3CH3(g)中,可以用反应物的总键能减去生成物的总键能计算反应热,即ΔH=4×413.4kJ/mol+615kJ/mol+436kJ/mol-6×413.4kJ/mol-347.7kJ/mol=-123.5kJ/mol,故B正确;
C.O最外层有6个电子,共用两对电子后达到8电子稳定结构,即存在 O=O ,同样,N最外层有5个电子,共用三对电子后达到8电子稳定结构,存在 N≡N ;C最外层有4个电子,可能存在CC ,C原子进行sp杂化,每个碳原子都形成1个C-Cσ键和1个C-Hσ键,两个碳原子间还有2个π键,故C正确;
D.键能越大,键长越短,所以键长:C-C>C=C>C≡C ;同样的: N-N>N=N>N≡N,故D正确;
故选A。
6.B
【详解】A.的中心原子B的价层电子对数为4+=4,而且没有孤电子对,所以VSEPR模型为正四面体形,故A错误;
B.每个C提供一个pz电子,N提供一对pz电子,C原子和N原子形成大π键,故B正确;
C.同周期,从左到右,元素的第一电离能逐渐增大,其中第IIA族的Be和第VA族的N的第一电离能均高于其相邻的元素,故第二周期中第一电离能介于B与N之间的元素有Be、C、O,共3种,故C错误;
D.甲基上的C原子只形成单键,为sp3杂化,杂环上的C原子形成了C=N双键,为sp2杂化,B原子的价电子对数为4+=4,因此B原子采取sp3杂化,故D错误;
故选:B。
7.B
【详解】A.过氧乙酸分子中含有单键碳原子和双键碳原子,碳原子的杂化方式不相同,分别为sp3杂化和sp2杂化,故A正确;
B.过氧乙酸为分子晶体,分子晶体的熔点取决于分子间作用力的强弱,与共价键的键能大小无关,故B错误;
C.过氧乙酸分子中含有碳氢、碳氧、氢氧极性共价键和碳碳、氧氧非极性共价键,故C正确;
D.过氧乙酸分子是能与水分子形成氢键的极性分子,在水中的溶解度大,易溶于水,故D正确;
故选B。
8.A
【详解】A.中配位键属于σ键,CN-中也有1根σ键,1mol离子中含有的σ键为12mol,即12NA ,A错误;
B.依据计算物质的量,氢键是分子间作用力,每个水分子形成两个氢键,18g冰中含有的氢键数目为2NA,B正确;
C.256g单质的物质的量为,而1mol中含8molS—S键,单质中含有8molS—S键,即8NA个,C正确;
D.依据计算物质的量,1mol形成的N—N键为,则形成N—N键个数为1.5 NA,D正确;
故选A。
9.C
【详解】A.烷烃分子中碳原子间均以单键结合成链状,碳原子剩余价键全部与氢原子结合,故A正确;
B.烷烃分子中碳原子间均以单键结合成链状,碳原子剩余价键全部与氢原子结合,烷烃的通式为CnH2n+2,则分子组成符合CnH2n+2的烃一定是烷烃,故B正确;
C.正丁烷分子中碳原子为饱和碳原子,空间构型为四面体形,所以分子中4个碳原子不在一条直线上,故C错误;
D.有机化合物中的三键含有一个头碰头的σ键和两个肩并肩的π键,故D正确;
故选C。
10.D
【详解】A.在SiO2晶体中每个O原子与2个Si原子形成共价键。含16 g氧原子的二氧化硅晶体中O原子的物质的量是1 mol,则其中含有的σ键数目为2NA,A正确;
B.58.5 g NaCl的物质的量是1 mol,NaCl是离子晶体,Na+、Cl-的配位数都是6,在图示晶体结构单元中含有Na+:8×+6×=4;含有Cl-数目是:1+12×=4,所以该图示是4个NaCl,则58.5 g NaCl晶体中含有0.25NA个如上图所示的结构单元,B正确;
C.18 g冰中含有H2O的物质的量是1 mol,由于每个H2O与相邻4个H2O形成氢键,每个氢键是相邻的2个H2O分子形成的,故含有1 mol冰中的氢键数为2NA,C正确;
D.标准状况下HF不是气体,因此不能使用气体摩尔体积计算其中所含共价键数目,D错误;
故合理选项是D。
11.B
【分析】根据元素在周期表中的位置判断其电子排布式,或根据价电子排布式判断元素所在周期表中的位置,利用结构图中的化学键判断成键及电子特点;
【详解】A.根据As位于元素周期表位置直接判断,在第四周期,故A正确;
B.根据硫和砷的成键特点判断,硫形成两个化学键,砷形成3个化学键,故白点是砷,黑点是硫,根据结构图中判断含有As—As键和As—S键,故B错误;
C.根据砷的位置或者电子排布式判断:As的价电子排布式为4s24p3,故C正确;
D.根据硫原子形成两个化学键,提出2个电子后,还剩余4个电子,故2对孤对电子,故D正确;
故选答案B。
【点睛】注意8电子稳定就结构根据原子最外层电子数判断,需要得到几个电子达到8电子稳定结构就能行成几个化学键。
12.B
【详解】A.由题中信息可知,BN晶体具有高熔点、高硬度的特性,所以其为原子晶体,其结构应与金刚石相似,A正确;
B.结构与金刚石相似,则每个原子均采用sp3杂化,B错误;
C.由于B最外层只有3个电子,故其原子的最外层有空轨道,而N原子有孤电子对,故两者可形成配位键,C正确;
D.由题中信息可知,BN晶体具有高熔点、高硬度的特性,因此该晶体可作耐高温、耐磨材料;
答案选B。
13.B
【详解】A.因为a和b具有不同的特性,所以a和b一定不是同一种物质,故A错误;
B.性质不同说明结构不同,而a与b的分子式是相同的,所以a和b互为同分异构体,故B正确;
C.根据分子的空间构型,a中正、负电荷重心重合,为非极性分子,b中正、负电荷重心不重合,为极性分子。a和b的空间构型若是四面体形,两个氯原子就不存在相邻和相间之分,因此a与b的空间构型只能是平面四边形,故C错误;
D.此题干中仅说明a具有抗癌作用,而b没有,但不能说明b在其他领域没有应用,故D错误;
故答案选B。
14.B
【详解】A.由非金属原子形成的化合物可能是离子化合物如NH4Cl,也可能是共价化合物如HCl,因此由非金属原子形成的化合物不一定是共价化合物,A错误;
B.离子化合物中一定存在离子键,可能存在共价键,例如NaOH中含有离子键和共价键,B正确;
C.离子键、共价键均属于化学键,氢键不是化学键,属于分子间作用力,C错误;
D.H2O是一种非常稳定的化合物,这是由于H2O分子中的H-O化学键所致,氢键不属于化学键,不能影响物质的稳定性,一般是影响其物理性质,如影响物质的熔沸点逆密度大小,D错误;
故合理选项是B。
15.A
【详解】A.的质子数为13,核外电子数为10,故结构示意图为 ,故A正确;
B.基态S原子的电子排布式,故B错误;
C.中子数为10的氧原子:,故C错误;
D.的立体构型为三角锥形,不是平面型,故D错误;
故选A。
16.(1) 1s22s22p63s23p63d64s2或[Ar]3d64s2 1s22s22p6
(2) 分子内的O-H键>H2O分子之间的氢键>分子间的范德华力 可形成分子间氢键,使其沸点升高,形成分子内氢键,使其沸点降低
(3) 正四面体 sp3 109°28′
(4) 不是手性分子
【详解】(1)Fe为26号元素,根据构造原理可知,基态铁原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,Mg为12号元素,根据构造原理可知,Mg2+的电子排布式为1s22s22p6。
(2)化学键比分子间作用力强的多,氢键是一种特殊的分子间作用力,比分子间的范德华力强,故H2O分子内的O-H键、分子间的范德华力和H2O分子之间的氢键从强到弱的顺序为分子内的O-H键>H2O分子之间的氢键>分子间的范德华力。的沸点比高的原因是可形成分子间氢键,使其沸点升高,形成分子内氢键,使其沸点降低。
(3)CCl4分子的中心原子C原子的σ键电子对数为4,孤电子对数为,则其空间构型为正四面体,中心原子成键时采取的杂化轨道类型为sp3,分子中共价键的键角为109°28′。
(4)手性碳原子是指连接四个不一样的原子或原子团的碳原子,为手性分子,手性碳原子如图所示。不含有手性碳原子,不是手性分子。
17. CO2 SO2
【详解】Z元素的原子核内有16个质子,故Z为S,而X与Z同一主族且为短周期元素,故X为O,则ZX2为SO2;X与Y在同一周期,故Y的核外有2个电子层,且Y元素原子最外层电子数是K层所能容纳的电子数的2倍,故Y的L层有4个电子,故为C,则YX2为CO2, 用电子式表示CO2的形成过程为: 。
18.(1)排尽装置内的空气
(2) 500 恒压滴液漏斗
(3)FeHClL2+Na[B(C6H5)4]+N2=NaCl+[FeH(N2)L2][B(C6H5)4]
(4) 石油醚 61.8%
(5)可以实现常温常压合成氨气
【详解】(1)由表格内容可知,反应物X与产物Y均易被氧化,通氮气可排出装置中的空气,防止X和Y被氧化;
(2)三颈瓶中加入的液体体积为120mL+50mL=170mL,瓶中的液体不能超过容积的一半,因此三颈瓶应选用500mL的;由仪器的外观可知,B是恒压滴液漏斗;
(3)FeHClL2和Na[B(C6H5)4]与N2反应生成[FeH(N2)L2][B(C6H5)4]和NaCl,方程式为FeHClL2+Na[B(C6H5)4]+N2=NaCl+[FeH(N2)L2][B(C6H5)4];
(4)产物Y难溶于石油醚,可以用石油醚洗涤;n(X)= ≈0.002973mol,n(Y)=n(X)=0.002973mol,m(Y)=0.002973mol×816g/mol=2.426g,产率=×100%≈61.8%;
(5)该过程不需要传统合成氨的高温高压条件,实现了在常温常压条件下合成氨气。
19.(1)3d104s1 离子键、共价键、配位键 (2)Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
(3)5NA 异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键 CO2
(4)sp3、sp2 (5)面心立方最密堆积 4 设Cu原子半径为r,则晶胞中Cu原子总体积为4×4/3πr3,晶胞棱长为4r×=2r,则晶胞体积为(2r)3 ="16" r3,空间利用率为≈74%。
【详解】试题分析:(1)基态铜原子的价电子排布式为3d104s1;向深蓝色溶液中加入适量乙醇,会析出深蓝色晶体,其化学式为[Cu(NH3)4]Cl2·H2O,存在的化学键的类型有:离子键、共价键、配位键。 (2)反应④的离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-。(3)(SCN)2的结构式为,根据(SCN)2的结构可知1个分子中有3个单键和2个碳氮叁键,单键为δ键,1个叁键含有1个δ键、2 个π键,1 个(SCN)2分子含有5个δ键,故 1mol(SCN)2分子中含有δ键的数目为5NA;由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H—S—CN)的沸点低于异硫氰酸的;与SCN-互为等电子体的分子有CO2等,原子数相同,价电子数均为16。(4)分子中连接氨基的C原子形成2个C—H键、1个C—N键、1个C—C键,没有孤电子对,杂化轨道数目为4,采取sp3杂化,而碳氧双键中的C原子形成3个δ键和 1 个π键,没有孤电子对,杂化轨道数目为3,采取sp2杂化。(5)Cu晶胞中,其晶体的堆积方式为面心立方最密堆积;一个晶胞中铜原子数为8×1/8+6×1/2=4个;设Cu原子半径为r,则晶胞中Cu原子总体积为4×4/3πr3,晶胞棱长为4r×=2r,则晶胞体积为(2r)3 ="16" r3,空间利用率为≈74%。
考点:考查物质结构与性质,涉及电子排布、杂化理论、晶胞结构分析与计算等。
20. (,1,)
【详解】①根据图示可知d点在后面的面心上,则d点的坐标为(,1,);
②根据图示可知:在一个晶胞中含有Ti原子个数为8×=1,含有Co原子数为1;含有O原子数为6×=3,所以晶胞质量,所以a=nm。
21.(1)3d10 4s1
(2) ABD sp3 N>C>H
(3) 乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键; N 元素电负性更小,更易给出孤对电子形成配位键;
(4) (,,)
【详解】(1)铜元素基态原子中3d、4s能级上电子为其价电子,3d能级上有10个电子、4s能级上有1个电子,其价电子排布式为3d10 4s1;
故答案为3d10 4s1;
(2)①Cu2+与乙二胺所形成的配离子内部粒子间含有C N、C H、N H、C C和N Cu键,C N、C H和N H为极性键,C C非极性键,N Cu之间的化学键是配位键;
故答案为ABD;
②乙二胺分子中氮原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断N原子的杂化轨道类型为 sp3,元素的非金属性越强,其电负性越大,电负性大小顺序是N>C>H;
故答案为sp3;N>C>H;
(3)乙二胺分子中N原子上连接有氢原子,可形成氢键,而三甲胺分子中氮原子上没有连接氢原子,不能形成氢键,故乙二胺的沸点比三甲胺高很多;向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,是因为N 元素电负性更小,更易给出孤对电子形成配位键;
故答案为乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键;N 元素电负性更小,更易给出孤对电子形成配位键;
(4)①C点位于体对角线的处,根据A点和B点的晶胞参数,容易写出C的晶胞参数为(,,);
故答案为(,,);
②阿伏加德罗常数值为;该晶胞是面心立方最密堆积,每个面上对角线上的3个Cu原子紧密相连,则晶胞棱长=, 晶胞体积=,该晶胞中Cu原子个数=,S原子个数是4,所有原子体积=,该晶体中原子的空间利用率=;
故答案为,。
