第二章第一节钠及其化合物课时训练(含解析)三高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第二章第一节钠及其化合物课时训练(含解析)三高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-07 00:00:00 | ||
图片预览



文档简介
人教版(2019)必修第一册第二章第一节 钠及其化合物
课时训练三
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学物质在航天领域有广泛用途。下列说法错误的是
A.作航天器的太阳能电池 B.过氧化钠作航天供氧剂
C.合成纤维可作航天员航天服 D.硬铝可作航天飞船材料
2.下列关于钠及其化合物的叙述错误的是
A.取用金属钠时,所需用品一般有小刀、镊子、滤纸、玻璃片
B.将过量粉末加入紫色石蕊试液中振荡,溶液变为蓝色,且有气泡产生
C.金属钠与溶液反应时,既有白色沉淀又有气体逸出
D.Na、、、NaOH长期放置在空气中,最终都将变为
3.下列有关Na2O2的说法不正确的是
A.向包有Na2O2粉末的脱脂棉滴加几滴水,脱脂棉剧烈燃烧,因为Na2O2与H2O反应放热且有氧气生成
B.Na2O2在空气中久置变白,最终产物为Na2CO3
C.Na2O2与CO2反应时有单质O2生成,该反应属于置换反应
D.将Na2O2粉末加入Ca(HCO3)2溶液中,溶液变浑浊并产生气体
4.是中学化学常用的强氧化剂,除了能与、反应外,还可与其他还原剂如、C发生反应,某化学课外兴趣小组为探究与的反应情况,设计了如图所示装置进行有关实验。下列说法错误的是
A.实验前应该先检查装置气密性
B.U型管中碱石灰的作用是装置中除去中的和水蒸气
C.实验过程中,应该先打开b处的弹簧夹,在干燥管上倒插一支小试管收集,检验的纯度
D.实验结束后,应该先关闭b处的弹簧夹,再撤离酒精灯
5.将10g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A.8g B.10g C.12g D.13.5g
6.实验室按如图装置测定纯碱(含少量NaCl)的纯度。下列说法不正确的是
A.装置①、④的作用是防止空气中的进入装置③
B.②中分液漏斗不能用长颈漏斗代替
C.必须在装置②、③间添加盛有饱和溶液的洗气瓶
D.反应结束时,应再通入空气将装置②中转移到装置③中
7.向和混合溶液中滴加的稀盐酸,的生成量与加入盐酸的量的关系如图所示。下列判断正确的是
A.在范围内,只发生中和反应
B.段发生反应的离子方程式为
C.
D.原混合溶液中与的物质的量之比为1∶1
8.化学与人类生产、生活、可持续发展密切相关,下列说法不正确的是
A.Na2O2可以做呼吸面具的供氧剂 B.Na2CO3可以治疗胃酸过多
C.明矾可以用于净水 D.酒精可以杀菌消毒
9.两只试管中分别装有Na2CO3和NaHCO3,下列操作或者判断正确的是
A.分别加入澄清石灰水,产生沉淀的为Na2CO3
B.分别加入等浓度的稀盐酸,反应较剧烈的为Na2CO3
C.分别加入CaCl2溶液,产生沉淀的为Na2CO3
D.逐滴加入等浓度盐酸,立即产生气泡的为Na2CO3
10.某化学兴趣小组为研究用不同膨松剂蒸馒头的效果,在相同条件下依次进行以下四组实验。实验结束后,比较不同实验中所蒸馒头的蓬松度、颜色和口味(碱性增强会使馒头颜色变黄)。下列说法错误的是
实验编号 1 2 3 4
所加物质 酵头、 酵头、 酵头、、适量柠檬酸 1.5g某种酵母
实验结果 硬实、黄色、带碱味 较松软、黄色、略带碱味 松软、黄色较浅、无碱味 松软、颜色正常、无碱味
A.该兴趣小组用到的研究方法有观察法、实验法等
B.实验4中所用酵母为生物膨松剂,使用过程中发生了化学反应
C.对比实验1和实验2,可知和均能单独作为蒸馒头的膨松剂
D.对比实验2和实验3,可知柠檬酸作用主要是降低馒头的碱性并使馒头更为松软
11.下列关于钠的化合物叙述不正确的是
A.碳酸氢钠是酸式盐,既可以与盐酸反应,又可以与氢氧化钠反应
B.过氧化钠可以做呼吸面具中的供氧剂
C.氯化钠可以做调味剂和防腐剂
D.碳酸钠可用于治疗胃酸过多
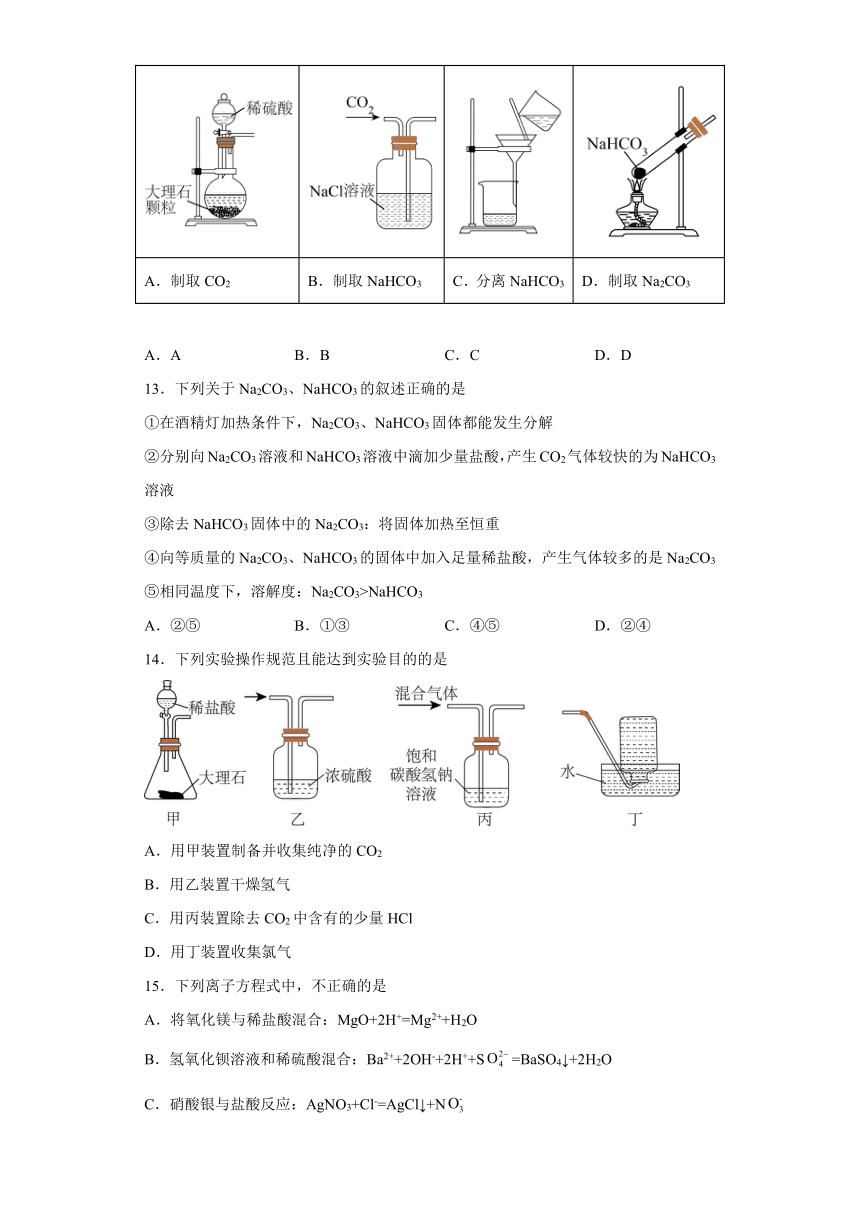
12.以NaCl为原料,可制取纯碱。Na2CO3可用侯氏制碱法制取,主要涉及如下反应:;,下列有关实验室模拟侯氏制碱法的实验原理和装置正确的是
A.制取CO2 B.制取NaHCO3 C.分离NaHCO3 D.制取Na2CO3
A.A B.B C.C D.D
13.下列关于Na2CO3、NaHCO3的叙述正确的是
①在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
②分别向Na2CO3溶液和NaHCO3溶液中滴加少量盐酸,产生CO2气体较快的为NaHCO3溶液
③除去NaHCO3固体中的Na2CO3:将固体加热至恒重
④向等质量的Na2CO3、NaHCO3的固体中加入足量稀盐酸,产生气体较多的是Na2CO3
⑤相同温度下,溶解度:Na2CO3>NaHCO3
A.②⑤ B.①③ C.④⑤ D.②④
14.下列实验操作规范且能达到实验目的的是
A.用甲装置制备并收集纯净的CO2
B.用乙装置干燥氢气
C.用丙装置除去CO2中含有的少量HCl
D.用丁装置收集氯气
15.下列离子方程式中,不正确的是
A.将氧化镁与稀盐酸混合:MgO+2H+=Mg2++H2O
B.氢氧化钡溶液和稀硫酸混合:Ba2++2OH-+2H++S=BaSO4↓+2H2O
C.硝酸银与盐酸反应:AgNO3+Cl-=AgCl↓+N
D.将碳酸氢钠溶液与稀盐酸混合:HC+H+=H2O+CO2↑
二、填空题
16.“化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。
(1)小苏打常用于糕点制作,还可治疗胃酸过多等,有多种用途。请写出小苏打溶液与氢氧化钠溶液反应的离子方程式:_________。
(2)过氧化钠常用作呼吸面具或潜水艇中的供氧剂,请你写出过氧化钠与二氧化碳反应的化学方程式:_________。
(3)有小组同学称取10 g所制备Na2O2的样品(设样品中杂质不参与下列反应),利用下列装置测定Na2O2样品的纯度(夹持仪器省略),已知Na2O2的摩尔质量为78 g/mol。
有同学提出该实验装置存在缺陷,应该在A、B装置之间增加一个盛有饱和溶液的洗气瓶,该同学想法是否有必要?理由是_________。倒出量筒内水的体积后,折算成标准状况下O2的体积为1120 mL,计算样品中Na2O2的质量分数约为_________。
(4)向30 mL NaOH溶液中逐渐通入一定量的CO2,再向该溶液中逐滴加入2 mol/L盐酸,所加入盐酸的体积(单位为mL)与产生二氧化碳的体积(标准状况下)关系如图所示。
A点溶液中溶质为:_________,计算原NaOH溶液的物质的量浓度是_________mol/L。
17.写出下列除杂的化学方程式(有离子方程式的还要写出相应的离子方程式)
混合物 除杂方法及试剂
(1)Na2CO3固体(NaHCO3) 加热
(2)NaHCO3溶液(Na2CO3) 通入足量CO2气体
(3)Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
(1)化学方程式_______。
(2)化学方程式_______,离子方程式_______。
(3)化学方程式_______,离子方程式_______。
18.某碳酸钠()固体样品中含有少量杂质。小组同学用不同的方案测定样品中碳酸钠的纯度。
已知:碳酸钠的纯度。
(1)方案1:
①操作x的名称是___________。
②溶液B中所含的金属阳离子有___________。
③该方案中,需测量的物理量有___________。
(2)方案2:利用如图所示装置进行实验,通过测量样品与稀硫酸反应产生的二氧化碳的体积,计算样品中碳酸钠的纯度。
①样品中的与稀硫酸反应的离子方程式是___________。
②将虚线框中的装置补充完整___________。
③为了提高测量的准确性,B中试剂的选择依据是___________。
(3)方案3:称量mg样品,并使其充分加热,冷却至室温,再称量固体质量为ng.则样品中碳酸钠的纯度=___________(用代数式表示)。[已知:,]
19.回答下列问题
(1)热稳定性:NaHCO3_______(填“>”或“<”)Na2CO3,实验室可用如图装置验证,试管B中应装入的固体是_______。
(2)某同学研究HCl性质,进行如下预测:
①从物质类别上看,HCl属于酸,能与大理石反应,相应的离子方程式为_______;
②从化合价角度看,具有_______性。
20.碳酸钠和碳酸氢钠是生活中比较常见的两种物质。某学校的课外化学学习兴趣小组对两者性质进行探究,并测定碳酸钠和碳酸氢钠混合物中各成分的含量。
实验I:
(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是_______(填化学式,下同)。
(2)继续向两支试管中分别加入10mL水,充分振荡,最先溶解完全的是_______;再分别加入几滴酚酞试液,溶液变红,但颜色较浅的是_______。
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后,接下来的操作是_______,再往试管中添加药品,则试管A中盛放的药品是_______,澄清石灰水变浑浊的是_______(填“a”或“b”)。
实验III:混合物中碳酸钠含量的测定
(4)为确定碳酸钠和碳酸氢钠混合物样品的组成,甲化学探究小组设计实验1:利用如图2所示的装置进行实验。
下列说法错误的是_______(填字母,单选)。
A.滴入盐酸前,应先将装置中含有的空气排尽
B.装置①、④的作用是防止空气中的进入装置③中
C.在装置②、③间需添加盛有饱和溶液的洗气瓶,以除去挥发的HCl气体
D.反应结束时,应继续通入空气将装置②中的转移到装置③中
(5)乙化学探究小组设计实验2:取ag样品加热、冷却、称重,重复以上操作至样品固体质量不再变化,称量其质量为bg。样品中质量分数为_______×100%(用a、b表示)。
(6)丙化学探究小组设计实验3:步骤ⅰ。称取一定量的混合物样品;步骤ⅱ。向其中逐滴滴入0.1000mol/L稀盐酸,记录生成的气体体积和滴入盐酸体积,如图3所示。
计算:①生成的在标况下的体积为_______mL;
②该混合物中的质量分数_______%(保留两位小数)。
三、实验题
21.Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:
已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为_______。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。
(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若_______,说明装置不漏气。
(3)装置A中的试剂为_______,装置C中的试剂为_______。
(4)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为_______(保留小数点后一位);若缺少E装置,会使测定结果_______(填“偏高”或“偏低”)。
22.纯碱在工业生产中具有广泛的用途。某化学兴趣小组利用下图所示装置,模拟侯氏制碱法制取纯碱。
请回答以下问题:
(1)A装置发生反应的化学方程式为_______。
(2)如何检验装置B的气密性?_______。
(3)装置C中盛有饱和食盐水。需要用粗盐精制后得到,已知粗盐中含有的杂质离子为,,。精制除杂的步骤为:粗盐溶解,滤去沉渣→加入_______(填化学式)溶液→加入溶液→_______(填操作名称)→加入盐酸调pH。
(4)仪器连接顺序为a接_______,b接_______。_______
(5)实验开始时,应先向C中通入_______(填电子式)。
(6)反应结束后,将C中的浊液过滤,分别得到滤渣与滤液。
①灼烧滤渣可制得,灼烧时所需要的硅酸盐仪器有:酒精灯、玻璃棒、_______
②向滤液中通氨气,冷却析出的副产品可用作氮肥,通氨气的作用有_______(填字母选项代号)。
A.增大的浓度,使更多地析出
B.使更多地析出
C.使转化为,提高析出的纯度
(7)该实验设计中明显的不足之处是_______。
参考答案:
1.A
【详解】A.硅是半导体,可作航天器的太阳能电池,故A错误;
B.过氧化钠能与二氧化碳和水反应生成氧气,可作航天供氧剂,故B正确;
C.合成纤维具有强度大等特性,可作航天员航天服,故C正确;
D.硬铝硬度大、密度小,可作航天飞船材料,故D正确;
故选A。
2.B
【详解】A.钠较软可以直接切,取用金属钠时,所需用品一般有小刀、镊子、滤纸、玻璃片,故A正确;
B.过氧化钠具有强氧化性,会使紫色石蕊试液褪色,故B错误;
C.金属钠与水反应生成氢气和氢氧化钠,氢氧化钠溶液反应生成碳酸钙沉淀,既有白色沉淀又有气体逸出,故C正确;
D.Na和氧气生成氧化钠,氧化钠吸收水生成氢氧化钠;和水生成氢氧化钠;和水生成氢氧化钠、和二氧化碳生成碳酸钠;NaOH吸收二氧化碳生成碳酸钠;故长期放置在空气中,最终都将变为,故D正确;
故选B。
3.C
【详解】A.向包有Na2O2粉末的脱脂棉滴加几滴水,脱脂棉剧烈燃烧,脱脂棉达到着火点,氧气浓度增大,说明Na2O2与H2O反应放热且有氧气生成,故A正确;
B.空气中过氧化钠和水反应生成氢氧化钠,氢氧化钠和空气中二氧化碳反应生成碳酸钠,因此Na2O2在空气中久置变白,最终产物为Na2CO3,故B正确;
C.Na2O2与CO2反应时有单质O2生成,2Na2O2+2CO2=2Na2CO3+O2,该反应不属于置换反应,故C错误;
D.将Na2O2粉末加入Ca(HCO3)2溶液中,生成碳酸钙沉淀和氧气,故D正确。
综上所述,答案为C。
4.D
【分析】锌和稀盐酸生成氢气,气体通过碱石灰干燥除杂后进入试管和过氧化钠反应,生成气体通过硫酸铜装置排出;
【详解】A.实验中有气体生成和参与,故实验前应该先检查装置气密性,防止装置漏气,A正确;
B .U型管中碱石灰含有固体氢氧化钠,能吸收水且能和HCl反应,其作用是装置中除去中的和水蒸气,B正确;
C.氢气易燃易爆,实验过程中,应该先打开b处的弹簧夹,在干燥管上倒插一支小试管收集,检验的纯度,C正确;
D.实验结束后,应该先撤离酒精灯,再关闭b处的弹簧夹,防止空气进入装置引起爆炸,D错误;
故选D。
5.B
【详解】CO在氧气中完全燃烧生成CO2,生成的CO2再与Na2O2反应,有关反应为:2CO+O2=2CO2,2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重为CO的质量;H2在氧气中完全燃烧H2O,H2O再与Na2O2反应,有关反应为:2H2+O2=2H2O,2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重为氢气质量。
综上分析,最终固体增重为CO与氢气的总质量,故10gCO和H2的混合气点燃后,再通入足量的Na2O2中,充分反应后,固体增重质量是10g,故选B。
6.C
【分析】样品与盐酸反应产生的CO2用足量Ba(OH)2溶液吸收,通过测量装置③中产生沉淀的质量计算纯碱的纯度。
【详解】A.装置①中NaOH溶液的作用是吸收通入的空气中的CO2,防止空气中CO2进入装置③中,装置④的作用是防止外界空气中的CO2进入装置③中,A正确;
B.为控制反应速率,最终②中分液漏斗不能用长颈漏斗代替,B正确;
C.由于盐酸具有挥发性,反应产生的CO2中混有HCl,若在装置②、③间添加盛有饱和NaHCO3溶液的洗气瓶,HCl与NaHCO3反应产生CO2,使得测得的CO2偏大,测得纯碱的纯度偏大,C错误;
D.为了保证测量的CO2的准确性,反应结束,应继续通入除去CO2的空气将滞留在装置②中CO2全部转移到装置③中,D正确;
故选C。
7.D
【详解】A.0-a范围内,NaOH与HCl发生中和反应,Na2CO3与HCl反应生成NaHCO3和NaCl,A错误;
B.ab段发生反应的离子方程式为,B错误;
C.已知生成CO2为2mol,则根据离子方程式可知,消耗HCl2mol,则a=4,C错误;
D.根据前述分析可知,混合溶液中碳酸钠有2mol,a=4,滴加的4molHCl中2mol与碳酸钠反应生成碳酸氢钠,2mol与NaOH发生中和反应,则NaOH与Na2CO3的物质的量之比为1:1,D正确;
故答案选D。
8.B
【详解】A.Na2O2可以吸收人体呼出的CO2、H2O,同时产生O2,故A正确;
B.Na2CO3碱性较强,会腐蚀胃壁,可以用NaHCO3治疗胃酸过多,故B不正确;
C.明矾溶于水会产生氢氧化铝胶体,具有吸附水中悬浮颗粒物的能力,故C正确;
D.酒精可以使蛋白质变性失活,所以可用于杀菌消毒,故D正确;
故选B。
9.C
【详解】A.NaHCO3可以与加入的Ca(OH)2发生反应,生成白色沉淀:,因此,A错误;
B.分别加入等浓度的稀盐酸,反应较剧烈的为NaHCO3,B错误;
C.分别加入CaCl2溶液,产生沉淀的为Na2CO3,C正确;
D.逐滴加入等浓度盐酸,Na2CO3先发生反应:,等反应完后,生成的NaHCO3才会与HCl反应生成气泡,因此立即产生气泡的是NaHCO3,D错误。
本题选C。
10.C
【详解】A.该实验过程中通过观察所蒸馒头的蓬松度、颜色等,以及利用分组实验进行分析,故该兴趣小组用到的研究方法有观察法、实验法等,选项A正确;
B.酵母是一种单细胞真菌微生物,是一种对人体有益的生物膨松剂,馒头蒸制过程中发生了化学反应,选项B正确;
C.Na2CO3加热不分解,碳酸钠和碳酸氢钠单独做蒸馒头的膨松剂,蒸出来的馒头口感都不好,选项C错误;
D.对比实验2和实验3的实验结果,可知柠檬酸与碳酸氢钠反应,降低馒头的碱性并使馒头更为松软,选项D正确;
答案选C。
11.D
【详解】A.碳酸氢钠是酸式盐,既可以与盐酸反应生成二氧化碳、氯化钠,又可以与氢氧化钠反应生成碳酸钠,A正确;
B.过氧化钠可以和水、二氧化碳反应生成氧气,做呼吸面具中的供氧剂,B正确;
C.氯化钠俗称食盐,可以做调味剂和防腐剂,C正确;
D.碳酸氢钠可用于治疗胃酸过多,D错误;
故选D。
12.C
【详解】A.稀硫酸与碳酸钙反应会生成微溶的硫酸钙,附着在固体表面,影响反应的进行,应该用稀盐酸与碳酸钙反应制备二氧化碳,故A错误;
B.二氧化碳在饱和食盐水中溶解度较小,向饱和食盐水中先通氨气使溶液呈碱性,再通入二氧化碳,二氧化碳应该从长管进,氨气要防止倒吸,从短管进,故B错误;
C.碳酸氢钠溶解度小,从饱和溶液中和析出晶体,可以用过滤的方法分离固体和溶液,故C正确;
D.碳酸氢钠不稳定,受热易分解,在试管中加热固体管口应向下倾斜,防止冷凝水倒流炸裂试管,故D错误;
故答案为C。
13.A
【详解】①Na2CO3热稳定性好,用酒精灯加热不会分解,①错误;
②向两溶液中滴加少量盐酸时,Na2CO3和HCl反应先生成NaHCO3,NaHCO3与HCl再反应生成CO2,故产生CO2气体较快的为NaHCO3溶液,②正确;
③NaHCO3受热易分解,2NaHCO3Na2CO3+H2O+CO2↑,被除去的是NaHCO3,③错误;
④等质量的Na2CO3、NaHCO3的固体,NaHCO3的物质的量大,放出的CO2多,④错误;
⑤相同温度下,溶解度Na2CO3>NaHCO3,⑤正确;
②⑤正确,故选A。
14.C
【详解】A.甲装置能制取二氧化碳,但是缺少除去氯化氢和水蒸气的杂质装置,不能收集纯净的二氧化碳,A错误;
B.乙装置为洗气装置,故气体应从长导管进入,短导管出去,有利于气体与除杂试剂充分接触,除杂效果好,B错误;
C.二氧化碳在饱和碳酸氢钠中的溶解度很小,碳酸氢钠可以与氯化氢反应,可以吸收氯化氢,故可以用丙装置除去CO2中含有的少量HCl,C正确;
D.氯气在水中有一定的溶解度,直接排水法收集会使氯气损失,故应用排饱和食盐水的方法收集氯气,氯气在饱和食盐水中溶解度很小,D错误;
故本题选C。
15.C
【详解】A.将氧化镁与稀盐酸混合生成氯化镁和水:MgO+2H+=Mg2++H2O,A正确;
B.氢氧化钡溶液和稀硫酸混合生成硫酸钡和水:Ba2++2OH-+2H++=BaSO4↓+2H2O,B正确;
C.硝酸银与盐酸反应生成氯化银和硝酸:Ag++Cl-=AgCl↓,C错误;
D.将碳酸氢钠溶液与稀盐酸混合生成氯化钠、水和二氧化碳:HCO+H+=H2O+CO2↑,D正确;
答案选C。
16.(1)
(2)2Na2O2+2CO2=2Na2CO3+O2
(3) 没有必要,因为从A装置出来的气体有CO2、H2O(g)、HCl,三者与Na2O2反应均生成O2,且关系为2Na2O2~O2,故HCl的存在不影响纯度的测定 78%
(4) NaHCO3 3
【详解】(1)小苏打溶液与氢氧化钠溶液混合,反应产生Na2CO3、H2O,反应的离子方程式:;
(2)过氧化钠与二氧化碳反应产生Na2CO3、O2,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;
(3)HCl与CaCO3会发生复分解反应:2HCl+CaCO3=CaCl2+CO2↑+H2O,盐酸具有挥发性,挥发的HCl及CO2、H2O(g)进入装置B中会发生反应:4HCl+2Na2O2=4NaCl+2H2O+O2↑、2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,根据反应方程式可知三个反应中都存在物质的量关系:2Na2O2~O2,故HCl的存在不影响纯度的测定,故在A、B装置之间没有必要增加一个盛有饱和NaHCO3溶液的洗气瓶;
n(O2)=,则10.0 g Na2O2样品中含有Na2O2的物质的量n(Na2O2)=2n(O2)=0.1 mol,其质量是0.1 mol×78 g/mol=7.8 g,故样品中Na2O2的质量分数为:;
(4)向NaOH溶液中通入一定量CO2气体,所得溶液的溶质可能为NaOH和Na2CO3;Na2CO3;Na2CO3和NaHCO3;NaHCO3。Na2CO3溶液中加入HCl,反应分步进行:Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑,根据方程式可知两步反应消耗HCl的物质的量相同,由于溶液浓度相同,故两步反应消耗HCl的体积相同,而图象中0-A消耗HCl的体积25 mL大于A-B消耗HCl的体积20 mL,说明向30 mL NaOH溶液中逐渐通入一定量的CO2,反应所得溶液为NaOH和Na2CO3的混合溶液,0A段除发生反应Na2CO3+HCl=NaCl+NaHCO3、还发生了反应HCl+NaOH=NaCl+H2O。A点溶质为NaHCO3,A-B段发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑;反应至B点时溶液为NaCl溶液,根据元素守恒可知n(NaOH)=n(HCl)=n(NaCl)=0.045 L×2 mol/L=0.09 mol,由于NaOH溶液的体积是30 mL,故该NaOH溶液的浓度为c(NaOH)=。
17.(1)2NaHCO3Na2CO3 + H2O + CO2↑
(2) Na2CO3+ H2O + CO2 = 2NaHCO3
(3) NaHCO3 + NaOH = Na2CO3 + H2O
【详解】(1)除去Na2CO3固体中的NaHCO3,可以将混合物直接加热,发生NaHCO3分解,反应化学方程式为2NaHCO3Na2CO3 + H2O + CO2↑,从而达到除杂目的;
(2)除去NaHCO3溶液中的Na2CO3,可往溶液中通入过量的CO2气体,Na2CO3、CO2和H2O反应生成NaHCO3,反应的化学方程式为Na2CO3+ H2O + CO2 = 2NaHCO3;离子方程式为;
(3)除去Na2CO3溶液中的NaHCO3,可往溶液中加入适量NaOH溶液,NaHCO3和NaOH反应生成Na2CO3和H2O,反应的化学方程式为NaHCO3 + NaOH = Na2CO3 + H2O;离子方程式为。
18.(1) 过滤 Na+、Ca2+ 样品的质量及固体D的质量
(2) B中的溶液应尽可能不溶解CO2,最好采用排饱和NaHCO3溶液的方法
(3)×100%
【详解】(1)某碳酸钠()固体样品中含有少量杂质,加水溶解的到溶液A含及,加入氢氧化钙溶液,则碳酸钠转化为碳酸钙沉淀和氢氧化钠,故操作X是过滤,溶液B含有氢氧化钠、碳酸氢钠及少量氢氧化钙,故含有的金属阳离子为Na+及Ca2+,沉淀C为碳酸钙沉淀,经过洗涤干燥,得到固体D为碳酸钙;根据样品纯度,由此需测量的物理量是反应前m(样品)及反应后m(CaCO3),再通过化学反应方程式的系数关系计算出m(Na2CO3)。
(2)与稀硫酸反应生成二氧化碳和水和硫酸钠,离子方程式是:;
该装置的目的是通过测量样品与稀硫酸反应产生的二氧化碳的体积,通过化学反应方程式的系数关系计算出样品中的碳酸氢钠,从而计算出碳酸钠的纯度,所以B中的溶液应尽可能不溶解CO2,所以最好采用排饱和NaHCO3溶液的方法,导管应该是短进长出;
为了提高测量的准确性,B中的溶液应尽可能不溶解CO2,最好采用排饱和NaHCO3溶液的方法。
(3)设样品中含有NaHCO3杂质的质量为x,根据可知,,解得,则,故答案为:×100%;
19.(1) < NaHCO3
(2) 2H++CaCO3=Ca2++CO2↑+H2O 还原
【详解】(1)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,碳酸钠受热不分解,因此热稳定性:NaHCO3<Na2CO3,实验室可用如图装置验证,A中温度高,B中温度比A中温度低,在低温下分解,在高温下不分解,则可以说明高温下的物质热稳定性好,因此试管B中应装入的固体是NaHCO3;故答案为:<;NaHCO3。
(2)①从物质类别上看,HCl属于酸,能与大理石反应,酸和盐反应生成新酸和新盐,则相应的离子方程式为2H++CaCO3=Ca2++CO2↑+H2O;故答案为:2H++CaCO3=Ca2++CO2↑+H2O。
②从化合价角度看,处于最低价,只能升高,因此具有还原性;故答案为:还原。
20.(1)
(2)
(3) 检查装置的气密性 a
(4)C
(5)
(6) 67.2 55.79
【详解】(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是,这是因为碳酸钠易与水生成结晶水合物并放出大量的热,碳酸氢钠溶于水几乎不放出热量;
(2)碳酸钠的溶解度大于碳酸氢钠,继续向两支试管中分别加入10mL水,充分振荡,最先完全溶解的为分别加入10mL水,充分振荡,最先完全溶解的为,两者溶于水都显碱性,但是碳酸钠溶液的碱性强于碳酸氢钠,再分别加入几滴酚酞试液,溶液变红,但颜色较浅的是;
(3)大试管先安装好后再装小试管,按图1组装好仪器B小试管后,然后检查装置气密性;其中试管A温度高,装固体,B装,碳酸钠受热不分解,B中碳酸氢钠受热分解生成二氧化碳使a中澄清石灰水变浑浊;
(4)A.为防止空气中的二氧化碳被氢氧化钡溶液吸收,干扰实验,滴入盐酸前,应先将装置中含有的空气排尽,故A正确;B.根据装置③中生成碳酸钡沉淀的质量计算样品的纯度,所以装置①、④防止空气中的进入装置③中干扰实验,故B正确;C.若在装置②。③间添加盛有饱和溶液的洗气瓶,碳酸氢钠和氯化氢反应放出二氧化碳,反应生成二氧化碳的质量增大,测定碳酸钠的纯度偏大,故C错误;D.为提高实验的准确性,反应结束时,应继续通入空气将装置②中的转移到装置③中,故D正确;故选C。
(5)设样品中碳酸钠的物质的量为xmol、碳酸氢钠为ymol,由样品的质量可得,由剩余固体质量可得,解方程可得,则碳酸钠的质量为g,碳酸钠的质量分数为,故答案为:;
(6)滴加盐酸体积从15.00mL~45.00mL时发生反应:,,则生成在标况下的体积;根据与盐酸反应分步进行,第一步是,第二步是,两步反应消耗盐酸相同,由图象可知消耗盐酸前15mL发生的是,则,则原固体中消耗HCl的体积是,根据可知,所以原固体样品中、的物质的量的比是1:1,故样品中的质量分数为:。答案:67.2 55.79。
21.(1)NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
(2)漏斗中与广口瓶中的液面差保持不变(或漏斗中的液面不再下降)
(3) 氢氧化钠溶液(或其他合理答案) 浓硫酸
(4) 73.6% 偏高
【分析】I.依次向饱和食盐水中通入氨气、二氧化碳,析出碳酸氢钠固体,过滤后加热分解碳酸氢钠得到CO2和纯碱;
Ⅱ.纯碱可以和稀硫酸反应生成二氧化碳,利用除去二氧化碳的空气将装置中的CO2全部赶到装置D中被吸收,由于碱石灰也可以吸收水蒸气,所以二氧化碳需要先进行干燥再进行吸收,同时也要注意要防止D装置吸收空气中的二氧化碳和水。
【详解】(1)依次向饱和食盐水中通入氨气、二氧化碳,析出碳酸氢钠固体,同时得到主要含氯化铵的溶液,化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(2)若装置B气密性良好,则常见漏斗内的液体不会滴落,所以若漏斗中与广口瓶中的液面差保持不变(或漏斗中的液面不再下降),说明装置不漏气;
(3)根据分析可知A装置可以除去空气中的二氧化碳,所以为氢氧化钠溶液;装置C对二氧化碳进行干燥,所以为浓硫酸;
(4)D装置增重8.80g,即生成=0.2mol二氧化碳,根据C元素守恒可知碳酸钠的物质的量为0.2mol,质量分数为×100%=73.6%;若缺少装置E,则D可能会吸收空气中的二氧化碳和水蒸气,导致测定的CO2的质量偏大,继而导致测定结果偏高。
22.(1)
(2)关闭导气管上的活塞,从长颈漏斗上口注入水,使长颈漏斗中的液面高于试管中的液面,静置一段时间,若液面位置保持不变,(或形成一段稳定的水柱)证明装置不漏气
(3) 过滤
(4)a接c,b接e
(5)
(6) 泥三角 AC
(7)缺少尾气处理装置
【分析】在A装置中利用熟石灰与氯化铵共热制氨气,在B装置中利用大理石和稀盐酸反应制二氧化碳,两种气体在装置C中与饱和食盐水反应制备碳酸氢钠晶体,过滤后灼烧得到纯碱。
【详解】(1)在A装置中利用熟石灰与氯化铵固体共热制备氨气,发生的化学反应方程式为: ;故答案为: ;
(2)检验B装置的气密性的方法是:关闭活塞b,向长颈漏斗中加入水,使长颈漏斗中液面高于试管中的液面,静置一段时间,若液面保持不变,则装置的气密性良好;故答案为:关闭活塞b,向长颈漏斗中加入水,使长颈漏斗中液面高于试管中的液面,静置一段时间,若液面保持不变,则装置的气密性良好;
(3)除去粗盐中的杂质Ca2+、Mg2+、时,应该先用Ba(OH)2溶液除去、Mg2+,用Na2CO3溶液除去Ca2+及过量的Ba2+过滤后,在滤液中加入盐酸调pH;故答案为: Ba(OH)2;过滤;
(4)由于NH3极易溶于水,CO2能溶于水,所以通入NH3要有防倒吸装置,通入CO2不用防倒吸装置;故a接c, b接e;故答案为: a接c, b接e;
(5)实验开始时,应该先通入NH3(由于CO2能溶于水、NH3极易溶于水。所以先通入NH3时,使溶液呈碱性,后面就能够溶解更多的CO2,从而提高产率)。NH3的电子式为: ;故答案为: ;
(6)①灼烧碱或碳酸盐时,不能用瓷坩埚,所以使用的硅酸盐仪器还有:泥三角;
②通入氨气的作用是:增大铵根离子的浓度,使NH4Cl更多地析出。同时,也可以使NaHCO3转化为Na2CO3,提高析出的NH4Cl的纯度。故答案为: AC;
(7)由于装置C中从d可以逸出没有反应的NH3和CO2,NH3可以污染环境。所以,该实验设计中明显的不足之处是:缺少尾气处理装置。故答案为:缺少尾气处理装置。
课时训练三
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学物质在航天领域有广泛用途。下列说法错误的是
A.作航天器的太阳能电池 B.过氧化钠作航天供氧剂
C.合成纤维可作航天员航天服 D.硬铝可作航天飞船材料
2.下列关于钠及其化合物的叙述错误的是
A.取用金属钠时,所需用品一般有小刀、镊子、滤纸、玻璃片
B.将过量粉末加入紫色石蕊试液中振荡,溶液变为蓝色,且有气泡产生
C.金属钠与溶液反应时,既有白色沉淀又有气体逸出
D.Na、、、NaOH长期放置在空气中,最终都将变为
3.下列有关Na2O2的说法不正确的是
A.向包有Na2O2粉末的脱脂棉滴加几滴水,脱脂棉剧烈燃烧,因为Na2O2与H2O反应放热且有氧气生成
B.Na2O2在空气中久置变白,最终产物为Na2CO3
C.Na2O2与CO2反应时有单质O2生成,该反应属于置换反应
D.将Na2O2粉末加入Ca(HCO3)2溶液中,溶液变浑浊并产生气体
4.是中学化学常用的强氧化剂,除了能与、反应外,还可与其他还原剂如、C发生反应,某化学课外兴趣小组为探究与的反应情况,设计了如图所示装置进行有关实验。下列说法错误的是
A.实验前应该先检查装置气密性
B.U型管中碱石灰的作用是装置中除去中的和水蒸气
C.实验过程中,应该先打开b处的弹簧夹,在干燥管上倒插一支小试管收集,检验的纯度
D.实验结束后,应该先关闭b处的弹簧夹,再撤离酒精灯
5.将10g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A.8g B.10g C.12g D.13.5g
6.实验室按如图装置测定纯碱(含少量NaCl)的纯度。下列说法不正确的是
A.装置①、④的作用是防止空气中的进入装置③
B.②中分液漏斗不能用长颈漏斗代替
C.必须在装置②、③间添加盛有饱和溶液的洗气瓶
D.反应结束时,应再通入空气将装置②中转移到装置③中
7.向和混合溶液中滴加的稀盐酸,的生成量与加入盐酸的量的关系如图所示。下列判断正确的是
A.在范围内,只发生中和反应
B.段发生反应的离子方程式为
C.
D.原混合溶液中与的物质的量之比为1∶1
8.化学与人类生产、生活、可持续发展密切相关,下列说法不正确的是
A.Na2O2可以做呼吸面具的供氧剂 B.Na2CO3可以治疗胃酸过多
C.明矾可以用于净水 D.酒精可以杀菌消毒
9.两只试管中分别装有Na2CO3和NaHCO3,下列操作或者判断正确的是
A.分别加入澄清石灰水,产生沉淀的为Na2CO3
B.分别加入等浓度的稀盐酸,反应较剧烈的为Na2CO3
C.分别加入CaCl2溶液,产生沉淀的为Na2CO3
D.逐滴加入等浓度盐酸,立即产生气泡的为Na2CO3
10.某化学兴趣小组为研究用不同膨松剂蒸馒头的效果,在相同条件下依次进行以下四组实验。实验结束后,比较不同实验中所蒸馒头的蓬松度、颜色和口味(碱性增强会使馒头颜色变黄)。下列说法错误的是
实验编号 1 2 3 4
所加物质 酵头、 酵头、 酵头、、适量柠檬酸 1.5g某种酵母
实验结果 硬实、黄色、带碱味 较松软、黄色、略带碱味 松软、黄色较浅、无碱味 松软、颜色正常、无碱味
A.该兴趣小组用到的研究方法有观察法、实验法等
B.实验4中所用酵母为生物膨松剂,使用过程中发生了化学反应
C.对比实验1和实验2,可知和均能单独作为蒸馒头的膨松剂
D.对比实验2和实验3,可知柠檬酸作用主要是降低馒头的碱性并使馒头更为松软
11.下列关于钠的化合物叙述不正确的是
A.碳酸氢钠是酸式盐,既可以与盐酸反应,又可以与氢氧化钠反应
B.过氧化钠可以做呼吸面具中的供氧剂
C.氯化钠可以做调味剂和防腐剂
D.碳酸钠可用于治疗胃酸过多
12.以NaCl为原料,可制取纯碱。Na2CO3可用侯氏制碱法制取,主要涉及如下反应:;,下列有关实验室模拟侯氏制碱法的实验原理和装置正确的是
A.制取CO2 B.制取NaHCO3 C.分离NaHCO3 D.制取Na2CO3
A.A B.B C.C D.D
13.下列关于Na2CO3、NaHCO3的叙述正确的是
①在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
②分别向Na2CO3溶液和NaHCO3溶液中滴加少量盐酸,产生CO2气体较快的为NaHCO3溶液
③除去NaHCO3固体中的Na2CO3:将固体加热至恒重
④向等质量的Na2CO3、NaHCO3的固体中加入足量稀盐酸,产生气体较多的是Na2CO3
⑤相同温度下,溶解度:Na2CO3>NaHCO3
A.②⑤ B.①③ C.④⑤ D.②④
14.下列实验操作规范且能达到实验目的的是
A.用甲装置制备并收集纯净的CO2
B.用乙装置干燥氢气
C.用丙装置除去CO2中含有的少量HCl
D.用丁装置收集氯气
15.下列离子方程式中,不正确的是
A.将氧化镁与稀盐酸混合:MgO+2H+=Mg2++H2O
B.氢氧化钡溶液和稀硫酸混合:Ba2++2OH-+2H++S=BaSO4↓+2H2O
C.硝酸银与盐酸反应:AgNO3+Cl-=AgCl↓+N
D.将碳酸氢钠溶液与稀盐酸混合:HC+H+=H2O+CO2↑
二、填空题
16.“化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。
(1)小苏打常用于糕点制作,还可治疗胃酸过多等,有多种用途。请写出小苏打溶液与氢氧化钠溶液反应的离子方程式:_________。
(2)过氧化钠常用作呼吸面具或潜水艇中的供氧剂,请你写出过氧化钠与二氧化碳反应的化学方程式:_________。
(3)有小组同学称取10 g所制备Na2O2的样品(设样品中杂质不参与下列反应),利用下列装置测定Na2O2样品的纯度(夹持仪器省略),已知Na2O2的摩尔质量为78 g/mol。
有同学提出该实验装置存在缺陷,应该在A、B装置之间增加一个盛有饱和溶液的洗气瓶,该同学想法是否有必要?理由是_________。倒出量筒内水的体积后,折算成标准状况下O2的体积为1120 mL,计算样品中Na2O2的质量分数约为_________。
(4)向30 mL NaOH溶液中逐渐通入一定量的CO2,再向该溶液中逐滴加入2 mol/L盐酸,所加入盐酸的体积(单位为mL)与产生二氧化碳的体积(标准状况下)关系如图所示。
A点溶液中溶质为:_________,计算原NaOH溶液的物质的量浓度是_________mol/L。
17.写出下列除杂的化学方程式(有离子方程式的还要写出相应的离子方程式)
混合物 除杂方法及试剂
(1)Na2CO3固体(NaHCO3) 加热
(2)NaHCO3溶液(Na2CO3) 通入足量CO2气体
(3)Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
(1)化学方程式_______。
(2)化学方程式_______,离子方程式_______。
(3)化学方程式_______,离子方程式_______。
18.某碳酸钠()固体样品中含有少量杂质。小组同学用不同的方案测定样品中碳酸钠的纯度。
已知:碳酸钠的纯度。
(1)方案1:
①操作x的名称是___________。
②溶液B中所含的金属阳离子有___________。
③该方案中,需测量的物理量有___________。
(2)方案2:利用如图所示装置进行实验,通过测量样品与稀硫酸反应产生的二氧化碳的体积,计算样品中碳酸钠的纯度。
①样品中的与稀硫酸反应的离子方程式是___________。
②将虚线框中的装置补充完整___________。
③为了提高测量的准确性,B中试剂的选择依据是___________。
(3)方案3:称量mg样品,并使其充分加热,冷却至室温,再称量固体质量为ng.则样品中碳酸钠的纯度=___________(用代数式表示)。[已知:,]
19.回答下列问题
(1)热稳定性:NaHCO3_______(填“>”或“<”)Na2CO3,实验室可用如图装置验证,试管B中应装入的固体是_______。
(2)某同学研究HCl性质,进行如下预测:
①从物质类别上看,HCl属于酸,能与大理石反应,相应的离子方程式为_______;
②从化合价角度看,具有_______性。
20.碳酸钠和碳酸氢钠是生活中比较常见的两种物质。某学校的课外化学学习兴趣小组对两者性质进行探究,并测定碳酸钠和碳酸氢钠混合物中各成分的含量。
实验I:
(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是_______(填化学式,下同)。
(2)继续向两支试管中分别加入10mL水,充分振荡,最先溶解完全的是_______;再分别加入几滴酚酞试液,溶液变红,但颜色较浅的是_______。
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后,接下来的操作是_______,再往试管中添加药品,则试管A中盛放的药品是_______,澄清石灰水变浑浊的是_______(填“a”或“b”)。
实验III:混合物中碳酸钠含量的测定
(4)为确定碳酸钠和碳酸氢钠混合物样品的组成,甲化学探究小组设计实验1:利用如图2所示的装置进行实验。
下列说法错误的是_______(填字母,单选)。
A.滴入盐酸前,应先将装置中含有的空气排尽
B.装置①、④的作用是防止空气中的进入装置③中
C.在装置②、③间需添加盛有饱和溶液的洗气瓶,以除去挥发的HCl气体
D.反应结束时,应继续通入空气将装置②中的转移到装置③中
(5)乙化学探究小组设计实验2:取ag样品加热、冷却、称重,重复以上操作至样品固体质量不再变化,称量其质量为bg。样品中质量分数为_______×100%(用a、b表示)。
(6)丙化学探究小组设计实验3:步骤ⅰ。称取一定量的混合物样品;步骤ⅱ。向其中逐滴滴入0.1000mol/L稀盐酸,记录生成的气体体积和滴入盐酸体积,如图3所示。
计算:①生成的在标况下的体积为_______mL;
②该混合物中的质量分数_______%(保留两位小数)。
三、实验题
21.Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:
已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为_______。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。
(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若_______,说明装置不漏气。
(3)装置A中的试剂为_______,装置C中的试剂为_______。
(4)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为_______(保留小数点后一位);若缺少E装置,会使测定结果_______(填“偏高”或“偏低”)。
22.纯碱在工业生产中具有广泛的用途。某化学兴趣小组利用下图所示装置,模拟侯氏制碱法制取纯碱。
请回答以下问题:
(1)A装置发生反应的化学方程式为_______。
(2)如何检验装置B的气密性?_______。
(3)装置C中盛有饱和食盐水。需要用粗盐精制后得到,已知粗盐中含有的杂质离子为,,。精制除杂的步骤为:粗盐溶解,滤去沉渣→加入_______(填化学式)溶液→加入溶液→_______(填操作名称)→加入盐酸调pH。
(4)仪器连接顺序为a接_______,b接_______。_______
(5)实验开始时,应先向C中通入_______(填电子式)。
(6)反应结束后,将C中的浊液过滤,分别得到滤渣与滤液。
①灼烧滤渣可制得,灼烧时所需要的硅酸盐仪器有:酒精灯、玻璃棒、_______
②向滤液中通氨气,冷却析出的副产品可用作氮肥,通氨气的作用有_______(填字母选项代号)。
A.增大的浓度,使更多地析出
B.使更多地析出
C.使转化为,提高析出的纯度
(7)该实验设计中明显的不足之处是_______。
参考答案:
1.A
【详解】A.硅是半导体,可作航天器的太阳能电池,故A错误;
B.过氧化钠能与二氧化碳和水反应生成氧气,可作航天供氧剂,故B正确;
C.合成纤维具有强度大等特性,可作航天员航天服,故C正确;
D.硬铝硬度大、密度小,可作航天飞船材料,故D正确;
故选A。
2.B
【详解】A.钠较软可以直接切,取用金属钠时,所需用品一般有小刀、镊子、滤纸、玻璃片,故A正确;
B.过氧化钠具有强氧化性,会使紫色石蕊试液褪色,故B错误;
C.金属钠与水反应生成氢气和氢氧化钠,氢氧化钠溶液反应生成碳酸钙沉淀,既有白色沉淀又有气体逸出,故C正确;
D.Na和氧气生成氧化钠,氧化钠吸收水生成氢氧化钠;和水生成氢氧化钠;和水生成氢氧化钠、和二氧化碳生成碳酸钠;NaOH吸收二氧化碳生成碳酸钠;故长期放置在空气中,最终都将变为,故D正确;
故选B。
3.C
【详解】A.向包有Na2O2粉末的脱脂棉滴加几滴水,脱脂棉剧烈燃烧,脱脂棉达到着火点,氧气浓度增大,说明Na2O2与H2O反应放热且有氧气生成,故A正确;
B.空气中过氧化钠和水反应生成氢氧化钠,氢氧化钠和空气中二氧化碳反应生成碳酸钠,因此Na2O2在空气中久置变白,最终产物为Na2CO3,故B正确;
C.Na2O2与CO2反应时有单质O2生成,2Na2O2+2CO2=2Na2CO3+O2,该反应不属于置换反应,故C错误;
D.将Na2O2粉末加入Ca(HCO3)2溶液中,生成碳酸钙沉淀和氧气,故D正确。
综上所述,答案为C。
4.D
【分析】锌和稀盐酸生成氢气,气体通过碱石灰干燥除杂后进入试管和过氧化钠反应,生成气体通过硫酸铜装置排出;
【详解】A.实验中有气体生成和参与,故实验前应该先检查装置气密性,防止装置漏气,A正确;
B .U型管中碱石灰含有固体氢氧化钠,能吸收水且能和HCl反应,其作用是装置中除去中的和水蒸气,B正确;
C.氢气易燃易爆,实验过程中,应该先打开b处的弹簧夹,在干燥管上倒插一支小试管收集,检验的纯度,C正确;
D.实验结束后,应该先撤离酒精灯,再关闭b处的弹簧夹,防止空气进入装置引起爆炸,D错误;
故选D。
5.B
【详解】CO在氧气中完全燃烧生成CO2,生成的CO2再与Na2O2反应,有关反应为:2CO+O2=2CO2,2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重为CO的质量;H2在氧气中完全燃烧H2O,H2O再与Na2O2反应,有关反应为:2H2+O2=2H2O,2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重为氢气质量。
综上分析,最终固体增重为CO与氢气的总质量,故10gCO和H2的混合气点燃后,再通入足量的Na2O2中,充分反应后,固体增重质量是10g,故选B。
6.C
【分析】样品与盐酸反应产生的CO2用足量Ba(OH)2溶液吸收,通过测量装置③中产生沉淀的质量计算纯碱的纯度。
【详解】A.装置①中NaOH溶液的作用是吸收通入的空气中的CO2,防止空气中CO2进入装置③中,装置④的作用是防止外界空气中的CO2进入装置③中,A正确;
B.为控制反应速率,最终②中分液漏斗不能用长颈漏斗代替,B正确;
C.由于盐酸具有挥发性,反应产生的CO2中混有HCl,若在装置②、③间添加盛有饱和NaHCO3溶液的洗气瓶,HCl与NaHCO3反应产生CO2,使得测得的CO2偏大,测得纯碱的纯度偏大,C错误;
D.为了保证测量的CO2的准确性,反应结束,应继续通入除去CO2的空气将滞留在装置②中CO2全部转移到装置③中,D正确;
故选C。
7.D
【详解】A.0-a范围内,NaOH与HCl发生中和反应,Na2CO3与HCl反应生成NaHCO3和NaCl,A错误;
B.ab段发生反应的离子方程式为,B错误;
C.已知生成CO2为2mol,则根据离子方程式可知,消耗HCl2mol,则a=4,C错误;
D.根据前述分析可知,混合溶液中碳酸钠有2mol,a=4,滴加的4molHCl中2mol与碳酸钠反应生成碳酸氢钠,2mol与NaOH发生中和反应,则NaOH与Na2CO3的物质的量之比为1:1,D正确;
故答案选D。
8.B
【详解】A.Na2O2可以吸收人体呼出的CO2、H2O,同时产生O2,故A正确;
B.Na2CO3碱性较强,会腐蚀胃壁,可以用NaHCO3治疗胃酸过多,故B不正确;
C.明矾溶于水会产生氢氧化铝胶体,具有吸附水中悬浮颗粒物的能力,故C正确;
D.酒精可以使蛋白质变性失活,所以可用于杀菌消毒,故D正确;
故选B。
9.C
【详解】A.NaHCO3可以与加入的Ca(OH)2发生反应,生成白色沉淀:,因此,A错误;
B.分别加入等浓度的稀盐酸,反应较剧烈的为NaHCO3,B错误;
C.分别加入CaCl2溶液,产生沉淀的为Na2CO3,C正确;
D.逐滴加入等浓度盐酸,Na2CO3先发生反应:,等反应完后,生成的NaHCO3才会与HCl反应生成气泡,因此立即产生气泡的是NaHCO3,D错误。
本题选C。
10.C
【详解】A.该实验过程中通过观察所蒸馒头的蓬松度、颜色等,以及利用分组实验进行分析,故该兴趣小组用到的研究方法有观察法、实验法等,选项A正确;
B.酵母是一种单细胞真菌微生物,是一种对人体有益的生物膨松剂,馒头蒸制过程中发生了化学反应,选项B正确;
C.Na2CO3加热不分解,碳酸钠和碳酸氢钠单独做蒸馒头的膨松剂,蒸出来的馒头口感都不好,选项C错误;
D.对比实验2和实验3的实验结果,可知柠檬酸与碳酸氢钠反应,降低馒头的碱性并使馒头更为松软,选项D正确;
答案选C。
11.D
【详解】A.碳酸氢钠是酸式盐,既可以与盐酸反应生成二氧化碳、氯化钠,又可以与氢氧化钠反应生成碳酸钠,A正确;
B.过氧化钠可以和水、二氧化碳反应生成氧气,做呼吸面具中的供氧剂,B正确;
C.氯化钠俗称食盐,可以做调味剂和防腐剂,C正确;
D.碳酸氢钠可用于治疗胃酸过多,D错误;
故选D。
12.C
【详解】A.稀硫酸与碳酸钙反应会生成微溶的硫酸钙,附着在固体表面,影响反应的进行,应该用稀盐酸与碳酸钙反应制备二氧化碳,故A错误;
B.二氧化碳在饱和食盐水中溶解度较小,向饱和食盐水中先通氨气使溶液呈碱性,再通入二氧化碳,二氧化碳应该从长管进,氨气要防止倒吸,从短管进,故B错误;
C.碳酸氢钠溶解度小,从饱和溶液中和析出晶体,可以用过滤的方法分离固体和溶液,故C正确;
D.碳酸氢钠不稳定,受热易分解,在试管中加热固体管口应向下倾斜,防止冷凝水倒流炸裂试管,故D错误;
故答案为C。
13.A
【详解】①Na2CO3热稳定性好,用酒精灯加热不会分解,①错误;
②向两溶液中滴加少量盐酸时,Na2CO3和HCl反应先生成NaHCO3,NaHCO3与HCl再反应生成CO2,故产生CO2气体较快的为NaHCO3溶液,②正确;
③NaHCO3受热易分解,2NaHCO3Na2CO3+H2O+CO2↑,被除去的是NaHCO3,③错误;
④等质量的Na2CO3、NaHCO3的固体,NaHCO3的物质的量大,放出的CO2多,④错误;
⑤相同温度下,溶解度Na2CO3>NaHCO3,⑤正确;
②⑤正确,故选A。
14.C
【详解】A.甲装置能制取二氧化碳,但是缺少除去氯化氢和水蒸气的杂质装置,不能收集纯净的二氧化碳,A错误;
B.乙装置为洗气装置,故气体应从长导管进入,短导管出去,有利于气体与除杂试剂充分接触,除杂效果好,B错误;
C.二氧化碳在饱和碳酸氢钠中的溶解度很小,碳酸氢钠可以与氯化氢反应,可以吸收氯化氢,故可以用丙装置除去CO2中含有的少量HCl,C正确;
D.氯气在水中有一定的溶解度,直接排水法收集会使氯气损失,故应用排饱和食盐水的方法收集氯气,氯气在饱和食盐水中溶解度很小,D错误;
故本题选C。
15.C
【详解】A.将氧化镁与稀盐酸混合生成氯化镁和水:MgO+2H+=Mg2++H2O,A正确;
B.氢氧化钡溶液和稀硫酸混合生成硫酸钡和水:Ba2++2OH-+2H++=BaSO4↓+2H2O,B正确;
C.硝酸银与盐酸反应生成氯化银和硝酸:Ag++Cl-=AgCl↓,C错误;
D.将碳酸氢钠溶液与稀盐酸混合生成氯化钠、水和二氧化碳:HCO+H+=H2O+CO2↑,D正确;
答案选C。
16.(1)
(2)2Na2O2+2CO2=2Na2CO3+O2
(3) 没有必要,因为从A装置出来的气体有CO2、H2O(g)、HCl,三者与Na2O2反应均生成O2,且关系为2Na2O2~O2,故HCl的存在不影响纯度的测定 78%
(4) NaHCO3 3
【详解】(1)小苏打溶液与氢氧化钠溶液混合,反应产生Na2CO3、H2O,反应的离子方程式:;
(2)过氧化钠与二氧化碳反应产生Na2CO3、O2,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;
(3)HCl与CaCO3会发生复分解反应:2HCl+CaCO3=CaCl2+CO2↑+H2O,盐酸具有挥发性,挥发的HCl及CO2、H2O(g)进入装置B中会发生反应:4HCl+2Na2O2=4NaCl+2H2O+O2↑、2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,根据反应方程式可知三个反应中都存在物质的量关系:2Na2O2~O2,故HCl的存在不影响纯度的测定,故在A、B装置之间没有必要增加一个盛有饱和NaHCO3溶液的洗气瓶;
n(O2)=,则10.0 g Na2O2样品中含有Na2O2的物质的量n(Na2O2)=2n(O2)=0.1 mol,其质量是0.1 mol×78 g/mol=7.8 g,故样品中Na2O2的质量分数为:;
(4)向NaOH溶液中通入一定量CO2气体,所得溶液的溶质可能为NaOH和Na2CO3;Na2CO3;Na2CO3和NaHCO3;NaHCO3。Na2CO3溶液中加入HCl,反应分步进行:Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑,根据方程式可知两步反应消耗HCl的物质的量相同,由于溶液浓度相同,故两步反应消耗HCl的体积相同,而图象中0-A消耗HCl的体积25 mL大于A-B消耗HCl的体积20 mL,说明向30 mL NaOH溶液中逐渐通入一定量的CO2,反应所得溶液为NaOH和Na2CO3的混合溶液,0A段除发生反应Na2CO3+HCl=NaCl+NaHCO3、还发生了反应HCl+NaOH=NaCl+H2O。A点溶质为NaHCO3,A-B段发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑;反应至B点时溶液为NaCl溶液,根据元素守恒可知n(NaOH)=n(HCl)=n(NaCl)=0.045 L×2 mol/L=0.09 mol,由于NaOH溶液的体积是30 mL,故该NaOH溶液的浓度为c(NaOH)=。
17.(1)2NaHCO3Na2CO3 + H2O + CO2↑
(2) Na2CO3+ H2O + CO2 = 2NaHCO3
(3) NaHCO3 + NaOH = Na2CO3 + H2O
【详解】(1)除去Na2CO3固体中的NaHCO3,可以将混合物直接加热,发生NaHCO3分解,反应化学方程式为2NaHCO3Na2CO3 + H2O + CO2↑,从而达到除杂目的;
(2)除去NaHCO3溶液中的Na2CO3,可往溶液中通入过量的CO2气体,Na2CO3、CO2和H2O反应生成NaHCO3,反应的化学方程式为Na2CO3+ H2O + CO2 = 2NaHCO3;离子方程式为;
(3)除去Na2CO3溶液中的NaHCO3,可往溶液中加入适量NaOH溶液,NaHCO3和NaOH反应生成Na2CO3和H2O,反应的化学方程式为NaHCO3 + NaOH = Na2CO3 + H2O;离子方程式为。
18.(1) 过滤 Na+、Ca2+ 样品的质量及固体D的质量
(2) B中的溶液应尽可能不溶解CO2,最好采用排饱和NaHCO3溶液的方法
(3)×100%
【详解】(1)某碳酸钠()固体样品中含有少量杂质,加水溶解的到溶液A含及,加入氢氧化钙溶液,则碳酸钠转化为碳酸钙沉淀和氢氧化钠,故操作X是过滤,溶液B含有氢氧化钠、碳酸氢钠及少量氢氧化钙,故含有的金属阳离子为Na+及Ca2+,沉淀C为碳酸钙沉淀,经过洗涤干燥,得到固体D为碳酸钙;根据样品纯度,由此需测量的物理量是反应前m(样品)及反应后m(CaCO3),再通过化学反应方程式的系数关系计算出m(Na2CO3)。
(2)与稀硫酸反应生成二氧化碳和水和硫酸钠,离子方程式是:;
该装置的目的是通过测量样品与稀硫酸反应产生的二氧化碳的体积,通过化学反应方程式的系数关系计算出样品中的碳酸氢钠,从而计算出碳酸钠的纯度,所以B中的溶液应尽可能不溶解CO2,所以最好采用排饱和NaHCO3溶液的方法,导管应该是短进长出;
为了提高测量的准确性,B中的溶液应尽可能不溶解CO2,最好采用排饱和NaHCO3溶液的方法。
(3)设样品中含有NaHCO3杂质的质量为x,根据可知,,解得,则,故答案为:×100%;
19.(1) < NaHCO3
(2) 2H++CaCO3=Ca2++CO2↑+H2O 还原
【详解】(1)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,碳酸钠受热不分解,因此热稳定性:NaHCO3<Na2CO3,实验室可用如图装置验证,A中温度高,B中温度比A中温度低,在低温下分解,在高温下不分解,则可以说明高温下的物质热稳定性好,因此试管B中应装入的固体是NaHCO3;故答案为:<;NaHCO3。
(2)①从物质类别上看,HCl属于酸,能与大理石反应,酸和盐反应生成新酸和新盐,则相应的离子方程式为2H++CaCO3=Ca2++CO2↑+H2O;故答案为:2H++CaCO3=Ca2++CO2↑+H2O。
②从化合价角度看,处于最低价,只能升高,因此具有还原性;故答案为:还原。
20.(1)
(2)
(3) 检查装置的气密性 a
(4)C
(5)
(6) 67.2 55.79
【详解】(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是,这是因为碳酸钠易与水生成结晶水合物并放出大量的热,碳酸氢钠溶于水几乎不放出热量;
(2)碳酸钠的溶解度大于碳酸氢钠,继续向两支试管中分别加入10mL水,充分振荡,最先完全溶解的为分别加入10mL水,充分振荡,最先完全溶解的为,两者溶于水都显碱性,但是碳酸钠溶液的碱性强于碳酸氢钠,再分别加入几滴酚酞试液,溶液变红,但颜色较浅的是;
(3)大试管先安装好后再装小试管,按图1组装好仪器B小试管后,然后检查装置气密性;其中试管A温度高,装固体,B装,碳酸钠受热不分解,B中碳酸氢钠受热分解生成二氧化碳使a中澄清石灰水变浑浊;
(4)A.为防止空气中的二氧化碳被氢氧化钡溶液吸收,干扰实验,滴入盐酸前,应先将装置中含有的空气排尽,故A正确;B.根据装置③中生成碳酸钡沉淀的质量计算样品的纯度,所以装置①、④防止空气中的进入装置③中干扰实验,故B正确;C.若在装置②。③间添加盛有饱和溶液的洗气瓶,碳酸氢钠和氯化氢反应放出二氧化碳,反应生成二氧化碳的质量增大,测定碳酸钠的纯度偏大,故C错误;D.为提高实验的准确性,反应结束时,应继续通入空气将装置②中的转移到装置③中,故D正确;故选C。
(5)设样品中碳酸钠的物质的量为xmol、碳酸氢钠为ymol,由样品的质量可得,由剩余固体质量可得,解方程可得,则碳酸钠的质量为g,碳酸钠的质量分数为,故答案为:;
(6)滴加盐酸体积从15.00mL~45.00mL时发生反应:,,则生成在标况下的体积;根据与盐酸反应分步进行,第一步是,第二步是,两步反应消耗盐酸相同,由图象可知消耗盐酸前15mL发生的是,则,则原固体中消耗HCl的体积是,根据可知,所以原固体样品中、的物质的量的比是1:1,故样品中的质量分数为:。答案:67.2 55.79。
21.(1)NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
(2)漏斗中与广口瓶中的液面差保持不变(或漏斗中的液面不再下降)
(3) 氢氧化钠溶液(或其他合理答案) 浓硫酸
(4) 73.6% 偏高
【分析】I.依次向饱和食盐水中通入氨气、二氧化碳,析出碳酸氢钠固体,过滤后加热分解碳酸氢钠得到CO2和纯碱;
Ⅱ.纯碱可以和稀硫酸反应生成二氧化碳,利用除去二氧化碳的空气将装置中的CO2全部赶到装置D中被吸收,由于碱石灰也可以吸收水蒸气,所以二氧化碳需要先进行干燥再进行吸收,同时也要注意要防止D装置吸收空气中的二氧化碳和水。
【详解】(1)依次向饱和食盐水中通入氨气、二氧化碳,析出碳酸氢钠固体,同时得到主要含氯化铵的溶液,化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(2)若装置B气密性良好,则常见漏斗内的液体不会滴落,所以若漏斗中与广口瓶中的液面差保持不变(或漏斗中的液面不再下降),说明装置不漏气;
(3)根据分析可知A装置可以除去空气中的二氧化碳,所以为氢氧化钠溶液;装置C对二氧化碳进行干燥,所以为浓硫酸;
(4)D装置增重8.80g,即生成=0.2mol二氧化碳,根据C元素守恒可知碳酸钠的物质的量为0.2mol,质量分数为×100%=73.6%;若缺少装置E,则D可能会吸收空气中的二氧化碳和水蒸气,导致测定的CO2的质量偏大,继而导致测定结果偏高。
22.(1)
(2)关闭导气管上的活塞,从长颈漏斗上口注入水,使长颈漏斗中的液面高于试管中的液面,静置一段时间,若液面位置保持不变,(或形成一段稳定的水柱)证明装置不漏气
(3) 过滤
(4)a接c,b接e
(5)
(6) 泥三角 AC
(7)缺少尾气处理装置
【分析】在A装置中利用熟石灰与氯化铵共热制氨气,在B装置中利用大理石和稀盐酸反应制二氧化碳,两种气体在装置C中与饱和食盐水反应制备碳酸氢钠晶体,过滤后灼烧得到纯碱。
【详解】(1)在A装置中利用熟石灰与氯化铵固体共热制备氨气,发生的化学反应方程式为: ;故答案为: ;
(2)检验B装置的气密性的方法是:关闭活塞b,向长颈漏斗中加入水,使长颈漏斗中液面高于试管中的液面,静置一段时间,若液面保持不变,则装置的气密性良好;故答案为:关闭活塞b,向长颈漏斗中加入水,使长颈漏斗中液面高于试管中的液面,静置一段时间,若液面保持不变,则装置的气密性良好;
(3)除去粗盐中的杂质Ca2+、Mg2+、时,应该先用Ba(OH)2溶液除去、Mg2+,用Na2CO3溶液除去Ca2+及过量的Ba2+过滤后,在滤液中加入盐酸调pH;故答案为: Ba(OH)2;过滤;
(4)由于NH3极易溶于水,CO2能溶于水,所以通入NH3要有防倒吸装置,通入CO2不用防倒吸装置;故a接c, b接e;故答案为: a接c, b接e;
(5)实验开始时,应该先通入NH3(由于CO2能溶于水、NH3极易溶于水。所以先通入NH3时,使溶液呈碱性,后面就能够溶解更多的CO2,从而提高产率)。NH3的电子式为: ;故答案为: ;
(6)①灼烧碱或碳酸盐时,不能用瓷坩埚,所以使用的硅酸盐仪器还有:泥三角;
②通入氨气的作用是:增大铵根离子的浓度,使NH4Cl更多地析出。同时,也可以使NaHCO3转化为Na2CO3,提高析出的NH4Cl的纯度。故答案为: AC;
(7)由于装置C中从d可以逸出没有反应的NH3和CO2,NH3可以污染环境。所以,该实验设计中明显的不足之处是:缺少尾气处理装置。故答案为:缺少尾气处理装置。
