5.1 合成高分子的基本方法同步练习 (含答案)高二下学期化学人教版(2019) 选择性必修3
文档属性
| 名称 | 5.1 合成高分子的基本方法同步练习 (含答案)高二下学期化学人教版(2019) 选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-07 21:26:06 | ||
图片预览




文档简介
5.1 合成高分子的基本方法同步练习 高中化学人教版(2019)选择性必修3
一、单选题
1.人造海绵的主要成分是聚氨酯,合成方法如图,下列说法正确的是
A.M的分子式为C15H8N2O2
B.聚氨酯和蛋白质分子的某些化学性质相似
C.聚氨酯在一定条件下不能发生水解反应
D.合成聚氨酯的反应属于缩聚反应
2.下列说法中正确的是
A.苯乙烯通过加聚反应得到
B.合成纤维完全燃烧只生成和
C.高分子材料由CH≡CH、,三种单体在一定条件下加聚得到
D.聚合物可由单体和加聚制得
3.下列合成高分子材料的反应式和反应类型均正确的是
A.nCH2=CH-Cl 加聚反应
B.n+nHCHO(n-1)H2O+ 加聚反应
C.n 加聚反应
D.nCH2=CH2+nCH2=CH-CH3缩聚反应
4.维生素A的结构简式如下图所示,关于它的叙述中正确的是
A.维生素A属于烃
B.维生素A有三种官能团
C.维生素A不能使酸性KMnO4溶液褪色
D.维生素A能发生取代、加成、加聚反应
5.下列对于有机高分子的叙述错误的是
A.高分子可分为天然高分子和合成高分子两大类
B.高分子的特点是组成元素简单、结构非常复杂、相对分子质量大
C.高分子均为混合物
D.合成高分子大部分是由小分子化合物通过聚合反应而制得的
6.下列关于有机物的叙述正确的是
A.液化石油气、汽油和石蜡的主要成分都是碳氢化合物
B.环己烷与苯可用酸性溶液鉴别
C.由合成的聚合物为
D.能与溶液反应且分子式为的有机物一定是羧酸
7.某高聚物的结构简式如图所示。下列分析错误的是
A.该高聚物是加聚反应的产物
B.该高聚物完全燃烧后产生CO2和H2O的物质的量之比为4:3
C.该高聚物的单体为CH2=CHCOOCH3
D.该高聚物是乙酸乙酯的同系物
8.广东有众多国家级非物质文化遗产,如广东剪纸、粤绣、潮汕工夫茶艺和香云纱染整技艺等。下列说法不正确的是
A.广东剪纸的裁剪过程不涉及化学变化
B.冲泡工夫茶时茶香四溢,体现了分子是运动的
C.制作粤绣所用的植物纤维布含有天然高分子化合物
D.染整技艺中去除丝胶所用的纯碱水溶液属于纯净物
9.合成橡胶的结构简式为,则合成该高分子化合物的单体是
A.和
B.和
C.和
D.和
10.聚乳酸是一种新型的生物可降解高分子材料,其合成路线如下:
下列说法错误的是
A.
B.聚乳酸分子中含有两种官能团
C.乳酸与足量的反应生成
D.两分子乳酸反应能够生成含六元环的分子
二、填空题
11.已知乙炔()与HCl在一定条件下反应:。请用化学方程式表示以食盐、水、乙炔为原料合成聚氯乙烯各步反应的化学方程式。_______
12.汽车车身两侧遮罩车轮的挡板(翼子板),传统上多使用金属材料制造,现在已有塑料材质的问世。这种改变对汽车生产厂、车主和行人可能有哪些“好处”?请查阅资料,结合塑料的性能进行说明,并了解汽车上还有哪些部件使用了有机高分子材料___________。
13.近100年来,有机合成的发展极大地改变了物质世界的面貌,改善了人类的生活条件。请查阅资料,举例说明_________。
14.氯丁橡胶的化学结构可表示为:
其链节为_______,单体为_______;该高分子化合物是通过_______(填“加聚”或“缩聚”)反应制得的。
三、实验题
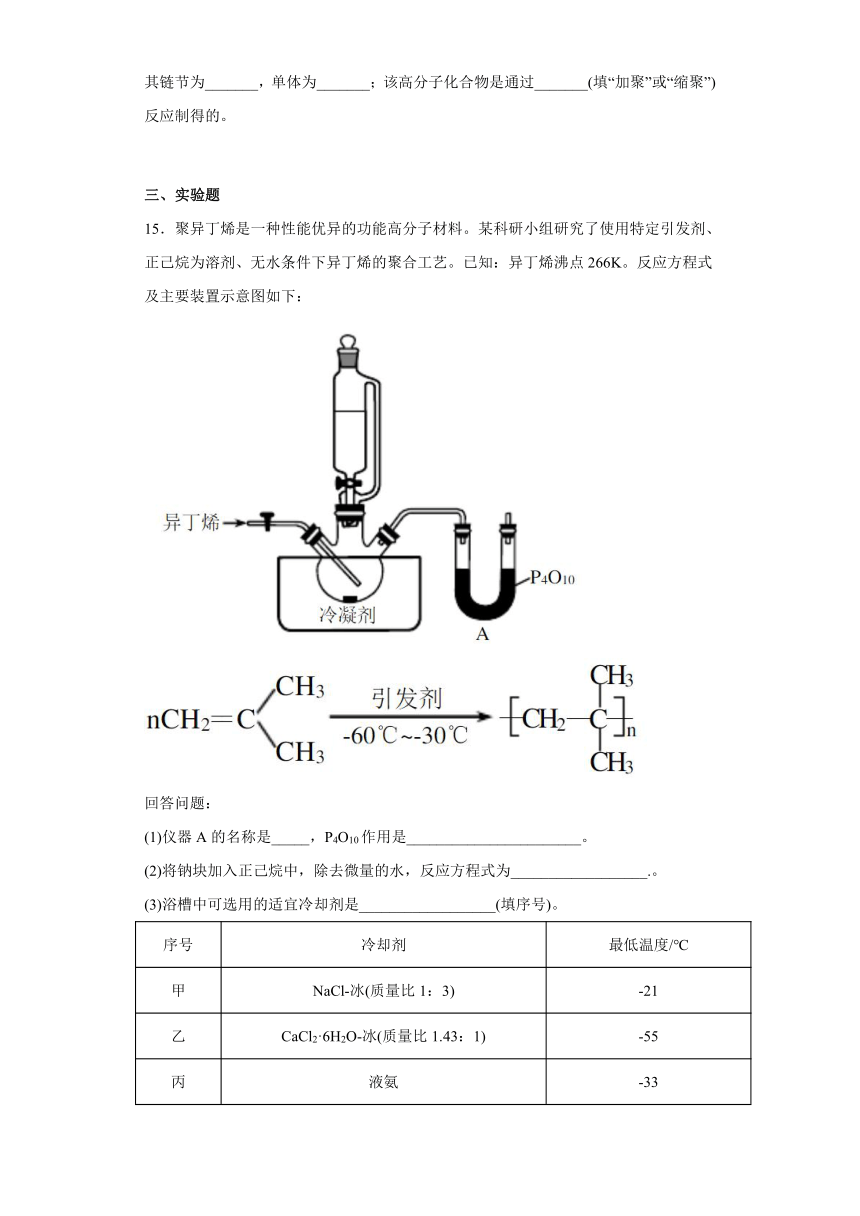
15.聚异丁烯是一种性能优异的功能高分子材料。某科研小组研究了使用特定引发剂、正己烷为溶剂、无水条件下异丁烯的聚合工艺。已知:异丁烯沸点266K。反应方程式及主要装置示意图如下:
回答问题:
(1)仪器A的名称是_____,P4O10作用是_______________________。
(2)将钠块加入正己烷中,除去微量的水,反应方程式为__________________.。
(3)浴槽中可选用的适宜冷却剂是__________________(填序号)。
序号 冷却剂 最低温度/℃
甲 NaCl-冰(质量比1:3) -21
乙 CaCl2·6H2O-冰(质量比1.43:1) -55
丙 液氨 -33
(4)补齐操作步骤
选项为:a.向三口瓶中通入一定量异丁烯
b.向三口瓶中加入一定量正己烷
①_______________(填编号);
②待反应体系温度下降至既定温度:
③______________(填编号);
④搅拌下滴加引发剂,一定时间后加入反应终止剂停止反应。经后续处理得成品。
(5)测得成品平均相对分子质量为2.8×106,平均聚合度为________________。
四、有机推断题
16.长效缓释阿司匹林(G)是日常生活中的常用药。一种合成G的路线如下:
回答下列问题:
(1)D中官能团的名称是_______,B中O原子的杂化类型是_______。
(2)B→C的反应类型是_______。
(3)在D的同分异构体中,同时满足下列条件的结构有_______种(不考虑立体异构体)。
①含有羟基和酯基 ②水解产物之一为HCOOH
(4) A、B、C、D、E中,属于手性分子的有_______种。(提示:与4个互不相同的原子或原子团相连的碳原子叫手性碳原子,含手性碳原子的分子叫手性分子。)
(5)阿司匹林的结构简式为_______,F→G的化学方程式为_______。
(6)以环己醇为原料合成,设计合成路线(无机试剂任选)。_______
五、元素或物质推断题
17.X、 Y、Z均为非金属元素(X的原子序数小于Y的原子序数),三者形成多种化合物。其中分子式为XYZ6的化合物被认为是潜在的储氢材料,氢的质量分数达19.6%。
(1)通过计算说明X、Y、Z各是什么元素___________、___________、___________。
(2)下图示出XYZ6及相关化合物的生成与转化的流程图:
其中,实线箭头表示在一定条件的转化过程,虚线仅表示分子式的关联关系:由A和B制备XYZ6的过程中给出了所有的反应物和产物,而其他过程仅给出所有反应物及其参与反应的计量系数的比例(例如,A → C,箭头上的1/2B表示“2A+B”反应, 产物为C或者C和其他可能的物质,计量系数未给出); B和D的结构中均含有正四面体构型的负离子基团,E、F和G均为六元环结构。根据图中的关系与所述条件,写出化合物A、B.C、D、E、F、G、H和I的化学式:___________、画出D和G的结构简式___________;写出D与A产生C的反应方程式___________。
六、工业流程题
18.天宫二号空间实验室已于2016 年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是______(填化学式)
(2)“碳纤维复合材料制品”应用于“天宫二号”的推进系统。碳纤维复合材料具有重量轻、可设计强度高的特点。碳纤维复合材料由碳纤维和合成树脂组成,其中合成树脂是高分子化合物,则制备合成树脂的反应类型是_____________。
(3)太阳能电池帆板是“天宫二号”空间运行的动力源泉,其性能直接影响到“天宫二号”的运行寿命和可靠性。
① 天宫二号使用的光伏太阳能电池,该电池的核心材料是_____,其能量转化方式为_____。
② 下图是一种全天候太阳能电池的工作原理:
太阳照射时的总反应为V3++ VO2++ H2O=V2++VO2++2H+,则负极反应式为__________;夜间时,电池正极为______(填“a”或“b”)。
(4)太阳能、风能发电逐渐得到广泛应用,下列说法中,正确的是______( 填字母序号)。
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(5)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+,Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:
已知溶液pH 范围不同时,钒的存在形式如下表所示:
钒的化合价 pH<2 pH>11
+4价 VO2+,VO(OH)+ VO(OH)3-
+5价 VO2+ VO43-
①加入NaOH 调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH 后生成沉淀1的反应过程为_______、_______;所得滤液1中,铝元素的存在形式为__________。
②向碱性的滤液1 ( V的化合价为+4 )中加入H2O2的作用是________(用离子方程式表示)。
七、原理综合题
19.I.治疗胃酸过多的药物达喜(其式量不超过 700)由五种短周期元素组成,按如下流程进行实验以确定其组成。
请回答:
(1)达喜的化学式是_____________。
(2)达喜与胃酸(含稀盐酸)反应的化学方程式是____________。
(3)气体 B 与环氧丙烷( )可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
II.将 NaClO3 溶液逐滴加入到碘单质和过量盐酸的混合液中可制备液态 ICl,实验装置如下图:
请回答:
(1)圆底烧瓶中发生的化学反应是______________( 用化学方程式表示)。
(2)若加入的 NaClO3 溶液已足量,请设计实验方案证明该反应已完全:_______。
参考答案:
1.B
2.D
3.C
4.D
5.B
6.A
7.D
8.D
9.B
10.B
11.,,,nCH2=CHCl
12.对手汽车生产厂来说,塑料的成本较低,曲度较低,可减小汽车自重,降低生产成本;对车主来说,购车费用较低,汽车自重小可节约燃油消耗,降低用车成本;对行人来说万一与汽车发生碰撞,塑料可迅速变形,一定程度上可降低行人被伤書的程度。
汽车上使用了有机高分子材料的部件还有:汽车轮胎使用了橡胶;汽车保险杠等零件采用了聚丙烯等材料;汽车内电线的绝缘层使用了聚氯乙烯材料:汽车灯罩等部件采用了聚碳酸酯材料。
13.以乙烯为原料,在一定温度和压力下合成聚乙烯塑料。常用聚乙烯塑料制造塑料薄膜、各种容器、电缆皮及泡沫塑料等。
14. 加聚
15. U形管或U型干燥管 吸收空气中的水分,防止水分进入三口瓶中 乙 b a
50000
16.(1) 羧基、羟基
(2)氧化反应
(3)5
(4)0
(5) n+nHOCH2CH2OH++2nH2O
(6)
17. B N H A NH4Cl; B LiBH4; C [H2B(NH3)2]Cl; D [H2B(NH3)2][BH4]; E Cl3B3N3H3;
F H3B3N3H3; G H3Cl3B3N3H6; H B2H6; I F3BNH3 、 [H2B(NH3)2][BH4]+2 NH4Cl=2[H2B(NH3)2]Cl
18. SiO2 聚合反应 Si(或答“晶体硅”) 太阳能转化为电能 VO2+ +H2O-e - =VO2++2H+ b abc Fe2+ + 2OH- Fe(OH)2↓ 4Fe(OH)2 + 2H2O + O2 4Fe(OH)3 AlO2- 2VO(OH)3- + H2O2 + 4OH- 2VO43-+ 6H2O
19. Al2O3 6MgO CO2 12H2O或 2Al(OH)3 5Mg(OH)2 MgCO3 4H2O或Al2Mg6(OH)16(CO3) 4H2O Al2Mg6(OH)16(CO3) 4H2O+18HCl=2AlCl3+ 6MgCl2+CO2↑+21H2O nCO2+n 3I2 +NaClO3+ 6HCl=6ICl + NaCl + 3H2O 取烧瓶内溶液,加淀粉溶液,如果不变蓝,说明反应已完全
一、单选题
1.人造海绵的主要成分是聚氨酯,合成方法如图,下列说法正确的是
A.M的分子式为C15H8N2O2
B.聚氨酯和蛋白质分子的某些化学性质相似
C.聚氨酯在一定条件下不能发生水解反应
D.合成聚氨酯的反应属于缩聚反应
2.下列说法中正确的是
A.苯乙烯通过加聚反应得到
B.合成纤维完全燃烧只生成和
C.高分子材料由CH≡CH、,三种单体在一定条件下加聚得到
D.聚合物可由单体和加聚制得
3.下列合成高分子材料的反应式和反应类型均正确的是
A.nCH2=CH-Cl 加聚反应
B.n+nHCHO(n-1)H2O+ 加聚反应
C.n 加聚反应
D.nCH2=CH2+nCH2=CH-CH3缩聚反应
4.维生素A的结构简式如下图所示,关于它的叙述中正确的是
A.维生素A属于烃
B.维生素A有三种官能团
C.维生素A不能使酸性KMnO4溶液褪色
D.维生素A能发生取代、加成、加聚反应
5.下列对于有机高分子的叙述错误的是
A.高分子可分为天然高分子和合成高分子两大类
B.高分子的特点是组成元素简单、结构非常复杂、相对分子质量大
C.高分子均为混合物
D.合成高分子大部分是由小分子化合物通过聚合反应而制得的
6.下列关于有机物的叙述正确的是
A.液化石油气、汽油和石蜡的主要成分都是碳氢化合物
B.环己烷与苯可用酸性溶液鉴别
C.由合成的聚合物为
D.能与溶液反应且分子式为的有机物一定是羧酸
7.某高聚物的结构简式如图所示。下列分析错误的是
A.该高聚物是加聚反应的产物
B.该高聚物完全燃烧后产生CO2和H2O的物质的量之比为4:3
C.该高聚物的单体为CH2=CHCOOCH3
D.该高聚物是乙酸乙酯的同系物
8.广东有众多国家级非物质文化遗产,如广东剪纸、粤绣、潮汕工夫茶艺和香云纱染整技艺等。下列说法不正确的是
A.广东剪纸的裁剪过程不涉及化学变化
B.冲泡工夫茶时茶香四溢,体现了分子是运动的
C.制作粤绣所用的植物纤维布含有天然高分子化合物
D.染整技艺中去除丝胶所用的纯碱水溶液属于纯净物
9.合成橡胶的结构简式为,则合成该高分子化合物的单体是
A.和
B.和
C.和
D.和
10.聚乳酸是一种新型的生物可降解高分子材料,其合成路线如下:
下列说法错误的是
A.
B.聚乳酸分子中含有两种官能团
C.乳酸与足量的反应生成
D.两分子乳酸反应能够生成含六元环的分子
二、填空题
11.已知乙炔()与HCl在一定条件下反应:。请用化学方程式表示以食盐、水、乙炔为原料合成聚氯乙烯各步反应的化学方程式。_______
12.汽车车身两侧遮罩车轮的挡板(翼子板),传统上多使用金属材料制造,现在已有塑料材质的问世。这种改变对汽车生产厂、车主和行人可能有哪些“好处”?请查阅资料,结合塑料的性能进行说明,并了解汽车上还有哪些部件使用了有机高分子材料___________。
13.近100年来,有机合成的发展极大地改变了物质世界的面貌,改善了人类的生活条件。请查阅资料,举例说明_________。
14.氯丁橡胶的化学结构可表示为:
其链节为_______,单体为_______;该高分子化合物是通过_______(填“加聚”或“缩聚”)反应制得的。
三、实验题
15.聚异丁烯是一种性能优异的功能高分子材料。某科研小组研究了使用特定引发剂、正己烷为溶剂、无水条件下异丁烯的聚合工艺。已知:异丁烯沸点266K。反应方程式及主要装置示意图如下:
回答问题:
(1)仪器A的名称是_____,P4O10作用是_______________________。
(2)将钠块加入正己烷中,除去微量的水,反应方程式为__________________.。
(3)浴槽中可选用的适宜冷却剂是__________________(填序号)。
序号 冷却剂 最低温度/℃
甲 NaCl-冰(质量比1:3) -21
乙 CaCl2·6H2O-冰(质量比1.43:1) -55
丙 液氨 -33
(4)补齐操作步骤
选项为:a.向三口瓶中通入一定量异丁烯
b.向三口瓶中加入一定量正己烷
①_______________(填编号);
②待反应体系温度下降至既定温度:
③______________(填编号);
④搅拌下滴加引发剂,一定时间后加入反应终止剂停止反应。经后续处理得成品。
(5)测得成品平均相对分子质量为2.8×106,平均聚合度为________________。
四、有机推断题
16.长效缓释阿司匹林(G)是日常生活中的常用药。一种合成G的路线如下:
回答下列问题:
(1)D中官能团的名称是_______,B中O原子的杂化类型是_______。
(2)B→C的反应类型是_______。
(3)在D的同分异构体中,同时满足下列条件的结构有_______种(不考虑立体异构体)。
①含有羟基和酯基 ②水解产物之一为HCOOH
(4) A、B、C、D、E中,属于手性分子的有_______种。(提示:与4个互不相同的原子或原子团相连的碳原子叫手性碳原子,含手性碳原子的分子叫手性分子。)
(5)阿司匹林的结构简式为_______,F→G的化学方程式为_______。
(6)以环己醇为原料合成,设计合成路线(无机试剂任选)。_______
五、元素或物质推断题
17.X、 Y、Z均为非金属元素(X的原子序数小于Y的原子序数),三者形成多种化合物。其中分子式为XYZ6的化合物被认为是潜在的储氢材料,氢的质量分数达19.6%。
(1)通过计算说明X、Y、Z各是什么元素___________、___________、___________。
(2)下图示出XYZ6及相关化合物的生成与转化的流程图:
其中,实线箭头表示在一定条件的转化过程,虚线仅表示分子式的关联关系:由A和B制备XYZ6的过程中给出了所有的反应物和产物,而其他过程仅给出所有反应物及其参与反应的计量系数的比例(例如,A → C,箭头上的1/2B表示“2A+B”反应, 产物为C或者C和其他可能的物质,计量系数未给出); B和D的结构中均含有正四面体构型的负离子基团,E、F和G均为六元环结构。根据图中的关系与所述条件,写出化合物A、B.C、D、E、F、G、H和I的化学式:___________、画出D和G的结构简式___________;写出D与A产生C的反应方程式___________。
六、工业流程题
18.天宫二号空间实验室已于2016 年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是______(填化学式)
(2)“碳纤维复合材料制品”应用于“天宫二号”的推进系统。碳纤维复合材料具有重量轻、可设计强度高的特点。碳纤维复合材料由碳纤维和合成树脂组成,其中合成树脂是高分子化合物,则制备合成树脂的反应类型是_____________。
(3)太阳能电池帆板是“天宫二号”空间运行的动力源泉,其性能直接影响到“天宫二号”的运行寿命和可靠性。
① 天宫二号使用的光伏太阳能电池,该电池的核心材料是_____,其能量转化方式为_____。
② 下图是一种全天候太阳能电池的工作原理:
太阳照射时的总反应为V3++ VO2++ H2O=V2++VO2++2H+,则负极反应式为__________;夜间时,电池正极为______(填“a”或“b”)。
(4)太阳能、风能发电逐渐得到广泛应用,下列说法中,正确的是______( 填字母序号)。
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(5)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+,Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:
已知溶液pH 范围不同时,钒的存在形式如下表所示:
钒的化合价 pH<2 pH>11
+4价 VO2+,VO(OH)+ VO(OH)3-
+5价 VO2+ VO43-
①加入NaOH 调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH 后生成沉淀1的反应过程为_______、_______;所得滤液1中,铝元素的存在形式为__________。
②向碱性的滤液1 ( V的化合价为+4 )中加入H2O2的作用是________(用离子方程式表示)。
七、原理综合题
19.I.治疗胃酸过多的药物达喜(其式量不超过 700)由五种短周期元素组成,按如下流程进行实验以确定其组成。
请回答:
(1)达喜的化学式是_____________。
(2)达喜与胃酸(含稀盐酸)反应的化学方程式是____________。
(3)气体 B 与环氧丙烷( )可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
II.将 NaClO3 溶液逐滴加入到碘单质和过量盐酸的混合液中可制备液态 ICl,实验装置如下图:
请回答:
(1)圆底烧瓶中发生的化学反应是______________( 用化学方程式表示)。
(2)若加入的 NaClO3 溶液已足量,请设计实验方案证明该反应已完全:_______。
参考答案:
1.B
2.D
3.C
4.D
5.B
6.A
7.D
8.D
9.B
10.B
11.,,,nCH2=CHCl
12.对手汽车生产厂来说,塑料的成本较低,曲度较低,可减小汽车自重,降低生产成本;对车主来说,购车费用较低,汽车自重小可节约燃油消耗,降低用车成本;对行人来说万一与汽车发生碰撞,塑料可迅速变形,一定程度上可降低行人被伤書的程度。
汽车上使用了有机高分子材料的部件还有:汽车轮胎使用了橡胶;汽车保险杠等零件采用了聚丙烯等材料;汽车内电线的绝缘层使用了聚氯乙烯材料:汽车灯罩等部件采用了聚碳酸酯材料。
13.以乙烯为原料,在一定温度和压力下合成聚乙烯塑料。常用聚乙烯塑料制造塑料薄膜、各种容器、电缆皮及泡沫塑料等。
14. 加聚
15. U形管或U型干燥管 吸收空气中的水分,防止水分进入三口瓶中 乙 b a
50000
16.(1) 羧基、羟基
(2)氧化反应
(3)5
(4)0
(5) n+nHOCH2CH2OH++2nH2O
(6)
17. B N H A NH4Cl; B LiBH4; C [H2B(NH3)2]Cl; D [H2B(NH3)2][BH4]; E Cl3B3N3H3;
F H3B3N3H3; G H3Cl3B3N3H6; H B2H6; I F3BNH3 、 [H2B(NH3)2][BH4]+2 NH4Cl=2[H2B(NH3)2]Cl
18. SiO2 聚合反应 Si(或答“晶体硅”) 太阳能转化为电能 VO2+ +H2O-e - =VO2++2H+ b abc Fe2+ + 2OH- Fe(OH)2↓ 4Fe(OH)2 + 2H2O + O2 4Fe(OH)3 AlO2- 2VO(OH)3- + H2O2 + 4OH- 2VO43-+ 6H2O
19. Al2O3 6MgO CO2 12H2O或 2Al(OH)3 5Mg(OH)2 MgCO3 4H2O或Al2Mg6(OH)16(CO3) 4H2O Al2Mg6(OH)16(CO3) 4H2O+18HCl=2AlCl3+ 6MgCl2+CO2↑+21H2O nCO2+n 3I2 +NaClO3+ 6HCl=6ICl + NaCl + 3H2O 取烧瓶内溶液,加淀粉溶液,如果不变蓝,说明反应已完全
