1.1 物质的分类及转化 同步练习题(含解析) 高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1 物质的分类及转化 同步练习题(含解析) 高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 743.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-08 06:57:18 | ||
图片预览




文档简介
1.1 物质的分类及转化 同步练习题
一、选择题
1.下列对有关实验方法选择的评价正确的是
选项 实验方法 评价
A. 用丁达尔效应鉴别葡萄糖溶液和淀粉溶液 可行
B. 用乙醇萃取溴水中的溴单质 可行
C. 用KOH溶液提纯NaCl(杂质为MgCl2) 可行
D. 灼烧闻气味鉴别丝绸与棉布 不可行
A.A B.B C.C D.D
2.化学与生产、生活密切相关。下列现象或事实、解释或原因均正确的是
选项 现象或事实 解释或原因
A 一氧化氮可用作灯泡填充气体 一氧化氮分子比较稳定
B 二氧化硫可添加于红酒中 二氧化硫具有漂白性
C 正常雨水的pH约为5.6 正常雨水中溶解了二氧化碳
D 碳酸钡可用作“钡餐” 碳酸钡难溶于水
A.A B.B C.C D.D
3.Fe(OH)3 胶体虽然是由 FeCl3 溶液制得,但两者是截然不同的两种物质。FeCl3 溶液、Fe(OH)3 胶体共同具有的性质是
A.都呈透明的红褐色
B.当有光线透过时,都能产生丁达尔效应
C.稳定,密封保存一段时间都不会产生沉淀
D.都能通过半透膜
4.下列各组物质,前者属于电解质,后者属于非电解质的是
A.Na2SO4、CO2 B.Cu、SO2 C.NaCl、BaSO4 D.稀盐酸、NH3
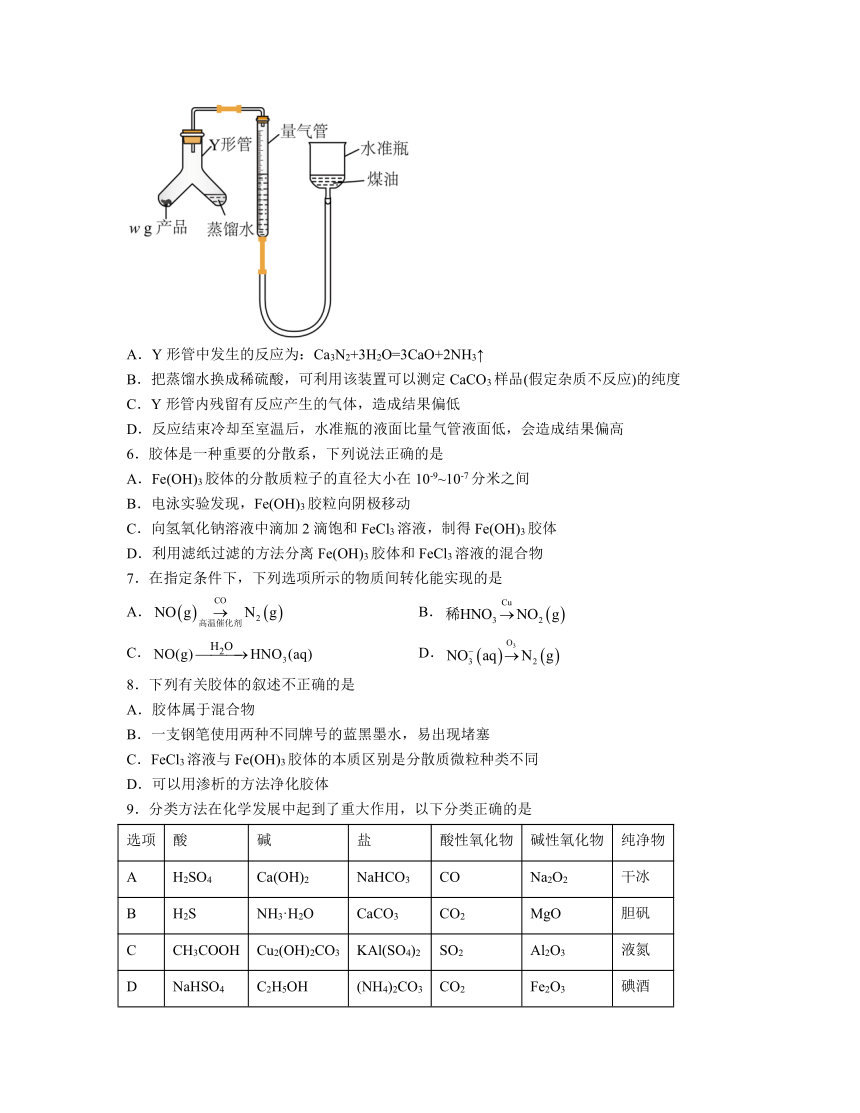
5.氮化钙(Ca3N2)是高端荧光粉的主要成分之一,其极易与水刷烈反应生成氨气。利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨不溶于煤油)。下列说法正确的是
A.Y形管中发生的反应为:Ca3N2+3H2O=3CaO+2NH3↑
B.把蒸馏水换成稀硫酸,可利用该装置可以测定CaCO3样品(假定杂质不反应)的纯度
C.Y形管内残留有反应产生的气体,造成结果偏低
D.反应结束冷却至室温后,水准瓶的液面比量气管液面低,会造成结果偏高
6.胶体是一种重要的分散系,下列说法正确的是
A.Fe(OH)3胶体的分散质粒子的直径大小在10-9~10-7分米之间
B.电泳实验发现,Fe(OH)3胶粒向阴极移动
C.向氢氧化钠溶液中滴加2滴饱和FeCl3溶液,制得Fe(OH)3胶体
D.利用滤纸过滤的方法分离Fe(OH)3胶体和FeCl3溶液的混合物
7.在指定条件下,下列选项所示的物质间转化能实现的是
A. B.
C. D.
8.下列有关胶体的叙述不正确的是
A.胶体属于混合物
B.一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞
C.FeCl3溶液与Fe(OH)3胶体的本质区别是分散质微粒种类不同
D.可以用渗析的方法净化胶体
9.分类方法在化学发展中起到了重大作用,以下分类正确的是
选项 酸 碱 盐 酸性氧化物 碱性氧化物 纯净物
A H2SO4 Ca(OH)2 NaHCO3 CO Na2O2 干冰
B H2S NH3·H2O CaCO3 CO2 MgO 胆矾
C CH3COOH Cu2(OH)2CO3 KAl(SO4)2 SO2 Al2O3 液氮
D NaHSO4 C2H5OH (NH4)2CO3 CO2 Fe2O3 碘酒
A.A B.B C.C D.D
10.清晨树林间有一条光柱,该现象主要缘于
A.光的直线传播 B.丁达尔效应 C.分子的运动 D.空气的流动
11.推理和归纳是化学学习和研究中常用的思维方法,下列推理正确的是
A.稀有气体可做保护气,可做保护气的一定是稀有气体
B.单质是由一种元素组成的纯净物,由一种元素组成的纯净物一定是单质
C.性质活泼的金属能与稀盐酸反应生成气体,能跟稀盐酸反应产生气体的物质一定是金属
D.有机化合物是含碳元素的化合物,含碳元素的化合物一定是有机化合物
12.下列物质中,不属于酸性氧化物的是
A. B. C. D.
13.下列关于物质分类的叙述中,不正确的是
A.属于酸性氧化物 B.属于酸
C.属于碱 D.属于盐
14.空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍的叫霾。当水汽凝结加剧、空气湿度增大时,霾就会转化为雾。二氧化硫、氮氧化物和可吸入颗粒物这三项是雾霾的主要组成。以下说法不正确的是
A.雾霾天,汽车车灯照出“通路”的现象属于丁达尔效应
B.燃煤中加入生石灰可减少二氧化硫的排放
C.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化物有关
D.PM2.5是直径小于或等于2.5微米的污染物颗粒,完全属于胶体粒子的直径范围
15.下列物质中属于碱性氧化物的是
A.HCl B.NO2 C.NO D.CaO
二、填空题
16.A、B、C、D是中学化学常见物质,如图是包含A、B、C、D和盐酸5种物质的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生反应。
(1)单质A不可能是___________(填序号)。
①Mg②Fe③Cu④C
(2)若B为铁锈的主要成分Fe2O3,则B与盐酸反应的化学方程式为___________。
(3)若D为苛性钠,写出属于中和反应的化学方程式:___________。
(4)若C为碳酸钠,将二氧化碳通入C溶液,可化合生成碳酸氢钠,该反应的化学方程式为___________。
17.有下列十种物质:①草木灰、②纯碱、③金刚石、④苛性钠、⑤生石灰、⑥硫酸、⑦碘酒、⑧氯化钠、⑨金属钠、⑩氧气和臭氧的混合气体,回答下列问题(填序号):
(1)只由一种元素组成的是____,只由两种元素组成的是____。
(2)属于混合物的是____,属于纯净物的是____。
(3)属于单质的是____,属于化合物的是____。
(4)属于酸的是____,属于碱的是_____,属于盐的是____。
18.现有下列12种物质:①空气;②H2O;③Mg;④CaO;⑤H2SO4;⑥Ca(OH)2;⑦CuSO4 5H2O;⑧碘酒;⑨CH3CH2OH;⑩NaHCO3; 淀粉溶液; 盐酸。
(1)属于混合物的是_____(填序号,下同);
(2)属于氧化物的是______;
(3)属于盐的是____;
(4)属于碱的是_____;
三、元素或物质推断题
19.铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
铜铜绿ACu(OH)2B Cu
(1)从三种不同分类标准回答,“铜绿”属于哪类物质:________________。
(2)请写出“铜绿”与盐酸反应的化学方程式:______________。
(3)写出④、⑤的化学方程式:
④____________________;⑤______________________。
(4)上述转化过程中属于化合反应的是________,属于复分解反应的是______,属于分解反应的是______。
四、实验题
20.某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)某温度,100mL饱和FeCl3溶液中含氯离子(Cl-)1.5mol,则该FeCl3溶液的物质的量浓度为_____。若将该饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是_____(选填字母)。
A. 冷水 B. 沸水 C. NaOH浓溶液 D. NaCl浓溶液
(2)制备Fe(OH)3胶体的化学方程式为___________ 。
(3)鉴别FeCl3溶液与Fe(OH)3胶体的实验方法是_______。
(4)向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为__________;继续滴加,沉淀最终消失且得棕黄色溶液,写出化学方程式_______。
(5)可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若___________(填实验现象),则说明该Fe(OH)3胶体中的杂质离子已经完全除去。
【参考答案】
一、选择题
1.A
解析:A.葡萄糖溶液属于溶液,淀粉溶液是胶体,可以用丁达尔效应鉴别,A正确;
B.乙醇易溶于水,不能用乙醇作萃取剂,B错误;
C.用KOH溶液提纯NaCl(杂质为MgCl2)时,会引入钾离子杂质,C错误;
D.灼烧丝绸有烧焦羽毛的气味,故可以用灼烧闻气味鉴别丝绸与棉布,D错误;
故选A。
2.C
解析:A.一般灯泡填充气体是充入氮气,且一氧化氮遇空气反应生成二氧化氮,不稳定,选项A错误;
B. SO2是很好的抑菌剂,红酒中常加入微量的SO2,但不是利用其漂白性,选项B错误;
C.正常雨水中因溶解了二氧化碳,pH约为5.6,选项C正确;
D.碳酸钡难溶于水,但可与胃酸反应生成可溶性的钡盐引起重金属中毒,不能用作“钡餐”,应选用硫酸钡,选项D错误;
答案选C。
3.C
【分析】胶体是分散质粒子大小在 1nm~100nm 的分散系;
解析:A.FeCl3溶液与Fe(OH)3胶体的颜色分别为棕黄色、红褐色,故A错误;
B.只有胶体具有丁达尔效应,所以Fe(OH)3胶体具有丁达尔效应,而FeCl3溶液不具备,故B错误;
C.胶体具有介稳性,放置不会产生沉淀,溶液是稳定的,故C正确;
D.FeCl3溶液的微粒小于1nm能通过半透膜,Fe(OH)3胶体粒子大小在 1nm~100nm不能通过半透膜,故D错误;
故选C。
4.A
【分析】在水溶液或熔融态可以导电的化合物为电解质;在水溶液和熔融态均不导电的化合物为非电解质。
解析:A.Na2SO4为电解质,CO2为非电解质,故A正确;
B.铜为单质,既不是电解质也不是非电解质,二氧化硫为非电解质,故B错误;
C.NaCl、BaSO4两者均为电解质,故C错误;
D.稀盐酸为混合物,既不是电解质也不是非电解质,氨气是非电解质,故D错误;
故选A。
5.D
解析:A.Y形管中发生的反应为:,A错误;
B.稀硫酸与CaCO3反应生成的硫酸钙微溶,包围在碳酸钙周围,使反应不能彻底进行,B错误;
C.Y形管中反应前存有一定量气体,反应后管内残留的气体体积与反应前存有的气体体积相同,故结果无影响,C错误;
D.反应结束,冷却至室温后,未调整水准瓶的高度即读数,会导致量气管内煤油液面比右侧液面高,则测量出来的生成的气体体积偏大,故会造成结果偏高,D正确;
故选D。
6.B
解析:A.分散质粒子的直径大小在10-9~10-7米之间,这是胶体的本质特征,单位是米不是分米,故A错误;
B.Fe(OH)3胶粒带正电,在电场的作用下向阴极移动,故B正确;
C.向氢氧化钠溶液中滴加2滴饱和FeCl3溶液,反应生成氢氧化铁沉淀,得不到Fe(OH)3胶体,故C错误;
D.Fe(OH)3胶体和FeCl3溶液都能通过滤纸,不能利用滤纸过滤的方法分离Fe(OH)3胶体和FeCl3溶液的混合物,故D错误;
故答案选B。
7.A
解析:A.NO与CO在高温高压的条件下生成N2和CO2,NO+CON2+CO2,选项A符合题意;
B.稀HNO3与Cu反应生成NO,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,选项B不符合题意;
C.NO不与H2O反应,选项C不符合题意;
D.NO中的N为最高价+5价,O3为氧化剂,因此不能生成N2,选项D不符合题意;
答案选A。
8.C
解析:A.根据分散系中分散质微粒直径大小,将分散系分为浊液、胶体和溶液,因此胶体属于混合物,A正确;
B.墨水属于胶体,不同品牌墨水的胶体的分散质微粒吸附的电荷种类可能不同,当混合使用时,胶体发生聚沉而形成沉淀而更容易堵塞笔尖,则一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞,B正确;
C.FeCl3溶液与Fe(OH)3胶体的本质区别是分散质微粒直径大小不同,而不是分散质微粒的种类不同,C错误;
D.胶体的分散质微粒不能通过半透膜,而溶液的溶质分子及离子可以通过半透膜,因此可以用渗析的方法提纯净化胶体,D正确;
故合理选项是C。
9.B
解析:A.CO为中性氧化物,Na2O2是过氧化物,A错误;
B.各物质分类正确,B正确;
C.Cu2(OH)2CO3为碱式盐,C错误;
D.NaHSO4为酸式盐,C2H5OH是有机物,碘酒是混合物,D错误;
故答案为:B。
10.B
解析:清晨树林间有一条光柱,是由于光的散射引起的,该现象主要缘于丁达尔效应,故B符合题意。
综上所述,答案为B。
11.B
解析:A.稀有气体可做保护气,可做保护气的不一定是稀有气体,如N2,A错误;
B.单质是由一种元素组成的纯净物,由一种元素组成的纯净物一定是单质,B正确;
C.性质活泼的金属能与稀盐酸反应生成气体,能跟稀盐酸反应产生气体的物质不一定是金属,如碳酸钙和稀盐酸反应生成CO2,C错误;
D.有机化合物是含碳元素的化合物,含碳元素的化合物不一定是有机化合物,如CO、CO2、碳酸盐等属于无机物,D错误;
故选B。
12.B
解析:凡是能与碱反应生成盐和水的氧化物为酸性氧化物,、、是酸性氧化物,不属于酸性氧化物,为不成盐氧化物;
答案选B。
13.D
解析:A.是非金属氧化物,属于酸性氧化物,故A正确;
B.属于中强酸,故B正确;
C.电离出的阴离子全部是氢氧根,属于碱,故C正确;
D.是氢化物,不属于盐,故D错误。
综上所述,答案为D。
14.D
解析:A.雾霾中含有部分微粒直径在胶粒范围之内,故汽车车灯照出通路的现象属于丁达尔现象,A正确;
B.燃煤中加入生石灰可以使燃烧产生的二氧化硫转化为硫酸钙,减少二氧化硫的排放,B正确;
C.以一氧化氮和二氧化氮为主的氮氧化物是形成“光化学烟雾”“硝酸型酸雨”的形成的一个重要原因,C正确;
D.PM2.5是直径小于或等于2.5um的污染物颗粒,即粒子直径<2.5×10-6m,胶体是粒子大小介于10-9-10-7m,不完全属于胶体粒子的直径范围,D错误;
故选D。
15.D
【分析】碱性氧化物,是指溶于水而只生成一种碱或与酸反应而成一种盐和水(除了盐和水以外不包括其它物质)的化合物。
解析:A.HCl不属于氧化物,故A错误;
B.NO2不属于酸性氧化物,故B错误;
C.NO不能与碱反应生成盐和水,故C错误;
D.CaO能与酸反应生成盐和水,属于碱性氧化物,故D正确;
故答案选D。
二、填空题
16.(1)③④
(2)
(3)
(4)
解析:(1)由金属活动性顺序可知,排在氢前面的金属可以将酸中的氢置换出来,所以铁、镁会与盐酸反应,Cu和C不会与盐酸反应。故选:③④。
(2)Fe2O3和盐酸反应生成氯化铁和水,化学方程式为。
(3)氢氧化钠和盐酸反应生成氯化钠和水的中和反应,故化学方程式为。
(4)二氧化碳、水和碳酸钠反应生成碳酸氢钠,所以将二氧化碳通入C溶液,可化合生成碳酸氢钠,化学方程式为。
17.(1) ③⑨⑩ ⑤⑧
(2) ①⑦⑩ ②③④⑤⑥⑧⑨
(3) ③⑨ ②④⑤⑥⑧
(4) ⑥ ④ ②⑧
解析:单质(③金刚石、⑨金属钠)、酸(⑥硫酸)、碱(④苛性钠)、盐(②纯碱、⑧氯化钠)、氧化物(⑤生石灰)都是纯净物;①草木灰、⑦碘酒、⑩氧气和臭氧的混合气体,都是混合物。
(1)据分析,单质只由一种元素组成,氧气和臭氧的混合气体只由一种元素组成,有③⑨⑩;只由两种元素组成的是:⑤生石灰(CaO)、⑧氯化钠(NaCl)。
(2)只有一种物质组成的是纯净物,多于一种物质组成的是混合物,据分析,属于混合物的是①⑦⑩;属于纯净物的是②③④⑤⑥⑧⑨。
(3)由一种元素组成的纯净物是单质,由多于一种元素组成的纯净物是化合物,据分析,属于单质的是③⑨;属于化合物的是:②④⑤⑥⑧
(4)电离出的阳离子全部是氢离子的化合物是酸,属于酸的是⑥;电离出的阴离子全部是氢氧根离子的化合物是碱,属于碱的是④;由金属阳离子和酸根阴离子构成的化合物是盐,属于盐的是②⑧。
18.①⑧ ②④ ⑦⑩ ⑥
解析:(1)①空气是由氧气、氮气、二氧化碳、稀有气体等组成的混合物;⑧碘酒是碘单质的酒精溶液; 淀粉溶液是淀粉溶于水形成的混合物; 盐酸是氯化氢的水溶液;它们都是由两种或两种以上不同物质组成的物质,为混合物,属于混合物的是①⑧ ;
(2)②H2O、④CaO都是由两种元素组成的化合物,其中一种是氧元素,属于氧化物,属于氧化物的是②④;
(3)⑦CuSO4 5H2O是结晶水合物,非结晶水部分由金属阳离子和酸根离子构成,所以属于盐;⑩NaHCO3由钠离子和碳酸氢根离子构成,属于盐,属于盐的是⑦⑩;
(4)⑥Ca(OH)2由金属阳离子和氢氧根离子构成,阴离子只有氢氧根离子,属于碱,属于碱的是⑥;
三、元素或物质推断题
19. 盐、铜盐、碱式盐(或碳酸盐) Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑ Cu(OH)2 CuO+H2O CuO+H2 Cu+H2O ① ②③ ④
解析:(1)Cu2(OH)2CO3中含有铜离子、氢氧根离子、碳酸根离子,其类别应属于:化合物、盐、铜盐、碱式盐、碳酸盐、含氧酸盐;(2)Cu2(OH)2CO3可溶于盐酸生成CuCl2、CO2和H2O,反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑;(3)Cu(OH)2的热稳定性差,受热易分解生成CuO和水,,④的化学方程式为:Cu(OH)2 CuO+H2O;⑤是氢气还原氧化铜,反应的化学方程式为:CuO+H2 Cu+H2O;(4)①铜和空气中的水蒸气、CO2、O2作用生成铜绿,是化合反应;②是铜绿与酸发生的复分解反应,③是铜盐与碱反应生成氢氧化铜沉淀和另一种盐,故②③属于复分解反应;④氢氧化铜受热分解生成氧化铜和水属于分解反应。
四、实验题
20.(1) 5mol L-1 B
(2)
(3)用激光笔水平照射,观察胶体有丁达尔现象
(4) Fe(OH)3胶粒带正电荷,与硫酸溶液中SO发生聚沉
(5)不出现白色沉淀
解析:本题是胶体制备类的实验题,实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,此时即可制得氢氧化铁胶体;Fe(OH)3胶体中的杂质离子是Cl-,Cl-可以透过半透膜,而胶体不能,可以加入AgNO3来检验Cl-是否存在,加入AgNO3若不出现白色沉淀,则说明该Fe(OH)3胶体中的杂质离子已经完全除去,以此解题。
(1)FeCl3溶液中含氯离子(Cl-)1.5mol,则该FeCl3溶液的物质的量浓度c(FeCl3)=;实验室制备氢氧化铁胶体的方法是:在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,故选B;
(2)将饱和FeCl3溶液滴入沸腾的蒸馏水中,继续加热煮沸至液体呈红褐色,停止加热,就制取得到氢氧化铁胶体,方程式为:;
(3)Fe(OH)3胶体有丁达尔效应,而FeCl3溶液没有,故鉴别FeCl3溶液与Fe(OH)3胶体的实验方法是:用激光笔水平照射,观察胶体有丁达尔现象;
(4)向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是由于加电解质胶体聚沉;继续滴加,二者发生中和反应产生可溶性硫酸铁和水,因此看到沉淀最终消失且得棕黄色溶液,故答案为:Fe(OH)3胶粒带正电荷,与硫酸溶液中SO发生聚沉;;
(5)因为银离子与氯离子反应生成白色氯化银沉淀,所以更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若不出现白色沉淀则说明该Fe(OH)3胶体中的杂质离子已经完全除去,答案为:不出现白色沉淀。
一、选择题
1.下列对有关实验方法选择的评价正确的是
选项 实验方法 评价
A. 用丁达尔效应鉴别葡萄糖溶液和淀粉溶液 可行
B. 用乙醇萃取溴水中的溴单质 可行
C. 用KOH溶液提纯NaCl(杂质为MgCl2) 可行
D. 灼烧闻气味鉴别丝绸与棉布 不可行
A.A B.B C.C D.D
2.化学与生产、生活密切相关。下列现象或事实、解释或原因均正确的是
选项 现象或事实 解释或原因
A 一氧化氮可用作灯泡填充气体 一氧化氮分子比较稳定
B 二氧化硫可添加于红酒中 二氧化硫具有漂白性
C 正常雨水的pH约为5.6 正常雨水中溶解了二氧化碳
D 碳酸钡可用作“钡餐” 碳酸钡难溶于水
A.A B.B C.C D.D
3.Fe(OH)3 胶体虽然是由 FeCl3 溶液制得,但两者是截然不同的两种物质。FeCl3 溶液、Fe(OH)3 胶体共同具有的性质是
A.都呈透明的红褐色
B.当有光线透过时,都能产生丁达尔效应
C.稳定,密封保存一段时间都不会产生沉淀
D.都能通过半透膜
4.下列各组物质,前者属于电解质,后者属于非电解质的是
A.Na2SO4、CO2 B.Cu、SO2 C.NaCl、BaSO4 D.稀盐酸、NH3
5.氮化钙(Ca3N2)是高端荧光粉的主要成分之一,其极易与水刷烈反应生成氨气。利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨不溶于煤油)。下列说法正确的是
A.Y形管中发生的反应为:Ca3N2+3H2O=3CaO+2NH3↑
B.把蒸馏水换成稀硫酸,可利用该装置可以测定CaCO3样品(假定杂质不反应)的纯度
C.Y形管内残留有反应产生的气体,造成结果偏低
D.反应结束冷却至室温后,水准瓶的液面比量气管液面低,会造成结果偏高
6.胶体是一种重要的分散系,下列说法正确的是
A.Fe(OH)3胶体的分散质粒子的直径大小在10-9~10-7分米之间
B.电泳实验发现,Fe(OH)3胶粒向阴极移动
C.向氢氧化钠溶液中滴加2滴饱和FeCl3溶液,制得Fe(OH)3胶体
D.利用滤纸过滤的方法分离Fe(OH)3胶体和FeCl3溶液的混合物
7.在指定条件下,下列选项所示的物质间转化能实现的是
A. B.
C. D.
8.下列有关胶体的叙述不正确的是
A.胶体属于混合物
B.一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞
C.FeCl3溶液与Fe(OH)3胶体的本质区别是分散质微粒种类不同
D.可以用渗析的方法净化胶体
9.分类方法在化学发展中起到了重大作用,以下分类正确的是
选项 酸 碱 盐 酸性氧化物 碱性氧化物 纯净物
A H2SO4 Ca(OH)2 NaHCO3 CO Na2O2 干冰
B H2S NH3·H2O CaCO3 CO2 MgO 胆矾
C CH3COOH Cu2(OH)2CO3 KAl(SO4)2 SO2 Al2O3 液氮
D NaHSO4 C2H5OH (NH4)2CO3 CO2 Fe2O3 碘酒
A.A B.B C.C D.D
10.清晨树林间有一条光柱,该现象主要缘于
A.光的直线传播 B.丁达尔效应 C.分子的运动 D.空气的流动
11.推理和归纳是化学学习和研究中常用的思维方法,下列推理正确的是
A.稀有气体可做保护气,可做保护气的一定是稀有气体
B.单质是由一种元素组成的纯净物,由一种元素组成的纯净物一定是单质
C.性质活泼的金属能与稀盐酸反应生成气体,能跟稀盐酸反应产生气体的物质一定是金属
D.有机化合物是含碳元素的化合物,含碳元素的化合物一定是有机化合物
12.下列物质中,不属于酸性氧化物的是
A. B. C. D.
13.下列关于物质分类的叙述中,不正确的是
A.属于酸性氧化物 B.属于酸
C.属于碱 D.属于盐
14.空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍的叫霾。当水汽凝结加剧、空气湿度增大时,霾就会转化为雾。二氧化硫、氮氧化物和可吸入颗粒物这三项是雾霾的主要组成。以下说法不正确的是
A.雾霾天,汽车车灯照出“通路”的现象属于丁达尔效应
B.燃煤中加入生石灰可减少二氧化硫的排放
C.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化物有关
D.PM2.5是直径小于或等于2.5微米的污染物颗粒,完全属于胶体粒子的直径范围
15.下列物质中属于碱性氧化物的是
A.HCl B.NO2 C.NO D.CaO
二、填空题
16.A、B、C、D是中学化学常见物质,如图是包含A、B、C、D和盐酸5种物质的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生反应。
(1)单质A不可能是___________(填序号)。
①Mg②Fe③Cu④C
(2)若B为铁锈的主要成分Fe2O3,则B与盐酸反应的化学方程式为___________。
(3)若D为苛性钠,写出属于中和反应的化学方程式:___________。
(4)若C为碳酸钠,将二氧化碳通入C溶液,可化合生成碳酸氢钠,该反应的化学方程式为___________。
17.有下列十种物质:①草木灰、②纯碱、③金刚石、④苛性钠、⑤生石灰、⑥硫酸、⑦碘酒、⑧氯化钠、⑨金属钠、⑩氧气和臭氧的混合气体,回答下列问题(填序号):
(1)只由一种元素组成的是____,只由两种元素组成的是____。
(2)属于混合物的是____,属于纯净物的是____。
(3)属于单质的是____,属于化合物的是____。
(4)属于酸的是____,属于碱的是_____,属于盐的是____。
18.现有下列12种物质:①空气;②H2O;③Mg;④CaO;⑤H2SO4;⑥Ca(OH)2;⑦CuSO4 5H2O;⑧碘酒;⑨CH3CH2OH;⑩NaHCO3; 淀粉溶液; 盐酸。
(1)属于混合物的是_____(填序号,下同);
(2)属于氧化物的是______;
(3)属于盐的是____;
(4)属于碱的是_____;
三、元素或物质推断题
19.铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
铜铜绿ACu(OH)2B Cu
(1)从三种不同分类标准回答,“铜绿”属于哪类物质:________________。
(2)请写出“铜绿”与盐酸反应的化学方程式:______________。
(3)写出④、⑤的化学方程式:
④____________________;⑤______________________。
(4)上述转化过程中属于化合反应的是________,属于复分解反应的是______,属于分解反应的是______。
四、实验题
20.某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)某温度,100mL饱和FeCl3溶液中含氯离子(Cl-)1.5mol,则该FeCl3溶液的物质的量浓度为_____。若将该饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是_____(选填字母)。
A. 冷水 B. 沸水 C. NaOH浓溶液 D. NaCl浓溶液
(2)制备Fe(OH)3胶体的化学方程式为___________ 。
(3)鉴别FeCl3溶液与Fe(OH)3胶体的实验方法是_______。
(4)向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是因为__________;继续滴加,沉淀最终消失且得棕黄色溶液,写出化学方程式_______。
(5)可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若___________(填实验现象),则说明该Fe(OH)3胶体中的杂质离子已经完全除去。
【参考答案】
一、选择题
1.A
解析:A.葡萄糖溶液属于溶液,淀粉溶液是胶体,可以用丁达尔效应鉴别,A正确;
B.乙醇易溶于水,不能用乙醇作萃取剂,B错误;
C.用KOH溶液提纯NaCl(杂质为MgCl2)时,会引入钾离子杂质,C错误;
D.灼烧丝绸有烧焦羽毛的气味,故可以用灼烧闻气味鉴别丝绸与棉布,D错误;
故选A。
2.C
解析:A.一般灯泡填充气体是充入氮气,且一氧化氮遇空气反应生成二氧化氮,不稳定,选项A错误;
B. SO2是很好的抑菌剂,红酒中常加入微量的SO2,但不是利用其漂白性,选项B错误;
C.正常雨水中因溶解了二氧化碳,pH约为5.6,选项C正确;
D.碳酸钡难溶于水,但可与胃酸反应生成可溶性的钡盐引起重金属中毒,不能用作“钡餐”,应选用硫酸钡,选项D错误;
答案选C。
3.C
【分析】胶体是分散质粒子大小在 1nm~100nm 的分散系;
解析:A.FeCl3溶液与Fe(OH)3胶体的颜色分别为棕黄色、红褐色,故A错误;
B.只有胶体具有丁达尔效应,所以Fe(OH)3胶体具有丁达尔效应,而FeCl3溶液不具备,故B错误;
C.胶体具有介稳性,放置不会产生沉淀,溶液是稳定的,故C正确;
D.FeCl3溶液的微粒小于1nm能通过半透膜,Fe(OH)3胶体粒子大小在 1nm~100nm不能通过半透膜,故D错误;
故选C。
4.A
【分析】在水溶液或熔融态可以导电的化合物为电解质;在水溶液和熔融态均不导电的化合物为非电解质。
解析:A.Na2SO4为电解质,CO2为非电解质,故A正确;
B.铜为单质,既不是电解质也不是非电解质,二氧化硫为非电解质,故B错误;
C.NaCl、BaSO4两者均为电解质,故C错误;
D.稀盐酸为混合物,既不是电解质也不是非电解质,氨气是非电解质,故D错误;
故选A。
5.D
解析:A.Y形管中发生的反应为:,A错误;
B.稀硫酸与CaCO3反应生成的硫酸钙微溶,包围在碳酸钙周围,使反应不能彻底进行,B错误;
C.Y形管中反应前存有一定量气体,反应后管内残留的气体体积与反应前存有的气体体积相同,故结果无影响,C错误;
D.反应结束,冷却至室温后,未调整水准瓶的高度即读数,会导致量气管内煤油液面比右侧液面高,则测量出来的生成的气体体积偏大,故会造成结果偏高,D正确;
故选D。
6.B
解析:A.分散质粒子的直径大小在10-9~10-7米之间,这是胶体的本质特征,单位是米不是分米,故A错误;
B.Fe(OH)3胶粒带正电,在电场的作用下向阴极移动,故B正确;
C.向氢氧化钠溶液中滴加2滴饱和FeCl3溶液,反应生成氢氧化铁沉淀,得不到Fe(OH)3胶体,故C错误;
D.Fe(OH)3胶体和FeCl3溶液都能通过滤纸,不能利用滤纸过滤的方法分离Fe(OH)3胶体和FeCl3溶液的混合物,故D错误;
故答案选B。
7.A
解析:A.NO与CO在高温高压的条件下生成N2和CO2,NO+CON2+CO2,选项A符合题意;
B.稀HNO3与Cu反应生成NO,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,选项B不符合题意;
C.NO不与H2O反应,选项C不符合题意;
D.NO中的N为最高价+5价,O3为氧化剂,因此不能生成N2,选项D不符合题意;
答案选A。
8.C
解析:A.根据分散系中分散质微粒直径大小,将分散系分为浊液、胶体和溶液,因此胶体属于混合物,A正确;
B.墨水属于胶体,不同品牌墨水的胶体的分散质微粒吸附的电荷种类可能不同,当混合使用时,胶体发生聚沉而形成沉淀而更容易堵塞笔尖,则一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞,B正确;
C.FeCl3溶液与Fe(OH)3胶体的本质区别是分散质微粒直径大小不同,而不是分散质微粒的种类不同,C错误;
D.胶体的分散质微粒不能通过半透膜,而溶液的溶质分子及离子可以通过半透膜,因此可以用渗析的方法提纯净化胶体,D正确;
故合理选项是C。
9.B
解析:A.CO为中性氧化物,Na2O2是过氧化物,A错误;
B.各物质分类正确,B正确;
C.Cu2(OH)2CO3为碱式盐,C错误;
D.NaHSO4为酸式盐,C2H5OH是有机物,碘酒是混合物,D错误;
故答案为:B。
10.B
解析:清晨树林间有一条光柱,是由于光的散射引起的,该现象主要缘于丁达尔效应,故B符合题意。
综上所述,答案为B。
11.B
解析:A.稀有气体可做保护气,可做保护气的不一定是稀有气体,如N2,A错误;
B.单质是由一种元素组成的纯净物,由一种元素组成的纯净物一定是单质,B正确;
C.性质活泼的金属能与稀盐酸反应生成气体,能跟稀盐酸反应产生气体的物质不一定是金属,如碳酸钙和稀盐酸反应生成CO2,C错误;
D.有机化合物是含碳元素的化合物,含碳元素的化合物不一定是有机化合物,如CO、CO2、碳酸盐等属于无机物,D错误;
故选B。
12.B
解析:凡是能与碱反应生成盐和水的氧化物为酸性氧化物,、、是酸性氧化物,不属于酸性氧化物,为不成盐氧化物;
答案选B。
13.D
解析:A.是非金属氧化物,属于酸性氧化物,故A正确;
B.属于中强酸,故B正确;
C.电离出的阴离子全部是氢氧根,属于碱,故C正确;
D.是氢化物,不属于盐,故D错误。
综上所述,答案为D。
14.D
解析:A.雾霾中含有部分微粒直径在胶粒范围之内,故汽车车灯照出通路的现象属于丁达尔现象,A正确;
B.燃煤中加入生石灰可以使燃烧产生的二氧化硫转化为硫酸钙,减少二氧化硫的排放,B正确;
C.以一氧化氮和二氧化氮为主的氮氧化物是形成“光化学烟雾”“硝酸型酸雨”的形成的一个重要原因,C正确;
D.PM2.5是直径小于或等于2.5um的污染物颗粒,即粒子直径<2.5×10-6m,胶体是粒子大小介于10-9-10-7m,不完全属于胶体粒子的直径范围,D错误;
故选D。
15.D
【分析】碱性氧化物,是指溶于水而只生成一种碱或与酸反应而成一种盐和水(除了盐和水以外不包括其它物质)的化合物。
解析:A.HCl不属于氧化物,故A错误;
B.NO2不属于酸性氧化物,故B错误;
C.NO不能与碱反应生成盐和水,故C错误;
D.CaO能与酸反应生成盐和水,属于碱性氧化物,故D正确;
故答案选D。
二、填空题
16.(1)③④
(2)
(3)
(4)
解析:(1)由金属活动性顺序可知,排在氢前面的金属可以将酸中的氢置换出来,所以铁、镁会与盐酸反应,Cu和C不会与盐酸反应。故选:③④。
(2)Fe2O3和盐酸反应生成氯化铁和水,化学方程式为。
(3)氢氧化钠和盐酸反应生成氯化钠和水的中和反应,故化学方程式为。
(4)二氧化碳、水和碳酸钠反应生成碳酸氢钠,所以将二氧化碳通入C溶液,可化合生成碳酸氢钠,化学方程式为。
17.(1) ③⑨⑩ ⑤⑧
(2) ①⑦⑩ ②③④⑤⑥⑧⑨
(3) ③⑨ ②④⑤⑥⑧
(4) ⑥ ④ ②⑧
解析:单质(③金刚石、⑨金属钠)、酸(⑥硫酸)、碱(④苛性钠)、盐(②纯碱、⑧氯化钠)、氧化物(⑤生石灰)都是纯净物;①草木灰、⑦碘酒、⑩氧气和臭氧的混合气体,都是混合物。
(1)据分析,单质只由一种元素组成,氧气和臭氧的混合气体只由一种元素组成,有③⑨⑩;只由两种元素组成的是:⑤生石灰(CaO)、⑧氯化钠(NaCl)。
(2)只有一种物质组成的是纯净物,多于一种物质组成的是混合物,据分析,属于混合物的是①⑦⑩;属于纯净物的是②③④⑤⑥⑧⑨。
(3)由一种元素组成的纯净物是单质,由多于一种元素组成的纯净物是化合物,据分析,属于单质的是③⑨;属于化合物的是:②④⑤⑥⑧
(4)电离出的阳离子全部是氢离子的化合物是酸,属于酸的是⑥;电离出的阴离子全部是氢氧根离子的化合物是碱,属于碱的是④;由金属阳离子和酸根阴离子构成的化合物是盐,属于盐的是②⑧。
18.①⑧ ②④ ⑦⑩ ⑥
解析:(1)①空气是由氧气、氮气、二氧化碳、稀有气体等组成的混合物;⑧碘酒是碘单质的酒精溶液; 淀粉溶液是淀粉溶于水形成的混合物; 盐酸是氯化氢的水溶液;它们都是由两种或两种以上不同物质组成的物质,为混合物,属于混合物的是①⑧ ;
(2)②H2O、④CaO都是由两种元素组成的化合物,其中一种是氧元素,属于氧化物,属于氧化物的是②④;
(3)⑦CuSO4 5H2O是结晶水合物,非结晶水部分由金属阳离子和酸根离子构成,所以属于盐;⑩NaHCO3由钠离子和碳酸氢根离子构成,属于盐,属于盐的是⑦⑩;
(4)⑥Ca(OH)2由金属阳离子和氢氧根离子构成,阴离子只有氢氧根离子,属于碱,属于碱的是⑥;
三、元素或物质推断题
19. 盐、铜盐、碱式盐(或碳酸盐) Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑ Cu(OH)2 CuO+H2O CuO+H2 Cu+H2O ① ②③ ④
解析:(1)Cu2(OH)2CO3中含有铜离子、氢氧根离子、碳酸根离子,其类别应属于:化合物、盐、铜盐、碱式盐、碳酸盐、含氧酸盐;(2)Cu2(OH)2CO3可溶于盐酸生成CuCl2、CO2和H2O,反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑;(3)Cu(OH)2的热稳定性差,受热易分解生成CuO和水,,④的化学方程式为:Cu(OH)2 CuO+H2O;⑤是氢气还原氧化铜,反应的化学方程式为:CuO+H2 Cu+H2O;(4)①铜和空气中的水蒸气、CO2、O2作用生成铜绿,是化合反应;②是铜绿与酸发生的复分解反应,③是铜盐与碱反应生成氢氧化铜沉淀和另一种盐,故②③属于复分解反应;④氢氧化铜受热分解生成氧化铜和水属于分解反应。
四、实验题
20.(1) 5mol L-1 B
(2)
(3)用激光笔水平照射,观察胶体有丁达尔现象
(4) Fe(OH)3胶粒带正电荷,与硫酸溶液中SO发生聚沉
(5)不出现白色沉淀
解析:本题是胶体制备类的实验题,实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,此时即可制得氢氧化铁胶体;Fe(OH)3胶体中的杂质离子是Cl-,Cl-可以透过半透膜,而胶体不能,可以加入AgNO3来检验Cl-是否存在,加入AgNO3若不出现白色沉淀,则说明该Fe(OH)3胶体中的杂质离子已经完全除去,以此解题。
(1)FeCl3溶液中含氯离子(Cl-)1.5mol,则该FeCl3溶液的物质的量浓度c(FeCl3)=;实验室制备氢氧化铁胶体的方法是:在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,故选B;
(2)将饱和FeCl3溶液滴入沸腾的蒸馏水中,继续加热煮沸至液体呈红褐色,停止加热,就制取得到氢氧化铁胶体,方程式为:;
(3)Fe(OH)3胶体有丁达尔效应,而FeCl3溶液没有,故鉴别FeCl3溶液与Fe(OH)3胶体的实验方法是:用激光笔水平照射,观察胶体有丁达尔现象;
(4)向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,这是由于加电解质胶体聚沉;继续滴加,二者发生中和反应产生可溶性硫酸铁和水,因此看到沉淀最终消失且得棕黄色溶液,故答案为:Fe(OH)3胶粒带正电荷,与硫酸溶液中SO发生聚沉;;
(5)因为银离子与氯离子反应生成白色氯化银沉淀,所以更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若不出现白色沉淀则说明该Fe(OH)3胶体中的杂质离子已经完全除去,答案为:不出现白色沉淀。
