第1章有机化合物的结构与性质--烃检测题(含答案)高二下学期化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 第1章有机化合物的结构与性质--烃检测题(含答案)高二下学期化学鲁科版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-08 00:00:00 | ||
图片预览


文档简介
第一章《有机化合物的结构与性质—烃》检测题
一、单选题(共13题)
1.在实验室中,下列除去杂质的方法正确的是
A.溴苯中混有溴,加入KI溶液,振荡,再用汽油萃取
B.硝基苯中混有浓硝酸和浓硫酸,加入NaOH溶液,静置,分液
C.用酸性KMnO4溶液除去乙炔中混有的H2S
D.乙烯中混有SO2和CO2,将其先后通入NaOH溶液和KMnO4酸性溶液中洗气
2.下列化学用语或图示表达不正确的是
A.乙烯的空间填充模型: B.CO2的电子式:
C.HClO的结构式:H-O-Cl D.氯元素的原子结构示意图:
3.下列有关实验的说法错误的是
A.取5mL0.1mol·L-1KI溶液,加入1mL0.1mol·L-1FeCl3溶液,萃取分离出碘单质后,向溶液中滴加5~6滴15%KSCN溶液变红,说明Fe3+并未完全转化为Fe2+
B.蒸馏实验时,若温度计水银球高于蒸馏烧瓶支管口,则收集到的馏分沸点偏低
C.氯气和甲烷体积比为1:1的混合气体,光照一段时间后瓶壁上有油状液滴附着
D.在苯与液溴制备溴苯的实验中,溴苯提纯步骤:水洗、用10%的氢氧化钠溶液洗涤、水洗、用干燥剂干燥、蒸馏
4.下列有机物命名正确的是
A. 2,2-二甲基-3-戊炔 B.环己醇
C.甲基苯甲醛 D.乙烯苯
5.下列说法正确的是
A.35Cl与37Cl互为同位素,两者化学性质不同
B.乙醇和甘油互为同系物
C.CH3COOCH2CH3和CH3CH2OOCCH3互为同分异构体
D.单质硫有S2、S4、S6等,它们都是硫的同素异形体
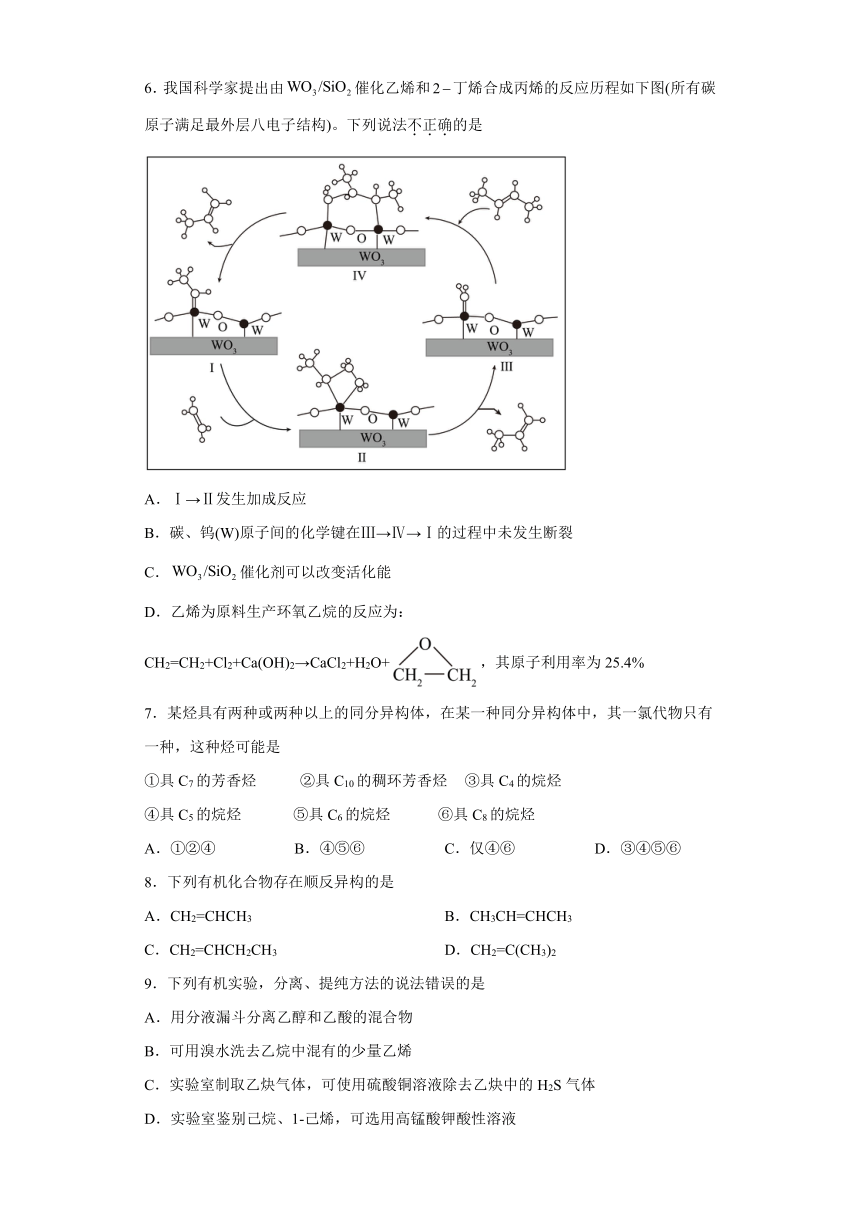
6.我国科学家提出由催化乙烯和丁烯合成丙烯的反应历程如下图(所有碳原子满足最外层八电子结构)。下列说法不正确的是
A.Ⅰ→Ⅱ发生加成反应
B.碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ的过程中未发生断裂
C.催化剂可以改变活化能
D.乙烯为原料生产环氧乙烷的反应为:CH2=CH2+Cl2+Ca(OH)2→CaCl2+H2O+,其原子利用率为25.4%
7.某烃具有两种或两种以上的同分异构体,在某一种同分异构体中,其一氯代物只有一种,这种烃可能是
①具C7的芳香烃 ②具C10的稠环芳香烃 ③具C4的烷烃
④具C5的烷烃 ⑤具C6的烷烃 ⑥具C8的烷烃
A.①②④ B.④⑤⑥ C.仅④⑥ D.③④⑤⑥
8.下列有机化合物存在顺反异构的是
A.CH2=CHCH3 B.CH3CH=CHCH3
C.CH2=CHCH2CH3 D.CH2=C(CH3)2
9.下列有机实验,分离、提纯方法的说法错误的是
A.用分液漏斗分离乙醇和乙酸的混合物
B.可用溴水洗去乙烷中混有的少量乙烯
C.实验室制取乙炔气体,可使用硫酸铜溶液除去乙炔中的H2S气体
D.实验室鉴别己烷、1-己烯,可选用高锰酸钾酸性溶液
10.下列化学用语正确的是
A.溴苯的分子式:C6H6Br
B.乙醛的结构简式:CH3CHO
C.乙烯的球棍模型:
D.氯原子的结构示意图:
11.下列说法不正确的是
A.用浸泡过高锰酸钾溶液的硅藻土可以保鲜水果
B.焦炭可在高温下还原二氧化硅制得高纯度硅
C.常用氯化铁溶液与铜反应制作印刷电路板
D.电解食盐水制取次氯酸钠溶液喷洒房间能杀菌消毒
12.脱落酸(ABA)是一种抑制生长的植物激素,常用于植物组织分化、培养实验,其结构简式如图所示。下列关于ABA的说法正确的是
A.ABA含有三种官能团 B.ABA中所有碳原子均能共平面
C.ABA能发生氧化反应、加成反应及取代反应 D.和足量的钠反应生成
13.某研究性学习小组对手性分子提出了以下四个观点:
①互为手性异构体的分子互为镜像
②利用手性催化剂合成可得到一种或主要得到一种手性分子
③手性异构体分子组成相同
④手性异构体性质相同
你认为正确的是
A.①②③ B.①②④ C.②③④ D.全部
二、非选择题(共10题)
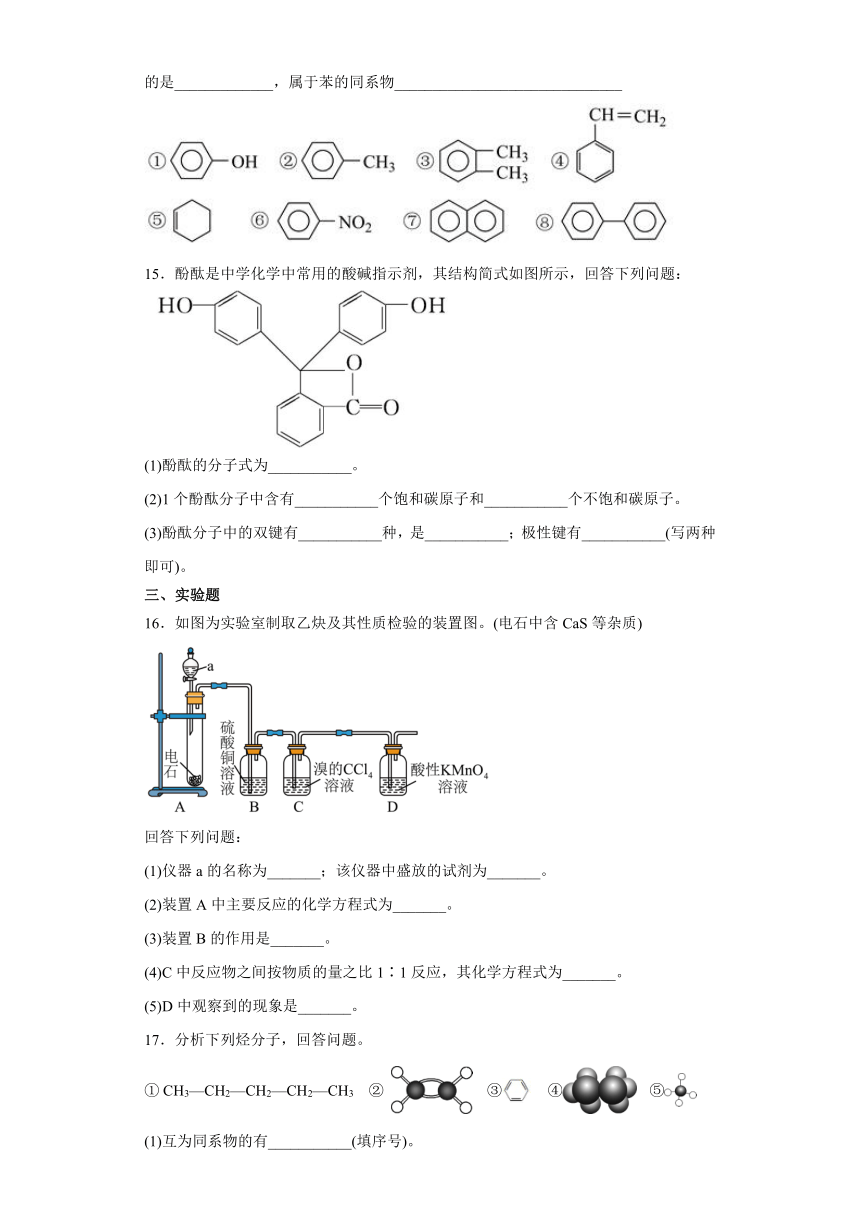
14.下列有机物属于芳香族化合物的是_____________________________,属于芳香烃的是_____________,属于苯的同系物______________________________
15.酚酞是中学化学中常用的酸碱指示剂,其结构简式如图所示,回答下列问题:
(1)酚酞的分子式为___________。
(2)1个酚酞分子中含有___________个饱和碳原子和___________个不饱和碳原子。
(3)酚酞分子中的双键有___________种,是___________;极性键有___________(写两种即可)。
三、实验题
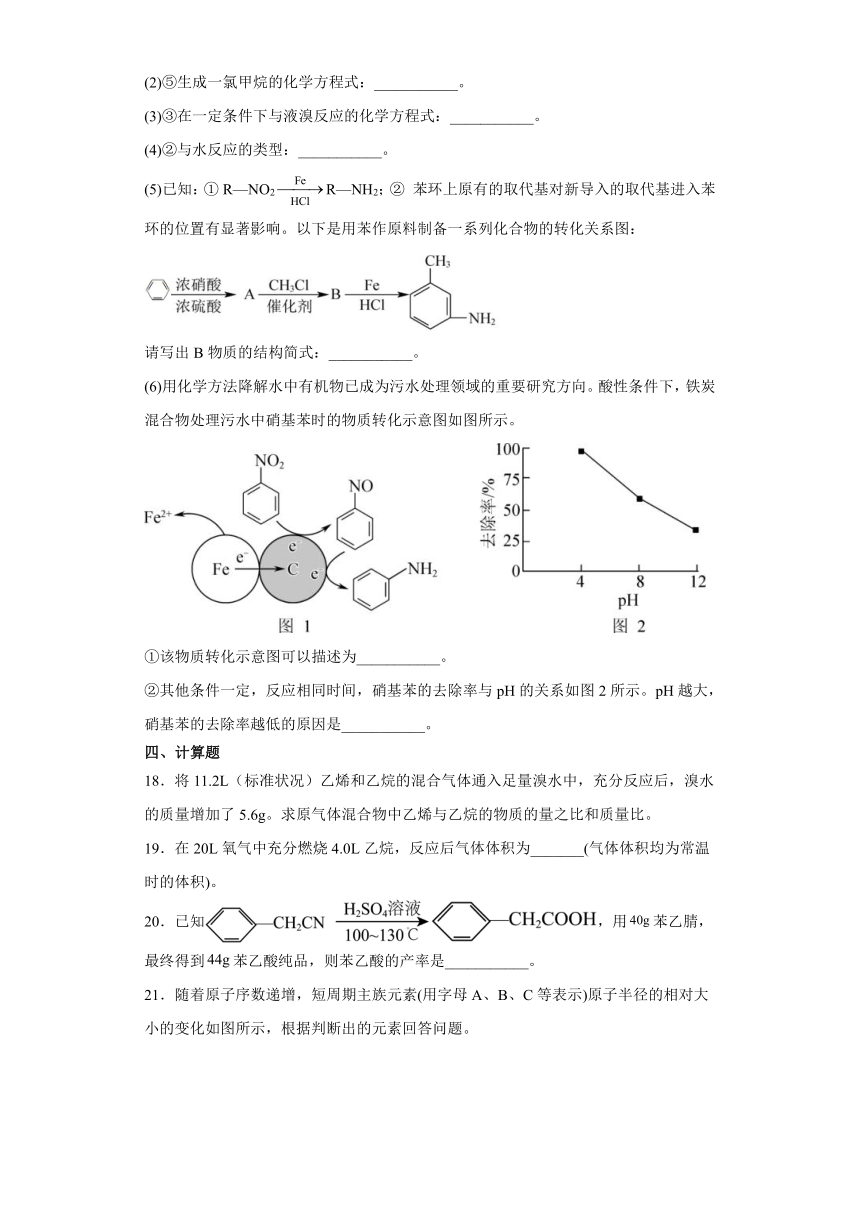
16.如图为实验室制取乙炔及其性质检验的装置图。(电石中含CaS等杂质)
回答下列问题:
(1)仪器a的名称为_______;该仪器中盛放的试剂为_______。
(2)装置A中主要反应的化学方程式为_______。
(3)装置B的作用是_______。
(4)C中反应物之间按物质的量之比1∶1反应,其化学方程式为_______。
(5)D中观察到的现象是_______。
17.分析下列烃分子,回答问题。
① CH3—CH2—CH2—CH2—CH3 ② ③ ④ ⑤
(1)互为同系物的有___________(填序号)。
(2)⑤生成一氯甲烷的化学方程式:___________。
(3)③在一定条件下与液溴反应的化学方程式:___________。
(4)②与水反应的类型:___________。
(5)已知:① R—NO2R—NH2;② 苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯作原料制备一系列化合物的转化关系图:
请写出B物质的结构简式:___________。
(6)用化学方法降解水中有机物已成为污水处理领域的重要研究方向。酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。
①该物质转化示意图可以描述为___________。
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是___________。
四、计算题
18.将11.2L(标准状况)乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g。求原气体混合物中乙烯与乙烷的物质的量之比和质量比。
19.在20L氧气中充分燃烧4.0L乙烷,反应后气体体积为_______(气体体积均为常温时的体积)。
20.已知,用苯乙腈,最终得到苯乙酸纯品,则苯乙酸的产率是___________。
21.随着原子序数递增,短周期主族元素(用字母A、B、C等表示)原子半径的相对大小的变化如图所示,根据判断出的元素回答问题。
(1)L在元素周期表中的位置是___________。
(2)M、G、H的简单气态氢化物的稳定性由强到弱的顺序是___________(用化学式表示)。
(3)E、X、Y三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是___________(用化学式表示)。
(4)G和I能形成一种淡黄色的固体,请写出该物质的电子式:___________。
(5)E与A形成的饱和链烃中,有几种物质每个分子的电子总数均为42,符合该条件的有机物共有___________种,其一氯代物有4种的该饱和链烃结构简式为___________。
(6)A与G、与X均可形成18个电子的分子,这两种分子在水溶液中反应后,生成物之一是含10电子的化合物,该反应可观察到现象是___________,原因是___________。(用化学方程式表示)
22.Ⅰ.由三种常见元素组成的化合物A,按如下流程进行实验。气体B、C、D均无色、无臭,B、D是纯净物;浓硫酸增重3.60g,碱石灰增重17.60g;溶液F焰色反应呈黄色。
请回答:
(1)组成A的非金属元素是_____,气体B的结构简式_____。
(2)固体A与足量水反应的化学方程式是_____。
(3)一定条件下,气体D可能和FeO发生氧化还原反应,试写出一个可能的化学方程式_____。
Ⅱ.某兴趣小组为验证卤素单质的氧化性强弱,向NaBr溶液中通入一定量Cl2,将少量分液漏斗中溶液滴入试管中,取试管振荡,静止后观察现象。实验装置如图:
(4)说明氧化性 Br2>I2的实验现象是_____。
(5)为了排除Cl2对溴置换碘实验的干扰,需确认分液漏斗中通入Cl2 未过量。试设计简单实验方案检____。
23.五种短周期元素A、B、D、E、G的原子序数依次增大,其中A、G同主族, B、D、E同周期。A分别与B、E、G形成原子个数比为1:1的化合物甲、乙、丙,它们在 常温常压下分别为气体、液体、固体,甲燃烧时火焰明亮且产生浓烈的黑烟,丙为离子晶体。
(1)D的基态原子有______个未成对电子,甲的电子式为____________
(2)丙与水剧烈反应生成强碱X和A的单质,其化学方程式为______。
(3)乙的水溶液显弱酸性,它在水中的电离方程式为______。
(4)B、E两种元素按原子个数比1:2形成化合物Y,当X与Y按物质的量之比为2:1 完全反应后,所得溶液浓度为0.1 mol/L,其中各离子浓度从大到小的顺序排列为______。
(5)在25°C、10l kPa时,16.0g液态D2A4在氧气中完全燃烧放出热量312 kJ,生成两 种无污染物质,其中一种为单质,另一种是氧化物。写出该反应的热化学方程式______。
参考答案:
1.B 2.B 3.B 4.B 5.D 6.B 7.C 8.B 9.A 10.B 11.B 12.C 13.A
14. ①②③④⑥⑦⑧ ②③④⑦⑧ ②③
15.(1)C20H14O4
(2) 1 19
(3) 1 H-O键、C-O键(或C=O键或C-H键)
16.(1) 分液漏斗 饱和食盐水
(2)CaC2+2H2O→Ca(OH)2+CH≡CH↑
(3)除去乙炔中混有的气体
(4)CH≡CH+Br2→CHBr=CHBr
(5)溶液褪色
17.(1)①④⑤
(2)CH4+Cl2CH3Cl+HCl
(3)+Br2+HBr
(4)加成反应
(5)
(6) 铁失去电子变成Fe2+,电子传递到炭中,C6H5NO2在炭表面得到电子变成C6H5NO,C6H5NO再得到电子变成C6H5NH2 pH增大,Fe2+生成Fe(OH)2沉淀,Fe(OH)2沉淀覆盖在铁炭混合物表面,阻碍了反应的进行,降低了反应速率
18.(1)物质的量之比2:3
(2)质量之比28:45
19.14
20.
21.(1)第三周期ⅣA族
(2)HF>H2O>PH3
(3)HClO4H2SO4H2CO3
(4)
(5) 3
(6) 生成淡黄色沉淀 H2O2+ H2S=S↓+2H2O
22. 碳(C)和氢(H) CH≡CH NaHC2+H2O=NaOH+C2H2 CO2+2FeOFe2O3+CO 试管内溶液分层,且下层为紫红色,上层无色, 取分液漏斗中上层少量溶液于试管中,向试管中通入Cl2,若试管中溶液出现红棕色,说明有溴单质生成,可确定氯气未过量
23.(1) 3 H∶C C∶H
(2)NaH+H2O==NaOH+H2↑
(3)H2O2H++
(4)c(Na+)>c()>c(OH-)>c()>c(H+)
(5)N2H4(l)+O2(g)= N2(g)+2H2O(l) ΔH=-624 kJ·mol-1
一、单选题(共13题)
1.在实验室中,下列除去杂质的方法正确的是
A.溴苯中混有溴,加入KI溶液,振荡,再用汽油萃取
B.硝基苯中混有浓硝酸和浓硫酸,加入NaOH溶液,静置,分液
C.用酸性KMnO4溶液除去乙炔中混有的H2S
D.乙烯中混有SO2和CO2,将其先后通入NaOH溶液和KMnO4酸性溶液中洗气
2.下列化学用语或图示表达不正确的是
A.乙烯的空间填充模型: B.CO2的电子式:
C.HClO的结构式:H-O-Cl D.氯元素的原子结构示意图:
3.下列有关实验的说法错误的是
A.取5mL0.1mol·L-1KI溶液,加入1mL0.1mol·L-1FeCl3溶液,萃取分离出碘单质后,向溶液中滴加5~6滴15%KSCN溶液变红,说明Fe3+并未完全转化为Fe2+
B.蒸馏实验时,若温度计水银球高于蒸馏烧瓶支管口,则收集到的馏分沸点偏低
C.氯气和甲烷体积比为1:1的混合气体,光照一段时间后瓶壁上有油状液滴附着
D.在苯与液溴制备溴苯的实验中,溴苯提纯步骤:水洗、用10%的氢氧化钠溶液洗涤、水洗、用干燥剂干燥、蒸馏
4.下列有机物命名正确的是
A. 2,2-二甲基-3-戊炔 B.环己醇
C.甲基苯甲醛 D.乙烯苯
5.下列说法正确的是
A.35Cl与37Cl互为同位素,两者化学性质不同
B.乙醇和甘油互为同系物
C.CH3COOCH2CH3和CH3CH2OOCCH3互为同分异构体
D.单质硫有S2、S4、S6等,它们都是硫的同素异形体
6.我国科学家提出由催化乙烯和丁烯合成丙烯的反应历程如下图(所有碳原子满足最外层八电子结构)。下列说法不正确的是
A.Ⅰ→Ⅱ发生加成反应
B.碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ的过程中未发生断裂
C.催化剂可以改变活化能
D.乙烯为原料生产环氧乙烷的反应为:CH2=CH2+Cl2+Ca(OH)2→CaCl2+H2O+,其原子利用率为25.4%
7.某烃具有两种或两种以上的同分异构体,在某一种同分异构体中,其一氯代物只有一种,这种烃可能是
①具C7的芳香烃 ②具C10的稠环芳香烃 ③具C4的烷烃
④具C5的烷烃 ⑤具C6的烷烃 ⑥具C8的烷烃
A.①②④ B.④⑤⑥ C.仅④⑥ D.③④⑤⑥
8.下列有机化合物存在顺反异构的是
A.CH2=CHCH3 B.CH3CH=CHCH3
C.CH2=CHCH2CH3 D.CH2=C(CH3)2
9.下列有机实验,分离、提纯方法的说法错误的是
A.用分液漏斗分离乙醇和乙酸的混合物
B.可用溴水洗去乙烷中混有的少量乙烯
C.实验室制取乙炔气体,可使用硫酸铜溶液除去乙炔中的H2S气体
D.实验室鉴别己烷、1-己烯,可选用高锰酸钾酸性溶液
10.下列化学用语正确的是
A.溴苯的分子式:C6H6Br
B.乙醛的结构简式:CH3CHO
C.乙烯的球棍模型:
D.氯原子的结构示意图:
11.下列说法不正确的是
A.用浸泡过高锰酸钾溶液的硅藻土可以保鲜水果
B.焦炭可在高温下还原二氧化硅制得高纯度硅
C.常用氯化铁溶液与铜反应制作印刷电路板
D.电解食盐水制取次氯酸钠溶液喷洒房间能杀菌消毒
12.脱落酸(ABA)是一种抑制生长的植物激素,常用于植物组织分化、培养实验,其结构简式如图所示。下列关于ABA的说法正确的是
A.ABA含有三种官能团 B.ABA中所有碳原子均能共平面
C.ABA能发生氧化反应、加成反应及取代反应 D.和足量的钠反应生成
13.某研究性学习小组对手性分子提出了以下四个观点:
①互为手性异构体的分子互为镜像
②利用手性催化剂合成可得到一种或主要得到一种手性分子
③手性异构体分子组成相同
④手性异构体性质相同
你认为正确的是
A.①②③ B.①②④ C.②③④ D.全部
二、非选择题(共10题)
14.下列有机物属于芳香族化合物的是_____________________________,属于芳香烃的是_____________,属于苯的同系物______________________________
15.酚酞是中学化学中常用的酸碱指示剂,其结构简式如图所示,回答下列问题:
(1)酚酞的分子式为___________。
(2)1个酚酞分子中含有___________个饱和碳原子和___________个不饱和碳原子。
(3)酚酞分子中的双键有___________种,是___________;极性键有___________(写两种即可)。
三、实验题
16.如图为实验室制取乙炔及其性质检验的装置图。(电石中含CaS等杂质)
回答下列问题:
(1)仪器a的名称为_______;该仪器中盛放的试剂为_______。
(2)装置A中主要反应的化学方程式为_______。
(3)装置B的作用是_______。
(4)C中反应物之间按物质的量之比1∶1反应,其化学方程式为_______。
(5)D中观察到的现象是_______。
17.分析下列烃分子,回答问题。
① CH3—CH2—CH2—CH2—CH3 ② ③ ④ ⑤
(1)互为同系物的有___________(填序号)。
(2)⑤生成一氯甲烷的化学方程式:___________。
(3)③在一定条件下与液溴反应的化学方程式:___________。
(4)②与水反应的类型:___________。
(5)已知:① R—NO2R—NH2;② 苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯作原料制备一系列化合物的转化关系图:
请写出B物质的结构简式:___________。
(6)用化学方法降解水中有机物已成为污水处理领域的重要研究方向。酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。
①该物质转化示意图可以描述为___________。
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是___________。
四、计算题
18.将11.2L(标准状况)乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g。求原气体混合物中乙烯与乙烷的物质的量之比和质量比。
19.在20L氧气中充分燃烧4.0L乙烷,反应后气体体积为_______(气体体积均为常温时的体积)。
20.已知,用苯乙腈,最终得到苯乙酸纯品,则苯乙酸的产率是___________。
21.随着原子序数递增,短周期主族元素(用字母A、B、C等表示)原子半径的相对大小的变化如图所示,根据判断出的元素回答问题。
(1)L在元素周期表中的位置是___________。
(2)M、G、H的简单气态氢化物的稳定性由强到弱的顺序是___________(用化学式表示)。
(3)E、X、Y三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是___________(用化学式表示)。
(4)G和I能形成一种淡黄色的固体,请写出该物质的电子式:___________。
(5)E与A形成的饱和链烃中,有几种物质每个分子的电子总数均为42,符合该条件的有机物共有___________种,其一氯代物有4种的该饱和链烃结构简式为___________。
(6)A与G、与X均可形成18个电子的分子,这两种分子在水溶液中反应后,生成物之一是含10电子的化合物,该反应可观察到现象是___________,原因是___________。(用化学方程式表示)
22.Ⅰ.由三种常见元素组成的化合物A,按如下流程进行实验。气体B、C、D均无色、无臭,B、D是纯净物;浓硫酸增重3.60g,碱石灰增重17.60g;溶液F焰色反应呈黄色。
请回答:
(1)组成A的非金属元素是_____,气体B的结构简式_____。
(2)固体A与足量水反应的化学方程式是_____。
(3)一定条件下,气体D可能和FeO发生氧化还原反应,试写出一个可能的化学方程式_____。
Ⅱ.某兴趣小组为验证卤素单质的氧化性强弱,向NaBr溶液中通入一定量Cl2,将少量分液漏斗中溶液滴入试管中,取试管振荡,静止后观察现象。实验装置如图:
(4)说明氧化性 Br2>I2的实验现象是_____。
(5)为了排除Cl2对溴置换碘实验的干扰,需确认分液漏斗中通入Cl2 未过量。试设计简单实验方案检____。
23.五种短周期元素A、B、D、E、G的原子序数依次增大,其中A、G同主族, B、D、E同周期。A分别与B、E、G形成原子个数比为1:1的化合物甲、乙、丙,它们在 常温常压下分别为气体、液体、固体,甲燃烧时火焰明亮且产生浓烈的黑烟,丙为离子晶体。
(1)D的基态原子有______个未成对电子,甲的电子式为____________
(2)丙与水剧烈反应生成强碱X和A的单质,其化学方程式为______。
(3)乙的水溶液显弱酸性,它在水中的电离方程式为______。
(4)B、E两种元素按原子个数比1:2形成化合物Y,当X与Y按物质的量之比为2:1 完全反应后,所得溶液浓度为0.1 mol/L,其中各离子浓度从大到小的顺序排列为______。
(5)在25°C、10l kPa时,16.0g液态D2A4在氧气中完全燃烧放出热量312 kJ,生成两 种无污染物质,其中一种为单质,另一种是氧化物。写出该反应的热化学方程式______。
参考答案:
1.B 2.B 3.B 4.B 5.D 6.B 7.C 8.B 9.A 10.B 11.B 12.C 13.A
14. ①②③④⑥⑦⑧ ②③④⑦⑧ ②③
15.(1)C20H14O4
(2) 1 19
(3) 1 H-O键、C-O键(或C=O键或C-H键)
16.(1) 分液漏斗 饱和食盐水
(2)CaC2+2H2O→Ca(OH)2+CH≡CH↑
(3)除去乙炔中混有的气体
(4)CH≡CH+Br2→CHBr=CHBr
(5)溶液褪色
17.(1)①④⑤
(2)CH4+Cl2CH3Cl+HCl
(3)+Br2+HBr
(4)加成反应
(5)
(6) 铁失去电子变成Fe2+,电子传递到炭中,C6H5NO2在炭表面得到电子变成C6H5NO,C6H5NO再得到电子变成C6H5NH2 pH增大,Fe2+生成Fe(OH)2沉淀,Fe(OH)2沉淀覆盖在铁炭混合物表面,阻碍了反应的进行,降低了反应速率
18.(1)物质的量之比2:3
(2)质量之比28:45
19.14
20.
21.(1)第三周期ⅣA族
(2)HF>H2O>PH3
(3)HClO4H2SO4H2CO3
(4)
(5) 3
(6) 生成淡黄色沉淀 H2O2+ H2S=S↓+2H2O
22. 碳(C)和氢(H) CH≡CH NaHC2+H2O=NaOH+C2H2 CO2+2FeOFe2O3+CO 试管内溶液分层,且下层为紫红色,上层无色, 取分液漏斗中上层少量溶液于试管中,向试管中通入Cl2,若试管中溶液出现红棕色,说明有溴单质生成,可确定氯气未过量
23.(1) 3 H∶C C∶H
(2)NaH+H2O==NaOH+H2↑
(3)H2O2H++
(4)c(Na+)>c()>c(OH-)>c()>c(H+)
(5)N2H4(l)+O2(g)= N2(g)+2H2O(l) ΔH=-624 kJ·mol-1
