第3章简单的有机化合物检测题(含答案)高一下学期化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第3章简单的有机化合物检测题(含答案)高一下学期化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-08 07:53:45 | ||
图片预览




文档简介
第3章《简单的有机化合物》检测题
一、单选题(共13题)
1.石油化学工业是国民经济重要支柱之一,下列有关石油化工的叙述错误的是
A B C D
石油分馏是利用各组分沸点不同 石油裂化过程会发生碳碳键断裂 聚丙烯防护服材料易被KMnO4氧化 沥青可用于铺设马路
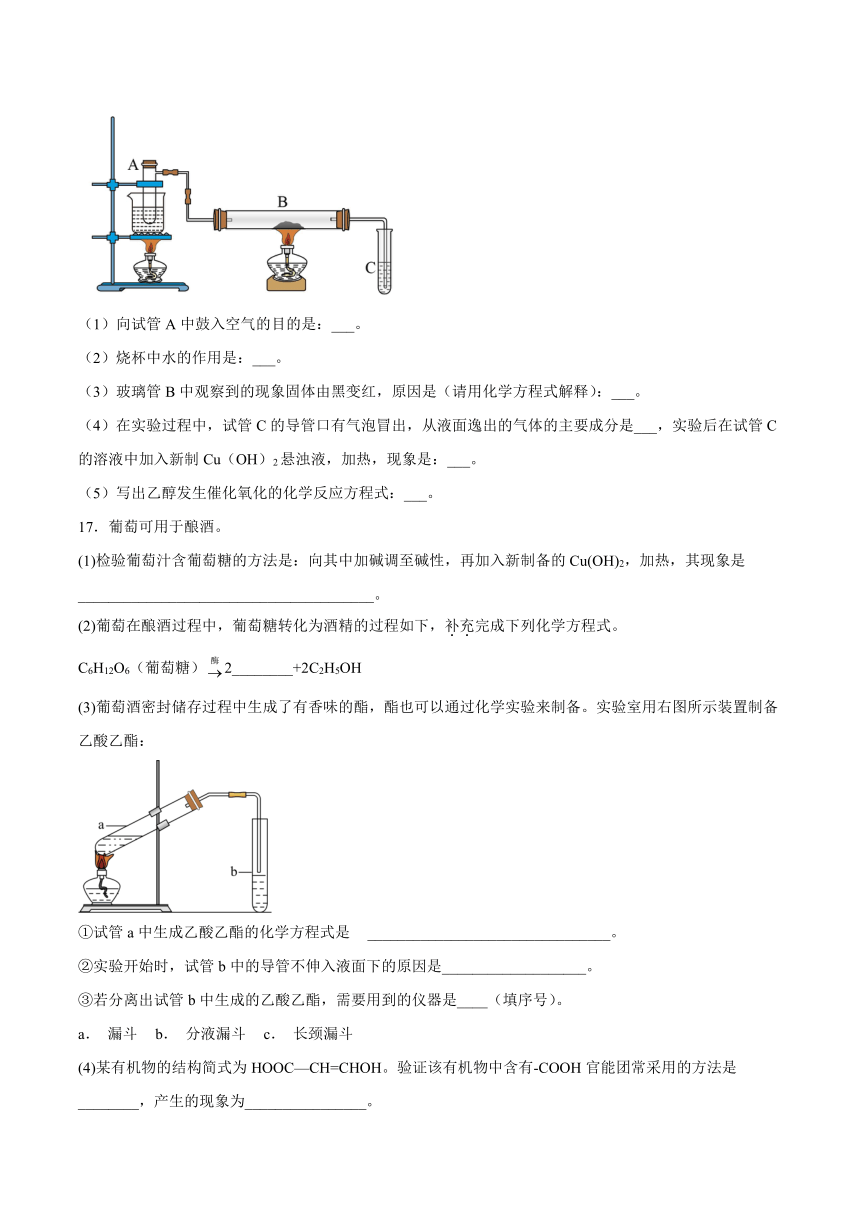
A.A B.B C.C D.D
2.下列反应中,属于加成反应的是
A.乙醇与钠反应生成乙醇钠 B.乙烯燃烧生成二氧化碳和水
C.乙烯与氢气反应生成乙烷 D.乙醇与乙酸反应生成乙酸乙酯
3.下列反应属于取代反应的是( )
①CH3CH=CH2+Br2CH3CHBrCH2Br
②CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O
③+HNO3+H2O
A.①② B.②③ C.①③ D.①②③
4.下列有关化学用语表示正确的是
A.二氧化碳的比例模型: B.氢氰酸的电子式:
C.H-的离子结构示意图为: D.醋酸的结构式:
5.下列过程可发生加成反应的是
A.光照条件下CH4与Cl2混合
B.乙烯通入溴的CCl4溶液中
C.苯与浓硫酸和浓硝酸混合加热
D.乙醇和冰醋酸与浓硫酸混合加热
6.下列说法正确的是
A.乙烷中混有少量乙烯,可通过溴的四氯化碳溶液除杂
B.石油的分馏、煤的气化和液化都是化学变化
C.煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
D.甲苯的一氯代物有4种同分异构体,它们的熔沸点各不相同
7.甲苯在一定条件下可以和氢气发生加成反应,生成W。下列说法不正确的是
A.甲苯与W均可发生氧化反应、取代反应
B.甲苯属于芳香族化合物,但W不属于芳香族化合物
C.W分子中一定共面的碳原子有7个
D.W的一氯代物有五种
8.下列说法不正确的是
A.C2H6和C3H8均不存在同分异构现象 B.金刚石和足球烯互为同素异形体
C.C2H4和C3H6互为同系物 D.乙醇和甲醚互为同分异构体
9.代表阿伏加德罗常数的数值,下列说法中正确的是
A.0.5mol苯中含有碳碳双键的数目为
B.1mol甲烷与氯气充分反应生成的分子数为
C.在标准状况下,11.2L己烷完全燃烧后,所生成的分子数为
D.常温常压下,28g乙烯与丙烯的混合气体中含有的碳原子数为
10.下列表示不正确的是
A.硅原子的结构示意图 B.丙烷的比例模型
C.乙烯的最简式 D.氯化钙的电子式
11.下列反应属于取代反应的是
① ②
③ ④
⑤
A.①② B.①④ C.①④⑤ D.①②④⑤
12.下列化学用语表示不正确的是
A.羟基的电子式: B.乙烷的球根模型:
C.氯原子的结构示意图: D.四氯化碳的电子式:
13.化学与生产、生活密切相关,下列叙述正确的是
A.高吸水性树脂都含有羟基、烷基等亲水基团
B.燃煤脱硫脱氮有利于实现碳中和
C.用于砂轮磨料的碳化硅属于共价晶体
D.5G技术中使用的光导纤维属于有机高分子材料
二、非选择题(共10题)
14.有机化合物的结构对其性质有着重要的影响。
①下列有机物易溶于水的是_____(填字母)。
a.乙烷 b.乙醇 c.乙酸乙酯
②下列有机物常温下呈气态的是_____(填字母)。
a.正丁烷 b.苯 c.溴乙烷
③分子式为C2H4O2的有机物中既能发生银镜反应又能发生水解反应的是_____(填字母)。
a.CH3COOH b.HOCH2CHO c.HCOOCH3
15.阅读下列科普短文,回答下列问题。
国家卫健委公布的《新型冠状病毒肺炎诊疗方案(试行)》中提到:在相对封闭环境中,长时间暴露于高浓度气溶胶情况下,新冠病毒存在经气溶胶传播的可能。穿医用防护服、佩戴医用N95型外科口罩都可起到防护作用,含有病毒的飞沫会被口罩中间层熔喷无纺布(主要材质是聚丙烯)吸附。消毒也是控制病毒传播的有效措施,《新型冠状病毒肺炎流行期间预防性消毒指引》建议:表面消毒可选择含氯消毒剂、75%酒精, 食饮具需要煮沸消毒15分钟以上。
(1)气溶胶中粒子的大小为___________。(填字母)
a.< l nm b.> 100 nm c.1 nm~100 nm
(2)医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯___________卤代烃。(填“属于”或“不属于”)
(3)N95型口罩的核心材料是聚丙烯,写出其结构简式:___________。
(4)75%酒精的有效成分是乙醇,乙醇的一种同分异构体的结构简式为___________。
(5)食饮具可通过煮沸消毒,病毒蛋白质在加热条件下发生了___________。
(6)环氧乙烷是一种低温灭菌剂,经典的生产方法是氯代乙醇法,包括两步反应:
i.CH2=CH2+Cl2+H2O→ClCH2CH2OH+HCl
ii.ClCH2CH2OH+HCl+Ca(OH)2→+CaCl2+2H2O
现代石油化工采用低温催化法:2CH2=CH2+O2 与氯代乙醇法相比,低温催化法的优点有___________、___________。
三、实验题
16.某课外活动小组如图所示进行了乙醇的催化氧化实验,试管A中盛有无水乙醇,B中装有Cu或CuO(用石棉绒作载体),C中装的是澄清石灰水。请回答下列问题:
(1)向试管A中鼓入空气的目的是:___。
(2)烧杯中水的作用是:___。
(3)玻璃管B中观察到的现象固体由黑变红,原因是(请用化学方程式解释):___。
(4)在实验过程中,试管C的导管口有气泡冒出,从液面逸出的气体的主要成分是___,实验后在试管C的溶液中加入新制Cu(OH)2悬浊液,加热,现象是:___。
(5)写出乙醇发生催化氧化的化学反应方程式:___。
17.葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式。
C6H12O6(葡萄糖)2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用右图所示装置制备乙酸乙酯:
①试管a中生成乙酸乙酯的化学方程式是 ________________________________。
②实验开始时,试管b中的导管不伸入液面下的原因是___________________。
③若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
(4)某有机物的结构简式为HOOC—CH=CHOH。验证该有机物中含有-COOH官能团常采用的方法是________,产生的现象为________________。
18.某课外活动小组利用如图所示装置探究甲烷与氯气的反应。根据题意回答下列问题:
(1)与发生反应的条件是__________;若用日光直射,可能会引起__________。
(2)实验中可观察到的实验现象有:试管内壁出现油状液滴,饱和食盐水中有少量固体析出,_____,__________,__________。
(3)实验中出现油状液滴的物质为____________________(填化学式)。
(4)用饱和食盐水而不用水的原因是______________________________。
四、计算题
19.将标准状况下22.4L某烃完全燃烧,生成54gH2O和44.8LCO2(标况下)
(1)通过计算求出该烃的分子式
(2)写出该烃的结构式。
20.称取某有机物(含C、H、O元素)4.6 g样品,经充分燃烧后,CO2质量8.8 g,H2O质量5.4 g。
(1)则该有机物中C、H、O个数比为_______。
(2)若该有机物的相对分子质量为46,且能与金属钠反应放出氢气,请写出该有机物的结构简式_______。
21.现有原子序数依次增大的短周期主族元素P、Q、X、Y、Z、W。P元素的一种核素无中子,元素Q的最外层电子数是电子层数的2倍,Y原子是其所在周期中半径最大的原子,元素Z的最外层电子数是K层电子数的3倍,X能与Y可以形成一种淡黄色固体M。
(1)写出元素Q在元素周期表中的位置_______。
(2)写出元素P与元素X形成的18e-分子的电子式_______。
(3)研究发现M具有强氧化性,Z的一种氧化物具有较强的还原性,可相互反应。写出该反应的化学方程式:_______。
(4)为了证明非金属性W>Z,某小组设计如图装置探究元素非金属性的变化规律。C中装有Y2Z溶液,B中装有YWX3固体。A中试剂为_______(填化学式)浓溶液,C中发生反应的离子方程式为_______。
(5)元素P与元素Q形成的一种物质Q2P4使溴水褪色,写出褪色过程中发生的化学反应方程式:_______。
22.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,按要求回答问题。
族周期 IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
(1)元素①~⑨中,金属性最强的元素是_______(填元素符号)。
(2)元素③的原子结构示意图是_______。
(3)元素①和②可以形成多种化合物,其中是天然气主要成分的化合物的电子式是_______,比该化合物多一个碳原子的同系物的结构简式是_______。
(4)元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序是_______(填化学式)。
(5)下列可以判断元素④和⑨非金属性强弱的是_______(填序号)。
A.单质的熔点④比⑨低
B.单质与氢气反应④比⑨剧烈
C.气态氢化物稳定性④比⑨强
D.单质的密度④比⑨小
(6)元素⑧的氢化物水溶液中通入少量元素⑨的单质,发生了置换反应,有淡黄色沉淀生成,该反应的化学方程式是_______。
23.下表是元素周期表的前三周期:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
一 A
二 B C D E F
三 G H I J
回答下列问题:
⑴写出下列元素的元素的符号:F______________、J_____________。
⑵G元素与E元素形成的化合物的化学式是____________、____________,它们都是_________________(填“离子”或“共价”)化合物。
⑶表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,属于两性氢氧化物的是_______________(用化合物的化学式表示)。
⑷只含有A、C两种元素的化合物称为_____________,这些化合物中:
①相对分子质量最小的是________________,该化合物的分子空间构型是_______________;
②分子中含有双键,但原子数最少的是______________,它与HCl反应的化学方程式为______________________________;
⑸将H单质与C的一种单质(导体)按如下图装置连接,该装置称为_____________。其中C极为______________,(填正负极)并写出该电极反应式为:____________________。请在下图中标出电子流动方向。______________
参考答案:
1.C 2.C 3.B 4.C 5.B 6.D 7.C 8.C 9.D 10.B 11.C 12.D 13.C
14. b a c
15. c 属于 CH3OCH3 变性 原子利用率100% (或原子经济性高),不产生CaCl2等工业废渣 对设备腐蚀性小、低温催化能耗低
16. 使空气通过乙醇,形成乙醇和空气的混合气体 使试管受热均匀,便于控制温度 CuO+C2H5OHCH3CHO+H2O+Cu N2 有红色沉淀产生 2CH2CH2OH+O22CH3CHO+2H2O
17. 产生红色沉淀 CO2 CH3COOH+C2H5OHCH3COOC2H5+H2O 防止倒吸 b 加入碳酸氢钠溶液 放出气体
18. 光照 爆炸 试管内黄绿色变浅 试管内液面上升 试管内有少量白雾产生 、、 降低在水中的溶解度,抑制和水的反应
19.(1)C2H6
(2)
20. 2:6:1 CH3CH2OH
21.(1)第二周期第IVA族
(2)
(3)Na2O2+SO2=Na2SO4
(4) HCl Cl2+S2-=2C1-+S↓
(5)CH2=CH2+Br2→CH2BrCH2Br
22.(1)Na
(2)
(3) CH3CH3
(4)HClO4>H2SO4>H2SiO3
(5)BC
(6)H2S+Cl2=2HCl+S↓
23. F Ar Na2O Na2O2 离子 HClO4 Al(OH)3 烃 CH4 正四面体 CH2=CH2 CH2=CH2+HClCH3CH2Cl 原电池 正极 2H++2e- =H2↑
一、单选题(共13题)
1.石油化学工业是国民经济重要支柱之一,下列有关石油化工的叙述错误的是
A B C D
石油分馏是利用各组分沸点不同 石油裂化过程会发生碳碳键断裂 聚丙烯防护服材料易被KMnO4氧化 沥青可用于铺设马路
A.A B.B C.C D.D
2.下列反应中,属于加成反应的是
A.乙醇与钠反应生成乙醇钠 B.乙烯燃烧生成二氧化碳和水
C.乙烯与氢气反应生成乙烷 D.乙醇与乙酸反应生成乙酸乙酯
3.下列反应属于取代反应的是( )
①CH3CH=CH2+Br2CH3CHBrCH2Br
②CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O
③+HNO3+H2O
A.①② B.②③ C.①③ D.①②③
4.下列有关化学用语表示正确的是
A.二氧化碳的比例模型: B.氢氰酸的电子式:
C.H-的离子结构示意图为: D.醋酸的结构式:
5.下列过程可发生加成反应的是
A.光照条件下CH4与Cl2混合
B.乙烯通入溴的CCl4溶液中
C.苯与浓硫酸和浓硝酸混合加热
D.乙醇和冰醋酸与浓硫酸混合加热
6.下列说法正确的是
A.乙烷中混有少量乙烯,可通过溴的四氯化碳溶液除杂
B.石油的分馏、煤的气化和液化都是化学变化
C.煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
D.甲苯的一氯代物有4种同分异构体,它们的熔沸点各不相同
7.甲苯在一定条件下可以和氢气发生加成反应,生成W。下列说法不正确的是
A.甲苯与W均可发生氧化反应、取代反应
B.甲苯属于芳香族化合物,但W不属于芳香族化合物
C.W分子中一定共面的碳原子有7个
D.W的一氯代物有五种
8.下列说法不正确的是
A.C2H6和C3H8均不存在同分异构现象 B.金刚石和足球烯互为同素异形体
C.C2H4和C3H6互为同系物 D.乙醇和甲醚互为同分异构体
9.代表阿伏加德罗常数的数值,下列说法中正确的是
A.0.5mol苯中含有碳碳双键的数目为
B.1mol甲烷与氯气充分反应生成的分子数为
C.在标准状况下,11.2L己烷完全燃烧后,所生成的分子数为
D.常温常压下,28g乙烯与丙烯的混合气体中含有的碳原子数为
10.下列表示不正确的是
A.硅原子的结构示意图 B.丙烷的比例模型
C.乙烯的最简式 D.氯化钙的电子式
11.下列反应属于取代反应的是
① ②
③ ④
⑤
A.①② B.①④ C.①④⑤ D.①②④⑤
12.下列化学用语表示不正确的是
A.羟基的电子式: B.乙烷的球根模型:
C.氯原子的结构示意图: D.四氯化碳的电子式:
13.化学与生产、生活密切相关,下列叙述正确的是
A.高吸水性树脂都含有羟基、烷基等亲水基团
B.燃煤脱硫脱氮有利于实现碳中和
C.用于砂轮磨料的碳化硅属于共价晶体
D.5G技术中使用的光导纤维属于有机高分子材料
二、非选择题(共10题)
14.有机化合物的结构对其性质有着重要的影响。
①下列有机物易溶于水的是_____(填字母)。
a.乙烷 b.乙醇 c.乙酸乙酯
②下列有机物常温下呈气态的是_____(填字母)。
a.正丁烷 b.苯 c.溴乙烷
③分子式为C2H4O2的有机物中既能发生银镜反应又能发生水解反应的是_____(填字母)。
a.CH3COOH b.HOCH2CHO c.HCOOCH3
15.阅读下列科普短文,回答下列问题。
国家卫健委公布的《新型冠状病毒肺炎诊疗方案(试行)》中提到:在相对封闭环境中,长时间暴露于高浓度气溶胶情况下,新冠病毒存在经气溶胶传播的可能。穿医用防护服、佩戴医用N95型外科口罩都可起到防护作用,含有病毒的飞沫会被口罩中间层熔喷无纺布(主要材质是聚丙烯)吸附。消毒也是控制病毒传播的有效措施,《新型冠状病毒肺炎流行期间预防性消毒指引》建议:表面消毒可选择含氯消毒剂、75%酒精, 食饮具需要煮沸消毒15分钟以上。
(1)气溶胶中粒子的大小为___________。(填字母)
a.< l nm b.> 100 nm c.1 nm~100 nm
(2)医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯___________卤代烃。(填“属于”或“不属于”)
(3)N95型口罩的核心材料是聚丙烯,写出其结构简式:___________。
(4)75%酒精的有效成分是乙醇,乙醇的一种同分异构体的结构简式为___________。
(5)食饮具可通过煮沸消毒,病毒蛋白质在加热条件下发生了___________。
(6)环氧乙烷是一种低温灭菌剂,经典的生产方法是氯代乙醇法,包括两步反应:
i.CH2=CH2+Cl2+H2O→ClCH2CH2OH+HCl
ii.ClCH2CH2OH+HCl+Ca(OH)2→+CaCl2+2H2O
现代石油化工采用低温催化法:2CH2=CH2+O2 与氯代乙醇法相比,低温催化法的优点有___________、___________。
三、实验题
16.某课外活动小组如图所示进行了乙醇的催化氧化实验,试管A中盛有无水乙醇,B中装有Cu或CuO(用石棉绒作载体),C中装的是澄清石灰水。请回答下列问题:
(1)向试管A中鼓入空气的目的是:___。
(2)烧杯中水的作用是:___。
(3)玻璃管B中观察到的现象固体由黑变红,原因是(请用化学方程式解释):___。
(4)在实验过程中,试管C的导管口有气泡冒出,从液面逸出的气体的主要成分是___,实验后在试管C的溶液中加入新制Cu(OH)2悬浊液,加热,现象是:___。
(5)写出乙醇发生催化氧化的化学反应方程式:___。
17.葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式。
C6H12O6(葡萄糖)2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用右图所示装置制备乙酸乙酯:
①试管a中生成乙酸乙酯的化学方程式是 ________________________________。
②实验开始时,试管b中的导管不伸入液面下的原因是___________________。
③若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
(4)某有机物的结构简式为HOOC—CH=CHOH。验证该有机物中含有-COOH官能团常采用的方法是________,产生的现象为________________。
18.某课外活动小组利用如图所示装置探究甲烷与氯气的反应。根据题意回答下列问题:
(1)与发生反应的条件是__________;若用日光直射,可能会引起__________。
(2)实验中可观察到的实验现象有:试管内壁出现油状液滴,饱和食盐水中有少量固体析出,_____,__________,__________。
(3)实验中出现油状液滴的物质为____________________(填化学式)。
(4)用饱和食盐水而不用水的原因是______________________________。
四、计算题
19.将标准状况下22.4L某烃完全燃烧,生成54gH2O和44.8LCO2(标况下)
(1)通过计算求出该烃的分子式
(2)写出该烃的结构式。
20.称取某有机物(含C、H、O元素)4.6 g样品,经充分燃烧后,CO2质量8.8 g,H2O质量5.4 g。
(1)则该有机物中C、H、O个数比为_______。
(2)若该有机物的相对分子质量为46,且能与金属钠反应放出氢气,请写出该有机物的结构简式_______。
21.现有原子序数依次增大的短周期主族元素P、Q、X、Y、Z、W。P元素的一种核素无中子,元素Q的最外层电子数是电子层数的2倍,Y原子是其所在周期中半径最大的原子,元素Z的最外层电子数是K层电子数的3倍,X能与Y可以形成一种淡黄色固体M。
(1)写出元素Q在元素周期表中的位置_______。
(2)写出元素P与元素X形成的18e-分子的电子式_______。
(3)研究发现M具有强氧化性,Z的一种氧化物具有较强的还原性,可相互反应。写出该反应的化学方程式:_______。
(4)为了证明非金属性W>Z,某小组设计如图装置探究元素非金属性的变化规律。C中装有Y2Z溶液,B中装有YWX3固体。A中试剂为_______(填化学式)浓溶液,C中发生反应的离子方程式为_______。
(5)元素P与元素Q形成的一种物质Q2P4使溴水褪色,写出褪色过程中发生的化学反应方程式:_______。
22.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,按要求回答问题。
族周期 IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
(1)元素①~⑨中,金属性最强的元素是_______(填元素符号)。
(2)元素③的原子结构示意图是_______。
(3)元素①和②可以形成多种化合物,其中是天然气主要成分的化合物的电子式是_______,比该化合物多一个碳原子的同系物的结构简式是_______。
(4)元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序是_______(填化学式)。
(5)下列可以判断元素④和⑨非金属性强弱的是_______(填序号)。
A.单质的熔点④比⑨低
B.单质与氢气反应④比⑨剧烈
C.气态氢化物稳定性④比⑨强
D.单质的密度④比⑨小
(6)元素⑧的氢化物水溶液中通入少量元素⑨的单质,发生了置换反应,有淡黄色沉淀生成,该反应的化学方程式是_______。
23.下表是元素周期表的前三周期:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
一 A
二 B C D E F
三 G H I J
回答下列问题:
⑴写出下列元素的元素的符号:F______________、J_____________。
⑵G元素与E元素形成的化合物的化学式是____________、____________,它们都是_________________(填“离子”或“共价”)化合物。
⑶表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,属于两性氢氧化物的是_______________(用化合物的化学式表示)。
⑷只含有A、C两种元素的化合物称为_____________,这些化合物中:
①相对分子质量最小的是________________,该化合物的分子空间构型是_______________;
②分子中含有双键,但原子数最少的是______________,它与HCl反应的化学方程式为______________________________;
⑸将H单质与C的一种单质(导体)按如下图装置连接,该装置称为_____________。其中C极为______________,(填正负极)并写出该电极反应式为:____________________。请在下图中标出电子流动方向。______________
参考答案:
1.C 2.C 3.B 4.C 5.B 6.D 7.C 8.C 9.D 10.B 11.C 12.D 13.C
14. b a c
15. c 属于 CH3OCH3 变性 原子利用率100% (或原子经济性高),不产生CaCl2等工业废渣 对设备腐蚀性小、低温催化能耗低
16. 使空气通过乙醇,形成乙醇和空气的混合气体 使试管受热均匀,便于控制温度 CuO+C2H5OHCH3CHO+H2O+Cu N2 有红色沉淀产生 2CH2CH2OH+O22CH3CHO+2H2O
17. 产生红色沉淀 CO2 CH3COOH+C2H5OHCH3COOC2H5+H2O 防止倒吸 b 加入碳酸氢钠溶液 放出气体
18. 光照 爆炸 试管内黄绿色变浅 试管内液面上升 试管内有少量白雾产生 、、 降低在水中的溶解度,抑制和水的反应
19.(1)C2H6
(2)
20. 2:6:1 CH3CH2OH
21.(1)第二周期第IVA族
(2)
(3)Na2O2+SO2=Na2SO4
(4) HCl Cl2+S2-=2C1-+S↓
(5)CH2=CH2+Br2→CH2BrCH2Br
22.(1)Na
(2)
(3) CH3CH3
(4)HClO4>H2SO4>H2SiO3
(5)BC
(6)H2S+Cl2=2HCl+S↓
23. F Ar Na2O Na2O2 离子 HClO4 Al(OH)3 烃 CH4 正四面体 CH2=CH2 CH2=CH2+HClCH3CH2Cl 原电池 正极 2H++2e- =H2↑
