选修4 化学反应原理----绪论 课件
文档属性
| 名称 | 选修4 化学反应原理----绪论 课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 971.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-09-15 00:00:00 | ||
图片预览











文档简介
(共35张PPT)
化学反应与能量
化学反应速率和化学平衡
水溶液中的离子平衡
电化学基础
引子
与必修的衔接
本模块中的一些知识在必修模块中已不同程度涉及到,因此本模块中的相关知识的选择在避免与之简单重复的同时,在必修模块的基础上作拓宽和加深,以满足对化学学习有兴趣的学生的求知欲望。如课程标准中规定的“了解化学反应中能量转化的原因”“了解酸碱电离理论”在本体系中就不再分设专节;而“化学电源”“化学反应速率与化学平衡”等内容则侧重介绍必修内容之外的原理、理论知识。
交叉内容的处理
内容 角度和重点 知识
范围
反应速率 由定性描述到定量表达,实验测定 深化
原电池 原电池由无盐桥到有盐桥(铜锌) 深化
拓展
教材理论水平定位
从本课程的选用对象和课程内容的特征出发,结合教育教学发展的实际,本教材的理论水平应定位在稍高于必修水平,概括地说就是:对于必修涉及到的、已有一定基础的内容,适当深入、宽泛些,如“化学电源”“化学平衡”及“溶液中的离子平衡”;对于必修未涉及的、较生疏和抽象的内容,则尽量简化,并从写法上使其通俗易懂,如“焓”和“熵”。
绪 言
1、化学研究的核心问题是:
2、化学中最具有创造性的工作是:
3、如何实现这个过程?
化学反应的原理和过程
设计和创造新的分子造福人类
利用已发现的原理、理论来进行设计并实现这个过程
4、所以我们必须对 清楚才能做到。
化学反应的原理的理解
必须知道:化学反应是怎样发生的,经历的过程,遵循的规律,如何有效去控制生产和化学污染……,只有解决好这些,才能使化学研究和化学工业生产获得最高的效益!
这就是学习化学反应原理的目的
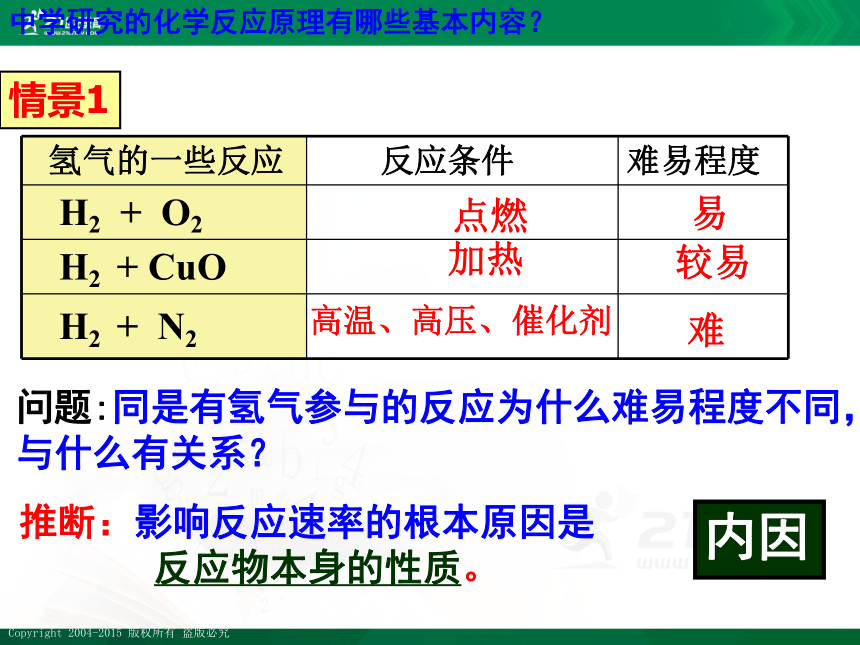
情景1
氢气的一些反应 反应条件 难易程度
H2 + O2
H2 + CuO
H2 + N2
问题:同是有氢气参与的反应为什么难易程度不同,与什么有关系?
推断:影响反应速率的根本原因是
反应物本身的性质。
内因
点燃
加热
高温、高压、催化剂
较易
易
难
中学研究的化学反应原理有哪些基本内容?
情景2
将H2 、O2混合,在室温条件下可以稳定存在数千年而不反应,但点燃后却立刻发生剧烈的爆鸣,转化成水。而且只要配比相当,可以完全转化成生成物。这说明了什么?
推断:外界条件能够改变化学反应的速率。
结论:内部因素已经具备了,不同的外界条件能够不同程度的改变化学反应的速率。
情景3
H2和N2即使在高温、高压、催化剂的条件下反应也不能完全转化为生成物(氨)。这又说明了什么?
问题:能发生反应的物质,为什么反应不能进行到底?
推断:有些反应是有一定限度的(化学平衡)。
情景4、情景5 、等等……
那么
如何来研究一个反应,研究化学反应原理的基本方法和思路是怎样?
认识几个重要概念:
1、有效碰撞
2、活化分子
3、活化能
4、催化剂
概念模型法
一、简化后的有效碰撞模型
气体分子之间通常存在着比气体分子本身的体积要大得多的空间,忽略了分子与分子之间的相互作用力,分子之间不存在牵制关系,因此,在常温常压下,可以认为气体分子的运动是自由的,因而,它们之间的碰撞可以视为是随机的。
1、设想
一、简化后的有效碰撞模型
在一个洁净的容器中,使H2和O2按体积比2:1的比例混合,气体分子因自由运动而不断相互碰撞(互相接触)——这是发生化学反应的必要条件。
2、模型的基本构架
假设与事实:研究结果表明,从分子的热运动看,分子发生碰撞的机会很多。如在常温常压下每个H2、O2自身或它们之间的碰撞频率为2.355×1010次/s。假如每次碰撞都能发生化学反应,则化学变化瞬间即可完成,但事实并非如此。
结论:并不是每次分子间的碰撞都会引起化学反应,只有其中部分的气体分子碰撞是有效的,即有效碰撞——这是发生化学反应的充分条件。
3、什么是有效碰撞?
有效碰撞—— 能够导致分子中化学键断裂,引起化学反应的碰撞。
分子间的碰撞是发生化学反应的必要条件
有效碰撞是发生化学反应的充分条件
推论:某一个化学反应的速率大小与单位时间内分子有效碰撞的次数有关
问题:为什么有的碰撞可以发生反应(有效碰撞),而有的不能发生反应(无效碰撞)
推断:一定与分子本身的性质和能量有关。
NO2和CO的反应过程
二 、活 化 分 子
1、什么是活化分子?
具较高能量,有可能发生有效碰撞的分子
①吸收外界能量 (如加热、光照等)
②分子间碰撞时,能量交换不均衡而出现较高能量的分子。
活化分子具有的高能量从何来
结论:
能发生有效碰撞的分子一定是活化分子,但活化分子的碰撞不一定是有效碰撞,还与碰撞的角度有关。
推论:
有效碰撞次数的多少与单位体积内反应物中活化分子数的多少有关。
单位体积中的活化分子数的多少又与什么有关?
问题:
2、活 化 能
活化分子平均能量高出反应物分子平均能量的部分。
问题4:活化能为“0”的例子是怎么回事?
问题3:活化能的大小决定了化学反应的难易,它会影响反应热的大小吗?
问题1:活化能的作用是什么?
问题2:提供“活化能”的途径是什么?
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
该反应是吸热反应还是放热反应
活化能与反应热有关吗
反应热
NO2和CO反应过程中能量的变化
解释:
活化能越小,一般分子成为活化分子越容易,则反应条件越简单。
活化能越小,则单位体积中活化分子数越多,单位时间内的有效碰撞越多,反应速率越快。
活化能高,活化分子的百分数低,反应难; 活化能低,活化分子的百分数高,反应易。
活化能的大小虽然意味着一般分子成为活化分子的难易,但是却对这个化学反应前后的能量变化并不产生任何影响。
活化能是决定化学反应难易的关键
活化能大小是由反应物分子的性质决定的。
内因
碰撞 有效碰撞 活化分子 活化能
就下列的每个词说句话,试试看:
常温常压下,每个氢分子和氧分子自身或它们之间每秒平均碰撞2.355×1010次,如果每一次碰撞都能发生反应,那么整个容器内的氢气和氧气将在瞬间变成水。
能发生化学反应的碰撞叫有效碰撞。
碰撞是发生化学反应的必要条件,有效碰撞才是发生化学反应的充分条件。
具有足够的能量能发生有效碰撞的分子叫活化分子。
活化分子间要发生有效碰撞,还要有合适的取向。
活化分子所多出的那部分能量叫活化能。
在相同条件下,反应的活化能越大,则该反应的速率越小。
一个反应要发生一般经历哪些过程?
普通
分子
活化能
活化
分子
合理取向
的碰撞
有效
碰撞
新物质
能量
在化学反应中能改变其他物质的反应速率,而本身质量和化学性质在反应前后不变的物质。
三、催 化 剂(触媒)
怎样改变反应的活化能为来加快反应的速率?是何措施?
能量
反应过程
生成物
反应物
反应热
E1
E2
活化分子
加了催化剂
没加催化剂
催化剂与反应物结合为中间产物,降低了反应的活化能,使活化分子百分数大大增加,反应速率大大加快。反应结束,中间产物消失,催化剂复原。
催化原理:中间产物理论
催化剂有正催化剂和负催化剂之分。
学习化学的方法
1.加强预习,做有准备的学习;
2.专心上课,做有时效的学习;
3.及时练习,做有基础的学习;
4.会提问题,做有反思的学习;
5.乐于动手,做有生活的学习。
解 释 问 题
1、为什么可燃物有氧气存在时,还必
须达到着火点才能燃烧?
2、催化剂在我们提高生产效率和经济效益中起关键作用,它主要作用是提高化学反应速率,试想一下为什么
催化剂能提高反应速率?
通过绪言的学习,初步了解“有效碰撞”、“活化分子与活化能”的概念模型,认识催化剂对于化学科学研究和化工生产的巨大作用,为其后的学习打下基础。
还知道: 某一化学反应的速率大小与
有关;而有效碰撞次数的多少与
有关;活化分子的多少又与
有关。活化能的大小是由该反应
决定的,而反应物分子的性质又与
密切相关。
单位体积活化分子百分数
的反应物分子性质
该反应活化能的大小
分子的内部结构
内分子的有效碰撞次数
单位时间
练习
1.实验室制氢气时,若向稀硫酸中加几滴硫酸铜溶液,则产生氢气的速率加快,该反应中硫酸铜 催化剂(填:是、不是)。
2.单独加热氯酸钾,产生氧气的速率小,而将少量高锰酸钾和氯酸钾混合共热制氧气,产生氧气的速率明显加快,该实验中高锰酸钾 催化剂(填:是、不是)。
不是
不是
3. 是发生化学反应的必要条件, 是发生化学反应的充分条件。
4.活化分子指的是能够 。
5.活化能的大小意味着一般分子成为活化分子的 ,活化能的大小不影响 ,活化能的作用在于 使 。
6.常用的提供活化能的方法有
等。
碰撞
有效碰撞
发生有效碰撞的分子
难易
反应前后的能量变化
反应物活化
加热、光照、超声波、核辐射 、 外加碰场
7.什么是有效碰撞?
8.某一化学反应的速率大小与单位时间
内 有关 。
9.什么是活化分子?
引起分子间的化学反应的碰撞是有效碰撞
有效碰撞的次数
具有较高能量,能够发生有效碰撞的分子是活化分子,发生有效碰撞的分子一定是活化分子,但活化分子的碰撞不一定是有效碰撞。有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关
随堂练习
10、下列说法错误的是
A.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
B.发生有效碰撞的分子一定是活化分子
C.活化分子间的碰撞一定是有效碰撞
D.活化分子间每次碰撞都发生化学反应
E.能发生有效碰撞的分子必须具有相当高的能量
F.活化能指活化分子多出反应物分子平均能量的那部分能量
G.使用催化剂能改变分子的活化能
H.催化剂能使不起反应的物质间发生反应
√
√
√
化学反应与能量
化学反应速率和化学平衡
水溶液中的离子平衡
电化学基础
引子
与必修的衔接
本模块中的一些知识在必修模块中已不同程度涉及到,因此本模块中的相关知识的选择在避免与之简单重复的同时,在必修模块的基础上作拓宽和加深,以满足对化学学习有兴趣的学生的求知欲望。如课程标准中规定的“了解化学反应中能量转化的原因”“了解酸碱电离理论”在本体系中就不再分设专节;而“化学电源”“化学反应速率与化学平衡”等内容则侧重介绍必修内容之外的原理、理论知识。
交叉内容的处理
内容 角度和重点 知识
范围
反应速率 由定性描述到定量表达,实验测定 深化
原电池 原电池由无盐桥到有盐桥(铜锌) 深化
拓展
教材理论水平定位
从本课程的选用对象和课程内容的特征出发,结合教育教学发展的实际,本教材的理论水平应定位在稍高于必修水平,概括地说就是:对于必修涉及到的、已有一定基础的内容,适当深入、宽泛些,如“化学电源”“化学平衡”及“溶液中的离子平衡”;对于必修未涉及的、较生疏和抽象的内容,则尽量简化,并从写法上使其通俗易懂,如“焓”和“熵”。
绪 言
1、化学研究的核心问题是:
2、化学中最具有创造性的工作是:
3、如何实现这个过程?
化学反应的原理和过程
设计和创造新的分子造福人类
利用已发现的原理、理论来进行设计并实现这个过程
4、所以我们必须对 清楚才能做到。
化学反应的原理的理解
必须知道:化学反应是怎样发生的,经历的过程,遵循的规律,如何有效去控制生产和化学污染……,只有解决好这些,才能使化学研究和化学工业生产获得最高的效益!
这就是学习化学反应原理的目的
情景1
氢气的一些反应 反应条件 难易程度
H2 + O2
H2 + CuO
H2 + N2
问题:同是有氢气参与的反应为什么难易程度不同,与什么有关系?
推断:影响反应速率的根本原因是
反应物本身的性质。
内因
点燃
加热
高温、高压、催化剂
较易
易
难
中学研究的化学反应原理有哪些基本内容?
情景2
将H2 、O2混合,在室温条件下可以稳定存在数千年而不反应,但点燃后却立刻发生剧烈的爆鸣,转化成水。而且只要配比相当,可以完全转化成生成物。这说明了什么?
推断:外界条件能够改变化学反应的速率。
结论:内部因素已经具备了,不同的外界条件能够不同程度的改变化学反应的速率。
情景3
H2和N2即使在高温、高压、催化剂的条件下反应也不能完全转化为生成物(氨)。这又说明了什么?
问题:能发生反应的物质,为什么反应不能进行到底?
推断:有些反应是有一定限度的(化学平衡)。
情景4、情景5 、等等……
那么
如何来研究一个反应,研究化学反应原理的基本方法和思路是怎样?
认识几个重要概念:
1、有效碰撞
2、活化分子
3、活化能
4、催化剂
概念模型法
一、简化后的有效碰撞模型
气体分子之间通常存在着比气体分子本身的体积要大得多的空间,忽略了分子与分子之间的相互作用力,分子之间不存在牵制关系,因此,在常温常压下,可以认为气体分子的运动是自由的,因而,它们之间的碰撞可以视为是随机的。
1、设想
一、简化后的有效碰撞模型
在一个洁净的容器中,使H2和O2按体积比2:1的比例混合,气体分子因自由运动而不断相互碰撞(互相接触)——这是发生化学反应的必要条件。
2、模型的基本构架
假设与事实:研究结果表明,从分子的热运动看,分子发生碰撞的机会很多。如在常温常压下每个H2、O2自身或它们之间的碰撞频率为2.355×1010次/s。假如每次碰撞都能发生化学反应,则化学变化瞬间即可完成,但事实并非如此。
结论:并不是每次分子间的碰撞都会引起化学反应,只有其中部分的气体分子碰撞是有效的,即有效碰撞——这是发生化学反应的充分条件。
3、什么是有效碰撞?
有效碰撞—— 能够导致分子中化学键断裂,引起化学反应的碰撞。
分子间的碰撞是发生化学反应的必要条件
有效碰撞是发生化学反应的充分条件
推论:某一个化学反应的速率大小与单位时间内分子有效碰撞的次数有关
问题:为什么有的碰撞可以发生反应(有效碰撞),而有的不能发生反应(无效碰撞)
推断:一定与分子本身的性质和能量有关。
NO2和CO的反应过程
二 、活 化 分 子
1、什么是活化分子?
具较高能量,有可能发生有效碰撞的分子
①吸收外界能量 (如加热、光照等)
②分子间碰撞时,能量交换不均衡而出现较高能量的分子。
活化分子具有的高能量从何来
结论:
能发生有效碰撞的分子一定是活化分子,但活化分子的碰撞不一定是有效碰撞,还与碰撞的角度有关。
推论:
有效碰撞次数的多少与单位体积内反应物中活化分子数的多少有关。
单位体积中的活化分子数的多少又与什么有关?
问题:
2、活 化 能
活化分子平均能量高出反应物分子平均能量的部分。
问题4:活化能为“0”的例子是怎么回事?
问题3:活化能的大小决定了化学反应的难易,它会影响反应热的大小吗?
问题1:活化能的作用是什么?
问题2:提供“活化能”的途径是什么?
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
该反应是吸热反应还是放热反应
活化能与反应热有关吗
反应热
NO2和CO反应过程中能量的变化
解释:
活化能越小,一般分子成为活化分子越容易,则反应条件越简单。
活化能越小,则单位体积中活化分子数越多,单位时间内的有效碰撞越多,反应速率越快。
活化能高,活化分子的百分数低,反应难; 活化能低,活化分子的百分数高,反应易。
活化能的大小虽然意味着一般分子成为活化分子的难易,但是却对这个化学反应前后的能量变化并不产生任何影响。
活化能是决定化学反应难易的关键
活化能大小是由反应物分子的性质决定的。
内因
碰撞 有效碰撞 活化分子 活化能
就下列的每个词说句话,试试看:
常温常压下,每个氢分子和氧分子自身或它们之间每秒平均碰撞2.355×1010次,如果每一次碰撞都能发生反应,那么整个容器内的氢气和氧气将在瞬间变成水。
能发生化学反应的碰撞叫有效碰撞。
碰撞是发生化学反应的必要条件,有效碰撞才是发生化学反应的充分条件。
具有足够的能量能发生有效碰撞的分子叫活化分子。
活化分子间要发生有效碰撞,还要有合适的取向。
活化分子所多出的那部分能量叫活化能。
在相同条件下,反应的活化能越大,则该反应的速率越小。
一个反应要发生一般经历哪些过程?
普通
分子
活化能
活化
分子
合理取向
的碰撞
有效
碰撞
新物质
能量
在化学反应中能改变其他物质的反应速率,而本身质量和化学性质在反应前后不变的物质。
三、催 化 剂(触媒)
怎样改变反应的活化能为来加快反应的速率?是何措施?
能量
反应过程
生成物
反应物
反应热
E1
E2
活化分子
加了催化剂
没加催化剂
催化剂与反应物结合为中间产物,降低了反应的活化能,使活化分子百分数大大增加,反应速率大大加快。反应结束,中间产物消失,催化剂复原。
催化原理:中间产物理论
催化剂有正催化剂和负催化剂之分。
学习化学的方法
1.加强预习,做有准备的学习;
2.专心上课,做有时效的学习;
3.及时练习,做有基础的学习;
4.会提问题,做有反思的学习;
5.乐于动手,做有生活的学习。
解 释 问 题
1、为什么可燃物有氧气存在时,还必
须达到着火点才能燃烧?
2、催化剂在我们提高生产效率和经济效益中起关键作用,它主要作用是提高化学反应速率,试想一下为什么
催化剂能提高反应速率?
通过绪言的学习,初步了解“有效碰撞”、“活化分子与活化能”的概念模型,认识催化剂对于化学科学研究和化工生产的巨大作用,为其后的学习打下基础。
还知道: 某一化学反应的速率大小与
有关;而有效碰撞次数的多少与
有关;活化分子的多少又与
有关。活化能的大小是由该反应
决定的,而反应物分子的性质又与
密切相关。
单位体积活化分子百分数
的反应物分子性质
该反应活化能的大小
分子的内部结构
内分子的有效碰撞次数
单位时间
练习
1.实验室制氢气时,若向稀硫酸中加几滴硫酸铜溶液,则产生氢气的速率加快,该反应中硫酸铜 催化剂(填:是、不是)。
2.单独加热氯酸钾,产生氧气的速率小,而将少量高锰酸钾和氯酸钾混合共热制氧气,产生氧气的速率明显加快,该实验中高锰酸钾 催化剂(填:是、不是)。
不是
不是
3. 是发生化学反应的必要条件, 是发生化学反应的充分条件。
4.活化分子指的是能够 。
5.活化能的大小意味着一般分子成为活化分子的 ,活化能的大小不影响 ,活化能的作用在于 使 。
6.常用的提供活化能的方法有
等。
碰撞
有效碰撞
发生有效碰撞的分子
难易
反应前后的能量变化
反应物活化
加热、光照、超声波、核辐射 、 外加碰场
7.什么是有效碰撞?
8.某一化学反应的速率大小与单位时间
内 有关 。
9.什么是活化分子?
引起分子间的化学反应的碰撞是有效碰撞
有效碰撞的次数
具有较高能量,能够发生有效碰撞的分子是活化分子,发生有效碰撞的分子一定是活化分子,但活化分子的碰撞不一定是有效碰撞。有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关
随堂练习
10、下列说法错误的是
A.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
B.发生有效碰撞的分子一定是活化分子
C.活化分子间的碰撞一定是有效碰撞
D.活化分子间每次碰撞都发生化学反应
E.能发生有效碰撞的分子必须具有相当高的能量
F.活化能指活化分子多出反应物分子平均能量的那部分能量
G.使用催化剂能改变分子的活化能
H.催化剂能使不起反应的物质间发生反应
√
√
√
