1.2 离子反应同步练习题(含解析) 高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2 离子反应同步练习题(含解析) 高一上学期化学人教版(2019)必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 633.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-08 00:00:00 | ||
图片预览




文档简介
1.2 离子反应 同步练习题
一、选择题
1.下列离子方程式正确的是
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.氧化钠与水反应:O2-+H2O=2OH-
C.碳酸钠溶液与足量盐酸反应:2H++=H2O+CO2↑
D.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
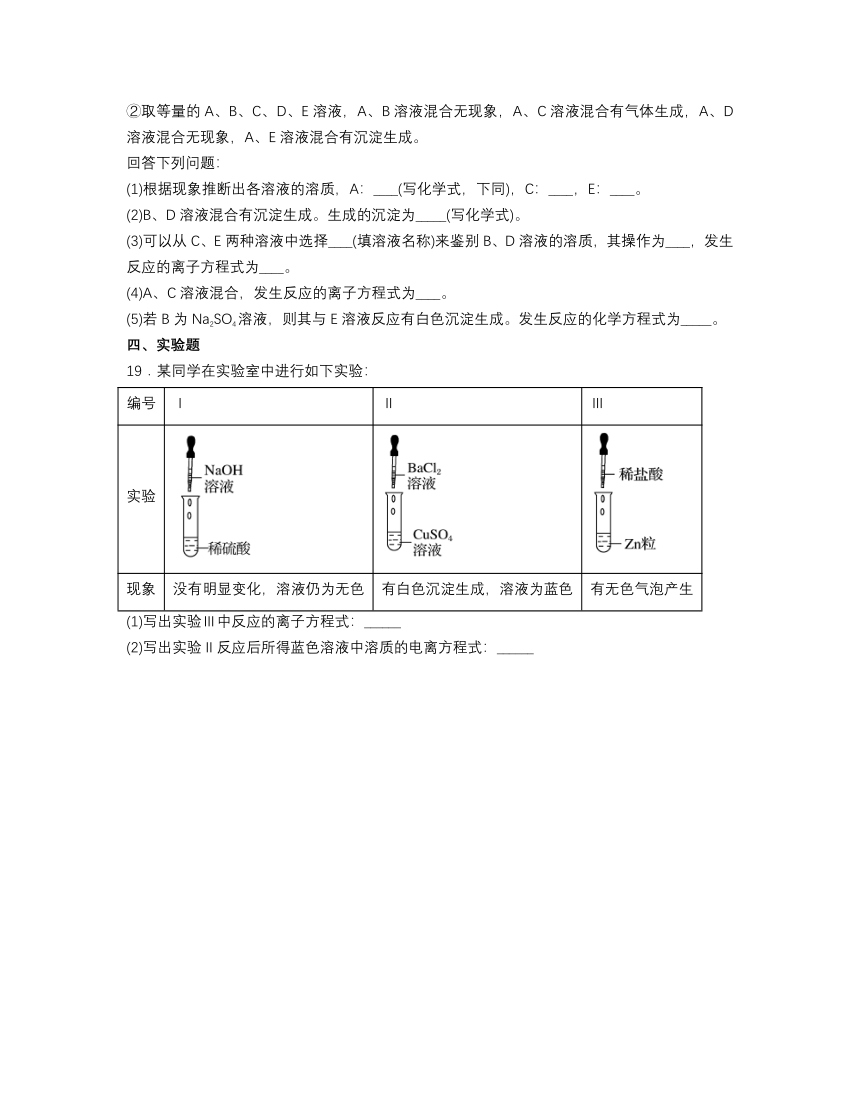
2.图a、b、c分别为氯化钠在不同状态下的导电实验的微观示意图(X、Y均表示石墨电极,且与直流电源连接方式相同,表示水分子),下列说法正确的是
A.NaCl在三种状态下都存在自由移动的离子
B.图c表示在电场作用下,水合离子发生定向移动
C.图中●代表的粒子是Na+
D.图b说明只有通电后才能发生:NaCl=Na++Cl-
3.下列离子方程式书写的正确的是
A.铜与稀硝酸反应:
B.向溶液中加入适量:
C.铁与稀盐酸反应:
D.向氯化铵的溶液中加入热的浓NaOH:
4.下列离子方程式中,正确的是
A.将稀硫酸滴到铜片上:
B.铜片插入硝酸银溶液中:
C.钠与水反应:
D.稀盐酸滴在石灰石上:
5.分类是学习和研究化学物质的一种科学方法。下列物质的分类正确的是
A.同素异形体:水和过氧化氢 B.碱:、
C.酸性氧化物:、 D.电解质:NaCl溶液、熔融的氢氧化钾
6.室温下,下列各组离子在指定溶液中一定能大量共存的是
A.的溶液:
B.溶液:
C.的溶液:
D.的溶液:
7.等物质的量浓度的下列溶液中,导电能力最强的是
A.盐酸 B.醋酸溶液 C.氯化钙 D.蔗糖溶液
8.向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如下图所示。下列说法正确的是
A.a点所得固体为银和铁
B.b点所得溶液中的溶质为硝酸银、硝酸亚铁和硝酸锌
C.c点所得溶液中的溶质为硝酸亚铁和硝酸锌
D.d点所得固体为银、铁和锌
9.下列离子能大量共存的是
A.使无色酚酞溶液呈红色的溶液中:Na+、K+、SO、CO
B.无色透明的溶液中:Ca2+、K+、SO、NO
C.含有大量Ba(NO3)2的溶液中:Mg2+、NH、SO、Cl-
D.使紫色石蕊溶液呈红色的溶液中:Na+、K+、CO、NO
10.氯气能与水反应,正确的离子方程式是
A.Cl2+H2O=HCl+HClO B.Cl2+H2O=H++Cl-+HClO
C.Cl2+H2O2H++Cl-+ClO- D.Cl2+H2OH++Cl-+HClO
11.下列电离方程式正确的是
A.H2O2H++O2- B.HClO=H++ClO-
C.Ba(OH)2=Ba2++2OH- D.CaCO3Ca2++CO
12.下列各组离子在水溶液中能大量共存的是
A.Na+、H+、Cl- B.H+、NO、CO
C.Al3+、K+、OH- D.HCO、OH-、Na+
13.某溶液中除Na+外,还含有、、和Br-离子,通入足量Cl2,溶液中离子浓度增大的是
A. B. C. D.Br-
14.下列离子方程式书写正确的是
A.将1molCl2通入含1molFeI2的溶液中:2Fe2++Cl2=2Fe3++2Cl-
B.海水提溴工艺中,用纯碱溶液富集Br2:3Br2+3CO=5Br-+BrO+3CO2↑
C.向NaClO溶液中通入少量SO2:ClO-+SO2+H2O=SO+Cl-+2H+
D.自来水长期煮沸时生成水垢:xCa2++yMg2++(2x+y)HCOxCaCO3↓+yMgCO3↓+(x+y)CO2↑+(x+y)H2O
15.下列物质之间的反应中,不能生成硫酸镁的是
A.镁与稀硫酸反应 B.氯化镁与稀硫酸反应
C.氧化镁与稀硫酸反应 D.碳酸镁与硫酸反应
二、填空题
16.现有中学化学中常见的八种物质:
①NaOH固体 ②Cu ③稀硫酸 ④O2 ⑤液态HCl ⑥CO2 ⑦蔗糖 ⑧Na2CO3固体
(1)上述状态下可导电的是_______。
(2)属于电解质的是_______。( 请用序号填空)
(3)写出①和⑧在水溶液中的电离方程式: ______、______。
(4)写出③和⑧在水溶液中反应的离子方程式:_______。
17.正确书写以下物质在水溶液中的电离方程式
(1)HNO3: _______________
(2)Ba(OH)2: _________
(3)Na3PO4: _______________
(4)(NH4)2Fe(SO4)2: ___________
三、元素或物质推断题
18.现有溶质分别为BaCl2、HCl、AgNO3、Na2CO3、Na2SO4的五种无标签溶液,某化学兴趣小组设计实验将它们鉴别出来.将上述五种溶液编号为A、B、C、D、E,进行相关实验.
①向A溶液中滴加紫色石蕊试液,溶液变红;
②取等量的A、B、C、D、E溶液,A、B溶液混合无现象,A、C溶液混合有气体生成,A、D溶液混合无现象,A、E溶液混合有沉淀生成。
回答下列问题:
(1)根据现象推断出各溶液的溶质,A:____(写化学式,下同),C:____,E:____。
(2)B、D溶液混合有沉淀生成。生成的沉淀为_____(写化学式)。
(3)可以从C、E两种溶液中选择____(填溶液名称)来鉴别B、D溶液的溶质,其操作为____,发生反应的离子方程式为____。
(4)A、C溶液混合,发生反应的离子方程式为____。
(5)若B为Na2SO4溶液,则其与E溶液反应有白色沉淀生成。发生反应的化学方程式为_____。
四、实验题
19.某同学在实验室中进行如下实验:
编号 Ⅰ Ⅱ Ⅲ
实验
现象 没有明显变化,溶液仍为无色 有白色沉淀生成,溶液为蓝色 有无色气泡产生
(1)写出实验Ⅲ中反应的离子方程式:______
(2)写出实验Ⅱ反应后所得蓝色溶液中溶质的电离方程式:______
【参考答案】
一、选择题
1.C
解析:A.钠与水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,选项A错误;
B.氧化钠与水反应生成氢氧化钠,反应的离子方程式为:Na2O+H2O=2Na++2OH-,选项B错误;
C.碳酸钠溶液与足量盐酸反应生成氯化钠、二氧化碳和水,反应的离子方程式为:2H++=H2O+CO2↑,选项C正确;
D.钠与CuSO4溶液反应生成氢氧化铜、硫酸钠和氢气,反应的离子方程式为:2Na+Cu2++2H2O =Cu(OH)2↓+2Na++H2↑,选项D错误;
答案选C。
2.B
解析:A.NaCl在晶体状态没有自由移动的离子不导电,即图a不导电,A错误;
B.图c在电场作用下,水合钠离子和水合氯离子发生定向移动至两电极,B正确;
C.氯离子半径大于钠离子,则图中黑色球●代表的离子是Cl-,C错误;
D.氯化钠生成钠离子和氯离子的过程为电离,不需要通电也能电离,D错误;
答案选B。
3.D
解析:A.铜与稀硝酸反应生成硝酸铜、一氧化氮、水,反应的离子方程式为,故A错误;
B.向溶液中加入适量生成硫酸钡沉淀和水,反应的离子方程式是,故B错误;
C.铁与稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式是,故C错误;
D.向氯化铵的溶液中加入热的浓NaOH生成氯化钠、氨气、水,反应的离子方程式是,故D正确;
选D。
4.C
解析:A.稀硫酸滴在铜片上,不发生反应,无法写出反应的离子方程式,故A错误;
B.二者发生置换反应生成铜离子和Ag,离子方程式为Cu+2Ag+=Cu2++2Ag,故B错误;
C.钠与水反应生成氢氧化钠和氢气:,故C正确;
D.稀盐酸滴在石灰石上反应生成氯化钙和二氧化碳、水,反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故D错误;
故选C。
5.C
解析:A.同种元素的不同单质之间互为同素异形体,水和过氧化氢为化合物,A错误;
B.是盐不是碱,B错误;
C.、能与碱(比如氢氧化钠)反应生成盐和水,符合酸性氧化物的定义,C正确;
D.电解质是溶于水或在熔融状态下自身能够导电的化合物,NaCl溶液是混合物,不是电解质,D错误;
故本题选C。
6.B
解析:A.含H+溶液呈酸性, 在酸性条件下有氧化性,能将Fe2+氧化Fe3+,A错误;
B.0.1mol L 1Na2SO4溶液中,Cu2+、Mg2+、Cl 、各种离子互不反应,B正确;
C.溶液中的与Ba2+产生沉淀BaCO3,不能共存,C错误;
D.溶液中的OH-与反应生成,与Ca2+继续反应生成沉淀CaCO3,D错误;
故答案为:B。
7.C
【分析】电解质溶液的导电能力与离子浓度和离子所带的电荷数有关。
解析:CH3COOH是弱电解质,部分电离,等物质的量浓度时离子浓度最小,导电能力最差;HCl、CaCl2均为强电解质,均完全电离,蔗糖属于非电解质,不能电离,由于HCl=H++Cl-、CaCl2=Ca++2Cl-,故氯化钙溶液中离子浓度最大,所带电荷最多,导电能力最强,
故答案为:C。
8.D
【分析】向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,锌粉先与硝酸银反应,溶液质量减少,a点是溶液中还有硝酸银,b点硝酸银反应完全,b点后开始与硝酸亚铁反应,c点硝酸亚铁恰好反应完全,d点锌粉过量,沉淀的固体有银、铁和锌。
解析:A.a点溶液中还有硝酸银,所得固体只有银,A错误;
B.b点溶液中硝酸银反应完全,溶液中不含有硝酸银,B错误;
C.c点溶液中硝酸银和硝酸亚铁都反应完全,溶液的溶质只有硝酸锌,C错误;
D.d点溶液中硝酸银和硝酸亚铁反应完全,固体有银和铁,d点锌粉过量,固体还有锌粉,D正确;
故答案为:D。
9.A
解析:A.使无色酚酞溶液呈红色的溶液为碱性溶液,碱性溶液中Na+、K+、、不发生任何反应,能大量共存,A正确;
B.无色透明的溶液中钙离子与硫酸根离子生成微溶物,所以不可能大量共存,B错误;
C.含有大量Ba(NO3)2的溶液中,钡离子与硫酸根离子反应生成硫酸钡沉淀,不能大量共存,C错误;
D.使紫色石蕊溶液呈红色的溶液为酸性溶液,酸性溶液中碳酸根离子与氢离子反应生成二氧化碳和水,不能大量共存,D错误;
故选A。
10.D
解析:氯气和水生成强酸盐酸和弱酸次氯酸,反应为可逆反应故为Cl2+H2OH++Cl-+HClO;故选D。
11.C
解析:A.水的电离方程式为H2OH++OH-,A错误;
B.HClO为弱电解质,其电离方程式为HClOH++ClO-,B错误;
C.Ba(OH)2电离方程式为Ba(OH)2=Ba2++2OH-,C正确;
D.CaCO3为强电解质,其电离方程式为CaCO3=Ca2++CO,D错误;
故选C。
12.A
解析:A.Na+、H+、Cl-三种离子之间不发生反应,能大量共存,故A选;
B.H+和CO反应生成二氧化碳和水,不能大量共存,故B不选;
C.Al3+和OH-反应生成氢氧化铝沉淀,不能大量共存,故C不选;
D.HCO和OH-反应生成碳酸根,不能大量共存,故D不选;
故选A。
13.A
解析:溶液中通入氯气时,发生Cl2++H2O=2Cl-+2H++、Cl2+2 Br-=2Cl-+Br2,使、Br-浓度减小,浓度增大;又有Cl2+ H2OH++Cl-+ HClO,生成的H+使转化成二氧化碳气体,浓度减小;
答案选A。
14.B
解析:A.将通入含的溶液中,还原性强于Fe2+,先与反应,故离子方程式为:,A错误;
B.纯碱与Br2反应,离子方程式为:3Br2+3CO=5Br-+BrO+3CO2↑,B正确;
C.向溶液中通入少量的离子方程式为:,C错误;
D.自来水长期煮沸时生成水垢的离子方程式为:,D错误;
故选B。
15.B
解析:A.镁与稀硫酸反应,生成硫酸镁和氢气,A不符合题意;
B.氯化镁与稀硫酸混合后,不能发生反应,没有硫酸镁生成,B符合题意;
C.氧化镁与稀硫酸反应,生成硫酸镁和水,C不符合题意;
D.碳酸镁与硫酸反应,生成硫酸镁、二氧化碳气体和水,D不符合题意;
故选B。
二、填空题
16.(1)②③
(2)①⑤⑧
(3) NaOH= Na++OH- Na2CO3= 2Na++CO
(4)CO+2H+ = H2O+CO2↑
解析:(1)导电性要求有自由移动的电子或自由移动的离子,②Cu是金属,有自由移动的电子,能导电,③稀硫酸存在自由移动的H+和离子,能导电;
(2)电解质是溶于水溶液中或在熔融状态下自身能够导电的化合物,①NaOH固体在水溶液中能电离出Na+和OH-,能够导电,属于电解质,⑤液态HCl在水溶液中能电离出H+和Cl-,能够导电,属于电解质,⑧Na2CO3固体,在水溶液中能电离出Na+和CO,能够导电,属于电解质;
(3)NaOH属于强碱,在水溶液中的电离方程式为NaOH=Na++OH-,Na2CO3属于可溶性盐,在水溶液中的电离方程式为Na2CO3=2Na++CO;
(4)稀硫酸和Na2CO3在水溶液中反应生成Na2SO4、H2O和CO2,其离子方程式为CO+2H+ = H2O+CO2↑。
【点睛】离子方程式书写的分为四步,第一步:正确写出反应的化学方程式,第二步:把易溶于水、易电离的物质拆写成离子形式,第三步:删去方程式两边不参加反应的离子,第四步:检查方程式两边的元素和电荷是否守恒。
17.(1)HNO3=H++NO
(2)Ba(OH)2=Ba2++2OH-
(3)Na3PO4=3Na++PO
(4)(NH4)2Fe(SO4)2=2NH+Fe2++2SO
解析:(1)HNO3为强酸,在水溶液中发生完全电离,生成氢离子和硝酸根离子,其电离方程式为:HNO3=H++NO;
(2)Ba(OH)2为强碱,在水溶液中发生完全电离,生成钡离子和氢氧根离子,其电离方程式为:Ba(OH)2=Ba2++2OH-;
(3)Na3PO4为盐,在水溶液中发生完全电离,生成钠离子和磷酸根离子,其电离方程式为:Na3PO4=3Na++PO;
(4)(NH4)2Fe(SO4)2为盐,在水溶液中发生完全电离,生成铵根离子、亚铁离子和硫酸根离子,其电离方程式为:(NH4)2Fe(SO4)2=2NH+Fe2++2SO。
三、元素或物质推断题
18.(1) HCl Na2CO3 AgNO3
(2)BaSO4
(3) 碳酸钠溶液 取少量且等量的B、D溶液于两支试管中,分别加入Na2CO3溶液,生成白色沉淀的是BaCl2溶液,无现象的是Na2SO4溶液 Ba2++CO=BaCO3↓
(4)CO+2H+=CO2↑+H2O
(5)Na2SO4+2AgNO3=Ag2SO4↓+2NaNO3
【分析】①向A溶液中滴加紫色石蕊试液,溶液变红,说明A为盐酸;②取等量的A、B、C、D、E溶液,A、B溶液混合无现象,A、C溶液混合有气体生成,说明C为碳酸钠,A、D溶液混合无现象,A、E溶液混合有沉淀生成,E为硝酸银。
解析:(1)根据现象分析A为盐酸,C为碳酸钠,E为硝酸银
(2)BD产生沉淀,即氯化钡和硫酸钠反应,生成硫酸钡沉淀。
(3)用碳酸钠检验氯化钡和硫酸钠,操作为取少量且等量的B、D溶液于两支试管中,分别加入Na2CO3溶液,生成白色沉淀的是BaCl2溶液,无现象的是Na2SO4溶液。
(4)盐酸和碳酸钠反应生成氯化钠和水和二氧化碳,反应的离子方程式为:CO+2H+=CO2↑+H2O。
(5)若B为硫酸钠,则D为氯化钡。硫酸钠和硝酸银反应生成硫酸银沉淀和硝酸钠,方程式为:Na2SO4+2AgNO3=Ag2SO4↓+2NaNO3。
四、实验题
19.(1)Zn+2H+=Zn2++H2↑
(2)CuCl2=Cu2++2Cl-
解析:(1)实验Ⅲ中盐酸与锌发生置换反应生成氢气,反应的离子方程式:Zn+2H+=Zn2++H2↑。
(2)实验Ⅱ中氯化钡与硫酸铜发生复分解反应生成氯化铜蓝色溶液和硫酸钡白色沉淀,反应后所得蓝色溶液中溶质是氯化铜,其电离方程式:CuCl2=Cu2++2Cl-。
一、选择题
1.下列离子方程式正确的是
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.氧化钠与水反应:O2-+H2O=2OH-
C.碳酸钠溶液与足量盐酸反应:2H++=H2O+CO2↑
D.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
2.图a、b、c分别为氯化钠在不同状态下的导电实验的微观示意图(X、Y均表示石墨电极,且与直流电源连接方式相同,表示水分子),下列说法正确的是
A.NaCl在三种状态下都存在自由移动的离子
B.图c表示在电场作用下,水合离子发生定向移动
C.图中●代表的粒子是Na+
D.图b说明只有通电后才能发生:NaCl=Na++Cl-
3.下列离子方程式书写的正确的是
A.铜与稀硝酸反应:
B.向溶液中加入适量:
C.铁与稀盐酸反应:
D.向氯化铵的溶液中加入热的浓NaOH:
4.下列离子方程式中,正确的是
A.将稀硫酸滴到铜片上:
B.铜片插入硝酸银溶液中:
C.钠与水反应:
D.稀盐酸滴在石灰石上:
5.分类是学习和研究化学物质的一种科学方法。下列物质的分类正确的是
A.同素异形体:水和过氧化氢 B.碱:、
C.酸性氧化物:、 D.电解质:NaCl溶液、熔融的氢氧化钾
6.室温下,下列各组离子在指定溶液中一定能大量共存的是
A.的溶液:
B.溶液:
C.的溶液:
D.的溶液:
7.等物质的量浓度的下列溶液中,导电能力最强的是
A.盐酸 B.醋酸溶液 C.氯化钙 D.蔗糖溶液
8.向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如下图所示。下列说法正确的是
A.a点所得固体为银和铁
B.b点所得溶液中的溶质为硝酸银、硝酸亚铁和硝酸锌
C.c点所得溶液中的溶质为硝酸亚铁和硝酸锌
D.d点所得固体为银、铁和锌
9.下列离子能大量共存的是
A.使无色酚酞溶液呈红色的溶液中:Na+、K+、SO、CO
B.无色透明的溶液中:Ca2+、K+、SO、NO
C.含有大量Ba(NO3)2的溶液中:Mg2+、NH、SO、Cl-
D.使紫色石蕊溶液呈红色的溶液中:Na+、K+、CO、NO
10.氯气能与水反应,正确的离子方程式是
A.Cl2+H2O=HCl+HClO B.Cl2+H2O=H++Cl-+HClO
C.Cl2+H2O2H++Cl-+ClO- D.Cl2+H2OH++Cl-+HClO
11.下列电离方程式正确的是
A.H2O2H++O2- B.HClO=H++ClO-
C.Ba(OH)2=Ba2++2OH- D.CaCO3Ca2++CO
12.下列各组离子在水溶液中能大量共存的是
A.Na+、H+、Cl- B.H+、NO、CO
C.Al3+、K+、OH- D.HCO、OH-、Na+
13.某溶液中除Na+外,还含有、、和Br-离子,通入足量Cl2,溶液中离子浓度增大的是
A. B. C. D.Br-
14.下列离子方程式书写正确的是
A.将1molCl2通入含1molFeI2的溶液中:2Fe2++Cl2=2Fe3++2Cl-
B.海水提溴工艺中,用纯碱溶液富集Br2:3Br2+3CO=5Br-+BrO+3CO2↑
C.向NaClO溶液中通入少量SO2:ClO-+SO2+H2O=SO+Cl-+2H+
D.自来水长期煮沸时生成水垢:xCa2++yMg2++(2x+y)HCOxCaCO3↓+yMgCO3↓+(x+y)CO2↑+(x+y)H2O
15.下列物质之间的反应中,不能生成硫酸镁的是
A.镁与稀硫酸反应 B.氯化镁与稀硫酸反应
C.氧化镁与稀硫酸反应 D.碳酸镁与硫酸反应
二、填空题
16.现有中学化学中常见的八种物质:
①NaOH固体 ②Cu ③稀硫酸 ④O2 ⑤液态HCl ⑥CO2 ⑦蔗糖 ⑧Na2CO3固体
(1)上述状态下可导电的是_______。
(2)属于电解质的是_______。( 请用序号填空)
(3)写出①和⑧在水溶液中的电离方程式: ______、______。
(4)写出③和⑧在水溶液中反应的离子方程式:_______。
17.正确书写以下物质在水溶液中的电离方程式
(1)HNO3: _______________
(2)Ba(OH)2: _________
(3)Na3PO4: _______________
(4)(NH4)2Fe(SO4)2: ___________
三、元素或物质推断题
18.现有溶质分别为BaCl2、HCl、AgNO3、Na2CO3、Na2SO4的五种无标签溶液,某化学兴趣小组设计实验将它们鉴别出来.将上述五种溶液编号为A、B、C、D、E,进行相关实验.
①向A溶液中滴加紫色石蕊试液,溶液变红;
②取等量的A、B、C、D、E溶液,A、B溶液混合无现象,A、C溶液混合有气体生成,A、D溶液混合无现象,A、E溶液混合有沉淀生成。
回答下列问题:
(1)根据现象推断出各溶液的溶质,A:____(写化学式,下同),C:____,E:____。
(2)B、D溶液混合有沉淀生成。生成的沉淀为_____(写化学式)。
(3)可以从C、E两种溶液中选择____(填溶液名称)来鉴别B、D溶液的溶质,其操作为____,发生反应的离子方程式为____。
(4)A、C溶液混合,发生反应的离子方程式为____。
(5)若B为Na2SO4溶液,则其与E溶液反应有白色沉淀生成。发生反应的化学方程式为_____。
四、实验题
19.某同学在实验室中进行如下实验:
编号 Ⅰ Ⅱ Ⅲ
实验
现象 没有明显变化,溶液仍为无色 有白色沉淀生成,溶液为蓝色 有无色气泡产生
(1)写出实验Ⅲ中反应的离子方程式:______
(2)写出实验Ⅱ反应后所得蓝色溶液中溶质的电离方程式:______
【参考答案】
一、选择题
1.C
解析:A.钠与水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,选项A错误;
B.氧化钠与水反应生成氢氧化钠,反应的离子方程式为:Na2O+H2O=2Na++2OH-,选项B错误;
C.碳酸钠溶液与足量盐酸反应生成氯化钠、二氧化碳和水,反应的离子方程式为:2H++=H2O+CO2↑,选项C正确;
D.钠与CuSO4溶液反应生成氢氧化铜、硫酸钠和氢气,反应的离子方程式为:2Na+Cu2++2H2O =Cu(OH)2↓+2Na++H2↑,选项D错误;
答案选C。
2.B
解析:A.NaCl在晶体状态没有自由移动的离子不导电,即图a不导电,A错误;
B.图c在电场作用下,水合钠离子和水合氯离子发生定向移动至两电极,B正确;
C.氯离子半径大于钠离子,则图中黑色球●代表的离子是Cl-,C错误;
D.氯化钠生成钠离子和氯离子的过程为电离,不需要通电也能电离,D错误;
答案选B。
3.D
解析:A.铜与稀硝酸反应生成硝酸铜、一氧化氮、水,反应的离子方程式为,故A错误;
B.向溶液中加入适量生成硫酸钡沉淀和水,反应的离子方程式是,故B错误;
C.铁与稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式是,故C错误;
D.向氯化铵的溶液中加入热的浓NaOH生成氯化钠、氨气、水,反应的离子方程式是,故D正确;
选D。
4.C
解析:A.稀硫酸滴在铜片上,不发生反应,无法写出反应的离子方程式,故A错误;
B.二者发生置换反应生成铜离子和Ag,离子方程式为Cu+2Ag+=Cu2++2Ag,故B错误;
C.钠与水反应生成氢氧化钠和氢气:,故C正确;
D.稀盐酸滴在石灰石上反应生成氯化钙和二氧化碳、水,反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故D错误;
故选C。
5.C
解析:A.同种元素的不同单质之间互为同素异形体,水和过氧化氢为化合物,A错误;
B.是盐不是碱,B错误;
C.、能与碱(比如氢氧化钠)反应生成盐和水,符合酸性氧化物的定义,C正确;
D.电解质是溶于水或在熔融状态下自身能够导电的化合物,NaCl溶液是混合物,不是电解质,D错误;
故本题选C。
6.B
解析:A.含H+溶液呈酸性, 在酸性条件下有氧化性,能将Fe2+氧化Fe3+,A错误;
B.0.1mol L 1Na2SO4溶液中,Cu2+、Mg2+、Cl 、各种离子互不反应,B正确;
C.溶液中的与Ba2+产生沉淀BaCO3,不能共存,C错误;
D.溶液中的OH-与反应生成,与Ca2+继续反应生成沉淀CaCO3,D错误;
故答案为:B。
7.C
【分析】电解质溶液的导电能力与离子浓度和离子所带的电荷数有关。
解析:CH3COOH是弱电解质,部分电离,等物质的量浓度时离子浓度最小,导电能力最差;HCl、CaCl2均为强电解质,均完全电离,蔗糖属于非电解质,不能电离,由于HCl=H++Cl-、CaCl2=Ca++2Cl-,故氯化钙溶液中离子浓度最大,所带电荷最多,导电能力最强,
故答案为:C。
8.D
【分析】向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,锌粉先与硝酸银反应,溶液质量减少,a点是溶液中还有硝酸银,b点硝酸银反应完全,b点后开始与硝酸亚铁反应,c点硝酸亚铁恰好反应完全,d点锌粉过量,沉淀的固体有银、铁和锌。
解析:A.a点溶液中还有硝酸银,所得固体只有银,A错误;
B.b点溶液中硝酸银反应完全,溶液中不含有硝酸银,B错误;
C.c点溶液中硝酸银和硝酸亚铁都反应完全,溶液的溶质只有硝酸锌,C错误;
D.d点溶液中硝酸银和硝酸亚铁反应完全,固体有银和铁,d点锌粉过量,固体还有锌粉,D正确;
故答案为:D。
9.A
解析:A.使无色酚酞溶液呈红色的溶液为碱性溶液,碱性溶液中Na+、K+、、不发生任何反应,能大量共存,A正确;
B.无色透明的溶液中钙离子与硫酸根离子生成微溶物,所以不可能大量共存,B错误;
C.含有大量Ba(NO3)2的溶液中,钡离子与硫酸根离子反应生成硫酸钡沉淀,不能大量共存,C错误;
D.使紫色石蕊溶液呈红色的溶液为酸性溶液,酸性溶液中碳酸根离子与氢离子反应生成二氧化碳和水,不能大量共存,D错误;
故选A。
10.D
解析:氯气和水生成强酸盐酸和弱酸次氯酸,反应为可逆反应故为Cl2+H2OH++Cl-+HClO;故选D。
11.C
解析:A.水的电离方程式为H2OH++OH-,A错误;
B.HClO为弱电解质,其电离方程式为HClOH++ClO-,B错误;
C.Ba(OH)2电离方程式为Ba(OH)2=Ba2++2OH-,C正确;
D.CaCO3为强电解质,其电离方程式为CaCO3=Ca2++CO,D错误;
故选C。
12.A
解析:A.Na+、H+、Cl-三种离子之间不发生反应,能大量共存,故A选;
B.H+和CO反应生成二氧化碳和水,不能大量共存,故B不选;
C.Al3+和OH-反应生成氢氧化铝沉淀,不能大量共存,故C不选;
D.HCO和OH-反应生成碳酸根,不能大量共存,故D不选;
故选A。
13.A
解析:溶液中通入氯气时,发生Cl2++H2O=2Cl-+2H++、Cl2+2 Br-=2Cl-+Br2,使、Br-浓度减小,浓度增大;又有Cl2+ H2OH++Cl-+ HClO,生成的H+使转化成二氧化碳气体,浓度减小;
答案选A。
14.B
解析:A.将通入含的溶液中,还原性强于Fe2+,先与反应,故离子方程式为:,A错误;
B.纯碱与Br2反应,离子方程式为:3Br2+3CO=5Br-+BrO+3CO2↑,B正确;
C.向溶液中通入少量的离子方程式为:,C错误;
D.自来水长期煮沸时生成水垢的离子方程式为:,D错误;
故选B。
15.B
解析:A.镁与稀硫酸反应,生成硫酸镁和氢气,A不符合题意;
B.氯化镁与稀硫酸混合后,不能发生反应,没有硫酸镁生成,B符合题意;
C.氧化镁与稀硫酸反应,生成硫酸镁和水,C不符合题意;
D.碳酸镁与硫酸反应,生成硫酸镁、二氧化碳气体和水,D不符合题意;
故选B。
二、填空题
16.(1)②③
(2)①⑤⑧
(3) NaOH= Na++OH- Na2CO3= 2Na++CO
(4)CO+2H+ = H2O+CO2↑
解析:(1)导电性要求有自由移动的电子或自由移动的离子,②Cu是金属,有自由移动的电子,能导电,③稀硫酸存在自由移动的H+和离子,能导电;
(2)电解质是溶于水溶液中或在熔融状态下自身能够导电的化合物,①NaOH固体在水溶液中能电离出Na+和OH-,能够导电,属于电解质,⑤液态HCl在水溶液中能电离出H+和Cl-,能够导电,属于电解质,⑧Na2CO3固体,在水溶液中能电离出Na+和CO,能够导电,属于电解质;
(3)NaOH属于强碱,在水溶液中的电离方程式为NaOH=Na++OH-,Na2CO3属于可溶性盐,在水溶液中的电离方程式为Na2CO3=2Na++CO;
(4)稀硫酸和Na2CO3在水溶液中反应生成Na2SO4、H2O和CO2,其离子方程式为CO+2H+ = H2O+CO2↑。
【点睛】离子方程式书写的分为四步,第一步:正确写出反应的化学方程式,第二步:把易溶于水、易电离的物质拆写成离子形式,第三步:删去方程式两边不参加反应的离子,第四步:检查方程式两边的元素和电荷是否守恒。
17.(1)HNO3=H++NO
(2)Ba(OH)2=Ba2++2OH-
(3)Na3PO4=3Na++PO
(4)(NH4)2Fe(SO4)2=2NH+Fe2++2SO
解析:(1)HNO3为强酸,在水溶液中发生完全电离,生成氢离子和硝酸根离子,其电离方程式为:HNO3=H++NO;
(2)Ba(OH)2为强碱,在水溶液中发生完全电离,生成钡离子和氢氧根离子,其电离方程式为:Ba(OH)2=Ba2++2OH-;
(3)Na3PO4为盐,在水溶液中发生完全电离,生成钠离子和磷酸根离子,其电离方程式为:Na3PO4=3Na++PO;
(4)(NH4)2Fe(SO4)2为盐,在水溶液中发生完全电离,生成铵根离子、亚铁离子和硫酸根离子,其电离方程式为:(NH4)2Fe(SO4)2=2NH+Fe2++2SO。
三、元素或物质推断题
18.(1) HCl Na2CO3 AgNO3
(2)BaSO4
(3) 碳酸钠溶液 取少量且等量的B、D溶液于两支试管中,分别加入Na2CO3溶液,生成白色沉淀的是BaCl2溶液,无现象的是Na2SO4溶液 Ba2++CO=BaCO3↓
(4)CO+2H+=CO2↑+H2O
(5)Na2SO4+2AgNO3=Ag2SO4↓+2NaNO3
【分析】①向A溶液中滴加紫色石蕊试液,溶液变红,说明A为盐酸;②取等量的A、B、C、D、E溶液,A、B溶液混合无现象,A、C溶液混合有气体生成,说明C为碳酸钠,A、D溶液混合无现象,A、E溶液混合有沉淀生成,E为硝酸银。
解析:(1)根据现象分析A为盐酸,C为碳酸钠,E为硝酸银
(2)BD产生沉淀,即氯化钡和硫酸钠反应,生成硫酸钡沉淀。
(3)用碳酸钠检验氯化钡和硫酸钠,操作为取少量且等量的B、D溶液于两支试管中,分别加入Na2CO3溶液,生成白色沉淀的是BaCl2溶液,无现象的是Na2SO4溶液。
(4)盐酸和碳酸钠反应生成氯化钠和水和二氧化碳,反应的离子方程式为:CO+2H+=CO2↑+H2O。
(5)若B为硫酸钠,则D为氯化钡。硫酸钠和硝酸银反应生成硫酸银沉淀和硝酸钠,方程式为:Na2SO4+2AgNO3=Ag2SO4↓+2NaNO3。
四、实验题
19.(1)Zn+2H+=Zn2++H2↑
(2)CuCl2=Cu2++2Cl-
解析:(1)实验Ⅲ中盐酸与锌发生置换反应生成氢气,反应的离子方程式:Zn+2H+=Zn2++H2↑。
(2)实验Ⅱ中氯化钡与硫酸铜发生复分解反应生成氯化铜蓝色溶液和硫酸钡白色沉淀,反应后所得蓝色溶液中溶质是氯化铜,其电离方程式:CuCl2=Cu2++2Cl-。
