第八章 化学与可持续发展 测试题 (含解析)高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第八章 化学与可持续发展 测试题 (含解析)高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 340.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-08 14:16:04 | ||
图片预览




文档简介
第八章《化学与可持续发展》测试题
一、单选题(共12题)
1.能源是人类文明发展和进步的基础,化学与能源紧密相关,下列说法不正确的是。
A.石油、沼气和潮汐能都是不可再生能源
B.煤、石油、太阳能都属于一次能源
C.“玉兔二号”月球车的帆板太阳能电池材料是硅
D.普及电动汽车有助于减缓城市汽车尾气污染
2.煤是工业的粮食,石油是工业的血液。下列关于煤和石油的说法错误的是
A.煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来
B.含C18以上烷烃的重油经过催化裂化可以得到汽油
C.石油裂解主要目的是得到短链的不饱和烃
D.石油分馏获得的汽油仍为混合物
3.化学与环境密切相关。下列有关说法错误的是
A.废旧电池应集中回收,并填埋处理
B.尽量使用可降解聚乳酸(PLA)塑料,可减少白色污染
C.燃煤使用前进行脱硫处理,有利于酸雨防治
D.高空臭氧层吸收太阳紫外线,保护地球生物
4.海洋是一个巨大的化学资源宝库。下列物质中不需要发生化学变化就能够从海水中获得的是
A.液溴 B.纯碱 C.淡水 D.金属镁
5.石油有“工业血液”之称。通过石油分馏可以得到的物质是
A.汽油 B.水煤气 C.焦炭 D.煤焦油
6.化石燃料仍是目前能源的主体,但已经面临危机,开发新能源是解决能源问题的关键。下列能量转换过程,不涉及化学变化的是
A.利用氢氧燃料电池提供电能 B.利用太阳能分解水制备氢气
C.利用水流驱动涡轮机发电 D.利用植物秸秆为原料生产乙醇燃料
7.下列叙述正确的是
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为2SO2(g)+O2(g)2SO3(g) ΔH<0
B.海水提镁的主要步骤为
C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
8.下列物质有固定的熔点和沸点的是:
A.可燃冰 B.石油 C.汽油 D.苯
9.下列说法不正确的是
A.二氧化硅导电能力强,可用于制造光导纤维
B.石灰石在高温下可用于消除燃煤烟气中的SO2
C.可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油
D.利用催化剂可减少汽车尾气中有害气体的排放
10.过氧苯甲酸与H2O2的分子结构中都有“—O—O—”。过氧苯甲酸可作为食品漂白剂,但它能破坏食品中的维生素C(俗名抗坏血酸)、维生素E(俗名生育酚)等,从而降低食品的营养价值,这个过程主要应是维生素C、维生素E等
A.酸性被中和 B.碱性被中和 C.被氧化 D.被还原
11.下列过程发生了化学变化的是
A.利用CO2合成燃料实现“碳中和”
B.原子核外电子发生跃迁
C.石油分馏得到汽油、柴油和煤油等
D.氘、氚用作“人造太阳”核聚变燃料
12.化学与生活密切相关。下列叙述正确的是
A.液氨可用作制冷剂 B.硅胶可作食品袋内的脱氧剂
C.加入“聚铁”净水剂可以使海水淡化 D.二氧化硫可作食品的增白剂
二、非选择题(共10题)
13.“绿色化学”是人类提出的一个新理念,主要内容之一是从技术、经济上设计一种可行的化学反应,尽可能减少对环境的负面作用。
(1)下列化学反应符合绿色化学理念的有________(填序号)。
A 制:
B 制:,
C 制:
D 制:,
(2)对垃圾的分类处理,属于绿色化学的范畴。请你根据日常生活中所见到的垃圾设计几种处理的方法:________________,________________,________________,________________。
(3)废旧电池的处理尤为重要,如果随意丢弃,主要会造成________(填序号)
A 水体污染 B 大气污染 C 资源污染 D 土壤污染
废旧电池的处理方法是________________。
14.食品安全、保持营养均衡,科学合理使用药物,是保障人体健康的基础。
(1)维生素C能促进人体生长发育。下列富含维生素C的是_______(填字母)。
A.牛肉 B.辣椒 C. 鸡蛋
(2)缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是_______。
A.碘 B.铁 C. 钙
(3)使用青霉素可能会产生过敏,在用药前患者一定要进行_______。
(4)人的胃壁细胞能产生胃液,胃液中含少量盐酸,称为胃酸。胃酸过多会消化不良和胃痛。抗酸药是治疗胃痛的药物。某抗酸药物中含有碳酸钙,氢氧化镁。写出此抗酸药发挥功效时的化学方程式:_______,_______。
15.(1)下表是某食品包装袋上的说明
品名 早餐饼
配料 面粉 鸡蛋 植物油 白砂糖 食盐 苯甲酸钠
保质期 十二个月
生产日期 2020年11月8日
在配料中,富含蛋白质的是______;富含淀粉的是______;富含油脂的是______。
(2)碘是人体必需的微量元素之一,是人体各个系统特别是神经系统发育所不可缺少的,因此,碘又有______元素之称。
(3)青霉素是最重要的抗生素,在使用前______(填“需要”或“不需要”)进行皮肤敏感试验。
(4)人体的胃液中含有少量盐酸,秘为胃酸。含有等成分的抗酸药可缓解胃酸分泌过多而导致的胃部不适。写出发挥药效时的化学方程式______。
16.豆干是一种健康的休闲食品,市面上某种豆干的配料表有:①大豆,②植物油,③食用盐,④白砂糖,⑤柠檬黄。
(1)富含蛋白质的是_________(填序号,下同);
(2)富含油脂的是_________;
(3)富含糖类的是_________;
(4)属于着色剂的是________。
17.海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
(1) 指出从海藻中提取 I2的实验操作名称:① _______ ,③_______;写出②的离子方程式:______ 。
(2) 提取碘的过程中,可供选择的有机溶剂是________。
A 酒精 B 四氯化碳 C 醋酸 D 甘油
(3) 为使海藻中 I-转化为碘的有机溶液,实验室里有坩埚、烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,还缺少的仪器是 _____ 。
18.工业上用电解熔融氧化铝的方法制取金属铝。
(1)请写出反应的化学方程式_____________________________________________。
(2)现欲冶炼270吨铝,至少需要多少吨氧化铝?__________________________
19.Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。
(1)正常人每天应补充14mg左右的铁。其中绝大部分来自食物。如果全部服用FeSO4·7H2O的片剂来补充铁,则正常人每天需服用含_____mgFeSO4·7H2O的片剂。
(2)“速力菲”是市场上常见的一种补铁药物,其中Fe2+的含量为35.0%。该药品中的Fe2+ 会缓慢氧化。国家规定该药物中的Fe2+氧化率超过10%即不能服用。为检验药店出售的“速力菲”是否失效,取10.00g该药品全部溶于稀硫酸,配制成1000mL溶液。取其中20.00mL,用0.01000mol/L KMnO4溶液滴定,用去KMnO424.00mL。通过计算说明该药物___________服用。(MnO4-在酸性条件下的还原产物为Mn2+,药品中除Fe元素外其他成分不与KMnO4反应。)
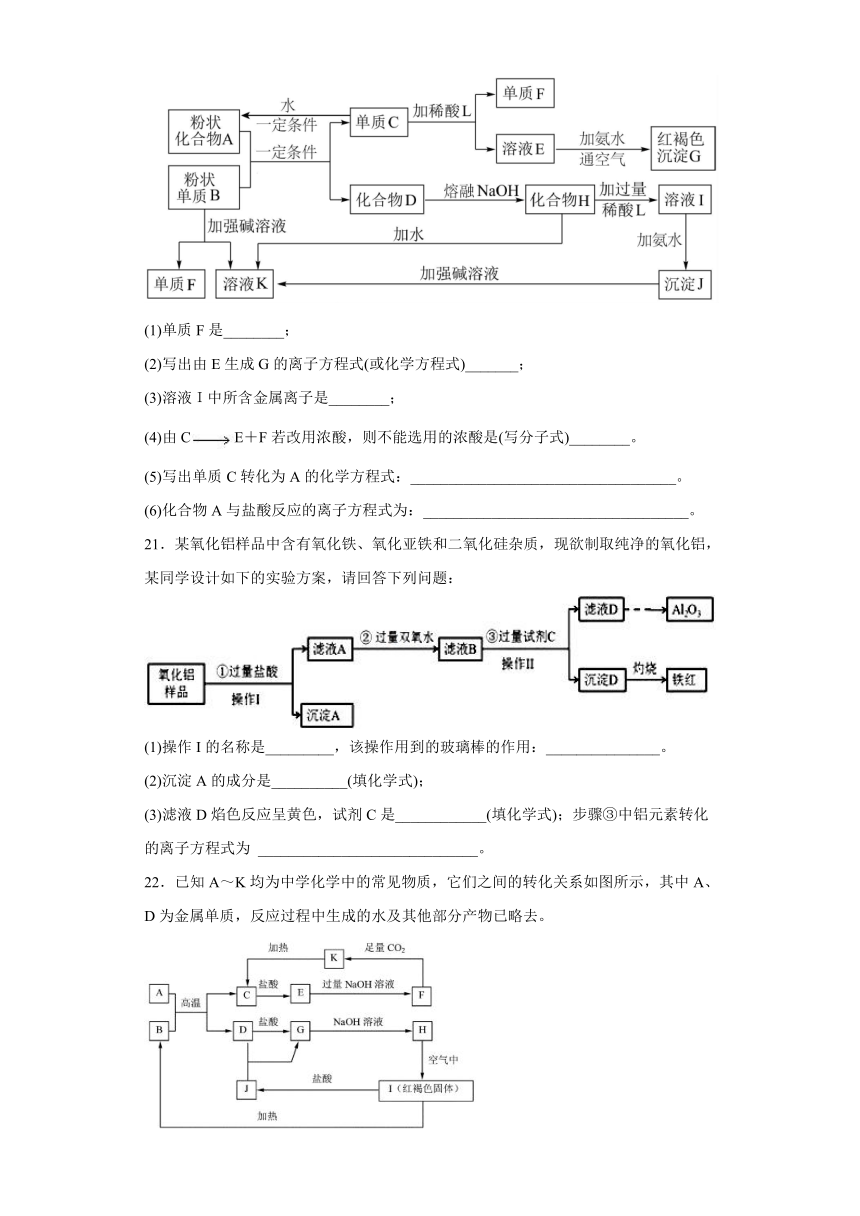
20.某些金属氧化物跟熔融烧碱反应可生成盐,根据图中化学反应方框图填空:
(1)单质F是________;
(2)写出由E生成G的离子方程式(或化学方程式)_______;
(3)溶液I中所含金属离子是________;
(4)由CE+F若改用浓酸,则不能选用的浓酸是(写分子式)________。
(5)写出单质C转化为A的化学方程式:___________________________________。
(6)化合物A与盐酸反应的离子方程式为:___________________________________。
21.某氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题:
(1)操作I的名称是_________,该操作用到的玻璃棒的作用:_______________。
(2)沉淀A的成分是__________(填化学式);
(3)滤液D焰色反应呈黄色,试剂C是____________(填化学式);步骤③中铝元素转化的离子方程式为 _____________________________。
22.已知A~K均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。
请回答以下问题:
(1)C是__,G是__。(填化学式)
(2)H生成I反应的化学方程式为__。
(3)向F中通入过量CO2生成K的离子方程式为__。
(4)E的溶液可以做净水剂,用离子方程式和必要的文字解释其净水原理:_____。
参考答案:
1.A
A.沼气和潮汐能可以再生,是可再生能源,而石油不能再生,故A错误;
B.直接从自然界获得的能源为一次能源,故煤、石油和太阳能均为一次能源,故B正确;
C.单质硅的重要用途之一是做太阳能电池板,能直接将太阳能转化为电能,故C正确;
D.燃油汽车会产生汽车尾气,而电动汽车不会,故普及电动汽车有助于减缓城市汽车尾气污染,故D正确。
故选:A。
2.A
A.煤中不含有苯、甲苯,它们是煤在干馏时经过复杂的化学变化产生的,A错误;
B.使长链烃分子断裂为短链烷烃的过程采用催化裂化的方法,含C18的烷烃经催化裂化可得到汽油,B正确;
C.石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃作化工原料,C正确;
D.汽油仍是多种烃组成的混合物,故D正确;
故选A。
3.A
A.废旧电池应集中回收,但不能填埋处理,若填埋处理,会污染地下水,故A错误;
B.白色污染是不能降解的塑料造成的污染,使用可降解聚乳酸(PLA)塑料可减少白色污染,故B正确;
C.燃煤使用前进行脱硫处理,将硫转化为CaSO4等,可以减少大气中SO2的含量,从而有利于酸雨防治,故C正确;
D.高空臭氧层能吸收太阳紫外线,保护地球生物免遭紫外线损伤,故D正确;
故选A。
4.C
A.海水提溴需要将Br-氧化为单质Br2,发生了化学变化,A错误;
B.获得纯碱需要向饱和氯化钠溶液中先通入氨气,再通入二氧化碳发生如下反应:,再经反应得到纯碱,制备过程中发生了化学变化,B错误;
C.从海水中获得淡水可以采用蒸馏法,不需要发生化学变化,C正确;
D.海水中获得金属镁,Mg2+先沉淀生成氢氧化镁,再和盐酸反应生成氯化镁,电解熔融态氯化镁可得到金属镁,发生了化学变化,D错误;
答案为:C。
5.A
A.石油为多种烃的混合物,通过石油分馏可以得到汽油、柴油等,A符合题意;
B.水煤气是碳在高温下与水蒸气反应得到的,B不符合题意;
C.焦炭是煤干馏的产物,C不符合题意;
D.煤焦油是煤干馏的产物,D不符合题意;
答案选A。
6.C
A.利用氢氧燃料电池提供电能是化学能转化为电能,涉及化学变化,错误;
B.利用太阳能分解水制备氢气是光能转化为化学能,涉及化学变化,错误;
C.利用水流驱动涡轮机发电是机械能转化为电能,不涉及化学变化,正确;
D.利用植物秸秆为原料生产乙醇燃料是发生化学变化,错误。
答案选C。
7.A
A.“接触法”制H2SO4时,催化氧化阶段是二氧化硫被氧气氧化为三氧化硫,A项正确;
B.海水提镁的过程中,海水中应加入石灰乳而不是碳酸钙,获得单质镁时应电解熔融的MgCl2,B项错误;
C.普通水泥的主要成分是硅酸三钙、硅酸二钙、铝酸三钙,C项错误;
D.黏土的主要成分是Al2O3·2SiO2·2H2O,D项错误;
选A。
8.D
A. 可燃冰为混合物,熔沸点不固定,故A错误;
B. 石油为混合物,其熔沸点不固定,故B错误;
C. 汽油为混合物,不具有固定熔沸点,故C错误;
D.苯为纯净物,具有固定的熔、沸点,故D正确;
故选D。
9.A
A.二氧化硅为共价化合物不导电,SiO2可用于制造光导纤维是因为其传导光的能力非常强,A选项错误;
B.向燃煤中加入适量石灰石,高温时将SO2转化为CaSO4,同时生成二氧化碳,B选项正确;
C.因为新制氢氧化铜悬浊液与多羟基有机物混合后,溶液会变为绛蓝色,因此可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油,C选项正确;
D.在排气管中安装高效催化剂,将NO转化为N2,减少了空气污染,D选项正确;
答案选A。
10.C
【解析】略
11.A
A.CO2合成燃料,发生了化学变化,选项A符合题意;
B.原子核外电子发生跃迁不产生新物质,不属于化学变化,选项B不符合题意;
C.石油分馏利用了石油中各组分物理性质的差异,主要是沸点的差异,不属于化学变化,选项C不符合题意;
D.氘、氚用作“人造太阳”核聚变燃料涉及核反应,不属于化学变化,选项D不符合题意;
答案选A。
12.A
A. 液氨汽化需要吸收大量的热,具有制冷作用,常用作制冷剂,故A正确;
B. 由于硅胶具有很好的吸附性,且无毒,可以用作袋装食品的干燥剂,故B错误;
C. 向海水中加入“聚铁”净水剂只能除去悬浮物杂质,但不能使海水淡化,应用蒸馏的方法,故C错误;
D. 二氧化硫有毒,不可作食品的漂白剂,故D错误;
答案选A。
13. BD 集中堆放· 填埋 焚烧 分类回收再利用(其他合理答案也可) AD 回收再利用(或用水泥包装后填埋)
(1)A.制CuSO4:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,反应中生成有毒气体,不符合绿色化学的要求,故A错误;
B.制CuSO4:2Cu+O22CuO、CuO+H2SO4(稀)=CuSO4+H2O,硫酸和Cu全部转化为目标产物,没有污染性的气体生成,符合绿色化学的要求,故B正确;
C.制Cu(NO3)2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应中生成有毒气体NO2,不符合绿色化学的要求,故C错误;
D.制Cu(NO3)2:2Cu+O22CuO、CuO+2HNO3(稀)=Cu(NO3)2+H2O,硝酸和Cu全部转化为目标产物,没有污染性的气体生成,符合绿色化学的要求,故D正确;
故答案为:BD;
(2)生活垃圾可用集中堆放、填埋、焚烧、分类回收再利用等方法处理;
(3)废旧电池中含有重金属元素汞等,随意丢弃会对水体和土壤造成污染,所以选AD;常采用回收再利用或水泥包装后填埋的方法处理。
14.(1)B
(2)A
(3)皮肤敏感试验
(4) 2HCl+CaCO3=CaCl2+H2O+CO2 Mg(OH)2+2HCl=MgCl2+H2O
【解析】(1)
蔬菜中富含维生素C,所以富含维生素C的是辣椒;
(2)
碘元素被称为智力元素,缺乏碘元素将导致甲状腺肿大,且造成智力损害;
(3)
部分抗生素会产生不良反应要做皮试,所以使用青霉素前使用者一定要进行皮肤敏感试验;
(4)
盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,反应的化学方程式:2HCl+CaCO3=CaCl2+H2O+CO2,氢氧化镁和盐酸反应生成氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+H2O;
15. 鸡蛋 面粉 植物油 智力 需要
(1)肉、蛋类中富含蛋白质,故富含蛋白质的是鸡蛋;谷物和薯类中富含淀粉,故富含淀粉的是面粉;菜油、麻油、花生油等植物油和动物脂肪中富含油脂,故富含油脂的是植物油。
(2) 碘是人体内合成甲状腺激素的主要原料,故缺碘易导致甲状腺疾病;碘俗称“智力元素”。
(3)青霉素在使用前需要进行皮肤敏感试验,即做皮试。
(4) 发挥药效时,即氢氧化镁与盐酸反应生成氯化镁和水,化学方程式为: 。
16. ① ② ④ ⑤
(1)富含蛋白质的是大豆,故选①;(2)富含油脂的是植物油,故选②;(3)富含糖类的是白砂糖,故选④;(4)属于着色剂的是柠檬黄,故选⑤;
17. 过滤 萃取分液 2I-+Cl2=I2+2Cl— B 分液漏斗、普通漏斗
海带晒干灼烧得到海带灰中含有碘化钾等物质,溶于水,浸泡后过滤得到含有碘离子的溶液,则操作①为过滤,滤液中通入氯气,发生Cl2+2I-=2Cl-+I2,得到碘的水溶液,操作③为萃取,用有机溶剂萃取得到含碘的有机溶液,最后蒸馏可得到碘,以此来解答。
(1)指出从海藻中提取I2的实验操作名称:①过滤,③萃取,过程②中有关反应的离子方程式为Cl2+2I-=2Cl-+I2,
故答案为:过滤;萃取;Cl2+2I-=2Cl-+I2;
(2)萃取剂与水分层,且不发生反应,则提取碘的过程中,可供选择的有机溶剂是B,而酒精,醋酸和甘油与水互溶,
故答案为:B;
(3)为使海藻中I 转化为碘的有机溶液,可溶解、过滤、氧化后萃取分离,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,尚缺少的仪器是分液漏斗、普通漏斗,
故答案为:分液漏斗、普通漏斗。
18. 2Al2O3(熔融) 4Al+3O2↑ 510t
电解熔融氧化铝的方法制取金属铝,发生2Al2O3(熔融) 4Al+3O2↑,将铝的质量代入计算即可。
(1)工业上用电解熔融氧化铝的方法制取金属铝,反应的化学方程式为2Al2O3(熔融) 4Al + 3O2↑,故答案为2Al2O3(熔融) 4Al + 3O2↑;
(2)设需要x吨氧化铝,则
2Al2O3(熔融) 4Al + 3O2↑
2×102 4×27
x t 270t
因此=,解得:x==510
答:理论上需要氧化铝510t。
19. 69.5 可以服用
(1)根据Fe — FeSO4·7H2O的关系得到全部服用FeSO4·7H2O需要的质量。
(2)根据5Fe2+ — MnO4-关系式,得到n(Fe2+)和质量,计算药品中未被氧化的Fe2+占整个Fe2+的质量分数,得出结论。
(1)根据Fe — FeSO4·7H2O的关系得到全部服用FeSO4·7H2O,需要FeSO4·7H2O质量;故答案为69.5。
(2)根据5Fe2+ — MnO4-关系式,得到n(Fe2+) = 5n(MnO4-) =5×0.01000 mol L 1×0.024L = 1.2×10 3 mol,10.00g该药品中n(Fe2+) = 1.2×10 3 mol×50 =6×10 2 mol,质量m =nM=6×10 2 mol × 56 g mol 1=3.36g,因此药品中未被氧化的Fe2+占整个Fe2+的质量分数,即该药物中的Fe2+氧化率未超过10%,可以服用;故答案为:可以服用。
20. H2 4Fe2++8NH3 H2O+O2+2H2O=4Fe(OH)3↓+8NH4+ Na+和Al3+ H2SO4、HNO3 3Fe+4H2OFe3O4+4H2 Fe3O4+8H+= Fe2++ 2Fe3++4H2O
溶液E和氨水、空气反应生成红褐色沉淀,红褐色沉淀G是Fe(OH)3,则E是亚铁盐;单质C和酸L反应生成E和单质F,E是亚铁盐,金属和酸反应生成盐,所以C是Fe、F为H2;沉淀J和强碱反应,则J是Al(OH)3,I和氨水反应生成Al(OH)3,所以I是铝盐;Al(OH)3和强碱反应生成溶液K,Al(OH)3和强碱反应生成偏铝酸盐,所以K是偏铝酸盐,单质B和强碱反应生成偏铝酸盐和氢气,则B是Al,F是H2;化合物A和Al反应生成Fe和化合物D,由铝热反应可知,A是铁的氧化物,D是氧化铝;高温条件下,氧化铝和熔融的氢氧化钠反应生成盐,H为NaAlO2,K是NaAlO2溶液,以此解答该题。
(1)由以上分析可知F为H2;
(2)G是Fe(OH)3,E和氨水、空气反应生成氢氧化铁,则E中含有亚铁离子,亚铁离子和氨水反应生成氢氧化亚铁、铵根离子,氢氧化亚铁和水、氧气生成氢氧化铁,所以总的离子方程式为:4Fe2++8NH3 H2O+O2+2H2O=4Fe(OH)3↓+8NH4+;
(3)溶液I中所含金属离子是Na+和Al3+;
(4)由铁生成亚铁盐和氢气,若改为浓酸,则浓酸不是浓硫酸或浓硝酸,常温下,浓硝酸和浓硫酸能与铁发生钝化反应,加热时生成铁盐不是亚铁盐;
(5)Fe在高温下和水蒸气反应生成四氧化三铁和氢气,发生反应的化学方程式为3Fe+4H2OFe3O4+4H2;
(6)化合物A为Fe3O4,与盐酸反应生成Fe2+和Fe3+的盐溶液,发生反应的离子方程式为Fe3O4+8H+= Fe2++ 2Fe3++4H2O。
21. 过滤 引流 SiO2 NaOH Al3++4OH-=AlO2-+2H2O
Al2O3样品中含有Fe2O3、FeO和SiO2,加入过量盐酸,金属氧化物溶解生成氯化铝、氯化铁、氯化亚铁溶液,过滤得到沉淀A为SiO2,滤液A含氯化铁、氯化亚铁和氯化铝、盐酸,加入过量H2O2,氯化亚铁被氧化为氯化铁,向得到滤液B中加入过量强碱NaOH溶液,生成Fe(OH)3沉淀和NaAlO2溶液,过滤得到沉淀D为Fe(OH)3,滤液D为含AlO2-溶液,向滤液中通入过量CO2气体反应生成Al(OH)3沉淀和NaHCO3,将氢氧化铝沉淀过滤、洗涤、干燥,然后加热分解生成氧化铝,沉淀D灼烧得到铁红——氧化铁,据此解答。
根据上述分析可知:沉淀A是SiO2,滤液A含有FeCl3、FeCl2、AlCl3、HCl,向滤液A中加入足量H2O2,FeCl2被氧化为FeCl3;滤液B中物质成分为FeCl3、AlCl3、HCl,
向滤液B中加入过量试剂C为强碱NaOH溶液,发生反应:Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=AlO2-+2H2O;过滤得到沉淀D为Fe(OH)3,滤液D为含AlO2-、OH-溶液,向滤液D中通入过量CO2气体,AlO2-反应生成Al(OH)3沉淀,将氢氧化铝沉淀过滤、洗涤、干燥,然后加热分解生成氧化铝,沉淀D灼烧得到铁红——氧化铁。
(1)操作I是分离难溶性固体和溶液混合物的方法,操作的名称是过滤,该操作用到的玻璃棒的作用是引流;
(2)沉淀A的成分是SiO2;
(3)滤液D焰色反应呈黄色,说明含有钠元素,加入的试剂C是NaOH溶液;在步骤③中Al3+与过量OH-反应的离子方程式为:Al3++4OH-=AlO2-+2H2O。
22. Al2O3 FeCl3 4Fe(OH)2+O2+2H2O=4 Fe(OH)3 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 氯化铝溶液中铝离子水解(Al3++3H2O= Al(OH)3(胶体)+3H+),生成氢氧化铝胶体,具有吸附性,可用于净水
D为金属单质,与盐酸反应生成氯化物G,加入氢氧化钠可生成氢氧化物H,H在空气中变为红褐色固体,可知I为氢氧化铁,那么H为氢氧化亚铁,G为氯化亚铁,D为铁,红褐色I氢氧化铁与盐酸反应生成氯化铁,即J为氯化铁,氯化铁与铁反应可生成G氯化亚铁;高温下A与B反应生成铁,可知发生的是铝热反应,那么A为Al,B为氧化铁,得知C为Al2O3,与盐酸反应生成E氯化铝,加入过量氢氧化钠可完全溶解生成F偏铝酸钠,通入过量CO2可生成K白色沉淀Al(OH)3,受热可分解为C,据此回答问题。
D为金属单质,与盐酸反应生成氯化物G,加入氢氧化钠可生成氢氧化物H,H在空气中变为红褐色固体,可知I为氢氧化铁,那么H为氢氧化亚铁,G为氯化亚铁,D为铁,红褐色I氢氧化铁与盐酸反应生成氯化铁,即J为氯化铁,氯化铁与铁反应可生成G氯化亚铁;高温下A与B反应生成铁,可知发生的是铝热反应,那么A为Al,B为氧化铁,得知C为Al2O3,与盐酸反应生成E氯化铝,加入过量氢氧化钠可完全溶解生成F偏铝酸钠,通入过量CO2可生成K白色沉淀Al(OH)3,受热可分解为C;
(1)由分析可知C为Al2O3,G是FeCl3;
(2)H为氢氧化亚铁被氧气氧化后生成红褐色的氢氧化铁,反应方程式为4Fe(OH)2+O2+2H2O=4 Fe(OH)3;
(3)向偏铝酸钠溶液中通入过量的CO2,生成氢氧化铝白色沉淀,离子反应为:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)E为氯化铝,铝离子水解生成氢氧化铝胶体,具有吸附性,可用于净水,反应为:Al3++3H2O= Al(OH)3(胶体)+3H+。
一、单选题(共12题)
1.能源是人类文明发展和进步的基础,化学与能源紧密相关,下列说法不正确的是。
A.石油、沼气和潮汐能都是不可再生能源
B.煤、石油、太阳能都属于一次能源
C.“玉兔二号”月球车的帆板太阳能电池材料是硅
D.普及电动汽车有助于减缓城市汽车尾气污染
2.煤是工业的粮食,石油是工业的血液。下列关于煤和石油的说法错误的是
A.煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来
B.含C18以上烷烃的重油经过催化裂化可以得到汽油
C.石油裂解主要目的是得到短链的不饱和烃
D.石油分馏获得的汽油仍为混合物
3.化学与环境密切相关。下列有关说法错误的是
A.废旧电池应集中回收,并填埋处理
B.尽量使用可降解聚乳酸(PLA)塑料,可减少白色污染
C.燃煤使用前进行脱硫处理,有利于酸雨防治
D.高空臭氧层吸收太阳紫外线,保护地球生物
4.海洋是一个巨大的化学资源宝库。下列物质中不需要发生化学变化就能够从海水中获得的是
A.液溴 B.纯碱 C.淡水 D.金属镁
5.石油有“工业血液”之称。通过石油分馏可以得到的物质是
A.汽油 B.水煤气 C.焦炭 D.煤焦油
6.化石燃料仍是目前能源的主体,但已经面临危机,开发新能源是解决能源问题的关键。下列能量转换过程,不涉及化学变化的是
A.利用氢氧燃料电池提供电能 B.利用太阳能分解水制备氢气
C.利用水流驱动涡轮机发电 D.利用植物秸秆为原料生产乙醇燃料
7.下列叙述正确的是
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为2SO2(g)+O2(g)2SO3(g) ΔH<0
B.海水提镁的主要步骤为
C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
8.下列物质有固定的熔点和沸点的是:
A.可燃冰 B.石油 C.汽油 D.苯
9.下列说法不正确的是
A.二氧化硅导电能力强,可用于制造光导纤维
B.石灰石在高温下可用于消除燃煤烟气中的SO2
C.可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油
D.利用催化剂可减少汽车尾气中有害气体的排放
10.过氧苯甲酸与H2O2的分子结构中都有“—O—O—”。过氧苯甲酸可作为食品漂白剂,但它能破坏食品中的维生素C(俗名抗坏血酸)、维生素E(俗名生育酚)等,从而降低食品的营养价值,这个过程主要应是维生素C、维生素E等
A.酸性被中和 B.碱性被中和 C.被氧化 D.被还原
11.下列过程发生了化学变化的是
A.利用CO2合成燃料实现“碳中和”
B.原子核外电子发生跃迁
C.石油分馏得到汽油、柴油和煤油等
D.氘、氚用作“人造太阳”核聚变燃料
12.化学与生活密切相关。下列叙述正确的是
A.液氨可用作制冷剂 B.硅胶可作食品袋内的脱氧剂
C.加入“聚铁”净水剂可以使海水淡化 D.二氧化硫可作食品的增白剂
二、非选择题(共10题)
13.“绿色化学”是人类提出的一个新理念,主要内容之一是从技术、经济上设计一种可行的化学反应,尽可能减少对环境的负面作用。
(1)下列化学反应符合绿色化学理念的有________(填序号)。
A 制:
B 制:,
C 制:
D 制:,
(2)对垃圾的分类处理,属于绿色化学的范畴。请你根据日常生活中所见到的垃圾设计几种处理的方法:________________,________________,________________,________________。
(3)废旧电池的处理尤为重要,如果随意丢弃,主要会造成________(填序号)
A 水体污染 B 大气污染 C 资源污染 D 土壤污染
废旧电池的处理方法是________________。
14.食品安全、保持营养均衡,科学合理使用药物,是保障人体健康的基础。
(1)维生素C能促进人体生长发育。下列富含维生素C的是_______(填字母)。
A.牛肉 B.辣椒 C. 鸡蛋
(2)缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是_______。
A.碘 B.铁 C. 钙
(3)使用青霉素可能会产生过敏,在用药前患者一定要进行_______。
(4)人的胃壁细胞能产生胃液,胃液中含少量盐酸,称为胃酸。胃酸过多会消化不良和胃痛。抗酸药是治疗胃痛的药物。某抗酸药物中含有碳酸钙,氢氧化镁。写出此抗酸药发挥功效时的化学方程式:_______,_______。
15.(1)下表是某食品包装袋上的说明
品名 早餐饼
配料 面粉 鸡蛋 植物油 白砂糖 食盐 苯甲酸钠
保质期 十二个月
生产日期 2020年11月8日
在配料中,富含蛋白质的是______;富含淀粉的是______;富含油脂的是______。
(2)碘是人体必需的微量元素之一,是人体各个系统特别是神经系统发育所不可缺少的,因此,碘又有______元素之称。
(3)青霉素是最重要的抗生素,在使用前______(填“需要”或“不需要”)进行皮肤敏感试验。
(4)人体的胃液中含有少量盐酸,秘为胃酸。含有等成分的抗酸药可缓解胃酸分泌过多而导致的胃部不适。写出发挥药效时的化学方程式______。
16.豆干是一种健康的休闲食品,市面上某种豆干的配料表有:①大豆,②植物油,③食用盐,④白砂糖,⑤柠檬黄。
(1)富含蛋白质的是_________(填序号,下同);
(2)富含油脂的是_________;
(3)富含糖类的是_________;
(4)属于着色剂的是________。
17.海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
(1) 指出从海藻中提取 I2的实验操作名称:① _______ ,③_______;写出②的离子方程式:______ 。
(2) 提取碘的过程中,可供选择的有机溶剂是________。
A 酒精 B 四氯化碳 C 醋酸 D 甘油
(3) 为使海藻中 I-转化为碘的有机溶液,实验室里有坩埚、烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,还缺少的仪器是 _____ 。
18.工业上用电解熔融氧化铝的方法制取金属铝。
(1)请写出反应的化学方程式_____________________________________________。
(2)现欲冶炼270吨铝,至少需要多少吨氧化铝?__________________________
19.Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。
(1)正常人每天应补充14mg左右的铁。其中绝大部分来自食物。如果全部服用FeSO4·7H2O的片剂来补充铁,则正常人每天需服用含_____mgFeSO4·7H2O的片剂。
(2)“速力菲”是市场上常见的一种补铁药物,其中Fe2+的含量为35.0%。该药品中的Fe2+ 会缓慢氧化。国家规定该药物中的Fe2+氧化率超过10%即不能服用。为检验药店出售的“速力菲”是否失效,取10.00g该药品全部溶于稀硫酸,配制成1000mL溶液。取其中20.00mL,用0.01000mol/L KMnO4溶液滴定,用去KMnO424.00mL。通过计算说明该药物___________服用。(MnO4-在酸性条件下的还原产物为Mn2+,药品中除Fe元素外其他成分不与KMnO4反应。)
20.某些金属氧化物跟熔融烧碱反应可生成盐,根据图中化学反应方框图填空:
(1)单质F是________;
(2)写出由E生成G的离子方程式(或化学方程式)_______;
(3)溶液I中所含金属离子是________;
(4)由CE+F若改用浓酸,则不能选用的浓酸是(写分子式)________。
(5)写出单质C转化为A的化学方程式:___________________________________。
(6)化合物A与盐酸反应的离子方程式为:___________________________________。
21.某氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题:
(1)操作I的名称是_________,该操作用到的玻璃棒的作用:_______________。
(2)沉淀A的成分是__________(填化学式);
(3)滤液D焰色反应呈黄色,试剂C是____________(填化学式);步骤③中铝元素转化的离子方程式为 _____________________________。
22.已知A~K均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。
请回答以下问题:
(1)C是__,G是__。(填化学式)
(2)H生成I反应的化学方程式为__。
(3)向F中通入过量CO2生成K的离子方程式为__。
(4)E的溶液可以做净水剂,用离子方程式和必要的文字解释其净水原理:_____。
参考答案:
1.A
A.沼气和潮汐能可以再生,是可再生能源,而石油不能再生,故A错误;
B.直接从自然界获得的能源为一次能源,故煤、石油和太阳能均为一次能源,故B正确;
C.单质硅的重要用途之一是做太阳能电池板,能直接将太阳能转化为电能,故C正确;
D.燃油汽车会产生汽车尾气,而电动汽车不会,故普及电动汽车有助于减缓城市汽车尾气污染,故D正确。
故选:A。
2.A
A.煤中不含有苯、甲苯,它们是煤在干馏时经过复杂的化学变化产生的,A错误;
B.使长链烃分子断裂为短链烷烃的过程采用催化裂化的方法,含C18的烷烃经催化裂化可得到汽油,B正确;
C.石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃作化工原料,C正确;
D.汽油仍是多种烃组成的混合物,故D正确;
故选A。
3.A
A.废旧电池应集中回收,但不能填埋处理,若填埋处理,会污染地下水,故A错误;
B.白色污染是不能降解的塑料造成的污染,使用可降解聚乳酸(PLA)塑料可减少白色污染,故B正确;
C.燃煤使用前进行脱硫处理,将硫转化为CaSO4等,可以减少大气中SO2的含量,从而有利于酸雨防治,故C正确;
D.高空臭氧层能吸收太阳紫外线,保护地球生物免遭紫外线损伤,故D正确;
故选A。
4.C
A.海水提溴需要将Br-氧化为单质Br2,发生了化学变化,A错误;
B.获得纯碱需要向饱和氯化钠溶液中先通入氨气,再通入二氧化碳发生如下反应:,再经反应得到纯碱,制备过程中发生了化学变化,B错误;
C.从海水中获得淡水可以采用蒸馏法,不需要发生化学变化,C正确;
D.海水中获得金属镁,Mg2+先沉淀生成氢氧化镁,再和盐酸反应生成氯化镁,电解熔融态氯化镁可得到金属镁,发生了化学变化,D错误;
答案为:C。
5.A
A.石油为多种烃的混合物,通过石油分馏可以得到汽油、柴油等,A符合题意;
B.水煤气是碳在高温下与水蒸气反应得到的,B不符合题意;
C.焦炭是煤干馏的产物,C不符合题意;
D.煤焦油是煤干馏的产物,D不符合题意;
答案选A。
6.C
A.利用氢氧燃料电池提供电能是化学能转化为电能,涉及化学变化,错误;
B.利用太阳能分解水制备氢气是光能转化为化学能,涉及化学变化,错误;
C.利用水流驱动涡轮机发电是机械能转化为电能,不涉及化学变化,正确;
D.利用植物秸秆为原料生产乙醇燃料是发生化学变化,错误。
答案选C。
7.A
A.“接触法”制H2SO4时,催化氧化阶段是二氧化硫被氧气氧化为三氧化硫,A项正确;
B.海水提镁的过程中,海水中应加入石灰乳而不是碳酸钙,获得单质镁时应电解熔融的MgCl2,B项错误;
C.普通水泥的主要成分是硅酸三钙、硅酸二钙、铝酸三钙,C项错误;
D.黏土的主要成分是Al2O3·2SiO2·2H2O,D项错误;
选A。
8.D
A. 可燃冰为混合物,熔沸点不固定,故A错误;
B. 石油为混合物,其熔沸点不固定,故B错误;
C. 汽油为混合物,不具有固定熔沸点,故C错误;
D.苯为纯净物,具有固定的熔、沸点,故D正确;
故选D。
9.A
A.二氧化硅为共价化合物不导电,SiO2可用于制造光导纤维是因为其传导光的能力非常强,A选项错误;
B.向燃煤中加入适量石灰石,高温时将SO2转化为CaSO4,同时生成二氧化碳,B选项正确;
C.因为新制氢氧化铜悬浊液与多羟基有机物混合后,溶液会变为绛蓝色,因此可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油,C选项正确;
D.在排气管中安装高效催化剂,将NO转化为N2,减少了空气污染,D选项正确;
答案选A。
10.C
【解析】略
11.A
A.CO2合成燃料,发生了化学变化,选项A符合题意;
B.原子核外电子发生跃迁不产生新物质,不属于化学变化,选项B不符合题意;
C.石油分馏利用了石油中各组分物理性质的差异,主要是沸点的差异,不属于化学变化,选项C不符合题意;
D.氘、氚用作“人造太阳”核聚变燃料涉及核反应,不属于化学变化,选项D不符合题意;
答案选A。
12.A
A. 液氨汽化需要吸收大量的热,具有制冷作用,常用作制冷剂,故A正确;
B. 由于硅胶具有很好的吸附性,且无毒,可以用作袋装食品的干燥剂,故B错误;
C. 向海水中加入“聚铁”净水剂只能除去悬浮物杂质,但不能使海水淡化,应用蒸馏的方法,故C错误;
D. 二氧化硫有毒,不可作食品的漂白剂,故D错误;
答案选A。
13. BD 集中堆放· 填埋 焚烧 分类回收再利用(其他合理答案也可) AD 回收再利用(或用水泥包装后填埋)
(1)A.制CuSO4:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,反应中生成有毒气体,不符合绿色化学的要求,故A错误;
B.制CuSO4:2Cu+O22CuO、CuO+H2SO4(稀)=CuSO4+H2O,硫酸和Cu全部转化为目标产物,没有污染性的气体生成,符合绿色化学的要求,故B正确;
C.制Cu(NO3)2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应中生成有毒气体NO2,不符合绿色化学的要求,故C错误;
D.制Cu(NO3)2:2Cu+O22CuO、CuO+2HNO3(稀)=Cu(NO3)2+H2O,硝酸和Cu全部转化为目标产物,没有污染性的气体生成,符合绿色化学的要求,故D正确;
故答案为:BD;
(2)生活垃圾可用集中堆放、填埋、焚烧、分类回收再利用等方法处理;
(3)废旧电池中含有重金属元素汞等,随意丢弃会对水体和土壤造成污染,所以选AD;常采用回收再利用或水泥包装后填埋的方法处理。
14.(1)B
(2)A
(3)皮肤敏感试验
(4) 2HCl+CaCO3=CaCl2+H2O+CO2 Mg(OH)2+2HCl=MgCl2+H2O
【解析】(1)
蔬菜中富含维生素C,所以富含维生素C的是辣椒;
(2)
碘元素被称为智力元素,缺乏碘元素将导致甲状腺肿大,且造成智力损害;
(3)
部分抗生素会产生不良反应要做皮试,所以使用青霉素前使用者一定要进行皮肤敏感试验;
(4)
盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,反应的化学方程式:2HCl+CaCO3=CaCl2+H2O+CO2,氢氧化镁和盐酸反应生成氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+H2O;
15. 鸡蛋 面粉 植物油 智力 需要
(1)肉、蛋类中富含蛋白质,故富含蛋白质的是鸡蛋;谷物和薯类中富含淀粉,故富含淀粉的是面粉;菜油、麻油、花生油等植物油和动物脂肪中富含油脂,故富含油脂的是植物油。
(2) 碘是人体内合成甲状腺激素的主要原料,故缺碘易导致甲状腺疾病;碘俗称“智力元素”。
(3)青霉素在使用前需要进行皮肤敏感试验,即做皮试。
(4) 发挥药效时,即氢氧化镁与盐酸反应生成氯化镁和水,化学方程式为: 。
16. ① ② ④ ⑤
(1)富含蛋白质的是大豆,故选①;(2)富含油脂的是植物油,故选②;(3)富含糖类的是白砂糖,故选④;(4)属于着色剂的是柠檬黄,故选⑤;
17. 过滤 萃取分液 2I-+Cl2=I2+2Cl— B 分液漏斗、普通漏斗
海带晒干灼烧得到海带灰中含有碘化钾等物质,溶于水,浸泡后过滤得到含有碘离子的溶液,则操作①为过滤,滤液中通入氯气,发生Cl2+2I-=2Cl-+I2,得到碘的水溶液,操作③为萃取,用有机溶剂萃取得到含碘的有机溶液,最后蒸馏可得到碘,以此来解答。
(1)指出从海藻中提取I2的实验操作名称:①过滤,③萃取,过程②中有关反应的离子方程式为Cl2+2I-=2Cl-+I2,
故答案为:过滤;萃取;Cl2+2I-=2Cl-+I2;
(2)萃取剂与水分层,且不发生反应,则提取碘的过程中,可供选择的有机溶剂是B,而酒精,醋酸和甘油与水互溶,
故答案为:B;
(3)为使海藻中I 转化为碘的有机溶液,可溶解、过滤、氧化后萃取分离,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,尚缺少的仪器是分液漏斗、普通漏斗,
故答案为:分液漏斗、普通漏斗。
18. 2Al2O3(熔融) 4Al+3O2↑ 510t
电解熔融氧化铝的方法制取金属铝,发生2Al2O3(熔融) 4Al+3O2↑,将铝的质量代入计算即可。
(1)工业上用电解熔融氧化铝的方法制取金属铝,反应的化学方程式为2Al2O3(熔融) 4Al + 3O2↑,故答案为2Al2O3(熔融) 4Al + 3O2↑;
(2)设需要x吨氧化铝,则
2Al2O3(熔融) 4Al + 3O2↑
2×102 4×27
x t 270t
因此=,解得:x==510
答:理论上需要氧化铝510t。
19. 69.5 可以服用
(1)根据Fe — FeSO4·7H2O的关系得到全部服用FeSO4·7H2O需要的质量。
(2)根据5Fe2+ — MnO4-关系式,得到n(Fe2+)和质量,计算药品中未被氧化的Fe2+占整个Fe2+的质量分数,得出结论。
(1)根据Fe — FeSO4·7H2O的关系得到全部服用FeSO4·7H2O,需要FeSO4·7H2O质量;故答案为69.5。
(2)根据5Fe2+ — MnO4-关系式,得到n(Fe2+) = 5n(MnO4-) =5×0.01000 mol L 1×0.024L = 1.2×10 3 mol,10.00g该药品中n(Fe2+) = 1.2×10 3 mol×50 =6×10 2 mol,质量m =nM=6×10 2 mol × 56 g mol 1=3.36g,因此药品中未被氧化的Fe2+占整个Fe2+的质量分数,即该药物中的Fe2+氧化率未超过10%,可以服用;故答案为:可以服用。
20. H2 4Fe2++8NH3 H2O+O2+2H2O=4Fe(OH)3↓+8NH4+ Na+和Al3+ H2SO4、HNO3 3Fe+4H2OFe3O4+4H2 Fe3O4+8H+= Fe2++ 2Fe3++4H2O
溶液E和氨水、空气反应生成红褐色沉淀,红褐色沉淀G是Fe(OH)3,则E是亚铁盐;单质C和酸L反应生成E和单质F,E是亚铁盐,金属和酸反应生成盐,所以C是Fe、F为H2;沉淀J和强碱反应,则J是Al(OH)3,I和氨水反应生成Al(OH)3,所以I是铝盐;Al(OH)3和强碱反应生成溶液K,Al(OH)3和强碱反应生成偏铝酸盐,所以K是偏铝酸盐,单质B和强碱反应生成偏铝酸盐和氢气,则B是Al,F是H2;化合物A和Al反应生成Fe和化合物D,由铝热反应可知,A是铁的氧化物,D是氧化铝;高温条件下,氧化铝和熔融的氢氧化钠反应生成盐,H为NaAlO2,K是NaAlO2溶液,以此解答该题。
(1)由以上分析可知F为H2;
(2)G是Fe(OH)3,E和氨水、空气反应生成氢氧化铁,则E中含有亚铁离子,亚铁离子和氨水反应生成氢氧化亚铁、铵根离子,氢氧化亚铁和水、氧气生成氢氧化铁,所以总的离子方程式为:4Fe2++8NH3 H2O+O2+2H2O=4Fe(OH)3↓+8NH4+;
(3)溶液I中所含金属离子是Na+和Al3+;
(4)由铁生成亚铁盐和氢气,若改为浓酸,则浓酸不是浓硫酸或浓硝酸,常温下,浓硝酸和浓硫酸能与铁发生钝化反应,加热时生成铁盐不是亚铁盐;
(5)Fe在高温下和水蒸气反应生成四氧化三铁和氢气,发生反应的化学方程式为3Fe+4H2OFe3O4+4H2;
(6)化合物A为Fe3O4,与盐酸反应生成Fe2+和Fe3+的盐溶液,发生反应的离子方程式为Fe3O4+8H+= Fe2++ 2Fe3++4H2O。
21. 过滤 引流 SiO2 NaOH Al3++4OH-=AlO2-+2H2O
Al2O3样品中含有Fe2O3、FeO和SiO2,加入过量盐酸,金属氧化物溶解生成氯化铝、氯化铁、氯化亚铁溶液,过滤得到沉淀A为SiO2,滤液A含氯化铁、氯化亚铁和氯化铝、盐酸,加入过量H2O2,氯化亚铁被氧化为氯化铁,向得到滤液B中加入过量强碱NaOH溶液,生成Fe(OH)3沉淀和NaAlO2溶液,过滤得到沉淀D为Fe(OH)3,滤液D为含AlO2-溶液,向滤液中通入过量CO2气体反应生成Al(OH)3沉淀和NaHCO3,将氢氧化铝沉淀过滤、洗涤、干燥,然后加热分解生成氧化铝,沉淀D灼烧得到铁红——氧化铁,据此解答。
根据上述分析可知:沉淀A是SiO2,滤液A含有FeCl3、FeCl2、AlCl3、HCl,向滤液A中加入足量H2O2,FeCl2被氧化为FeCl3;滤液B中物质成分为FeCl3、AlCl3、HCl,
向滤液B中加入过量试剂C为强碱NaOH溶液,发生反应:Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=AlO2-+2H2O;过滤得到沉淀D为Fe(OH)3,滤液D为含AlO2-、OH-溶液,向滤液D中通入过量CO2气体,AlO2-反应生成Al(OH)3沉淀,将氢氧化铝沉淀过滤、洗涤、干燥,然后加热分解生成氧化铝,沉淀D灼烧得到铁红——氧化铁。
(1)操作I是分离难溶性固体和溶液混合物的方法,操作的名称是过滤,该操作用到的玻璃棒的作用是引流;
(2)沉淀A的成分是SiO2;
(3)滤液D焰色反应呈黄色,说明含有钠元素,加入的试剂C是NaOH溶液;在步骤③中Al3+与过量OH-反应的离子方程式为:Al3++4OH-=AlO2-+2H2O。
22. Al2O3 FeCl3 4Fe(OH)2+O2+2H2O=4 Fe(OH)3 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 氯化铝溶液中铝离子水解(Al3++3H2O= Al(OH)3(胶体)+3H+),生成氢氧化铝胶体,具有吸附性,可用于净水
D为金属单质,与盐酸反应生成氯化物G,加入氢氧化钠可生成氢氧化物H,H在空气中变为红褐色固体,可知I为氢氧化铁,那么H为氢氧化亚铁,G为氯化亚铁,D为铁,红褐色I氢氧化铁与盐酸反应生成氯化铁,即J为氯化铁,氯化铁与铁反应可生成G氯化亚铁;高温下A与B反应生成铁,可知发生的是铝热反应,那么A为Al,B为氧化铁,得知C为Al2O3,与盐酸反应生成E氯化铝,加入过量氢氧化钠可完全溶解生成F偏铝酸钠,通入过量CO2可生成K白色沉淀Al(OH)3,受热可分解为C,据此回答问题。
D为金属单质,与盐酸反应生成氯化物G,加入氢氧化钠可生成氢氧化物H,H在空气中变为红褐色固体,可知I为氢氧化铁,那么H为氢氧化亚铁,G为氯化亚铁,D为铁,红褐色I氢氧化铁与盐酸反应生成氯化铁,即J为氯化铁,氯化铁与铁反应可生成G氯化亚铁;高温下A与B反应生成铁,可知发生的是铝热反应,那么A为Al,B为氧化铁,得知C为Al2O3,与盐酸反应生成E氯化铝,加入过量氢氧化钠可完全溶解生成F偏铝酸钠,通入过量CO2可生成K白色沉淀Al(OH)3,受热可分解为C;
(1)由分析可知C为Al2O3,G是FeCl3;
(2)H为氢氧化亚铁被氧气氧化后生成红褐色的氢氧化铁,反应方程式为4Fe(OH)2+O2+2H2O=4 Fe(OH)3;
(3)向偏铝酸钠溶液中通入过量的CO2,生成氢氧化铝白色沉淀,离子反应为:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)E为氯化铝,铝离子水解生成氢氧化铝胶体,具有吸附性,可用于净水,反应为:Al3++3H2O= Al(OH)3(胶体)+3H+。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
