第五章 化工生产中的重要非金属元素 单元测试卷(含解析) 高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章 化工生产中的重要非金属元素 单元测试卷(含解析) 高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-08 14:06:13 | ||
图片预览




文档简介
第五章 化工生产中的重要非金属元素 单元测试卷
一、单选题
1.化学在生活中有着广泛的应用,下列说法不正确的是
A.光导纤维的主要成分是晶体硅 B.用铁桶可以装浓硫酸
C.自来水可以用氯气来杀菌、消毒 D.碳酸钠可用于去除餐具的油污
2.云南是茶的故乡,普洱茶是云南的一张名片。普洱熟茶的制作过程主要包括采摘、摊晾、杀青、揉捻、渥堆发酵、出堆解块等操作,下列普洱熟茶的制作过程中以化学反应为主的是
A B C D
摊晾 揉捻 渥堆发酵 出堆解块
A.A B.B C.C D.D
3.化学与日常生活密切相关,下列说法错误的是
A.Al2O3可用作高温耐火材料 B.利用漂白粉的氧化性漂白织物
C.浓硫酸可刻蚀石英制艺术品 D.在医疗上碳酸氢钠可用于治疗胃酸过多
4.下列关于N2的叙述错误的是
A.N2既可作氧化剂又可做还原剂
B.雷雨天,空气中的N2和O2可反应生成NO
C.氮的固定是将N2转化成含氮化合物
D.NO和NO2都可稳定存在于空气中
5.下列有关物质的性质与用途具有对应关系的是( )
A.NH3具有还原性,可用作制冷剂 B.NaClO溶液显碱性,可用作杀菌消毒
C.浓硫酸具有吸水性,可用作干燥剂 D.Al2O3具有两性,可用作耐高温材料
6.下列气体的收集中,既能用向上排空气法又能用排水集气法收集的气体是
A.H2 B.O2 C.NO D.HCl
7.某小组辨析非金属及其化合物,下列说法正确的是( )
①Cl2具有很强的氧化性,在化学反应中只能作氧化剂
②SO2具有还原性,故可作漂白剂
③浓硝酸中的HNO3见光会分解,故浓硝酸呈黄色
④浓硫酸有强氧化性,不能与Cu发生反应
⑤将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,褪色后加热也能恢复原色
⑥金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
A.①③⑤ B.②④⑥ C.③ D.均不正确
8.下列反应中,观察不到颜色变化的是
A.黄色的氯化铁溶液中加入足量铁粉
B.往稀硫酸中通入氨气
C.往品红溶液中通入足量二氧化硫气体
D.一氧化氮气体暴露在空气中
9.下列条件下,可以大量共存的离子组是( )
A.pH=9的溶液中:Na+、Fe3+、,SCN-
B.含有大量S2O32-的溶液中:H+、K+、、Al3+
C.0.1mol L-1的NH4Cl溶液中:Li+、Ba2+、CH3COO-、OH-
D.某酸性无色透明溶液中:Na+、I-、Cl-、Mg2+
10.NA表示阿伏加德罗常数的数值,下列说法正确的是
A.25℃,101KPa,0.5molNO与NO2的混合气体中含有0.5NA个N原子
B.由H2O2制得2.24LO2,转移的电子数目为0.2NA
C.1molN2和3molH2完全反应生成2molNH3
D.常温下,0.01mol/L的H2SO4溶液中含有的H+数目为0.02NA
11.在给定条件下,下列选项中所示的物质间转化合理的是
A.
B.
C.
D.
12.下列有关物质性质的叙述一定不正确的是
A.过量铁粉与硝酸反应生成Fe(NO3)3
B.KAl(SO4)2 12H2O溶于水可形成Al(OH)3胶体
C.NH4Cl与Ca(OH)2混合加热可生成NH3
D.Cu与FeCl3溶液反应可生成CuCl2
13.下列指定反应的离子方程式正确的是
A.0.1mol·L-1MgCl2溶液中加入足量石灰乳:Mg2++Ca(OH)2=Mg(OH)2+Ca2+
B.0.1mol·L-1AlCl3溶液中加入过量浓氨水:Al3++4NH3·H2O=+2H2O+4
C.FeO溶于少量稀硝酸:FeO+2H+=Fe2++H2O
D.向KAl(SO4)2溶液中滴加Ba(OH)2溶液至恰好完全沉淀:Al3++2+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓
14.根据下列实验操作和现象所得出的结论正确的是
选项 实验操作和现象 结论
A 将石蕊溶液滴入新制氯水中,溶液先变红后褪色 新制氯水具有酸性和漂白性
B 向某溶液中滴加盐酸,产生使澄清石灰水变浑浊的气体 原溶液一定含有
C 向溶液中滴加盐酸,溶液变为浅黄色 盐酸显强氧化性,将转为
D 向某溶液中滴加硝酸银溶液产生白色沉淀,再加入过量硫酸,沉淀不消失 原溶液中一定含有
A.A B.B C.C D.D
15.关于物质的相关用途,下列说法错误的是
A.SO2可用作食品添加剂 B.小苏打可用于治疗胃溃疡
C.硅和锗可作半导体材料 D.Na2O2可用于潜水艇中作供氧剂
二、填空题
16.选取下列实验方法分离物质,将分离方法的字母填在横线上:
A.萃取、分液法 B.结晶法 C.分液法 D.蒸馏法 E.过滤法 F.加热分解法 G.升华法
(1)___________分离饱和食盐水与泥沙的混合物。
(2)___________分离水和汽油的混合物。
(3)___________分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
(4)___________除去氧化钙中少量碳酸钙。
(5)___________从含硝酸钾和氯化钠的混合液中分离出硝酸钾。
17.由于NO极易与O2反应,并且其密度与空气相差不多,因此收集NO只能用排水法。(__)
18.硫酸是重要的化工生产原料,工业上常用硫铁矿焙烧生成SO2,SO2氧化到SO3,再用98.3%左右的浓硫酸吸收SO3得到“发烟”硫酸(H2SO4·SO3)。最后用制得的“发烟”硫酸配制各种不同浓度的硫酸用于工业生产。
完成下列计算:
(1)1kg98%的浓硫酸吸收SO3后,可生产___kg“发烟”硫酸。
(2)“发烟”硫酸(H2SO4·SO3)溶于水,其中SO3都转化为硫酸。若将890g“发烟”硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为___mol/L。
(3)硫铁矿氧化焙烧的化学反应如下:3FeS2+8O2→Fe3O4+6SO24FeS2+11O2→2Fe2O3+8SO2
①1吨含FeS280%的硫铁矿,理论上可生产多少吨98%的浓硫酸__
②若24molFeS2完全反应耗用氧气1467.2L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比___。
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。硫化氢与水蒸气的混合气体在空气中完全燃烧,再经过催化氧化冷却制得了98%的浓硫酸(整个过程中SO2损失2%,不补充水不损失水)求硫化氢在混合气中的体积分数___。
三、实验题
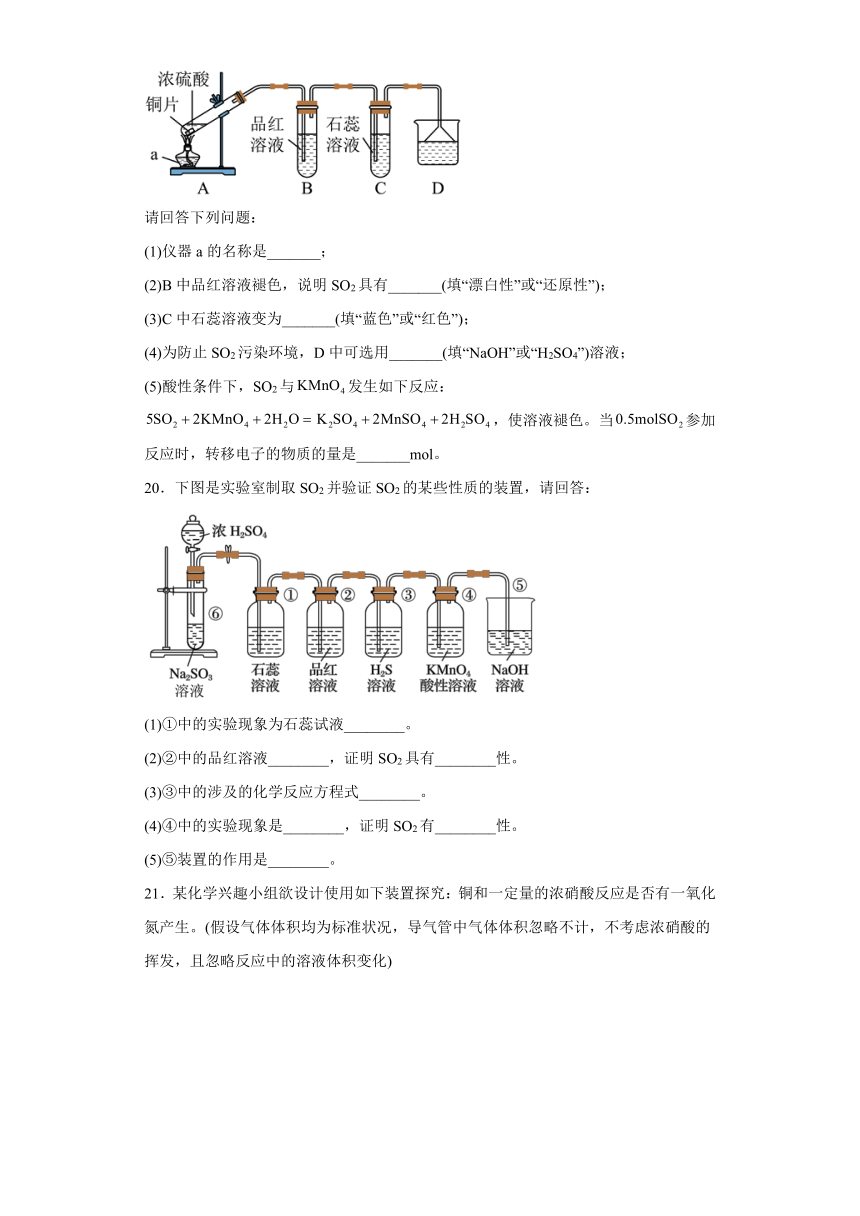
19.已知反应:,某化学兴趣小组用如图所示装置制取SO2,并进行相关性质实验。
请回答下列问题:
(1)仪器a的名称是_______;
(2)B中品红溶液褪色,说明SO2具有_______(填“漂白性”或“还原性”);
(3)C中石蕊溶液变为_______(填“蓝色”或“红色”);
(4)为防止SO2污染环境,D中可选用_______(填“NaOH”或“H2SO4”)溶液;
(5)酸性条件下,SO2与发生如下反应:,使溶液褪色。当参加反应时,转移电子的物质的量是_______mol。
20.下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:
(1)①中的实验现象为石蕊试液________。
(2)②中的品红溶液________,证明SO2具有________性。
(3)③中的涉及的化学反应方程式________。
(4)④中的实验现象是________,证明SO2有________性。
(5)⑤装置的作用是________。
21.某化学兴趣小组欲设计使用如下装置探究:铜和一定量的浓硝酸反应是否有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,不考虑浓硝酸的挥发,且忽略反应中的溶液体积变化)
试回答下列问题:
(1)铜粉的作用是___________________;将铜粉分散在是石棉绒中的原因_____________。
(2)在铜和浓硝酸反应前,关闭k3,打开k1、k2 ,挤压打气球,经A、B、C反应后,进入D中的气体是_____(填化学式)。
(3)关闭k1、k2,打开k3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:____________;
(4)E装置中发生反应的化学方程式为_____________________________。
(5)从E装置所得溶液中取出25.00mL,用0.1000 mol/L的NaOH溶液进行中和,当恰好呈中性时消耗NaOH溶液18.00mL,则E中所得硝酸的物质的量浓度为_________mol/L,若实验测得F装置所收集到的气体体积为139.00 mL,则气体的成分为_________(填化学式),则铜和一定量的浓硝酸反应有______ mL NO生成。
参考答案:
1.A
【来源】陕西省渭南市大荔县2020-2021学年高一上学期期末考试化学试题
【详解】A.光导纤维的主要成分是二氧化硅,故A错误;
B.常温下,铁遇浓硫酸发生钝化,可阻止铁与浓硫酸继续反应,因此可用铁铜储存浓硫酸,故B正确;
C.氯气溶于水反应产生次氯酸,HClO具有强氧化性,可杀菌、消毒,故C正确;
D.碳酸钠溶于水,水解显碱性,可使油脂发生水解反应溶解,故D正确;
故选:A。
2.C
【来源】云南省楚雄州2021-2022学年高一上学期期末教育学业质量监测化学试题
【详解】A.摊晾主要是蒸发部分水分,使茎、叶萎蔫,A项不符合题意;
B.揉捻是塑形工序,通过揉捻可形成紧结弯曲的外形,B项不符合题意;
C.发酵过程中发生了复杂的化学变化,生成了新的物质,C项符合题意;
D.渥堆通常会造成茶青结块,所以在出堆以后采用传统手工分解,D项不符合题意;
故选C。
3.C
【来源】【百强校】2015-2016年内蒙古巴彦淖尔一中高二下4月考化学卷(带解析)
【详解】试题分析:A、Al2O3的熔点很高,可用作高温耐火材料,故A正确;B、漂白粉具有强氧化性能够将有色物质氧化褪色,可以漂白织物,故B正确;C、浓硫酸与二氧化硅不反应,应用氢氟酸,故C错误;D、碳酸氢钠能够与盐酸反应,且碱性较弱,可用于治疗胃酸过多,故D正确;故选C。
考点:考查了化学与生活的相关知识。
4.D
【来源】西藏自治区林芝市第二高级中学2019-2020学年高一下学期第一学段考试化学试题
【详解】A.N2中N元素的化合价可以降低变成NH3,也可以升高生成NO等,故N2既可作氧化剂又可做还原剂,故A正确;
B.雷雨天时,发生自然固氮,空气中N2和O2可反应生成NO,故B正确;
C.氮的固定是将空气中游离态的氮(N2)转化为含氮化合物的过程,故C正确;
D.NO与空气中的氧气反应生成二氧化氮,所以一氧化氮在空气中不能稳定存在,故D错误;
答案选D。
5.C
【来源】江苏省苏北四市2020届高三上学期期末考试化学试题
【详解】A. 液氨气化能够吸收大量热,因此可作制冷剂,A项错误;
B. NaClO溶液具有较强的氧化性,因此可用作杀菌消毒,B项错误;
C. 浓硫酸具有吸水性,因此可用作干燥剂,C项正确;
D. Al2O3具有很高的熔点,因此可用作耐高温材料,D项错误;
答案选C。
6.B
【来源】江苏省淮安市淮安区2021-2022学年高一上学期期中调研测试化学试题
【详解】A.H2相对分子质量比空气小,不能用向上排空气法收集,A不符合题意;
B.O2的相对分子质量比空气大,且不易溶于水,既能用向上排空气法又能用排水集气法收集,B符合题意;
C.NO能与空气中的O2发生反应,不能用排空气法收集,C不符合题意;
D.HCl易溶于水,不能用排水法收集,D不符合题意;
故选B。
7.C
【来源】上海市上海财经大学附属中学2019——2020学年高三上学期期中考试化学试题
【详解】①Cl2具有很强的氧化性,可作氧化剂,但在和水以及强碱的反应中既做氧化剂,又做还原剂,故错误;
②二氧化硫做漂白剂是因为其具有漂白性,与还原性无关,故错误;
③硝酸分解生成红棕色二氧化氮,二氧化氮溶于水导致浓硝酸呈黄色,故正确;
④浓H2SO4具有强氧化性,浓硫酸和铜加热反应生成硫酸铜、二氧化硫和水,故错误;
⑤SO2通入溴水发生氧化还原反应生成硫酸和HBr,则加热颜色不会恢复,故错误;
⑥金刚石和氧气反应生成二氧化碳,故错误;
正确的有③;
故答案为C。
8.B
【来源】【百强校】2015-2016学年山西省太原五中高二5月月考文科化学试卷(带解析)
【详解】A.黄色的氯化铁溶液中加入足量铁粉,发生Fe+2Fe3+=3Fe2+,溶液颜色由黄色变为浅绿色,A不符合题意;
B.往稀硫酸中通入氨气,发生2NH3+H2SO4=(NH4)2SO4溶液由无色到无色,没有颜色的变化,B符合题意;
C.往品红溶液中通入足量二氧化硫气体,溶液由红色变为无色,C不符合题意;
D.一氧化氮气体暴露在空气中,发生2NO+O2=2NO2,气体颜色由无色变为红棕色,D不符合题意;
答案选B。
9.D
【来源】安徽省淮北市2020届高三第一次模拟考试化学试题
【详解】A.pH=9的溶液呈碱性,碱性条件下Fe3+生成沉淀,且Fe3+、SCN-发生络合反应而不能大量共存,故A错误;
B.能和反应的离子不能大量共存,酸性条件下生成S和二氧化硫而不能大量存在,故B错误;
C.能和氯化铵反应的离子不能大量共存,铵根离子和OH-生成弱电解质而不能大量共存,Li+、OH-不能大量共存,故C错误;
D.酸性溶液中含有大量氢离子,无色溶液不含有色离子,这几种离子都无色且和氢离子不反应,所以能大量共存,故D正确;
故选:D。
【点睛】为硫代硫酸根,与氢离子可以发生反应: 。
10.A
【来源】四川省甘孜州康定中学2022-2023学年高一下学期3月月考化学试题
【详解】A.0.5molNO与NO2的混合气体中N原子的物质的量为0.5mol,含有0.5NA个N原子,A正确;
B.气体所处的状态未知,2.24LO2的物质的量不一定是0.1mol,B错误;
C.N2(g)+3H2(g)2NH3(g)是可逆反应,1molN2和3molH2不可能完全反应生成2molNH3,C错误;
D.溶液的体积未知,不能计算氢离子数目,D错误;
故选A。
11.A
【来源】黑龙江省大庆实验中学2022-2023学年高三上学期开学考试化学试题
【详解】A.氢氧化钠和二氧化硅生成硅酸钠,硅酸钠和盐酸生成硅酸沉淀,A正确;
B.和硫酸生成硫酸铜溶液,加入钠会先和水反应生成氢氧化钠,氢氧化钠和硫酸铜生成氢氧化铜沉淀,B错误;
C.铁和氯气燃烧生成氯化铁,C错误;
D.碳化钙和水反应,不存在碳化钙溶液,D错误;
故选A。
12.A
【来源】江苏省泰州市海陵区2021届高三上学期第一次月考化学试题
【详解】A.Fe具有还原性,能还原铁离子,所以过量的Fe与硝酸反应生成Fe(NO3)2,不能生成Fe(NO3)3,故A错误;
B.KAl(SO4)2 12H2O溶于水发生电离,电离出铝离子,铝离子水解生成氢氧化铝胶体,故B正确;
C.铵盐与强碱在加热条件下能反应生成氨气,所以NH4Cl与Ca(OH)2混合加热可生成NH3,故C正确;
D.铁离子有氧化性,能氧化Cu,则Cu与FeCl3溶液反应可生成CuCl2,故D正确;
答案选A。
13.A
【来源】宁夏银川一中2021-2022学年高三上学期第二次月考理科综合化学试题
【详解】A.在MgCl2溶液中加入足量石灰乳,Ca(OH)2形成悬浊液,在离子方程式中以化学式表示,与MgCl2发生复分解反应,离子方程式为Mg2++Ca(OH)2=Mg(OH)2+Ca2+,A正确;
B.Al(OH)3不溶于过量的氨水,所以往AlCl3溶液中加入过量浓氨水,只能发生复分解反应,最终生成NH4Cl和Al(OH)3沉淀,B不正确;
C.硝酸不仅能表现出酸性,还能表现出强氧化性,所以将FeO溶于少量稀硝酸,最终生成Fe3+、NO和H2O,C不正确;
D.设KAl(SO4)2物质的量为1mol,则滴加Ba(OH)2溶液至恰好完全沉淀,需加入Ba(OH)22mol,最终铝元素应转化为,D不正确;
故选A。
14.A
【来源】河南省焦作市2022-2023学年高一下学期4月期中考试化学试题
【详解】A.新制氯水中含有氢离子和HClO,HClO具有漂白性,可使石蕊溶液先变红后褪色,A正确;
B.碳酸根、碳酸氢根都能和盐酸反应产生二氧化碳,且能使澄清石灰水变浑浊的气体可能为SO2,则原溶液中可能含有或等,不一定含有CO,B错误;
C.向 Fe(NO3)2溶液中滴加盐酸,和H+的组合具有强氧化性,能将Fe2+氧化为Fe3+,而不是因为盐酸具有强氧化性,C错误;
D.若原溶液中含有硫酸根离子,往溶液中滴加硝酸银溶液产生Ag2SO4白色沉淀,再加入过量硫酸,沉淀也不消失,由此可知原溶液中不一定含有 Cl ,D错误;
故选A。
15.B
【来源】广西钦州市2021-2022学年高一上学期期末考试化学试题
【详解】A.SO2具有一定的还原性,能够消耗食品包装中的氧气,防止食品氧化变质,故适量的添加SO2可用作食品添加剂,A正确;
B.小苏打能够与胃酸发生反应,降低胃酸的浓度,因而可用于治疗胃酸过多。但若该病人同时还患有胃溃疡,由于小苏打与胃酸反应会产生CO2气体,容易导致胃穿孔,因此不可用于治疗患有胃溃疡病的病人的胃酸过多,B错误;
C.硅和锗离子元素都处于元素周期表金属与非金属分界线附近,元素既有金属性又有非金属性,单质的导电性介于导体和绝缘体之间,因此可作半导体材料,C正确;
D.Na2O2能够与人呼吸产生的CO2、H2O反应产生O2,故可用于潜水艇中作供氧剂,D正确;
故合理选项是B。
16.(1)E
(2)C
(3)D
(4)F
(5)B
【来源】四川省攀枝花市成都外国语学校2021-2022学年高一上学期期中考试化学试题
【解析】(1)
泥沙不溶于水,所以分离饱和食盐水与泥沙的混合物使用过滤,选E;
(2)
水和汽油是不能相溶的液体,所以采取分液的方法分离,选C;
(3)
四氯化碳和甲苯是能够相溶的两种液体且沸点差异较大,采取蒸馏的方法分离,选D;
(4)
碳酸钙受热分解生成氧化钙,故采取加热分解法除去氧化钙中少量碳酸钙,选F;
(5)
硝酸钾的溶解度随温度变化较大,氯化钠的溶解度随温度变化较小,采取降温结晶的方法从含硝酸钾和氯化钠的混合液中分离出硝酸钾,选B。
17.正确
【来源】课前-5.2.1氮气和氮氧化物-人教2019必修第二册
【解析】略
18. 1.978kg 2.5mol/L 1.33吨 2:9 0.918
【来源】上海市六校2015年高三下学期第二次联考化学试题
【详解】(1)1kg 98%的浓硫酸中H2SO4的质量为1kg×98%=0.98g,故H2O的质量为1kg-0.98g=0.02kg,由H2O+SO3=H2SO4,可知生成H2SO4的质量为0.02kg×,故H2SO4总质量=0.98g+0.02kg×=kg,根据关系式H2SO4~H2SO4 SO3,可知得到发烟硫酸质量为:kg×=1.978kg,故答案为:1.978;
(2)H2SO4 SO3的物质的量为=5mol,根据硫元素守恒n(H2SO4)=2n(H2SO4 SO3)=10mol,该硫酸的物质的量浓度为=2.5mol/L,故答案为:2.5;
(3)①设理论上可生产x吨98%的浓硫酸,则:
所以120:2×98=1吨×80%:x吨×98%,解得x=1.33答:理论上可生产1.33吨98%的浓硫酸;
②根据硫元素守恒,n(SO2)=2n(FeS2)=48mol,消耗氧气物质的量为65.5mol,设Fe3O4、Fe2O3物质的量分别为xmol、
ymol,根据Fe原子守恒、O原子守恒,则:
解得:,故Fe3O4、Fe2O3物质的量之比为2:9,答:反应产物中Fe3O4与Fe2O3物质的量之比为2:9;
(4)98%的浓硫酸中H2SO4、H2O的物质的量之比为,98%的浓硫酸化学式可以表示为H2SO4,H2O,假设硫化氢为amol,整个过程中SO2损失2%,则S元素利用率为98%,根据S元素守恒,H2SO4,H2O的物质的量amol×98%,根据H原子守恒,硫化氢与水蒸气总物质的量为amol×98%×(1+)=,故硫化氢的体积分数为,答:0.918。
19.(1)酒精灯
(2)漂白性
(3)红色
(4)NaOH
(5)1
【来源】甘肃省天水市第一中学2021-2022学年高一下学期第一次学业水平检测化学试题
【分析】铜与浓硫酸在加热条件下发生反应生成硫酸铜、二氧化硫和水,装置B是为了验证二氧化硫的漂白性,生成的气体经过装置B,品红溶液会褪色,装置C的目的是为了验证二氧化硫的酸性,装置D为尾气处理装置,吸收多余二氧化硫,防止污染环境,据此结合二氧化硫性质分析解答。
【详解】(1)根据仪器结构可知,仪器a的名称是酒精灯;
(2)二氧化硫能使品红溶液褪色,说明二氧化硫具有漂白性;
(3)二氧化硫水溶液呈酸性,所以将二氧化硫通入石蕊溶液,溶液会变为红色,二氧化硫不能漂白石蕊溶液,所以最终变为红色;
(4)二氧化硫为酸性气体,所以尾气处理装置中应盛放碱性溶液,故答案为:NaOH;
(5)根据方程式可知,二氧化硫转化为硫酸,S元素化合价升高,根据电子转移数守恒可知,当参加反应时,转移电子的物质的量是=1 mol。
20.(1)变红
(2) 褪色 漂白
(3)SO2+2H2S=3S+2H2O
(4) 高锰酸钾溶液褪色 还原
(5)吸收二氧化硫,防止二氧化硫污染环境
【来源】新疆乌苏市第一中学2021-2022学年高一下学期3月月考化学试题(平行班)
【分析】浓硫酸与Na2SO3溶液反应制取SO2,SO2气体溶于水生成酸性的H2SO3使石蕊溶液变红,使品红溶液褪色,与H2S溶液反应生成S单质,与KMnO4溶液发生氧化还原反应,尾气被NaOH吸收。
(1)
据分析,①中的实验现象为石蕊试液变红。
(2)
据分析,②中的品红溶液褪色;证明SO2具有漂白性。
(3)
据分析,③中SO2与H2S反应生成S,涉及的化学反应方程式SO2+2H2S=3S+2H2O。
(4)
据分析,④中SO2与KMnO4溶液发生氧化还原反应,实验现象是高锰酸钾溶液褪色;证明SO2有还原性。
(5)
SO2是污染性气体,为防止污染环境,对SO2尾气用NaOH溶液吸收,⑤装置的作用是吸收二氧化硫,防止二氧化硫污染环境。
21. 除去空气中的氧气,防止干扰实验 增大铜粉与氧的接触面积使反应充分 N2 Cu+2NO- 3+4H+=Cu2++2NO2↑+2H2O 3NO2+H2O=2HNO3+NO 0.0720 N2 和NO 8.36
【来源】安徽师范大学附属中学2017-2018学年高一下学期期中考试化学试题
【详解】(1)铜粉的作用是除去空气中的氧气,防止干扰实验;将铜粉分散在是石棉绒中的原因增大铜粉与氧的接触面积使反应充分;
(2)气球中的空气成分主要是氧气、氮气、二氧化碳、水蒸气等,通过氢氧化钠溶液除去二氧化碳,通过浓硫酸除去水蒸气;C装置是反应掉空气中的氧气,所以进入D装置的气体主要是N2;
(3)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸,一定发生的反应是铜和浓硝酸反应生成硝酸铜、二氧化氮和水,可能发生的反应是浓硝酸变稀后和铜的反应生成硝酸铜、一氧化氮和水;因此D中一定发生反应的离子方程式:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O;
(4)E装置中二氧化氮与水反应生成硝酸和一氧化氮,发生反应的化学方程式为3NO2+H2O=2HNO3+NO;
(5)从E装置所得溶液中取出25.00mL,用0.1000mol/L的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,则设硝酸浓度为C,发生的反应实质是H++OH-=H2O,所以25.00mL×C=18.00mL×0.1000mol/L,解得C=0.0720mol/L; E装置中生成的硝酸溶液体积为100mL,浓度为0.0720mol/L,所以生成硝酸物质的量为0.0072mol,根据化学方程式3NO2+H2O=2HNO3+NO,生成的一氧化氮气体物质的量为0.0036mol,在标准状况下的体积=0.0036mol×22.4L/mol=0.08064L=80.64ml,而试管中原有50 mL N2,二者之和为80.64 mL+ 50 mL=130.64 mL。而测得F装置所收集到的气体体积为139.00 mL,说明生成NO2的同时有NO生成,且生成的NO体积为139.00mL–130.64 mL=8.36 mL。
一、单选题
1.化学在生活中有着广泛的应用,下列说法不正确的是
A.光导纤维的主要成分是晶体硅 B.用铁桶可以装浓硫酸
C.自来水可以用氯气来杀菌、消毒 D.碳酸钠可用于去除餐具的油污
2.云南是茶的故乡,普洱茶是云南的一张名片。普洱熟茶的制作过程主要包括采摘、摊晾、杀青、揉捻、渥堆发酵、出堆解块等操作,下列普洱熟茶的制作过程中以化学反应为主的是
A B C D
摊晾 揉捻 渥堆发酵 出堆解块
A.A B.B C.C D.D
3.化学与日常生活密切相关,下列说法错误的是
A.Al2O3可用作高温耐火材料 B.利用漂白粉的氧化性漂白织物
C.浓硫酸可刻蚀石英制艺术品 D.在医疗上碳酸氢钠可用于治疗胃酸过多
4.下列关于N2的叙述错误的是
A.N2既可作氧化剂又可做还原剂
B.雷雨天,空气中的N2和O2可反应生成NO
C.氮的固定是将N2转化成含氮化合物
D.NO和NO2都可稳定存在于空气中
5.下列有关物质的性质与用途具有对应关系的是( )
A.NH3具有还原性,可用作制冷剂 B.NaClO溶液显碱性,可用作杀菌消毒
C.浓硫酸具有吸水性,可用作干燥剂 D.Al2O3具有两性,可用作耐高温材料
6.下列气体的收集中,既能用向上排空气法又能用排水集气法收集的气体是
A.H2 B.O2 C.NO D.HCl
7.某小组辨析非金属及其化合物,下列说法正确的是( )
①Cl2具有很强的氧化性,在化学反应中只能作氧化剂
②SO2具有还原性,故可作漂白剂
③浓硝酸中的HNO3见光会分解,故浓硝酸呈黄色
④浓硫酸有强氧化性,不能与Cu发生反应
⑤将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,褪色后加热也能恢复原色
⑥金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
A.①③⑤ B.②④⑥ C.③ D.均不正确
8.下列反应中,观察不到颜色变化的是
A.黄色的氯化铁溶液中加入足量铁粉
B.往稀硫酸中通入氨气
C.往品红溶液中通入足量二氧化硫气体
D.一氧化氮气体暴露在空气中
9.下列条件下,可以大量共存的离子组是( )
A.pH=9的溶液中:Na+、Fe3+、,SCN-
B.含有大量S2O32-的溶液中:H+、K+、、Al3+
C.0.1mol L-1的NH4Cl溶液中:Li+、Ba2+、CH3COO-、OH-
D.某酸性无色透明溶液中:Na+、I-、Cl-、Mg2+
10.NA表示阿伏加德罗常数的数值,下列说法正确的是
A.25℃,101KPa,0.5molNO与NO2的混合气体中含有0.5NA个N原子
B.由H2O2制得2.24LO2,转移的电子数目为0.2NA
C.1molN2和3molH2完全反应生成2molNH3
D.常温下,0.01mol/L的H2SO4溶液中含有的H+数目为0.02NA
11.在给定条件下,下列选项中所示的物质间转化合理的是
A.
B.
C.
D.
12.下列有关物质性质的叙述一定不正确的是
A.过量铁粉与硝酸反应生成Fe(NO3)3
B.KAl(SO4)2 12H2O溶于水可形成Al(OH)3胶体
C.NH4Cl与Ca(OH)2混合加热可生成NH3
D.Cu与FeCl3溶液反应可生成CuCl2
13.下列指定反应的离子方程式正确的是
A.0.1mol·L-1MgCl2溶液中加入足量石灰乳:Mg2++Ca(OH)2=Mg(OH)2+Ca2+
B.0.1mol·L-1AlCl3溶液中加入过量浓氨水:Al3++4NH3·H2O=+2H2O+4
C.FeO溶于少量稀硝酸:FeO+2H+=Fe2++H2O
D.向KAl(SO4)2溶液中滴加Ba(OH)2溶液至恰好完全沉淀:Al3++2+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓
14.根据下列实验操作和现象所得出的结论正确的是
选项 实验操作和现象 结论
A 将石蕊溶液滴入新制氯水中,溶液先变红后褪色 新制氯水具有酸性和漂白性
B 向某溶液中滴加盐酸,产生使澄清石灰水变浑浊的气体 原溶液一定含有
C 向溶液中滴加盐酸,溶液变为浅黄色 盐酸显强氧化性,将转为
D 向某溶液中滴加硝酸银溶液产生白色沉淀,再加入过量硫酸,沉淀不消失 原溶液中一定含有
A.A B.B C.C D.D
15.关于物质的相关用途,下列说法错误的是
A.SO2可用作食品添加剂 B.小苏打可用于治疗胃溃疡
C.硅和锗可作半导体材料 D.Na2O2可用于潜水艇中作供氧剂
二、填空题
16.选取下列实验方法分离物质,将分离方法的字母填在横线上:
A.萃取、分液法 B.结晶法 C.分液法 D.蒸馏法 E.过滤法 F.加热分解法 G.升华法
(1)___________分离饱和食盐水与泥沙的混合物。
(2)___________分离水和汽油的混合物。
(3)___________分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
(4)___________除去氧化钙中少量碳酸钙。
(5)___________从含硝酸钾和氯化钠的混合液中分离出硝酸钾。
17.由于NO极易与O2反应,并且其密度与空气相差不多,因此收集NO只能用排水法。(__)
18.硫酸是重要的化工生产原料,工业上常用硫铁矿焙烧生成SO2,SO2氧化到SO3,再用98.3%左右的浓硫酸吸收SO3得到“发烟”硫酸(H2SO4·SO3)。最后用制得的“发烟”硫酸配制各种不同浓度的硫酸用于工业生产。
完成下列计算:
(1)1kg98%的浓硫酸吸收SO3后,可生产___kg“发烟”硫酸。
(2)“发烟”硫酸(H2SO4·SO3)溶于水,其中SO3都转化为硫酸。若将890g“发烟”硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为___mol/L。
(3)硫铁矿氧化焙烧的化学反应如下:3FeS2+8O2→Fe3O4+6SO24FeS2+11O2→2Fe2O3+8SO2
①1吨含FeS280%的硫铁矿,理论上可生产多少吨98%的浓硫酸__
②若24molFeS2完全反应耗用氧气1467.2L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比___。
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。硫化氢与水蒸气的混合气体在空气中完全燃烧,再经过催化氧化冷却制得了98%的浓硫酸(整个过程中SO2损失2%,不补充水不损失水)求硫化氢在混合气中的体积分数___。
三、实验题
19.已知反应:,某化学兴趣小组用如图所示装置制取SO2,并进行相关性质实验。
请回答下列问题:
(1)仪器a的名称是_______;
(2)B中品红溶液褪色,说明SO2具有_______(填“漂白性”或“还原性”);
(3)C中石蕊溶液变为_______(填“蓝色”或“红色”);
(4)为防止SO2污染环境,D中可选用_______(填“NaOH”或“H2SO4”)溶液;
(5)酸性条件下,SO2与发生如下反应:,使溶液褪色。当参加反应时,转移电子的物质的量是_______mol。
20.下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:
(1)①中的实验现象为石蕊试液________。
(2)②中的品红溶液________,证明SO2具有________性。
(3)③中的涉及的化学反应方程式________。
(4)④中的实验现象是________,证明SO2有________性。
(5)⑤装置的作用是________。
21.某化学兴趣小组欲设计使用如下装置探究:铜和一定量的浓硝酸反应是否有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,不考虑浓硝酸的挥发,且忽略反应中的溶液体积变化)
试回答下列问题:
(1)铜粉的作用是___________________;将铜粉分散在是石棉绒中的原因_____________。
(2)在铜和浓硝酸反应前,关闭k3,打开k1、k2 ,挤压打气球,经A、B、C反应后,进入D中的气体是_____(填化学式)。
(3)关闭k1、k2,打开k3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:____________;
(4)E装置中发生反应的化学方程式为_____________________________。
(5)从E装置所得溶液中取出25.00mL,用0.1000 mol/L的NaOH溶液进行中和,当恰好呈中性时消耗NaOH溶液18.00mL,则E中所得硝酸的物质的量浓度为_________mol/L,若实验测得F装置所收集到的气体体积为139.00 mL,则气体的成分为_________(填化学式),则铜和一定量的浓硝酸反应有______ mL NO生成。
参考答案:
1.A
【来源】陕西省渭南市大荔县2020-2021学年高一上学期期末考试化学试题
【详解】A.光导纤维的主要成分是二氧化硅,故A错误;
B.常温下,铁遇浓硫酸发生钝化,可阻止铁与浓硫酸继续反应,因此可用铁铜储存浓硫酸,故B正确;
C.氯气溶于水反应产生次氯酸,HClO具有强氧化性,可杀菌、消毒,故C正确;
D.碳酸钠溶于水,水解显碱性,可使油脂发生水解反应溶解,故D正确;
故选:A。
2.C
【来源】云南省楚雄州2021-2022学年高一上学期期末教育学业质量监测化学试题
【详解】A.摊晾主要是蒸发部分水分,使茎、叶萎蔫,A项不符合题意;
B.揉捻是塑形工序,通过揉捻可形成紧结弯曲的外形,B项不符合题意;
C.发酵过程中发生了复杂的化学变化,生成了新的物质,C项符合题意;
D.渥堆通常会造成茶青结块,所以在出堆以后采用传统手工分解,D项不符合题意;
故选C。
3.C
【来源】【百强校】2015-2016年内蒙古巴彦淖尔一中高二下4月考化学卷(带解析)
【详解】试题分析:A、Al2O3的熔点很高,可用作高温耐火材料,故A正确;B、漂白粉具有强氧化性能够将有色物质氧化褪色,可以漂白织物,故B正确;C、浓硫酸与二氧化硅不反应,应用氢氟酸,故C错误;D、碳酸氢钠能够与盐酸反应,且碱性较弱,可用于治疗胃酸过多,故D正确;故选C。
考点:考查了化学与生活的相关知识。
4.D
【来源】西藏自治区林芝市第二高级中学2019-2020学年高一下学期第一学段考试化学试题
【详解】A.N2中N元素的化合价可以降低变成NH3,也可以升高生成NO等,故N2既可作氧化剂又可做还原剂,故A正确;
B.雷雨天时,发生自然固氮,空气中N2和O2可反应生成NO,故B正确;
C.氮的固定是将空气中游离态的氮(N2)转化为含氮化合物的过程,故C正确;
D.NO与空气中的氧气反应生成二氧化氮,所以一氧化氮在空气中不能稳定存在,故D错误;
答案选D。
5.C
【来源】江苏省苏北四市2020届高三上学期期末考试化学试题
【详解】A. 液氨气化能够吸收大量热,因此可作制冷剂,A项错误;
B. NaClO溶液具有较强的氧化性,因此可用作杀菌消毒,B项错误;
C. 浓硫酸具有吸水性,因此可用作干燥剂,C项正确;
D. Al2O3具有很高的熔点,因此可用作耐高温材料,D项错误;
答案选C。
6.B
【来源】江苏省淮安市淮安区2021-2022学年高一上学期期中调研测试化学试题
【详解】A.H2相对分子质量比空气小,不能用向上排空气法收集,A不符合题意;
B.O2的相对分子质量比空气大,且不易溶于水,既能用向上排空气法又能用排水集气法收集,B符合题意;
C.NO能与空气中的O2发生反应,不能用排空气法收集,C不符合题意;
D.HCl易溶于水,不能用排水法收集,D不符合题意;
故选B。
7.C
【来源】上海市上海财经大学附属中学2019——2020学年高三上学期期中考试化学试题
【详解】①Cl2具有很强的氧化性,可作氧化剂,但在和水以及强碱的反应中既做氧化剂,又做还原剂,故错误;
②二氧化硫做漂白剂是因为其具有漂白性,与还原性无关,故错误;
③硝酸分解生成红棕色二氧化氮,二氧化氮溶于水导致浓硝酸呈黄色,故正确;
④浓H2SO4具有强氧化性,浓硫酸和铜加热反应生成硫酸铜、二氧化硫和水,故错误;
⑤SO2通入溴水发生氧化还原反应生成硫酸和HBr,则加热颜色不会恢复,故错误;
⑥金刚石和氧气反应生成二氧化碳,故错误;
正确的有③;
故答案为C。
8.B
【来源】【百强校】2015-2016学年山西省太原五中高二5月月考文科化学试卷(带解析)
【详解】A.黄色的氯化铁溶液中加入足量铁粉,发生Fe+2Fe3+=3Fe2+,溶液颜色由黄色变为浅绿色,A不符合题意;
B.往稀硫酸中通入氨气,发生2NH3+H2SO4=(NH4)2SO4溶液由无色到无色,没有颜色的变化,B符合题意;
C.往品红溶液中通入足量二氧化硫气体,溶液由红色变为无色,C不符合题意;
D.一氧化氮气体暴露在空气中,发生2NO+O2=2NO2,气体颜色由无色变为红棕色,D不符合题意;
答案选B。
9.D
【来源】安徽省淮北市2020届高三第一次模拟考试化学试题
【详解】A.pH=9的溶液呈碱性,碱性条件下Fe3+生成沉淀,且Fe3+、SCN-发生络合反应而不能大量共存,故A错误;
B.能和反应的离子不能大量共存,酸性条件下生成S和二氧化硫而不能大量存在,故B错误;
C.能和氯化铵反应的离子不能大量共存,铵根离子和OH-生成弱电解质而不能大量共存,Li+、OH-不能大量共存,故C错误;
D.酸性溶液中含有大量氢离子,无色溶液不含有色离子,这几种离子都无色且和氢离子不反应,所以能大量共存,故D正确;
故选:D。
【点睛】为硫代硫酸根,与氢离子可以发生反应: 。
10.A
【来源】四川省甘孜州康定中学2022-2023学年高一下学期3月月考化学试题
【详解】A.0.5molNO与NO2的混合气体中N原子的物质的量为0.5mol,含有0.5NA个N原子,A正确;
B.气体所处的状态未知,2.24LO2的物质的量不一定是0.1mol,B错误;
C.N2(g)+3H2(g)2NH3(g)是可逆反应,1molN2和3molH2不可能完全反应生成2molNH3,C错误;
D.溶液的体积未知,不能计算氢离子数目,D错误;
故选A。
11.A
【来源】黑龙江省大庆实验中学2022-2023学年高三上学期开学考试化学试题
【详解】A.氢氧化钠和二氧化硅生成硅酸钠,硅酸钠和盐酸生成硅酸沉淀,A正确;
B.和硫酸生成硫酸铜溶液,加入钠会先和水反应生成氢氧化钠,氢氧化钠和硫酸铜生成氢氧化铜沉淀,B错误;
C.铁和氯气燃烧生成氯化铁,C错误;
D.碳化钙和水反应,不存在碳化钙溶液,D错误;
故选A。
12.A
【来源】江苏省泰州市海陵区2021届高三上学期第一次月考化学试题
【详解】A.Fe具有还原性,能还原铁离子,所以过量的Fe与硝酸反应生成Fe(NO3)2,不能生成Fe(NO3)3,故A错误;
B.KAl(SO4)2 12H2O溶于水发生电离,电离出铝离子,铝离子水解生成氢氧化铝胶体,故B正确;
C.铵盐与强碱在加热条件下能反应生成氨气,所以NH4Cl与Ca(OH)2混合加热可生成NH3,故C正确;
D.铁离子有氧化性,能氧化Cu,则Cu与FeCl3溶液反应可生成CuCl2,故D正确;
答案选A。
13.A
【来源】宁夏银川一中2021-2022学年高三上学期第二次月考理科综合化学试题
【详解】A.在MgCl2溶液中加入足量石灰乳,Ca(OH)2形成悬浊液,在离子方程式中以化学式表示,与MgCl2发生复分解反应,离子方程式为Mg2++Ca(OH)2=Mg(OH)2+Ca2+,A正确;
B.Al(OH)3不溶于过量的氨水,所以往AlCl3溶液中加入过量浓氨水,只能发生复分解反应,最终生成NH4Cl和Al(OH)3沉淀,B不正确;
C.硝酸不仅能表现出酸性,还能表现出强氧化性,所以将FeO溶于少量稀硝酸,最终生成Fe3+、NO和H2O,C不正确;
D.设KAl(SO4)2物质的量为1mol,则滴加Ba(OH)2溶液至恰好完全沉淀,需加入Ba(OH)22mol,最终铝元素应转化为,D不正确;
故选A。
14.A
【来源】河南省焦作市2022-2023学年高一下学期4月期中考试化学试题
【详解】A.新制氯水中含有氢离子和HClO,HClO具有漂白性,可使石蕊溶液先变红后褪色,A正确;
B.碳酸根、碳酸氢根都能和盐酸反应产生二氧化碳,且能使澄清石灰水变浑浊的气体可能为SO2,则原溶液中可能含有或等,不一定含有CO,B错误;
C.向 Fe(NO3)2溶液中滴加盐酸,和H+的组合具有强氧化性,能将Fe2+氧化为Fe3+,而不是因为盐酸具有强氧化性,C错误;
D.若原溶液中含有硫酸根离子,往溶液中滴加硝酸银溶液产生Ag2SO4白色沉淀,再加入过量硫酸,沉淀也不消失,由此可知原溶液中不一定含有 Cl ,D错误;
故选A。
15.B
【来源】广西钦州市2021-2022学年高一上学期期末考试化学试题
【详解】A.SO2具有一定的还原性,能够消耗食品包装中的氧气,防止食品氧化变质,故适量的添加SO2可用作食品添加剂,A正确;
B.小苏打能够与胃酸发生反应,降低胃酸的浓度,因而可用于治疗胃酸过多。但若该病人同时还患有胃溃疡,由于小苏打与胃酸反应会产生CO2气体,容易导致胃穿孔,因此不可用于治疗患有胃溃疡病的病人的胃酸过多,B错误;
C.硅和锗离子元素都处于元素周期表金属与非金属分界线附近,元素既有金属性又有非金属性,单质的导电性介于导体和绝缘体之间,因此可作半导体材料,C正确;
D.Na2O2能够与人呼吸产生的CO2、H2O反应产生O2,故可用于潜水艇中作供氧剂,D正确;
故合理选项是B。
16.(1)E
(2)C
(3)D
(4)F
(5)B
【来源】四川省攀枝花市成都外国语学校2021-2022学年高一上学期期中考试化学试题
【解析】(1)
泥沙不溶于水,所以分离饱和食盐水与泥沙的混合物使用过滤,选E;
(2)
水和汽油是不能相溶的液体,所以采取分液的方法分离,选C;
(3)
四氯化碳和甲苯是能够相溶的两种液体且沸点差异较大,采取蒸馏的方法分离,选D;
(4)
碳酸钙受热分解生成氧化钙,故采取加热分解法除去氧化钙中少量碳酸钙,选F;
(5)
硝酸钾的溶解度随温度变化较大,氯化钠的溶解度随温度变化较小,采取降温结晶的方法从含硝酸钾和氯化钠的混合液中分离出硝酸钾,选B。
17.正确
【来源】课前-5.2.1氮气和氮氧化物-人教2019必修第二册
【解析】略
18. 1.978kg 2.5mol/L 1.33吨 2:9 0.918
【来源】上海市六校2015年高三下学期第二次联考化学试题
【详解】(1)1kg 98%的浓硫酸中H2SO4的质量为1kg×98%=0.98g,故H2O的质量为1kg-0.98g=0.02kg,由H2O+SO3=H2SO4,可知生成H2SO4的质量为0.02kg×,故H2SO4总质量=0.98g+0.02kg×=kg,根据关系式H2SO4~H2SO4 SO3,可知得到发烟硫酸质量为:kg×=1.978kg,故答案为:1.978;
(2)H2SO4 SO3的物质的量为=5mol,根据硫元素守恒n(H2SO4)=2n(H2SO4 SO3)=10mol,该硫酸的物质的量浓度为=2.5mol/L,故答案为:2.5;
(3)①设理论上可生产x吨98%的浓硫酸,则:
所以120:2×98=1吨×80%:x吨×98%,解得x=1.33答:理论上可生产1.33吨98%的浓硫酸;
②根据硫元素守恒,n(SO2)=2n(FeS2)=48mol,消耗氧气物质的量为65.5mol,设Fe3O4、Fe2O3物质的量分别为xmol、
ymol,根据Fe原子守恒、O原子守恒,则:
解得:,故Fe3O4、Fe2O3物质的量之比为2:9,答:反应产物中Fe3O4与Fe2O3物质的量之比为2:9;
(4)98%的浓硫酸中H2SO4、H2O的物质的量之比为,98%的浓硫酸化学式可以表示为H2SO4,H2O,假设硫化氢为amol,整个过程中SO2损失2%,则S元素利用率为98%,根据S元素守恒,H2SO4,H2O的物质的量amol×98%,根据H原子守恒,硫化氢与水蒸气总物质的量为amol×98%×(1+)=,故硫化氢的体积分数为,答:0.918。
19.(1)酒精灯
(2)漂白性
(3)红色
(4)NaOH
(5)1
【来源】甘肃省天水市第一中学2021-2022学年高一下学期第一次学业水平检测化学试题
【分析】铜与浓硫酸在加热条件下发生反应生成硫酸铜、二氧化硫和水,装置B是为了验证二氧化硫的漂白性,生成的气体经过装置B,品红溶液会褪色,装置C的目的是为了验证二氧化硫的酸性,装置D为尾气处理装置,吸收多余二氧化硫,防止污染环境,据此结合二氧化硫性质分析解答。
【详解】(1)根据仪器结构可知,仪器a的名称是酒精灯;
(2)二氧化硫能使品红溶液褪色,说明二氧化硫具有漂白性;
(3)二氧化硫水溶液呈酸性,所以将二氧化硫通入石蕊溶液,溶液会变为红色,二氧化硫不能漂白石蕊溶液,所以最终变为红色;
(4)二氧化硫为酸性气体,所以尾气处理装置中应盛放碱性溶液,故答案为:NaOH;
(5)根据方程式可知,二氧化硫转化为硫酸,S元素化合价升高,根据电子转移数守恒可知,当参加反应时,转移电子的物质的量是=1 mol。
20.(1)变红
(2) 褪色 漂白
(3)SO2+2H2S=3S+2H2O
(4) 高锰酸钾溶液褪色 还原
(5)吸收二氧化硫,防止二氧化硫污染环境
【来源】新疆乌苏市第一中学2021-2022学年高一下学期3月月考化学试题(平行班)
【分析】浓硫酸与Na2SO3溶液反应制取SO2,SO2气体溶于水生成酸性的H2SO3使石蕊溶液变红,使品红溶液褪色,与H2S溶液反应生成S单质,与KMnO4溶液发生氧化还原反应,尾气被NaOH吸收。
(1)
据分析,①中的实验现象为石蕊试液变红。
(2)
据分析,②中的品红溶液褪色;证明SO2具有漂白性。
(3)
据分析,③中SO2与H2S反应生成S,涉及的化学反应方程式SO2+2H2S=3S+2H2O。
(4)
据分析,④中SO2与KMnO4溶液发生氧化还原反应,实验现象是高锰酸钾溶液褪色;证明SO2有还原性。
(5)
SO2是污染性气体,为防止污染环境,对SO2尾气用NaOH溶液吸收,⑤装置的作用是吸收二氧化硫,防止二氧化硫污染环境。
21. 除去空气中的氧气,防止干扰实验 增大铜粉与氧的接触面积使反应充分 N2 Cu+2NO- 3+4H+=Cu2++2NO2↑+2H2O 3NO2+H2O=2HNO3+NO 0.0720 N2 和NO 8.36
【来源】安徽师范大学附属中学2017-2018学年高一下学期期中考试化学试题
【详解】(1)铜粉的作用是除去空气中的氧气,防止干扰实验;将铜粉分散在是石棉绒中的原因增大铜粉与氧的接触面积使反应充分;
(2)气球中的空气成分主要是氧气、氮气、二氧化碳、水蒸气等,通过氢氧化钠溶液除去二氧化碳,通过浓硫酸除去水蒸气;C装置是反应掉空气中的氧气,所以进入D装置的气体主要是N2;
(3)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸,一定发生的反应是铜和浓硝酸反应生成硝酸铜、二氧化氮和水,可能发生的反应是浓硝酸变稀后和铜的反应生成硝酸铜、一氧化氮和水;因此D中一定发生反应的离子方程式:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O;
(4)E装置中二氧化氮与水反应生成硝酸和一氧化氮,发生反应的化学方程式为3NO2+H2O=2HNO3+NO;
(5)从E装置所得溶液中取出25.00mL,用0.1000mol/L的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,则设硝酸浓度为C,发生的反应实质是H++OH-=H2O,所以25.00mL×C=18.00mL×0.1000mol/L,解得C=0.0720mol/L; E装置中生成的硝酸溶液体积为100mL,浓度为0.0720mol/L,所以生成硝酸物质的量为0.0072mol,根据化学方程式3NO2+H2O=2HNO3+NO,生成的一氧化氮气体物质的量为0.0036mol,在标准状况下的体积=0.0036mol×22.4L/mol=0.08064L=80.64ml,而试管中原有50 mL N2,二者之和为80.64 mL+ 50 mL=130.64 mL。而测得F装置所收集到的气体体积为139.00 mL,说明生成NO2的同时有NO生成,且生成的NO体积为139.00mL–130.64 mL=8.36 mL。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
