第1章原子结构 元素周期律检测题 (含答案)高一下学期化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章原子结构 元素周期律检测题 (含答案)高一下学期化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 651.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-08 19:32:14 | ||
图片预览



文档简介
第1章《原子结构 元素周期律》检测题
一、单选题(共13题)
1.下列关于水玻璃的性质和用途的叙述中不正确的是
A.水玻璃是一种矿物胶,既不燃烧也不受腐蚀
B.水玻璃在建筑工业上可以作黏合剂、耐酸水泥掺料
C.木材、织物浸过水玻璃后具有防腐性能且不易燃烧
D.水玻璃的化学性质稳定,在空气中不易变质
2.某些建筑材料含有放射性元素氡Rn),会对人体产生一定危害。研究表明氡的α射线会致癌,WHO认定的19种致癌因素中,氡为其中之一,仅次于吸烟。该原子中中子数和质子数之差是( )
A.136 B.50 C.86 D.222
3.石棉是一类价格低廉的硅酸盐材料,但是有毒,能使人患肺癌。一种叫矿青石棉的化学式为:Na2Fe5Si8O22(OH)2。它用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是
A.该物质中Fe元素的化合价为+2价,它属于硅酸盐
B.该物质的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
C.1mol该物质能和18molHNO3反应,也能与含18molHCl的盐酸反应
D.这种石棉属于新型无机非金属材料
4.物质的性质决定用途,下列两者对应关系不正确的是
A.NaClO溶液有强氧化性,可用作漂白液
B.硅的导电性介于导体和绝缘体之间,可用于制造光导纤维
C.浓硫酸有吸水性,在实验室中常用作干燥剂
D.明矾溶于水形成胶体,可用于净水
5.下列有关物质的性质与用途具有对应关系的是
A.硅胶吸附水能力强,可用作食品干燥剂
B.Al2O3 熔点高,可用作电解冶炼铝的原料
C.浓硫酸具有强氧化性,可用作酯化反应的催化剂
D.次氯酸具有弱酸性,可用作有色物质的漂白剂
6.下列实验过程不能达到实验目的的是
选项 实验目的 实验过程
A 比较Al和Ni的活泼性 将Al和Ni用导线与电流表相连,并同时插入稀硫酸中,观察电流表指针的偏转
B 验证温度对反应速率的影响 在两支相同的试管中都加入3 mL H2O2溶液和2滴FeCl3溶液,一支放入40℃热水中,另一支放入5℃冷水中
C 在铁制的钥匙表面镀一层金属铜 将纯铜和钥匙分别与直流电源的正极和负极相连,同时插入CuSO4溶液中
D 验证元素非金属性强弱:Cl>C 向盐酸中加几粒石灰石,产生大量气体
A.A B.B C.C D.D
7.《流浪地球2》向观众展示了太空电梯、行星发动机、超级计算机550W等超前的科技幻想,探讨了数字生命、人工智能等科技伦理问题。它们与化学有着密切联系,下列说法不正确的是
A.我国“硅—石墨烯—锗高速晶体管”技术获重大突破,C、Si、Ge都是主族元素
B.我国提出网络强国战略,光纤线路总长超过三千万公里,光纤的主要成分是SiO2
C.新型陶瓷碳化硅(SiC)可作耐高温结构材料
D.富勒烯、石墨烯都是含碳化合物
8.我国“天问一号”火星探测器成功着陆火星,其中许多部件用铝锂合金制造。下列有关说法正确的是
A.锂位于周期表中第3周期ⅠA族
B.在第3周期的金属元素中,铝的金属性最强
C.铝锂合金的熔点比金属铝、金属锂的熔点都低
D.“天问一号”使用铝锂合金,主要利用其易导电的性质
9.下列两种物质互为同素异形体的是
A.O2和O3 B.H2SO4和H2SO3
C.胆矾和硫酸铜溶液 D.CO和CO2
10.科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图,W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法正确的是
A.氢化物的热稳定性:X>Y
B.元素X、Y各自最高和最低化合价的代数和分别为0、4
C.Y与Z可组成阴阳离子数之比为1:2的离子化合物
D.ZW与水反应生成W2的反应中,ZW为氧化剂
11.下列元素属于卤族元素的是:
A.F B.P C.He D.Li
12.下列关于现行的元素周期表的说法正确的是( )
A.元素周期表的非金属元素都位于主族和0族
B.第ⅠA族的元素全部都是金属元素
C.位于同一主族相邻的甲乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4
D.位于同一周期的甲乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙的原子序数可能为x+13
13.下列叙述正确的是
A.同一周期元素的原子,半径越小越容易失去电子
B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素
C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构
D.IA族与VIIA族元素间可形成共价化合物或离子化合物
二、非选择题(共10题)
14.有A、B、C、D、E五种元素,其中A、B、C位于同周期,A原子最外层p轨道电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成型化合物,已知在和中,D与B的质量比为7:8,E与B的质量比为1:1。根据以上条件,回答下列问题:
(1)画出C的原子结构示意图:______。
(2)写出D原子的价电子排布式:______。
(3)写出A元素的单质在B中完全燃烧的化学方程式:____________。
(4)指出E元素在周期表中的位置:______。
(5)A、B、C三种元素的第一电离能由大到小的顺序为______(用元素符号表示)。
(6)比较元素D和E电负性的大小:______(用元素符号表示)。
15.化学与人类社会可持续发展密切相关,环境、材料以及日常生活等都离不开化学。
(1)硅是无机非金属材料的主角,硅最重要的氧化物是二氧化硅,是玻璃的主要成分,那么存放氢氧化钠溶液的试剂瓶不用玻璃塞的原因是__________(用离子方程式表示);
(2)在呼吸面具和潜水艇中,常用Na2O2作供氧剂,该反应的化学方程式为_______,其中还原剂是_________,每生成1 mol O2转移_______mol e-;
(3)生活中常用漂白粉来杀菌消毒,其有效成分是_______;工业上制漂白粉的化学方程式为_______。
三、实验题
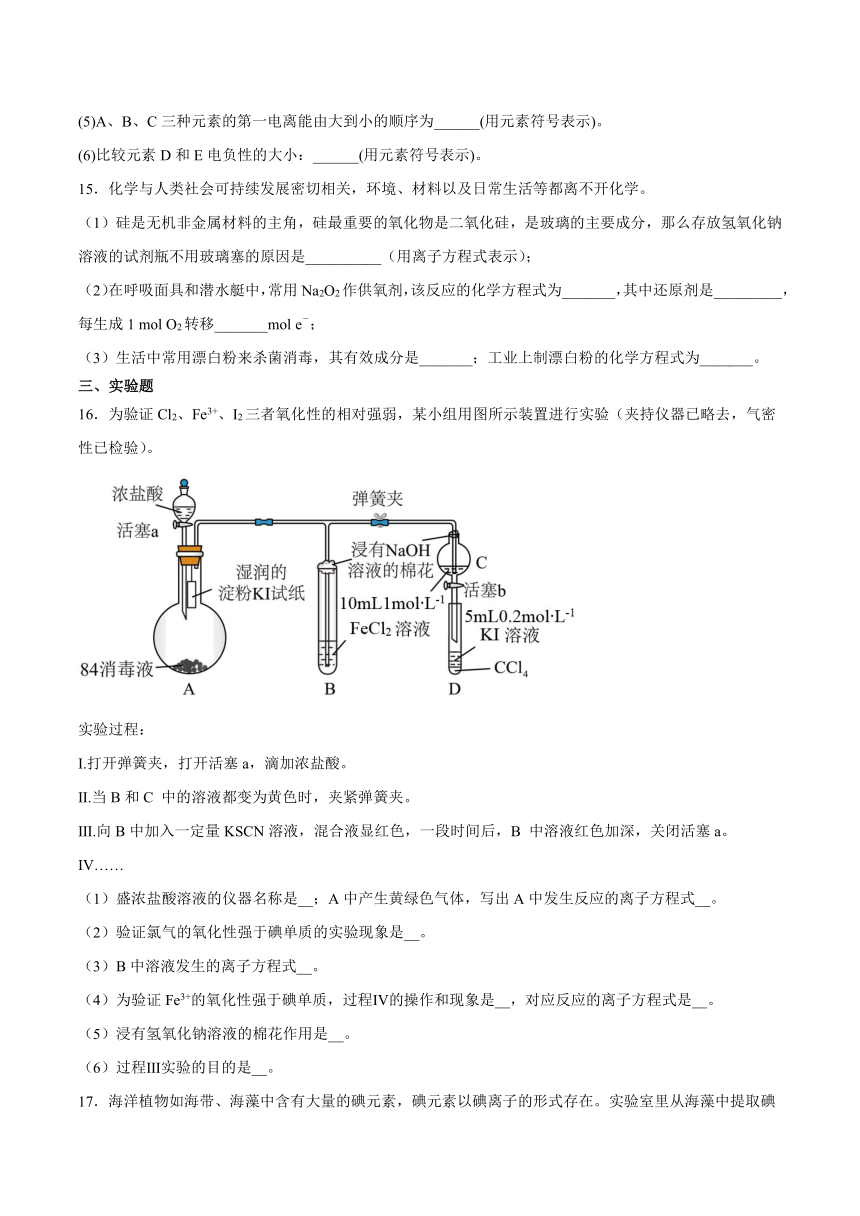
16.为验证Cl2、Fe3+、I2三者氧化性的相对强弱,某小组用图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C 中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,一段时间后,B 中溶液红色加深,关闭活塞a。
Ⅳ……
(1)盛浓盐酸溶液的仪器名称是__;A中产生黄绿色气体,写出A中发生反应的离子方程式__。
(2)验证氯气的氧化性强于碘单质的实验现象是__。
(3)B中溶液发生的离子方程式__。
(4)为验证Fe3+的氧化性强于碘单质,过程Ⅳ的操作和现象是__,对应反应的离子方程式是__。
(5)浸有氢氧化钠溶液的棉花作用是__。
(6)过程Ⅲ实验的目的是__。
17.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
(1)实验室灼烧海带,需要用到的仪器:酒精灯、铁三脚架、________、泥三角。
(2)提取碘的过程中实验操作①的名称是_____________。
(3)操作③不可选择的有机试剂是___________。
A.四氯化碳 B.苯 C.酒精 D.汽油
(4)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈___________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是______________________________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过下列实验装置蒸馏。
写出装置图中实验仪器①和②的名称:①_____________;②______________。
找出图中的错误之处:_______________________;________________________;
18.海洋资源应用非常广泛,从中可提取氯化钠、碘等化工产品。回答下列问题:
I.实验室用氯化钠固体配制1.0mol L-1的食盐水500mL。
(1)所需仪器为容量瓶(规格为____)、托盘天平、烧杯、玻璃棒和_____。
(2)配制时,下列操作对所配溶液的浓度有何影响?(填字母)无影响的有_____,偏大的有______,偏小的有_______。
A.称量时使用了生锈的砝码
B.往容量瓶中移液时,有少量液体溅出
C.容量瓶未干燥即用来配制溶液
(3)若加蒸馏水定容时不慎超过了刻度线,应如何处理?_______
II.海藻中含有丰富的碘元素,某课外活动小组欲从海藻中提取碘(已知过程②中反应的离子方程式为2I—+C12=2C1—+I2),设计如下的流程:
(4)指出提取碘的过程中有关实验操作的名称:①_______,③______。
(5)提取碘的过程中,可选择的有机溶剂是______。
A.酒精 B.醋酸 C.苯
四、计算题
19.将一定质量的镁和铝的固体混合物投入200mL稀盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。
回答下列问题:
(1)写出加入NaOH溶液的体积为200~240 mL时反应的离子方程式:___________。
(2)在反应过程中放出的气体在标准状况下的体积为___________。
(3)原固体混合物的质量为___________。
20.根据所学知识填空:
(1)16 g物质A中含有的分子数为3.01×1023,则A的摩尔质量为_______。
(2)1.7 g NH3与标准状况下_______ L H2S含有相同数目的氢原子。
(3)0.17 g OH-中质子的物质的量为_______,电子的微粒数为_______个。
(4)某气体在标准状况下的密度为1.25 g/L,则14 g该气体所含有的分子数为_______。
21.一个SO2分子的质量为a g,一个SO3分子的质量为b g,若以氧原子质量的1/8为标准,则SO2的相对分子质量为_______,硫的相对原子质量为_______。 (用a、b表示)
22.甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第_周期;乙元素在周期表中位于第__族;丙元素的名称为___。
(2)甲的单质与水反应的离子方程式为___,乙单质与丙单质反应的化学方程式为____,甲的单质与水反应的生成物的电子式为:____,____
23.A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
(1)B元素的名称为_________
(2)B位于元素周期表中的位置为__________________
(3)C的原子结构示意图为_________ ,C的单质与H2反应的化学方程式为_________________
参考答案:
1.D 2.B 3.B 4.B 5.A 6.D 7.D 8.C 9.A 10.C 11.A 12.A 13.D
14. 第3周期ⅥA族
15. SiO2+2OH-=SiO32-+H2O 2CO2+ 2Na2O2=2Na2CO3+ O2 Na2O2 2 Ca(ClO)2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
16. 分液漏斗 ClO-+Cl-+2H+=Cl2↑+H2O 润的淀粉KI试纸变蓝 Cl2+2Fe2+=2Cl-+2Fe3+ 打开活塞b,将C中溶液滴入D中,关闭活塞b,取下D振荡 静置后CCl4层溶液变为紫色 吸收氯气等有毒气体,防止污染空气 确认C的黄色溶液中无Cl2,排除Cl2对Fe3+氧化碘离子实验的干扰
17. 坩埚 过滤 C 紫红色 分液漏斗上口塞没有打开(上口塞凹槽没有对准小孔) 蒸馏烧瓶 冷凝管 温度计水银球应在支管口处 冷凝管进出水的方向颠倒
18. 500mL 胶头滴管 C A B 应倒掉溶液,洗涤容量瓶,重新配制 过滤 萃取 C
19.(1)Al(OH)3+OH-=AlO+2H2O
(2)10.08 L
(3)9g
20.(1)32 g·mol-1
(2)3.36
(3) 0.09 mol 6.02×1022
(4)3.01×1023
21. 8a/(b-a) (24a-16b)/(b-a)
22. 四 VIA 锂 2K+2H2O=2K++2OH-+H2↑ 4Li+O22Li2O
23. 硫 第三周期ⅥA族 F2+H2=2HF
一、单选题(共13题)
1.下列关于水玻璃的性质和用途的叙述中不正确的是
A.水玻璃是一种矿物胶,既不燃烧也不受腐蚀
B.水玻璃在建筑工业上可以作黏合剂、耐酸水泥掺料
C.木材、织物浸过水玻璃后具有防腐性能且不易燃烧
D.水玻璃的化学性质稳定,在空气中不易变质
2.某些建筑材料含有放射性元素氡Rn),会对人体产生一定危害。研究表明氡的α射线会致癌,WHO认定的19种致癌因素中,氡为其中之一,仅次于吸烟。该原子中中子数和质子数之差是( )
A.136 B.50 C.86 D.222
3.石棉是一类价格低廉的硅酸盐材料,但是有毒,能使人患肺癌。一种叫矿青石棉的化学式为:Na2Fe5Si8O22(OH)2。它用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是
A.该物质中Fe元素的化合价为+2价,它属于硅酸盐
B.该物质的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
C.1mol该物质能和18molHNO3反应,也能与含18molHCl的盐酸反应
D.这种石棉属于新型无机非金属材料
4.物质的性质决定用途,下列两者对应关系不正确的是
A.NaClO溶液有强氧化性,可用作漂白液
B.硅的导电性介于导体和绝缘体之间,可用于制造光导纤维
C.浓硫酸有吸水性,在实验室中常用作干燥剂
D.明矾溶于水形成胶体,可用于净水
5.下列有关物质的性质与用途具有对应关系的是
A.硅胶吸附水能力强,可用作食品干燥剂
B.Al2O3 熔点高,可用作电解冶炼铝的原料
C.浓硫酸具有强氧化性,可用作酯化反应的催化剂
D.次氯酸具有弱酸性,可用作有色物质的漂白剂
6.下列实验过程不能达到实验目的的是
选项 实验目的 实验过程
A 比较Al和Ni的活泼性 将Al和Ni用导线与电流表相连,并同时插入稀硫酸中,观察电流表指针的偏转
B 验证温度对反应速率的影响 在两支相同的试管中都加入3 mL H2O2溶液和2滴FeCl3溶液,一支放入40℃热水中,另一支放入5℃冷水中
C 在铁制的钥匙表面镀一层金属铜 将纯铜和钥匙分别与直流电源的正极和负极相连,同时插入CuSO4溶液中
D 验证元素非金属性强弱:Cl>C 向盐酸中加几粒石灰石,产生大量气体
A.A B.B C.C D.D
7.《流浪地球2》向观众展示了太空电梯、行星发动机、超级计算机550W等超前的科技幻想,探讨了数字生命、人工智能等科技伦理问题。它们与化学有着密切联系,下列说法不正确的是
A.我国“硅—石墨烯—锗高速晶体管”技术获重大突破,C、Si、Ge都是主族元素
B.我国提出网络强国战略,光纤线路总长超过三千万公里,光纤的主要成分是SiO2
C.新型陶瓷碳化硅(SiC)可作耐高温结构材料
D.富勒烯、石墨烯都是含碳化合物
8.我国“天问一号”火星探测器成功着陆火星,其中许多部件用铝锂合金制造。下列有关说法正确的是
A.锂位于周期表中第3周期ⅠA族
B.在第3周期的金属元素中,铝的金属性最强
C.铝锂合金的熔点比金属铝、金属锂的熔点都低
D.“天问一号”使用铝锂合金,主要利用其易导电的性质
9.下列两种物质互为同素异形体的是
A.O2和O3 B.H2SO4和H2SO3
C.胆矾和硫酸铜溶液 D.CO和CO2
10.科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图,W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法正确的是
A.氢化物的热稳定性:X>Y
B.元素X、Y各自最高和最低化合价的代数和分别为0、4
C.Y与Z可组成阴阳离子数之比为1:2的离子化合物
D.ZW与水反应生成W2的反应中,ZW为氧化剂
11.下列元素属于卤族元素的是:
A.F B.P C.He D.Li
12.下列关于现行的元素周期表的说法正确的是( )
A.元素周期表的非金属元素都位于主族和0族
B.第ⅠA族的元素全部都是金属元素
C.位于同一主族相邻的甲乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4
D.位于同一周期的甲乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙的原子序数可能为x+13
13.下列叙述正确的是
A.同一周期元素的原子,半径越小越容易失去电子
B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素
C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构
D.IA族与VIIA族元素间可形成共价化合物或离子化合物
二、非选择题(共10题)
14.有A、B、C、D、E五种元素,其中A、B、C位于同周期,A原子最外层p轨道电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成型化合物,已知在和中,D与B的质量比为7:8,E与B的质量比为1:1。根据以上条件,回答下列问题:
(1)画出C的原子结构示意图:______。
(2)写出D原子的价电子排布式:______。
(3)写出A元素的单质在B中完全燃烧的化学方程式:____________。
(4)指出E元素在周期表中的位置:______。
(5)A、B、C三种元素的第一电离能由大到小的顺序为______(用元素符号表示)。
(6)比较元素D和E电负性的大小:______(用元素符号表示)。
15.化学与人类社会可持续发展密切相关,环境、材料以及日常生活等都离不开化学。
(1)硅是无机非金属材料的主角,硅最重要的氧化物是二氧化硅,是玻璃的主要成分,那么存放氢氧化钠溶液的试剂瓶不用玻璃塞的原因是__________(用离子方程式表示);
(2)在呼吸面具和潜水艇中,常用Na2O2作供氧剂,该反应的化学方程式为_______,其中还原剂是_________,每生成1 mol O2转移_______mol e-;
(3)生活中常用漂白粉来杀菌消毒,其有效成分是_______;工业上制漂白粉的化学方程式为_______。
三、实验题
16.为验证Cl2、Fe3+、I2三者氧化性的相对强弱,某小组用图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C 中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,一段时间后,B 中溶液红色加深,关闭活塞a。
Ⅳ……
(1)盛浓盐酸溶液的仪器名称是__;A中产生黄绿色气体,写出A中发生反应的离子方程式__。
(2)验证氯气的氧化性强于碘单质的实验现象是__。
(3)B中溶液发生的离子方程式__。
(4)为验证Fe3+的氧化性强于碘单质,过程Ⅳ的操作和现象是__,对应反应的离子方程式是__。
(5)浸有氢氧化钠溶液的棉花作用是__。
(6)过程Ⅲ实验的目的是__。
17.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
(1)实验室灼烧海带,需要用到的仪器:酒精灯、铁三脚架、________、泥三角。
(2)提取碘的过程中实验操作①的名称是_____________。
(3)操作③不可选择的有机试剂是___________。
A.四氯化碳 B.苯 C.酒精 D.汽油
(4)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈___________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是______________________________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过下列实验装置蒸馏。
写出装置图中实验仪器①和②的名称:①_____________;②______________。
找出图中的错误之处:_______________________;________________________;
18.海洋资源应用非常广泛,从中可提取氯化钠、碘等化工产品。回答下列问题:
I.实验室用氯化钠固体配制1.0mol L-1的食盐水500mL。
(1)所需仪器为容量瓶(规格为____)、托盘天平、烧杯、玻璃棒和_____。
(2)配制时,下列操作对所配溶液的浓度有何影响?(填字母)无影响的有_____,偏大的有______,偏小的有_______。
A.称量时使用了生锈的砝码
B.往容量瓶中移液时,有少量液体溅出
C.容量瓶未干燥即用来配制溶液
(3)若加蒸馏水定容时不慎超过了刻度线,应如何处理?_______
II.海藻中含有丰富的碘元素,某课外活动小组欲从海藻中提取碘(已知过程②中反应的离子方程式为2I—+C12=2C1—+I2),设计如下的流程:
(4)指出提取碘的过程中有关实验操作的名称:①_______,③______。
(5)提取碘的过程中,可选择的有机溶剂是______。
A.酒精 B.醋酸 C.苯
四、计算题
19.将一定质量的镁和铝的固体混合物投入200mL稀盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。
回答下列问题:
(1)写出加入NaOH溶液的体积为200~240 mL时反应的离子方程式:___________。
(2)在反应过程中放出的气体在标准状况下的体积为___________。
(3)原固体混合物的质量为___________。
20.根据所学知识填空:
(1)16 g物质A中含有的分子数为3.01×1023,则A的摩尔质量为_______。
(2)1.7 g NH3与标准状况下_______ L H2S含有相同数目的氢原子。
(3)0.17 g OH-中质子的物质的量为_______,电子的微粒数为_______个。
(4)某气体在标准状况下的密度为1.25 g/L,则14 g该气体所含有的分子数为_______。
21.一个SO2分子的质量为a g,一个SO3分子的质量为b g,若以氧原子质量的1/8为标准,则SO2的相对分子质量为_______,硫的相对原子质量为_______。 (用a、b表示)
22.甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第_周期;乙元素在周期表中位于第__族;丙元素的名称为___。
(2)甲的单质与水反应的离子方程式为___,乙单质与丙单质反应的化学方程式为____,甲的单质与水反应的生成物的电子式为:____,____
23.A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
(1)B元素的名称为_________
(2)B位于元素周期表中的位置为__________________
(3)C的原子结构示意图为_________ ,C的单质与H2反应的化学方程式为_________________
参考答案:
1.D 2.B 3.B 4.B 5.A 6.D 7.D 8.C 9.A 10.C 11.A 12.A 13.D
14. 第3周期ⅥA族
15. SiO2+2OH-=SiO32-+H2O 2CO2+ 2Na2O2=2Na2CO3+ O2 Na2O2 2 Ca(ClO)2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
16. 分液漏斗 ClO-+Cl-+2H+=Cl2↑+H2O 润的淀粉KI试纸变蓝 Cl2+2Fe2+=2Cl-+2Fe3+ 打开活塞b,将C中溶液滴入D中,关闭活塞b,取下D振荡 静置后CCl4层溶液变为紫色 吸收氯气等有毒气体,防止污染空气 确认C的黄色溶液中无Cl2,排除Cl2对Fe3+氧化碘离子实验的干扰
17. 坩埚 过滤 C 紫红色 分液漏斗上口塞没有打开(上口塞凹槽没有对准小孔) 蒸馏烧瓶 冷凝管 温度计水银球应在支管口处 冷凝管进出水的方向颠倒
18. 500mL 胶头滴管 C A B 应倒掉溶液,洗涤容量瓶,重新配制 过滤 萃取 C
19.(1)Al(OH)3+OH-=AlO+2H2O
(2)10.08 L
(3)9g
20.(1)32 g·mol-1
(2)3.36
(3) 0.09 mol 6.02×1022
(4)3.01×1023
21. 8a/(b-a) (24a-16b)/(b-a)
22. 四 VIA 锂 2K+2H2O=2K++2OH-+H2↑ 4Li+O22Li2O
23. 硫 第三周期ⅥA族 F2+H2=2HF
