第3章不同聚集状态的物质与性质检测题(含答案)高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第3章不同聚集状态的物质与性质检测题(含答案)高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-08 19:42:16 | ||
图片预览




文档简介
第三章《不同聚集状态的物质与性质》检测题
一、单选题(共13题)
1.下列对一些实验事实的理论解释正确的是
选项 实验事实 理论解释
A 氮原子的第一电离能大于氧原子 氮原子2p能级半充满电子
B CO2为非极性分子 CO2分子中键是非极性键
C 金刚石的熔点低于石墨 金刚石是分子晶体,石墨是原子晶体
D HF的沸点高于HCl HF的相对分子质量小于HCl
A.A B.B C.C D.D
2.最近科学家在实验室里成功地将CO2在高压下转化为类似SiO2的共价晶体。下列关于该CO2晶体的叙述中,不正确的是
A.该晶体中C、O原子个数比为1∶2
B.该晶体中C—O—C的键角为180°
C.该晶体的熔、沸点高,硬度大
D.该晶体中C、O原子最外层都满足8电子结构
3.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界中硬度最大的共价晶体。下列叙述错误的是
A.晶体的熔点高于晶体的熔点
B.固态是分子晶体
C.ZW是共价晶体,其硬度比Z晶体的大
D.Z、W是同一主族的元素,Z、W与元素Y形成的晶体都是共价晶体
4.下列有关晶体的说法正确的有
①石英和金刚石都是共价晶体,最小环上都有6个原子
②在晶体中只要有阴离子就一定有阳离子
③金刚石、金刚砂、冰、干冰晶体的熔点依次降低
④石墨晶体中碳原子数和C-C键个数之比为1:2
⑤Al2O3晶体中离子键成分百分数较小,所以可以当作共价晶体
⑥石墨晶体中只有σ键
A.1项 B.2项 C.3项 D.4项
5.如图,氮化硼晶体有两种。关于这两种晶体的说法正确的是
A.立方相氮化硼含有σ键和π键,所以硬度大
B.六方相氮化硼层间作用力小,所以质地软
C.两种晶体中的B-N键均为σ键
D.两种晶体均为分子晶体
6.下列说法错误的是
A.李比希元素定量分析可以确定有机物分子组成及其结构式
B.胶体和溶液的本质区别是粒子直径大小
C.X-射线衍射图谱可以区分晶体和非晶体
D.氧化还原反应的本质是电子的转移
7.下列说法中正确的是
A.原子晶体中只含有共价键,离子晶体中只含有离子键
B.原子晶体的熔点一定比金属晶体的高
C.分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键
D.任何晶体中,若含有阳离子就一定含有阴离子
8.下列关于物质结构的叙述正确的是
A.熔点:
B.酸性:
C.键角:
D.、的VSEPR模型、空间结构均相同
9.下列对一些实验事实的理论解释正确的是
选项 实验事实 理论解释
A CsCl晶体中阳离子和阴离子都有确定的配位数 离子键具有饱和性
B 环状分子结构如图 原子采取的杂化方式为
C 金刚石的熔点低于石墨 金刚石是分子晶体,石墨是原子晶体
D HF的沸点高于HCl HF的相对分子质量小于HCl
A.A B.B C.C D.D
10.以色列科学家因发现准晶体独享2011年诺贝尔化学奖。已知的准晶体都是金属化合物(又称金属互化物),当形成合金的元素原子的电子层结构、原子半径和晶体类型相差较大时,易形成金属化合物。人们发现组成为铝-铜-铁-铬的准晶体具有低摩擦系数、高硬度、低表面能,正被开发为炒菜锅的镀层,十分耐磨,被开发为高温电弧喷嘴的镀层。下列说法正确的是
A.已知的准晶体是离子化合物
B.Al、Fe、Cu三者的单质放置在空气中均只生成氧化物
C.合金的硬度一般比各组分金属的硬度小
D.准晶体可开发成为新型材料
11.中美学者携手发现了全硼富勒烯团簇—B40。B40团簇的结构,酷似中国的红灯笼(如图)。该材料可用于组装分子器件,在储氢储锂、半导体、超导、绿色催化等领域具有重要应用前景。下列有关说法正确的是( )
A.B40与石墨烯的结构相同,二者互为同素异形体
B.43.2g该物质含有2.408×1024个原子
C.B40中既含有极性键又含有非极性键
D.全硼富勒烯团簇是一种新型的高分子材料
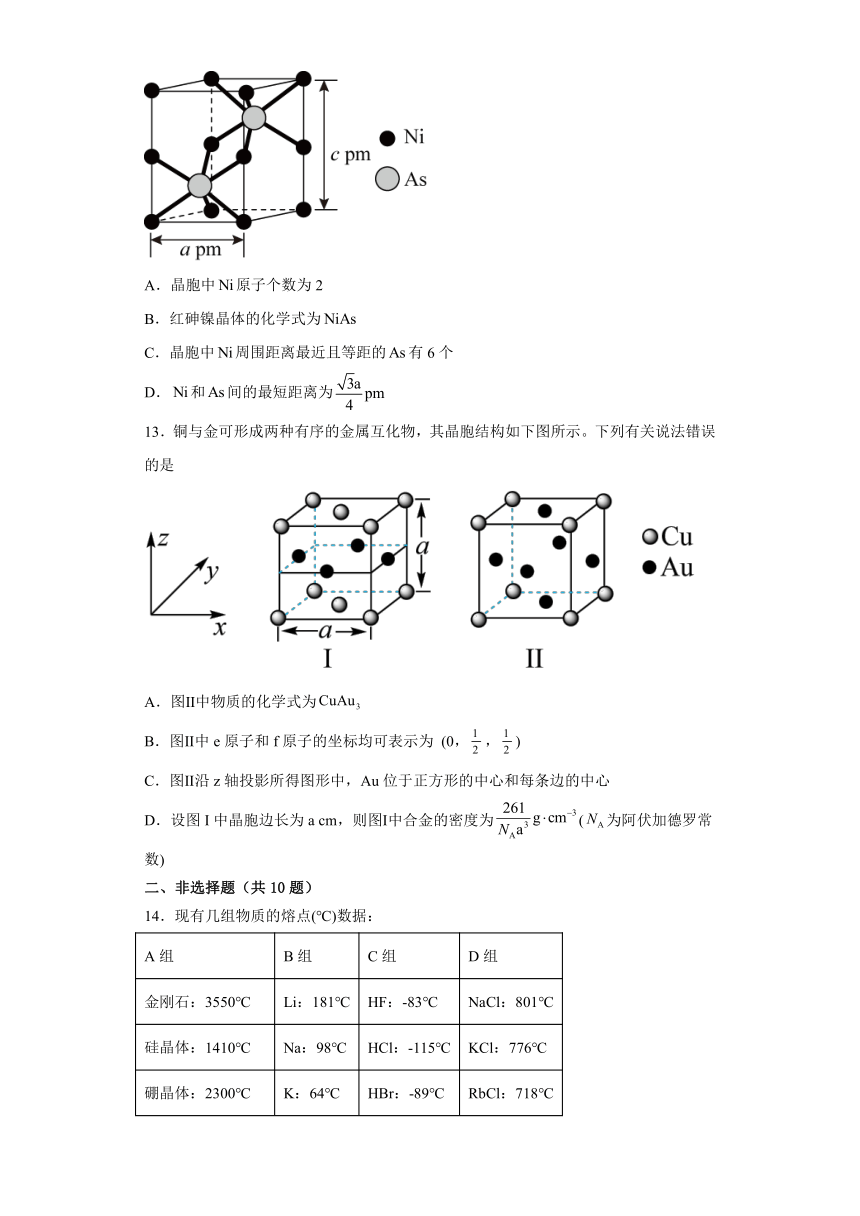
12.红砷镍是一种六方晶体(底面为和的菱形),其晶胞如图所示。下列说法错误的是
A.晶胞中原子个数为2
B.红砷镍晶体的化学式为
C.晶胞中周围距离最近且等距的有6个
D.和间的最短距离为
13.铜与金可形成两种有序的金属互化物,其晶胞结构如下图所示。下列有关说法错误的是
A.图Ⅱ中物质的化学式为
B.图Ⅱ中e原子和f原子的坐标均可表示为 (0,,)
C.图Ⅱ沿z轴投影所得图形中,Au位于正方形的中心和每条边的中心
D.设图I中晶胞边长为a cm,则图Ⅰ中合金的密度为(为阿伏加德罗常数)
二、非选择题(共10题)
14.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550℃ Li:181℃ HF:-83℃ NaCl:801℃
硅晶体:1410℃ Na:98℃ HCl:-115℃ KCl:776℃
硼晶体:2300℃ K:64℃ HBr:-89℃ RbCl:718℃
二氧化硅:1723℃ Rb:39℃ HI:-51℃ CsCl:645℃
据此回答下列问题:
(1)A组属于_______晶体,其熔化时克服的微粒间的作用力是_______。
(2)B组晶体共同的物理性质是_______(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中自HCl至HI熔点依次升高,原因是_______。
(4)D组晶体可能具有的性质是_______(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_______。
15.氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为___________,该晶体的密度为___________g·cm-3(用含NA、a的式子表示)。
三、实验题
16.随着科学技术的发展,阿伏加 德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为Vcm3。
(1)步骤①中仪器A最好使用___(填序号)。
A.量筒B.烧杯C.容量瓶D.试管
(2)步骤②中是用酸式滴定管还是用碱式滴定管___,理由是___。
(3)能否用水代替苯___(填“是”或“否”),理由是___。
(4)已知NaCl晶体中,靠得最近的Na+、Cl﹣间的距离为acm(如图),则用上述方法测得的阿伏加德常数NA的表达式为___。
17.的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为_______(用含a、b、,的代数式表示,表示阿伏加德罗常数的值)。
18.某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱。供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
(1)仪器a的名称:___________。
(2)锥形瓶中装有某可溶性正盐,a中所盛试剂为___________。
(3)装置B所盛试剂是___________,其作用是___________。
(4)装置C所盛试剂是___________,C中反应的离子方程式是___________。
(5)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是___________。
(6)写出碳、氮、硅三元素的简单气态氢化物的稳定性由强到弱的顺序是(写化学式)___________。
(7)写出碳、氮、硅三元素的简单气态氢化物的沸点由高到低的顺序是(写化学式)___________。
四、计算题
19.Zn与S形成某种化合物的晶胞如图所示。
已知晶体密度为,该晶胞的边长表达式为_______pm(写计算表达式)。
20.为便于研究只含C、H、O三种元素的有机物燃烧时生成物与所需氧气的量的关系,可用通式、或表示它们(m、n、x、y均为正整数)。例如、、等物质可用通式表示,它们的m分别为1、2、3,n均为1。它们完全燃烧时所需的氧气和生成的二氧化碳的体积比为3∶2。
(1)现有一类只含C、H、O三种元素的有机物,它们完全燃烧时消耗的氧气和生成的二氧化碳的体积比为5∶4,按照上述要求,该类有机物的通式可表示为__________,写出该类有机物相对分子质量最小的物质的结构简式__________。
(2)若某一类有机物可用通式表示,则在相同条件下,该类有机物完全燃烧时消耗氧气的体积和生成的体积必须满足的条件是__________。
21.四方晶系CuFeS2晶胞结构如图所示。
(1)Cu+的配位数为___________。
(2)已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是___________g·cm-3(列出计算式)。
22.下表是元素周期表的一部分。表中 A-K 分别代表某一种化学元素。
(1)D、G 中,电负性较大的是_______(用元素符号表示)。
(2)H 的基态原子价层电子的轨道表示式是_______。
(3)D、E、F 的第一电离能由大到小的顺序是_______(填元素符号)。
(4)BC2分子的电子式是_______,是_______(填“极性分子”或“非极性分子”)。在 BC2晶体中,1 个 BC2 分子周围有_______个紧邻分子。
(5)由 K、B、C 三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为 K(BC)4,构型为正四面体。基态 K 原子的简化核外电子排布式是_______;中心原子杂化类型是_______,K(BC)4固态时属于_______晶体(填晶体类型)。
(6)A 与 E 组成的一种化合物 EA2,刷新了金属化合物超导温度的最高记录。下图是该化合物的晶体结构单元。图中 代表的原子是_______(填元素符号)。
23.A、B两元素的最外层都只有一个电子,A的原子序数等于B的原子序数的11倍,A离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素C与B易形成化合物B2C,该化合物常温下呈液态,则:
(1)A的原子结构示意图为____,在固态时属于___晶体。
(2)C的单质属于___晶体。B与C形成化合物B2C的化学式为___,电子式为____;它是由___键形成的___分子,在固态时属于___晶体。
参考答案:
1.A 2.B 3.D 4.C 5.B 6.A 7.C 8.B 9.B 10.D 11.B 12.D 13.C
14.(1) 原子晶体 共价键
(2)①②③④
(3)含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常
(4)②④
(5)这些都属于离子晶体,熔点与晶格能有关,由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
15. 16
16. C 酸式滴定管 碱式滴定管的橡胶管会溶于苯而变形 否 水会溶解NaCl,无法准确测出NaCl固体的体积
17.
18.(1)分液漏斗
(2)稀硝酸
(3) 饱和碳酸氢钠溶液 吸收气体中硝酸
(4) 硅酸钠溶液 SiO+CO2+H2O=H2SiO3↓+CO
(5)N>C>Si
(6)NH3>CH4>SiH4
(7)NH3>SiH4>CH4
19.
20.
21. 4
22.(1)Cl
(2)
(3)Mg>Al>Na
(4) 非极性分子 12
(5) [Ar]3d84s2 sp3 分子
(6)Mg
23. 金属 分子 H2O 极性共价 极性 分子
一、单选题(共13题)
1.下列对一些实验事实的理论解释正确的是
选项 实验事实 理论解释
A 氮原子的第一电离能大于氧原子 氮原子2p能级半充满电子
B CO2为非极性分子 CO2分子中键是非极性键
C 金刚石的熔点低于石墨 金刚石是分子晶体,石墨是原子晶体
D HF的沸点高于HCl HF的相对分子质量小于HCl
A.A B.B C.C D.D
2.最近科学家在实验室里成功地将CO2在高压下转化为类似SiO2的共价晶体。下列关于该CO2晶体的叙述中,不正确的是
A.该晶体中C、O原子个数比为1∶2
B.该晶体中C—O—C的键角为180°
C.该晶体的熔、沸点高,硬度大
D.该晶体中C、O原子最外层都满足8电子结构
3.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界中硬度最大的共价晶体。下列叙述错误的是
A.晶体的熔点高于晶体的熔点
B.固态是分子晶体
C.ZW是共价晶体,其硬度比Z晶体的大
D.Z、W是同一主族的元素,Z、W与元素Y形成的晶体都是共价晶体
4.下列有关晶体的说法正确的有
①石英和金刚石都是共价晶体,最小环上都有6个原子
②在晶体中只要有阴离子就一定有阳离子
③金刚石、金刚砂、冰、干冰晶体的熔点依次降低
④石墨晶体中碳原子数和C-C键个数之比为1:2
⑤Al2O3晶体中离子键成分百分数较小,所以可以当作共价晶体
⑥石墨晶体中只有σ键
A.1项 B.2项 C.3项 D.4项
5.如图,氮化硼晶体有两种。关于这两种晶体的说法正确的是
A.立方相氮化硼含有σ键和π键,所以硬度大
B.六方相氮化硼层间作用力小,所以质地软
C.两种晶体中的B-N键均为σ键
D.两种晶体均为分子晶体
6.下列说法错误的是
A.李比希元素定量分析可以确定有机物分子组成及其结构式
B.胶体和溶液的本质区别是粒子直径大小
C.X-射线衍射图谱可以区分晶体和非晶体
D.氧化还原反应的本质是电子的转移
7.下列说法中正确的是
A.原子晶体中只含有共价键,离子晶体中只含有离子键
B.原子晶体的熔点一定比金属晶体的高
C.分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键
D.任何晶体中,若含有阳离子就一定含有阴离子
8.下列关于物质结构的叙述正确的是
A.熔点:
B.酸性:
C.键角:
D.、的VSEPR模型、空间结构均相同
9.下列对一些实验事实的理论解释正确的是
选项 实验事实 理论解释
A CsCl晶体中阳离子和阴离子都有确定的配位数 离子键具有饱和性
B 环状分子结构如图 原子采取的杂化方式为
C 金刚石的熔点低于石墨 金刚石是分子晶体,石墨是原子晶体
D HF的沸点高于HCl HF的相对分子质量小于HCl
A.A B.B C.C D.D
10.以色列科学家因发现准晶体独享2011年诺贝尔化学奖。已知的准晶体都是金属化合物(又称金属互化物),当形成合金的元素原子的电子层结构、原子半径和晶体类型相差较大时,易形成金属化合物。人们发现组成为铝-铜-铁-铬的准晶体具有低摩擦系数、高硬度、低表面能,正被开发为炒菜锅的镀层,十分耐磨,被开发为高温电弧喷嘴的镀层。下列说法正确的是
A.已知的准晶体是离子化合物
B.Al、Fe、Cu三者的单质放置在空气中均只生成氧化物
C.合金的硬度一般比各组分金属的硬度小
D.准晶体可开发成为新型材料
11.中美学者携手发现了全硼富勒烯团簇—B40。B40团簇的结构,酷似中国的红灯笼(如图)。该材料可用于组装分子器件,在储氢储锂、半导体、超导、绿色催化等领域具有重要应用前景。下列有关说法正确的是( )
A.B40与石墨烯的结构相同,二者互为同素异形体
B.43.2g该物质含有2.408×1024个原子
C.B40中既含有极性键又含有非极性键
D.全硼富勒烯团簇是一种新型的高分子材料
12.红砷镍是一种六方晶体(底面为和的菱形),其晶胞如图所示。下列说法错误的是
A.晶胞中原子个数为2
B.红砷镍晶体的化学式为
C.晶胞中周围距离最近且等距的有6个
D.和间的最短距离为
13.铜与金可形成两种有序的金属互化物,其晶胞结构如下图所示。下列有关说法错误的是
A.图Ⅱ中物质的化学式为
B.图Ⅱ中e原子和f原子的坐标均可表示为 (0,,)
C.图Ⅱ沿z轴投影所得图形中,Au位于正方形的中心和每条边的中心
D.设图I中晶胞边长为a cm,则图Ⅰ中合金的密度为(为阿伏加德罗常数)
二、非选择题(共10题)
14.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550℃ Li:181℃ HF:-83℃ NaCl:801℃
硅晶体:1410℃ Na:98℃ HCl:-115℃ KCl:776℃
硼晶体:2300℃ K:64℃ HBr:-89℃ RbCl:718℃
二氧化硅:1723℃ Rb:39℃ HI:-51℃ CsCl:645℃
据此回答下列问题:
(1)A组属于_______晶体,其熔化时克服的微粒间的作用力是_______。
(2)B组晶体共同的物理性质是_______(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中自HCl至HI熔点依次升高,原因是_______。
(4)D组晶体可能具有的性质是_______(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_______。
15.氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为___________,该晶体的密度为___________g·cm-3(用含NA、a的式子表示)。
三、实验题
16.随着科学技术的发展,阿伏加 德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为Vcm3。
(1)步骤①中仪器A最好使用___(填序号)。
A.量筒B.烧杯C.容量瓶D.试管
(2)步骤②中是用酸式滴定管还是用碱式滴定管___,理由是___。
(3)能否用水代替苯___(填“是”或“否”),理由是___。
(4)已知NaCl晶体中,靠得最近的Na+、Cl﹣间的距离为acm(如图),则用上述方法测得的阿伏加德常数NA的表达式为___。
17.的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为_______(用含a、b、,的代数式表示,表示阿伏加德罗常数的值)。
18.某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱。供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
(1)仪器a的名称:___________。
(2)锥形瓶中装有某可溶性正盐,a中所盛试剂为___________。
(3)装置B所盛试剂是___________,其作用是___________。
(4)装置C所盛试剂是___________,C中反应的离子方程式是___________。
(5)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是___________。
(6)写出碳、氮、硅三元素的简单气态氢化物的稳定性由强到弱的顺序是(写化学式)___________。
(7)写出碳、氮、硅三元素的简单气态氢化物的沸点由高到低的顺序是(写化学式)___________。
四、计算题
19.Zn与S形成某种化合物的晶胞如图所示。
已知晶体密度为,该晶胞的边长表达式为_______pm(写计算表达式)。
20.为便于研究只含C、H、O三种元素的有机物燃烧时生成物与所需氧气的量的关系,可用通式、或表示它们(m、n、x、y均为正整数)。例如、、等物质可用通式表示,它们的m分别为1、2、3,n均为1。它们完全燃烧时所需的氧气和生成的二氧化碳的体积比为3∶2。
(1)现有一类只含C、H、O三种元素的有机物,它们完全燃烧时消耗的氧气和生成的二氧化碳的体积比为5∶4,按照上述要求,该类有机物的通式可表示为__________,写出该类有机物相对分子质量最小的物质的结构简式__________。
(2)若某一类有机物可用通式表示,则在相同条件下,该类有机物完全燃烧时消耗氧气的体积和生成的体积必须满足的条件是__________。
21.四方晶系CuFeS2晶胞结构如图所示。
(1)Cu+的配位数为___________。
(2)已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是___________g·cm-3(列出计算式)。
22.下表是元素周期表的一部分。表中 A-K 分别代表某一种化学元素。
(1)D、G 中,电负性较大的是_______(用元素符号表示)。
(2)H 的基态原子价层电子的轨道表示式是_______。
(3)D、E、F 的第一电离能由大到小的顺序是_______(填元素符号)。
(4)BC2分子的电子式是_______,是_______(填“极性分子”或“非极性分子”)。在 BC2晶体中,1 个 BC2 分子周围有_______个紧邻分子。
(5)由 K、B、C 三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为 K(BC)4,构型为正四面体。基态 K 原子的简化核外电子排布式是_______;中心原子杂化类型是_______,K(BC)4固态时属于_______晶体(填晶体类型)。
(6)A 与 E 组成的一种化合物 EA2,刷新了金属化合物超导温度的最高记录。下图是该化合物的晶体结构单元。图中 代表的原子是_______(填元素符号)。
23.A、B两元素的最外层都只有一个电子,A的原子序数等于B的原子序数的11倍,A离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素C与B易形成化合物B2C,该化合物常温下呈液态,则:
(1)A的原子结构示意图为____,在固态时属于___晶体。
(2)C的单质属于___晶体。B与C形成化合物B2C的化学式为___,电子式为____;它是由___键形成的___分子,在固态时属于___晶体。
参考答案:
1.A 2.B 3.D 4.C 5.B 6.A 7.C 8.B 9.B 10.D 11.B 12.D 13.C
14.(1) 原子晶体 共价键
(2)①②③④
(3)含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常
(4)②④
(5)这些都属于离子晶体,熔点与晶格能有关,由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
15. 16
16. C 酸式滴定管 碱式滴定管的橡胶管会溶于苯而变形 否 水会溶解NaCl,无法准确测出NaCl固体的体积
17.
18.(1)分液漏斗
(2)稀硝酸
(3) 饱和碳酸氢钠溶液 吸收气体中硝酸
(4) 硅酸钠溶液 SiO+CO2+H2O=H2SiO3↓+CO
(5)N>C>Si
(6)NH3>CH4>SiH4
(7)NH3>SiH4>CH4
19.
20.
21. 4
22.(1)Cl
(2)
(3)Mg>Al>Na
(4) 非极性分子 12
(5) [Ar]3d84s2 sp3 分子
(6)Mg
23. 金属 分子 H2O 极性共价 极性 分子
