专题4硫与环境保护单元测试卷(含解析)高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题4硫与环境保护单元测试卷(含解析)高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 945.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-08 19:50:26 | ||
图片预览




文档简介
专题4 硫与环境保护 单元测试卷
一、单选题
1.下列物质属于离子化合物的是( )
A.He B.H2 C.HCl D.Na2O
2.下列各组物质中都是纯净物的是
A.氧化钙,碘酒 B.氢氧化铁胶体,金刚石
C.冰水混合物,干冰 D.液氧,空气
3.为防止缺碘,可在食盐中加入少量KIO3,KIO3属于
A.氧化物 B.酸 C.碱 D.盐
4.下列说法正确的是
A.只含一种元素的物质不一定是纯净物
B.氧化反应一定属于化合反应
C.含有两种或两种以上不同的元素的物质一定属于混合物
D.纯净物就是由同种元素组成的物质
5.下列各组物质按照单质、化合物、混合物顺序排列的是
A.石墨、Fe(OH)3胶体、澄清石灰水 B.氮气、干冰、冰水混合物
C.液氧、CuSO4、浓硫酸 D.硫粉、氨水、蓝矾
6.下列各组物质中,不能按照如图所示进行转化的是
选项 X Y Z
A C CO CO2
B H2S S SO2
C Al AlCl3 Al(OH)3
D NaOH Na2CO3 NaHCO3
A.A B.B C.C D.D
7.下列关于氯的单质及化合物的叙述中,不正确的是
A.常温常压下,是黄绿色气体 B.在化学反应中能表现还原性
C.加热能使次氯酸发生分解 D.氯水和液氯的成分相同
8.按纯净物、混合物、电解质和非电解质顺序排列的一组物质是( )
A.盐酸、空气、醋酸、干冰 B.烧碱、海水、硫酸钠、乙醇
C.稀硫酸、胆矾、烧碱、石灰石 D.胆矾、盐酸、氯化钾、硫酸钡
9.菜谱中记载:虾类不宜与西红柿等富含维生素C 的食物同食。这是因为虾类食物中含有无毒的+5 价砷(As)类物质,其在维生素C 的作用下生成了有毒的+3 价砷(As)类化合物。下列说法正确的是
A.维生素C 做氧化剂
B.+5 价砷类物质被氧化
C.+5 价砷转化为+3 价砷时,得到电子
D.已知剧毒物砒霜是砷的氧化物,由上述信息可推知砒霜的化学式为 As2O5
10.下列实验对应的结论错误的是
A.向品红溶液中通入二氧化硫气体,品红溶液褪色,证明二氧化硫具有漂白性
B.向常温下的浓硫酸中加入铜片,无明显现象,证明浓硫酸使铜片钝化
C.向和混合溶液中滴加氯水,溶液变成红色,证明氯水具有氧化性
D.通过灼热的,黑色固体逐渐变为红色,证明具有还原性
11.下列关于硫酸工业的说法正确的是
A.在纯氧中煅烧黄铁矿 B.在高压条件下制
C.用98%浓硫酸吸收 D.用澄清石灰水吸收尾气
12.下列物质的性质和用途均正确且具有因果关系的是
A.单质硫具有可燃性,可用于焰色试验
B.氢气具有可燃性,可用于金属冶炼
C.铝丝具有还原性,可用作电缆材料
D.铁粉具有还原性,可用作食品的抗氧化剂
13.ClO2作为一种广谱型的消毒剂,将逐渐取代Cl2成为自来水的消毒剂。可用氯酸钠和双氧水在酸性条件下制备,反应方程式为:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+2H2O+O2↑,下列说法不正确的是
A.H2O2的还原性强于ClO2
B.NaClO3在反应中被还原
C.1个NaClO3参加反应,转移2个电子
D.该反应的离子方程式为:2ClO+H2O2+2H+=2ClO2↑+2H2O+O2↑
14.对下列物质及其反应的叙述正确的是( )
A.Cl2、ClO2、O3和Na2O2等都具有强氧化性,均可用于饮用水的消毒
B.稀硝酸具有酸性,可除去铜制品表面的铜锈
C.乙烯可发生氧化反应,因此用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯
D.反应:3C+SiO2=SiC+2CO中氧化剂与还原剂的物质的量之比为3:1
15.下列气体排放到空气中,不会导致酸雨的是
A.NO B.NO2 C.CO2 D.SO2
二、填空题
16.下列是中学阶段常见的重要化学物质:
a.氢氧化铁胶体 b.氢氧化钠 c.溶液 d.明矾 e.氧化铝 f.稀硫酸酸化的硫酸亚铁溶液 g.84消毒液 h.稀盐酸 i.二氧化硅 j.偏铝酸钠
请完成下列各题:
(1)属于氧化物的有___________(填序号,下同),能净水的有___________,属于盐的有___________。
(2)g的有效成分是___________(填化学式)。
(3)向f中滴加几滴c,观察到的现象是___________,发生反应的离子方程式为___________。
(4)向d溶液中加入过量b溶液,发生反应的离子方程式为___________。
17.NaH可在野外用作生氢剂,化学反应原理为:NaH+H2O=NaOH+H2↑。请回答下列问题。
(1)NaH中氢元素化合价为为___________价。
(2)反应中NaH作___________剂。
(3)H2是___________产物。
(4)被氧化的元素和被还原的元素物质的量之比是___________。
(5)若生成1.204×1024个H2,理论上需要NaH的质量是___________克。
18.铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】I.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
II.KSCN中的硫元素为-2价。
III.受热分解生成。
实验I.检验该补铁剂中铁元素的价态。
(1)试剂2是___________。
(2)能证明溶液①中含有的实验现象是___________。
(3)补全在上述条件下与发生反应的离子方程式:_____
______________________________+___________
(4)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的与发生了化学反应。甲同学猜测的理论依据是___________。
实验II.测定该补铁剂中铁元素的含量。
(5)易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C。维生素C的作用是___________。
(6)计算每片该补铁剂含铁元素的质量为___________g。
三、实验题
19.健康人体内含铁元素大约 2~3g,人体内铁元素以亚铁离子和三价铁离子的形式存在,Fe2+易被吸收,所以给贫血者补充铁元素时,应补充含 Fe2+的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
(1) 试剂1的名称是__________;试剂2的化学式为______________。
(2) 加入新制氯水,溶液中发生反应的离子方程式是_____________________________。
(3) 加入试剂2 时溶液为淡红色说明 “速力菲”中的 Fe2+已部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有___________性。
(4) 不仅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,请写出反应的化学方程式________________________,现象为__________________________。
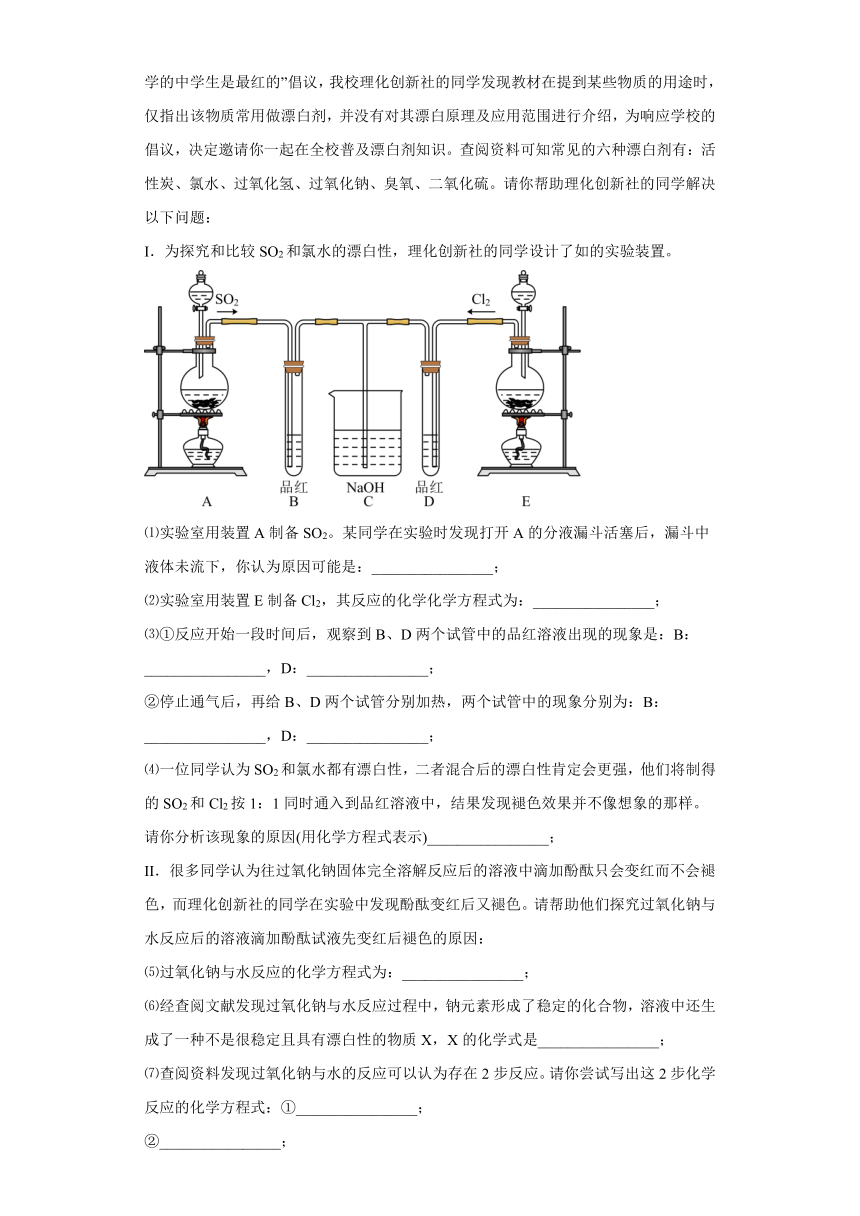
20.随着网络信息时代不断的发展,人和事件在网络上曝光的几率更大了,所以网络红人也逐渐的增加起来。2018年8月9日,美国男子为了变成网络红人,居然用漂白粉洗澡,结果差点被送进医院。太和一中为塑造中学生正确的价值观,结合此事发出“好学的中学生是最红的”倡议,我校理化创新社的同学发现教材在提到某些物质的用途时,仅指出该物质常用做漂白剂,并没有对其漂白原理及应用范围进行介绍,为响应学校的倡议,决定邀请你一起在全校普及漂白剂知识。查阅资料可知常见的六种漂白剂有:活性炭、氯水、过氧化氢、过氧化钠、臭氧、二氧化硫。请你帮助理化创新社的同学解决以下问题:
I.为探究和比较SO2和氯水的漂白性,理化创新社的同学设计了如的实验装置。
⑴实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:________________;
⑵实验室用装置E制备Cl2,其反应的化学化学方程式为:________________;
⑶①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:________________,D:________________;
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:B:________________,D:________________;
⑷一位同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________________;
II.很多同学认为往过氧化钠固体完全溶解反应后的溶液中滴加酚酞只会变红而不会褪色,而理化创新社的同学在实验中发现酚酞变红后又褪色。请帮助他们探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后褪色的原因:
⑸过氧化钠与水反应的化学方程式为:________________;
⑹经查阅文献发现过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不是很稳定且具有漂白性的物质X,X的化学式是________________;
⑺查阅资料发现过氧化钠与水的反应可以认为存在2步反应。请你尝试写出这2步化学反应的化学方程式:①________________;
②________________;
⑻下列说法正确的是________________。
A.利用SO2的漂白性可使酸性高锰酸钾溶液褪色
B.漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂
C.为便于储存和使用,可用液氯代替氯水漂白干燥棉布上的有色物质
D.制造白糖工业中可用活性炭做脱色剂,是利用了活性炭的物理吸附能力
E.臭氧的漂白原理和双氧水不相同
21.下面是某校化学研究性学习小组探究足量锌与浓硫酸反应的实验:
I.甲同学设计如图实验验证该反应产生的混合气体中含有、、,已知装置C中试剂过量。
A. B. C. D.
E. F.
(1)写出A中生成的化学方程式________
(2)若按气体从左到右的流向,气体流经的各装置连接顺序是________
(3)E中干燥管的作用是________
(4)证明混合气体中含有的实验现象为________
参考答案:
1.D
【来源】2019年6月福建省普通高中学业水平合格性考试化学试题
【详解】A. He是单质不是化合物,故A错误;
B. H2是单质不是化合物,故B错误;
C. HCl只含有共价键,是共价化合物,故C错误;
D. Na2O只含有离子键,是离子化合物;故D正确;
答案选D。
【点睛】一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,含离子键的一定为离子化合物,以此来解答。
2.C
【来源】广东省湛江市2021-2022学年高一上学期期中考试化学试题
【详解】A.碘酒是指碘和酒精的混合物,A项不选;
B.氢氧化铁胶体是混合物,B项不选;
C.冰是水的固态,故冰水混合物是纯净物,干冰是CO2,是纯净物,C项选;
D.空气是混合物,D项不选;
答案选C。
3.D
【来源】【浙江新东方】高中化学20210621-012【2021】【高一下】
【详解】KIO3会电离产生金属阳离子K+、酸根离子,因此属于盐,故合理选项是D。
4.A
【来源】河北省衡水市武强中学2021-2022学年高一上学期第一次月考化学试题
【详解】A.只含一种元素的物质不一定是纯净物,例如O2和O3的混合物,A正确;
B.氧化反应不一定是化合反应,如甲烷与氧气反应生成二氧化碳和水,B错误;
C.含有两种或两种以上不同的元素的物质中,若只有一种构成微粒,则属于化合物;若含有两种或两种以上的构成微粒,则属于混合物,因此不一定属于混合物,C错误;
D.纯净物是由一种物质组成,可以是化合物(多种元素组成),D错误;
综上所述答案为A。
5.C
【来源】河南省豫西名校2020-2021学年高一上学期第一次联考化学试题
【详解】A. Fe(OH)3胶体是混合物,不属于化合物,A错误;
B.冰水混合物的构成微粒是H2O,属于纯净物,B错误;
C.选项中的各种物质分类合理,C正确;
D.氨水属于混合物,不是化合物,D错误;
答案选C。
6.C
【来源】云南省昆明市2019-2020学年高一下学期期末质量检测化学试题
【详解】A.C在氧气不充足的条件下反应生成CO,CO在氧气中燃烧产生CO2,C和CO2可以在高温下反应生成了CO,符合图中的转化关系,故A不符合题意;
B.H2S可以和氧气反应制得S,S在氧气中燃烧得到SO2,H2S和SO2可以反应得到S,符合图中的转化关系,故B不符合题意;
C.Al可以和氯气或稀盐酸反应得到AlCl3,AlCl3可以和氨水或适量的氢氧化钠反应得到Al(OH)3,Al和Al(OH)3不能反应得到AlCl3,不符合图中的转化关系,故C符合题意;
D.NaOH和少量二氧化碳反应得到Na2CO3,Na2CO3和二氧化碳和水反应得到NaHCO3,NaOH和NaHCO3可以反应得到Na2CO3,符合图中的转化关系,故D不符合题意;
答案选C。
7.D
【来源】北京市东城区2022-2023学年高一上学期期末统一检测化学试卷
【详解】A.常温常压下,是黄绿色气体,故A正确;
B.中氯元素化合价既可以升高又可以降低,在化学反应中既能表现还原性又能表现氧化性,故B正确;
C.次氯酸加热分解为盐酸和氧气,故C正确;
D.氯水是氯气的水溶液,氯水是混合物;液氯中只含氯分子,液氯是纯净物,故D错误;
选D。
8.B
【来源】贵州省安顺市平坝第一高级中学2019-2020学年高一上学期期中考试化学试题
【分析】只由一种物质组成的是纯净物;由多种物质组成的是混合物;在水溶液或熔融状态下能导电的化合物是电解质;在水溶液和熔融状态下不能导电的化合物是非电解质,据此判断。
【详解】A. 盐酸是混合物,空气是混合物,醋酸是电解质,干冰是非电解质,A项错误;
B. 烧碱是纯净物,海水是混合物,硫酸钠是电解质,乙醇是非电解质,B项正确;
C. 稀硫酸是混合物,胆矾是纯净物,烧碱是电解质,石灰石是电解质,C项错误;
D. 胆矾是纯净物,盐酸是混合物,氯化钾是电解质,硫酸钡是电解质,D项错误;
答案选B。
9.C
【来源】湖湘教育三新探索协作体2020-2021学年高一11月联考化学试题
【详解】A.由信息可知,反应中砷元素的化合价降低,则维生素 C 中某元素的化合价升高,则维生素 C 在反应中做还原剂,A 错误;
B.+5 价砷类物质做氧化剂,价态降低,被还原,B 错误;
C.+5 价砷转化为+3 价砷时,化合价降低,得到电子,C 正确;
D.由题中给出+5 砷类物质是无毒的,+3 价砷类化合物有毒,则推知砒霜是+3 价砷的氧化物,其化学式为As2O3,D 错误;
故选C。
10.B
【来源】山东省潍坊市2022-2023学年高三上学期期中考试化学考试题
【详解】A.向品红溶液中通入二氧化硫气体,品红溶液褪色,证明二氧化硫具有漂白性,A选项正确;
B.向常温下的浓硫酸中加入铜片,无明显现象,不是因为钝化,是因为浓硫酸与铜在常温下不反应,浓硫酸与铜需要加热才会反应, B选项错误;
C.向和混合溶液中滴加氯水,溶液变成红色,是因为氯水将FeSO4氧化为Fe2(SO4)3,Fe3+与反应使溶液变红,证明氯水具有氧化性,C选项正确;
D.通过灼热的,黑色固体逐渐变为红色,发生了反应:2NH3+3CuO 3Cu+N2+3H2O,该反应中NH3做还原剂,证明具有还原性,D选项正确;
答案选B。
11.C
【来源】上海市普通高中2022年学业水平等级考试化学试题
【详解】A.硫酸的工业制备 硫酸工业中,在沸腾炉中通入空气煅烧黄铁矿制备二氧化硫,A错误;
B.硫酸工业中催化氧化制备,在常压条件下进行即可,因为该反应在常压下的转化率已经很大,加压虽然可以使转化率增大,但同时对设备要求提高、经济成本增大,B错误;
C.采用98%的浓硫酸吸收,可避免产生大量酸雾降低吸收效率,C正确;
D.硫酸工业产生的尾气主要是,工业上通常采用石灰乳进行吸收,澄清石灰水中浓度太低,不适合处理工业尾气,D错误;
故选C。
12.D
【来源】广西北海市2020-2021学年高一上学期期末教学质量检测化学试题
【详解】A.单质硫具有可燃性,与用于焰色反应无关,焰色反应是指金属和它们的化合物在灼烧时会有特殊颜色,故A错误;
B.并非所有可燃性物质都能用于金属冶炼,故氢气具有可燃性,与它用于金属冶炼无关,故B错误;
C.铝丝具有还原性,与它可用作导体即具有导电性无关,故C错误;
D.铁粉具有还原性,可用氧气反应,防止食品氧化、腐败,可作抗氧化剂,故D正确;
故选D。
13.C
【来源】江苏省天一中学2021-2022学年高一上学期期中考试化学(强化班)试题
【详解】A.氧化剂的氧化性比氧化产物的氧化性强,还原剂的还原性比还原产物的还原性强。在该反应中,NaClO3作氧化剂,得到电子被还原为还原产物ClO2;H2O2作还原剂,失去电子被氧化为氧化产物O2,所以H2O2的还原性强于ClO2,A正确;
B.Cl元素化合价由反应前NaClO3中的+5价变为反应后ClO2中的+4价,化合价降低,得到电子,被还原为ClO2,B正确;
C.Cl元素化合价由反应前NaClO3中的+5价变为反应后ClO2中的+4价,化合价降低,得到电子,每有1个NaClO3参加反应,转移1个电子,C错误;
D.根据物质的拆分原则,反应2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+2H2O+O2↑的离子方程式可表示为:2ClO+H2O2+2H+=2ClO2↑+2H2O+O2↑,D正确;
故选C。
14.C
【来源】浙江省宁波市北仑中学2019-2020学年高二下学期期中考试化学(1班)试题
【详解】A.过氧化钠与水反应生成氢氧化钠和氧气,氢氧化钠具有腐蚀性,不能用于自来水的杀菌消毒,故A错误;
B.Cu与稀硝酸反应,应选稀硫酸或稀盐酸清除铜镜表面的铜锈,故B错误;
C.乙烯是水果的催熟剂,高锰酸钾溶液能氧化乙烯,则可达到水果保鲜的目的,故C正确;
D.3molC参加反应,2molC作还原剂,1molC作氧化剂,则氧化剂与还原剂物质的量之比为l:2,故D错误;
故答案选C。
15.C
【来源】【苏州新东方】06姑苏五中
【详解】造成酸雨的是氮氧化物、二氧化硫等气体,CO2会造成温室效应,故选:C。
16.(1) ei ad dj
(2)NaClO
(3) 溶液由浅绿色变为黄色
(4)
【来源】四川省广元中学2021-2022学年高一下学期入学考试化学试题
【详解】(1)氧化物为两种元素形成的化合物中其中一种元素为氧元素的,属于氧化物的有ei,氢氧化铁胶体具有较大的表面积,能吸附水中悬浮杂质,能净水,明矾中的铝离子也能水解生成氢氧化铝胶体,也能净水,故能净水的有ad,明矾是十二水合硫酸铝钾,属于盐,偏铝酸钠属于盐。故属于盐的有dj。
(2)84消毒液的主要成分为次氯酸钠。
(3)硫酸亚铁溶液中加入过氧化氢生成硫酸铁,溶液的颜色从绿色变成黄色,反应的离子方程式为:。
(4)向明矾溶液中加入过量的氢氧化钠,反应生成偏铝酸根离子,反应的离子方程式为:。
17.(1)-1
(2)还原
(3)氧化产物、还原产物
(4)1:1
(5)48
【来源】宁夏吴忠中学2022-2023学年高一上学期期中考试化学试题
【详解】(1)NaH中Na元素为金属元素,因此Na元素呈+1价,根据化合物化合价为0可知,H元素呈-1价。
(2)反应过程中只有H元素化合价发生变化,根据氧化还原反应中同种元素化合价“只靠近,不交叉”原则可知双线桥表示为,NaH中H元素化合价升高,被氧化,作还原剂。
(3)由双线桥可知,H2既是氧化产物,也是还原产物。
(4)由双线桥可知,被氧化的元素和被还原的元素物质的量之比是1:1。
(5)1.204×1024个H2的物质的量为2mol,根据化学方程式可知,每生成2mol H2时消耗2mol NaH,NaH的质量为2mol×24g/mol=48g。
18.(1)KSCN溶液
(2)加入H2O2溶液后,溶液②由浅红色变成深红色
(3)2H++2Fe2++H2O2=2Fe3++2H2O
(4)SCN-中硫元素为-2价,具有还原性,H2O2中氧元素为-1价,具有氧化性
(5)维生素C具有较强还原性,防止Fe2+被氧化
(6)
【来源】上海市杨浦高级中学2021-2022学年高一下学期期期末考试化学试题
【分析】将补铁剂碾碎,然后向其中加入足量盐酸,使二者充分接触发生反应,看到溶液几乎无色,向与盐酸反应后的溶液中加入KSCN溶液,看到溶液显浅红色,说明其中含有少量Fe3+,然后再加入绿色氧化剂H2O2,看到溶液变为深红色,说明该溶液中同时含有Fe2+,H2O2将Fe2+氧化为Fe3+,要验证补铁剂中铁元素的含量,可以将补铁剂碾碎,然后向其中加入足量盐酸,使二者充分接触发生反应,然后过滤除去不溶性杂质,再向滤液中加入足量H2O2,将Fe2+氧化为Fe3+,然后加入足量NaOH溶液,使溶液中的Fe3+转化为Fe(OH)3红褐色沉淀,将沉淀洗涤、灼烧,分解产生Fe2O3,根据Fe2O3的质量,利用Fe元素可计算出补铁剂中铁元素的含量,据此分析解题。
(1)
由分析可知,试剂2是KSCN溶液。
(2)
能证明溶液①中含有Fe2+的实验现象是:加入H2O2溶液后,溶液②由浅红色变成深红色,说明溶液中有更多的Fe3+生成,是Fe2+被H2O2氧化产生的。
(3)
在该反应中Fe元素化合价由反应前Fe2+中的+2价变为反应后Fe3+的+3价,升高1价;O元素化合价由反应前H2O2中的-1价变为反应后H2O中的-2价,化合价降低1×2=2价,化合价升降最小公倍数是2,所以Fe2+、Fe3+的系数是2,H2O2的系数是1,然后根据电荷守恒可知H+的系数是2,最后根据原子守恒可知H2O的系数是2,则配平后的离子方程式为:2H++2Fe2++H2O2=2Fe3++2H2O。
(4)
SCN-中硫元素为-2价,具有还原性,H2O2中氧元素为-1价,具有氧化性,二者可发生氧化还原反应消耗SCN-,导致溶液红色褪去,因此深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
(5)
维生素C具有较强还原性,能够与Fe3+反应产生Fe2+,从而可防止Fe2+被氧化而导致失效变质,因此可在服用该补铁剂时,同时服用维生素C。
(6)
m 片补铁剂经上述处理后反应产生Fe2O3质量是a g,则其中Fe元素的质量为m(Fe)==g,故每一片补铁剂中含有铁元素的质量为 g。
19. 盐酸 KSCN 2Fe2+ + Cl2 == 2Fe3+ + 2Cl- 还原性 4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3 白色沉淀迅速变为灰绿色,最终变为红褐色
【来源】安徽省蚌埠市第二中学2019-2020学年高一上学期期中考试化学试题
【分析】(1)根据“琥珀酸亚铁不溶于水但能溶于人体中的胃酸”分析,应用盐酸溶解琥珀酸亚铁;淡黄色溶液加入试剂2变为淡红色,加入新制氯水后溶液变血红色,则加入的试剂2是KSCN;
(2)加入新制氯水后溶液变为血红色,说明Fe2+被氧化为Fe3+;
(3)Vc可使食物中的Fe3+转化成Fe2+,Fe元素的化合价降低,所以Fe3+是氧化剂,Vc是还原剂,则Vc具有还原性;
(4)碱性环境中Fe(OH)2被O2氧化为氢氧化铁;现象为白色沉淀迅速变为灰绿色,最终变为红褐色。
【详解】(1)根据“琥珀酸亚铁不溶于水但能溶于人体中的胃酸”,用盐酸溶解琥珀酸亚铁,所以试剂1是盐酸;淡黄色溶液加入试剂2变为淡红色,加入新制氯水后溶液变血红色,则加入的试剂2是KSCN溶液;
故答案为盐酸;KSCN;
(2)加入新制氯水后溶液变为血红色,说明Fe2+被氧化为Fe3+,溶液中发生反应的离子方程式是2Fe2+ + Cl2 == 2Fe3+ + 2Cl-;
故答案为2Fe2+ + Cl2 == 2Fe3+ + 2Cl-;
(3)Vc可使食物中的Fe3+转化成Fe2+,Fe元素的化合价降低,所以Fe3+是氧化剂,Vc是还原剂,则Vc具有还原性;
故答案为还原性;
(4)碱性环境中Fe(OH)2被O2氧化为氢氧化铁,反应方程式为4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3;现象为白色沉淀迅速变为灰绿色,最终变为红褐色;
故答案为4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3;白色沉淀迅速变为灰绿色,最终变为红褐色。
20. 分液漏斗的塞子没有取下来 MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 品红褪色 品红褪色 褪色的品红又恢复成红色 无明显现象 Cl2+SO2+2H2O= 2HCl+H2SO4 2Na2O2+2H2O = 4NaOH+O2↑ H2O2 Na2O2+2H2O= 2NaOH+H2O2 2H2O2= 2H2O+O2↑ BD
【来源】安徽省安庆市太湖县太湖中学2019-2020学年高一上学期期末考试化学试题
【分析】实验室用亚硫酸钠和浓硫酸反应生成二氧化硫,二氧化硫具有漂白性,通入品红溶液,品红溶液褪色,加热褪色后的溶液,又变为红色,说明二氧化硫的漂白是可逆性的漂白;实验室用二氧化锰和浓盐酸加热反应生成氯气,氯气通入到品红中,品红溶液褪色,并不是氯气有漂白性,而是氯气与水反应生成次氯酸,次氯酸具有漂白性,加热褪色的溶液,无现象,说明次氯酸的漂白是永久性漂白。
过氧化钠与水反应,滴加酚酞溶液,溶液先变红后褪色,说明不仅生成了碱,还生成了具有漂白性的物质,根据质量守恒得到NaOH溶液和过氧化氢。
【详解】⑴塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,造成分液漏斗内的压强小于大气压强,液体无法流出,故答案为:分液漏斗的玻璃塞没有取下来。
⑵实验室用装置E制备Cl2,其反应的化学化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
⑶①SO2具有漂白性,二氧化硫通入品红溶液中,品红褪色;氯气和水反应生成的次氯酸具有漂白性,因而氯气通入品红溶液中也能使品红褪色;故答案为:品红褪色;品红褪色。
②SO2的漂白具有可逆性,褪色后的溶液加热时又恢复原来的红色;次氯酸的漂白不可逆,加热时,不能恢复红色;故答案为:褪色的品红又恢复成红色;无明显现象。
⑷氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者1:1发生反应:Cl2+SO2+2H2O═2HCl+H2SO4,生成物都无漂白性,因而SO2和Cl2按1:1同时通入到品红溶液时,品红溶液并不褪色;故答案为:Cl2+SO2+2H2O==2HCl+H2SO4。
⑸过氧化钠与水反应生成氢氧化钠和氧气生成,反应方程式为:2Na2O2+2H2O = 4NaOH + O2↑;故答案为:2Na2O2+2H2O = 4NaOH+O2↑。
⑹过氧化钠与水反应过程中,钠元素形成了稳定的化合物,其它元素组合形成的不很稳定、具有漂白性的物质X,X只能为具有强氧化性的H2O2;故答案为:H2O2。
⑺根据实验现象及其质量守恒定律可以推知中间产物为具有氧化性的过氧化氢,双氧水不稳定,分解生成水和氧气,因此反应方程式分别为:Na2O2+2H2O = 2NaOH+H2O2;2H2O2= 2H2O+O2↑;故答案为:Na2O2+2H2O = 2NaOH+H2O2;2H2O2= 2H2O+O2↑。
⑻A. SO2具有还原性,能使酸性高锰酸钾溶液褪色,与SO2的漂白性无关系,故A错误;
B. 漂白粉的有效成分是次氯酸钙,漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂,故B正确;
C. 氯气没有漂白性,真正起漂白剂作用的是氯气与水反应生成的次氯酸,因此液氯没有漂白性,故C错误;
D. 活性炭漂白的本质原因是由于活性炭的比表面积很大,具有很强的吸附能力,所以制造白糖工业中可用活性炭做脱色剂,是利用了活性炭的物理吸附能力,故D正确;
E. 臭氧和双氧水漂白都利用了强氧化性,故漂白原理相同,故E错误;
综上所述,答案为BD。
【点睛】化学实验探究是常考题型,主要考查学生动手实验的操作能力、考查学生通过所学知识推理能力,遇见新问题、新的现象分析问题的能力。
21.(1)2H2SO4(浓)+Zn=ZnSO4+SO2↑+2H2O
(2)A、D、B、F、C、E
(3)防止空气中的水进入干扰实验
(4)CuO由黑色变为红色,且无水CuSO4变蓝
【来源】天津市第二十中学2022-2023学年高一下学期3月月考化学试题
【详解】(1)浓硫酸中S为+6具有强氧化性,被还原为SO2。答案为2H2SO4(浓)+Zn=ZnSO4+2H2O+SO2↑;
(2)SO2用品红检验,H2O用无水硫酸铜检验,而H2利用还原CuO产生水最终检验水来确定。但SO2的检验代入了水,所以先检验H2O再检验SO2,且验完SO2需用酸性KMnO4除去并干燥以免加热不纯的H2爆炸。答案为A、D、B、F、C、E;
(3)空气中含有水汽会干扰水的检验,加入装置进行隔绝。答案防止空气中的水进入CuSO4中干扰实验;
(4)H2具有还原性加热条件下可将CuO还原为Cu,且产生H2O。答案为CuO由黑色变为红色,且无水CuSO4变蓝。
一、单选题
1.下列物质属于离子化合物的是( )
A.He B.H2 C.HCl D.Na2O
2.下列各组物质中都是纯净物的是
A.氧化钙,碘酒 B.氢氧化铁胶体,金刚石
C.冰水混合物,干冰 D.液氧,空气
3.为防止缺碘,可在食盐中加入少量KIO3,KIO3属于
A.氧化物 B.酸 C.碱 D.盐
4.下列说法正确的是
A.只含一种元素的物质不一定是纯净物
B.氧化反应一定属于化合反应
C.含有两种或两种以上不同的元素的物质一定属于混合物
D.纯净物就是由同种元素组成的物质
5.下列各组物质按照单质、化合物、混合物顺序排列的是
A.石墨、Fe(OH)3胶体、澄清石灰水 B.氮气、干冰、冰水混合物
C.液氧、CuSO4、浓硫酸 D.硫粉、氨水、蓝矾
6.下列各组物质中,不能按照如图所示进行转化的是
选项 X Y Z
A C CO CO2
B H2S S SO2
C Al AlCl3 Al(OH)3
D NaOH Na2CO3 NaHCO3
A.A B.B C.C D.D
7.下列关于氯的单质及化合物的叙述中,不正确的是
A.常温常压下,是黄绿色气体 B.在化学反应中能表现还原性
C.加热能使次氯酸发生分解 D.氯水和液氯的成分相同
8.按纯净物、混合物、电解质和非电解质顺序排列的一组物质是( )
A.盐酸、空气、醋酸、干冰 B.烧碱、海水、硫酸钠、乙醇
C.稀硫酸、胆矾、烧碱、石灰石 D.胆矾、盐酸、氯化钾、硫酸钡
9.菜谱中记载:虾类不宜与西红柿等富含维生素C 的食物同食。这是因为虾类食物中含有无毒的+5 价砷(As)类物质,其在维生素C 的作用下生成了有毒的+3 价砷(As)类化合物。下列说法正确的是
A.维生素C 做氧化剂
B.+5 价砷类物质被氧化
C.+5 价砷转化为+3 价砷时,得到电子
D.已知剧毒物砒霜是砷的氧化物,由上述信息可推知砒霜的化学式为 As2O5
10.下列实验对应的结论错误的是
A.向品红溶液中通入二氧化硫气体,品红溶液褪色,证明二氧化硫具有漂白性
B.向常温下的浓硫酸中加入铜片,无明显现象,证明浓硫酸使铜片钝化
C.向和混合溶液中滴加氯水,溶液变成红色,证明氯水具有氧化性
D.通过灼热的,黑色固体逐渐变为红色,证明具有还原性
11.下列关于硫酸工业的说法正确的是
A.在纯氧中煅烧黄铁矿 B.在高压条件下制
C.用98%浓硫酸吸收 D.用澄清石灰水吸收尾气
12.下列物质的性质和用途均正确且具有因果关系的是
A.单质硫具有可燃性,可用于焰色试验
B.氢气具有可燃性,可用于金属冶炼
C.铝丝具有还原性,可用作电缆材料
D.铁粉具有还原性,可用作食品的抗氧化剂
13.ClO2作为一种广谱型的消毒剂,将逐渐取代Cl2成为自来水的消毒剂。可用氯酸钠和双氧水在酸性条件下制备,反应方程式为:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+2H2O+O2↑,下列说法不正确的是
A.H2O2的还原性强于ClO2
B.NaClO3在反应中被还原
C.1个NaClO3参加反应,转移2个电子
D.该反应的离子方程式为:2ClO+H2O2+2H+=2ClO2↑+2H2O+O2↑
14.对下列物质及其反应的叙述正确的是( )
A.Cl2、ClO2、O3和Na2O2等都具有强氧化性,均可用于饮用水的消毒
B.稀硝酸具有酸性,可除去铜制品表面的铜锈
C.乙烯可发生氧化反应,因此用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯
D.反应:3C+SiO2=SiC+2CO中氧化剂与还原剂的物质的量之比为3:1
15.下列气体排放到空气中,不会导致酸雨的是
A.NO B.NO2 C.CO2 D.SO2
二、填空题
16.下列是中学阶段常见的重要化学物质:
a.氢氧化铁胶体 b.氢氧化钠 c.溶液 d.明矾 e.氧化铝 f.稀硫酸酸化的硫酸亚铁溶液 g.84消毒液 h.稀盐酸 i.二氧化硅 j.偏铝酸钠
请完成下列各题:
(1)属于氧化物的有___________(填序号,下同),能净水的有___________,属于盐的有___________。
(2)g的有效成分是___________(填化学式)。
(3)向f中滴加几滴c,观察到的现象是___________,发生反应的离子方程式为___________。
(4)向d溶液中加入过量b溶液,发生反应的离子方程式为___________。
17.NaH可在野外用作生氢剂,化学反应原理为:NaH+H2O=NaOH+H2↑。请回答下列问题。
(1)NaH中氢元素化合价为为___________价。
(2)反应中NaH作___________剂。
(3)H2是___________产物。
(4)被氧化的元素和被还原的元素物质的量之比是___________。
(5)若生成1.204×1024个H2,理论上需要NaH的质量是___________克。
18.铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】I.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
II.KSCN中的硫元素为-2价。
III.受热分解生成。
实验I.检验该补铁剂中铁元素的价态。
(1)试剂2是___________。
(2)能证明溶液①中含有的实验现象是___________。
(3)补全在上述条件下与发生反应的离子方程式:_____
______________________________+___________
(4)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的与发生了化学反应。甲同学猜测的理论依据是___________。
实验II.测定该补铁剂中铁元素的含量。
(5)易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C。维生素C的作用是___________。
(6)计算每片该补铁剂含铁元素的质量为___________g。
三、实验题
19.健康人体内含铁元素大约 2~3g,人体内铁元素以亚铁离子和三价铁离子的形式存在,Fe2+易被吸收,所以给贫血者补充铁元素时,应补充含 Fe2+的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
(1) 试剂1的名称是__________;试剂2的化学式为______________。
(2) 加入新制氯水,溶液中发生反应的离子方程式是_____________________________。
(3) 加入试剂2 时溶液为淡红色说明 “速力菲”中的 Fe2+已部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有___________性。
(4) 不仅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,请写出反应的化学方程式________________________,现象为__________________________。
20.随着网络信息时代不断的发展,人和事件在网络上曝光的几率更大了,所以网络红人也逐渐的增加起来。2018年8月9日,美国男子为了变成网络红人,居然用漂白粉洗澡,结果差点被送进医院。太和一中为塑造中学生正确的价值观,结合此事发出“好学的中学生是最红的”倡议,我校理化创新社的同学发现教材在提到某些物质的用途时,仅指出该物质常用做漂白剂,并没有对其漂白原理及应用范围进行介绍,为响应学校的倡议,决定邀请你一起在全校普及漂白剂知识。查阅资料可知常见的六种漂白剂有:活性炭、氯水、过氧化氢、过氧化钠、臭氧、二氧化硫。请你帮助理化创新社的同学解决以下问题:
I.为探究和比较SO2和氯水的漂白性,理化创新社的同学设计了如的实验装置。
⑴实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:________________;
⑵实验室用装置E制备Cl2,其反应的化学化学方程式为:________________;
⑶①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:________________,D:________________;
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:B:________________,D:________________;
⑷一位同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________________;
II.很多同学认为往过氧化钠固体完全溶解反应后的溶液中滴加酚酞只会变红而不会褪色,而理化创新社的同学在实验中发现酚酞变红后又褪色。请帮助他们探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后褪色的原因:
⑸过氧化钠与水反应的化学方程式为:________________;
⑹经查阅文献发现过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不是很稳定且具有漂白性的物质X,X的化学式是________________;
⑺查阅资料发现过氧化钠与水的反应可以认为存在2步反应。请你尝试写出这2步化学反应的化学方程式:①________________;
②________________;
⑻下列说法正确的是________________。
A.利用SO2的漂白性可使酸性高锰酸钾溶液褪色
B.漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂
C.为便于储存和使用,可用液氯代替氯水漂白干燥棉布上的有色物质
D.制造白糖工业中可用活性炭做脱色剂,是利用了活性炭的物理吸附能力
E.臭氧的漂白原理和双氧水不相同
21.下面是某校化学研究性学习小组探究足量锌与浓硫酸反应的实验:
I.甲同学设计如图实验验证该反应产生的混合气体中含有、、,已知装置C中试剂过量。
A. B. C. D.
E. F.
(1)写出A中生成的化学方程式________
(2)若按气体从左到右的流向,气体流经的各装置连接顺序是________
(3)E中干燥管的作用是________
(4)证明混合气体中含有的实验现象为________
参考答案:
1.D
【来源】2019年6月福建省普通高中学业水平合格性考试化学试题
【详解】A. He是单质不是化合物,故A错误;
B. H2是单质不是化合物,故B错误;
C. HCl只含有共价键,是共价化合物,故C错误;
D. Na2O只含有离子键,是离子化合物;故D正确;
答案选D。
【点睛】一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,含离子键的一定为离子化合物,以此来解答。
2.C
【来源】广东省湛江市2021-2022学年高一上学期期中考试化学试题
【详解】A.碘酒是指碘和酒精的混合物,A项不选;
B.氢氧化铁胶体是混合物,B项不选;
C.冰是水的固态,故冰水混合物是纯净物,干冰是CO2,是纯净物,C项选;
D.空气是混合物,D项不选;
答案选C。
3.D
【来源】【浙江新东方】高中化学20210621-012【2021】【高一下】
【详解】KIO3会电离产生金属阳离子K+、酸根离子,因此属于盐,故合理选项是D。
4.A
【来源】河北省衡水市武强中学2021-2022学年高一上学期第一次月考化学试题
【详解】A.只含一种元素的物质不一定是纯净物,例如O2和O3的混合物,A正确;
B.氧化反应不一定是化合反应,如甲烷与氧气反应生成二氧化碳和水,B错误;
C.含有两种或两种以上不同的元素的物质中,若只有一种构成微粒,则属于化合物;若含有两种或两种以上的构成微粒,则属于混合物,因此不一定属于混合物,C错误;
D.纯净物是由一种物质组成,可以是化合物(多种元素组成),D错误;
综上所述答案为A。
5.C
【来源】河南省豫西名校2020-2021学年高一上学期第一次联考化学试题
【详解】A. Fe(OH)3胶体是混合物,不属于化合物,A错误;
B.冰水混合物的构成微粒是H2O,属于纯净物,B错误;
C.选项中的各种物质分类合理,C正确;
D.氨水属于混合物,不是化合物,D错误;
答案选C。
6.C
【来源】云南省昆明市2019-2020学年高一下学期期末质量检测化学试题
【详解】A.C在氧气不充足的条件下反应生成CO,CO在氧气中燃烧产生CO2,C和CO2可以在高温下反应生成了CO,符合图中的转化关系,故A不符合题意;
B.H2S可以和氧气反应制得S,S在氧气中燃烧得到SO2,H2S和SO2可以反应得到S,符合图中的转化关系,故B不符合题意;
C.Al可以和氯气或稀盐酸反应得到AlCl3,AlCl3可以和氨水或适量的氢氧化钠反应得到Al(OH)3,Al和Al(OH)3不能反应得到AlCl3,不符合图中的转化关系,故C符合题意;
D.NaOH和少量二氧化碳反应得到Na2CO3,Na2CO3和二氧化碳和水反应得到NaHCO3,NaOH和NaHCO3可以反应得到Na2CO3,符合图中的转化关系,故D不符合题意;
答案选C。
7.D
【来源】北京市东城区2022-2023学年高一上学期期末统一检测化学试卷
【详解】A.常温常压下,是黄绿色气体,故A正确;
B.中氯元素化合价既可以升高又可以降低,在化学反应中既能表现还原性又能表现氧化性,故B正确;
C.次氯酸加热分解为盐酸和氧气,故C正确;
D.氯水是氯气的水溶液,氯水是混合物;液氯中只含氯分子,液氯是纯净物,故D错误;
选D。
8.B
【来源】贵州省安顺市平坝第一高级中学2019-2020学年高一上学期期中考试化学试题
【分析】只由一种物质组成的是纯净物;由多种物质组成的是混合物;在水溶液或熔融状态下能导电的化合物是电解质;在水溶液和熔融状态下不能导电的化合物是非电解质,据此判断。
【详解】A. 盐酸是混合物,空气是混合物,醋酸是电解质,干冰是非电解质,A项错误;
B. 烧碱是纯净物,海水是混合物,硫酸钠是电解质,乙醇是非电解质,B项正确;
C. 稀硫酸是混合物,胆矾是纯净物,烧碱是电解质,石灰石是电解质,C项错误;
D. 胆矾是纯净物,盐酸是混合物,氯化钾是电解质,硫酸钡是电解质,D项错误;
答案选B。
9.C
【来源】湖湘教育三新探索协作体2020-2021学年高一11月联考化学试题
【详解】A.由信息可知,反应中砷元素的化合价降低,则维生素 C 中某元素的化合价升高,则维生素 C 在反应中做还原剂,A 错误;
B.+5 价砷类物质做氧化剂,价态降低,被还原,B 错误;
C.+5 价砷转化为+3 价砷时,化合价降低,得到电子,C 正确;
D.由题中给出+5 砷类物质是无毒的,+3 价砷类化合物有毒,则推知砒霜是+3 价砷的氧化物,其化学式为As2O3,D 错误;
故选C。
10.B
【来源】山东省潍坊市2022-2023学年高三上学期期中考试化学考试题
【详解】A.向品红溶液中通入二氧化硫气体,品红溶液褪色,证明二氧化硫具有漂白性,A选项正确;
B.向常温下的浓硫酸中加入铜片,无明显现象,不是因为钝化,是因为浓硫酸与铜在常温下不反应,浓硫酸与铜需要加热才会反应, B选项错误;
C.向和混合溶液中滴加氯水,溶液变成红色,是因为氯水将FeSO4氧化为Fe2(SO4)3,Fe3+与反应使溶液变红,证明氯水具有氧化性,C选项正确;
D.通过灼热的,黑色固体逐渐变为红色,发生了反应:2NH3+3CuO 3Cu+N2+3H2O,该反应中NH3做还原剂,证明具有还原性,D选项正确;
答案选B。
11.C
【来源】上海市普通高中2022年学业水平等级考试化学试题
【详解】A.硫酸的工业制备 硫酸工业中,在沸腾炉中通入空气煅烧黄铁矿制备二氧化硫,A错误;
B.硫酸工业中催化氧化制备,在常压条件下进行即可,因为该反应在常压下的转化率已经很大,加压虽然可以使转化率增大,但同时对设备要求提高、经济成本增大,B错误;
C.采用98%的浓硫酸吸收,可避免产生大量酸雾降低吸收效率,C正确;
D.硫酸工业产生的尾气主要是,工业上通常采用石灰乳进行吸收,澄清石灰水中浓度太低,不适合处理工业尾气,D错误;
故选C。
12.D
【来源】广西北海市2020-2021学年高一上学期期末教学质量检测化学试题
【详解】A.单质硫具有可燃性,与用于焰色反应无关,焰色反应是指金属和它们的化合物在灼烧时会有特殊颜色,故A错误;
B.并非所有可燃性物质都能用于金属冶炼,故氢气具有可燃性,与它用于金属冶炼无关,故B错误;
C.铝丝具有还原性,与它可用作导体即具有导电性无关,故C错误;
D.铁粉具有还原性,可用氧气反应,防止食品氧化、腐败,可作抗氧化剂,故D正确;
故选D。
13.C
【来源】江苏省天一中学2021-2022学年高一上学期期中考试化学(强化班)试题
【详解】A.氧化剂的氧化性比氧化产物的氧化性强,还原剂的还原性比还原产物的还原性强。在该反应中,NaClO3作氧化剂,得到电子被还原为还原产物ClO2;H2O2作还原剂,失去电子被氧化为氧化产物O2,所以H2O2的还原性强于ClO2,A正确;
B.Cl元素化合价由反应前NaClO3中的+5价变为反应后ClO2中的+4价,化合价降低,得到电子,被还原为ClO2,B正确;
C.Cl元素化合价由反应前NaClO3中的+5价变为反应后ClO2中的+4价,化合价降低,得到电子,每有1个NaClO3参加反应,转移1个电子,C错误;
D.根据物质的拆分原则,反应2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+2H2O+O2↑的离子方程式可表示为:2ClO+H2O2+2H+=2ClO2↑+2H2O+O2↑,D正确;
故选C。
14.C
【来源】浙江省宁波市北仑中学2019-2020学年高二下学期期中考试化学(1班)试题
【详解】A.过氧化钠与水反应生成氢氧化钠和氧气,氢氧化钠具有腐蚀性,不能用于自来水的杀菌消毒,故A错误;
B.Cu与稀硝酸反应,应选稀硫酸或稀盐酸清除铜镜表面的铜锈,故B错误;
C.乙烯是水果的催熟剂,高锰酸钾溶液能氧化乙烯,则可达到水果保鲜的目的,故C正确;
D.3molC参加反应,2molC作还原剂,1molC作氧化剂,则氧化剂与还原剂物质的量之比为l:2,故D错误;
故答案选C。
15.C
【来源】【苏州新东方】06姑苏五中
【详解】造成酸雨的是氮氧化物、二氧化硫等气体,CO2会造成温室效应,故选:C。
16.(1) ei ad dj
(2)NaClO
(3) 溶液由浅绿色变为黄色
(4)
【来源】四川省广元中学2021-2022学年高一下学期入学考试化学试题
【详解】(1)氧化物为两种元素形成的化合物中其中一种元素为氧元素的,属于氧化物的有ei,氢氧化铁胶体具有较大的表面积,能吸附水中悬浮杂质,能净水,明矾中的铝离子也能水解生成氢氧化铝胶体,也能净水,故能净水的有ad,明矾是十二水合硫酸铝钾,属于盐,偏铝酸钠属于盐。故属于盐的有dj。
(2)84消毒液的主要成分为次氯酸钠。
(3)硫酸亚铁溶液中加入过氧化氢生成硫酸铁,溶液的颜色从绿色变成黄色,反应的离子方程式为:。
(4)向明矾溶液中加入过量的氢氧化钠,反应生成偏铝酸根离子,反应的离子方程式为:。
17.(1)-1
(2)还原
(3)氧化产物、还原产物
(4)1:1
(5)48
【来源】宁夏吴忠中学2022-2023学年高一上学期期中考试化学试题
【详解】(1)NaH中Na元素为金属元素,因此Na元素呈+1价,根据化合物化合价为0可知,H元素呈-1价。
(2)反应过程中只有H元素化合价发生变化,根据氧化还原反应中同种元素化合价“只靠近,不交叉”原则可知双线桥表示为,NaH中H元素化合价升高,被氧化,作还原剂。
(3)由双线桥可知,H2既是氧化产物,也是还原产物。
(4)由双线桥可知,被氧化的元素和被还原的元素物质的量之比是1:1。
(5)1.204×1024个H2的物质的量为2mol,根据化学方程式可知,每生成2mol H2时消耗2mol NaH,NaH的质量为2mol×24g/mol=48g。
18.(1)KSCN溶液
(2)加入H2O2溶液后,溶液②由浅红色变成深红色
(3)2H++2Fe2++H2O2=2Fe3++2H2O
(4)SCN-中硫元素为-2价,具有还原性,H2O2中氧元素为-1价,具有氧化性
(5)维生素C具有较强还原性,防止Fe2+被氧化
(6)
【来源】上海市杨浦高级中学2021-2022学年高一下学期期期末考试化学试题
【分析】将补铁剂碾碎,然后向其中加入足量盐酸,使二者充分接触发生反应,看到溶液几乎无色,向与盐酸反应后的溶液中加入KSCN溶液,看到溶液显浅红色,说明其中含有少量Fe3+,然后再加入绿色氧化剂H2O2,看到溶液变为深红色,说明该溶液中同时含有Fe2+,H2O2将Fe2+氧化为Fe3+,要验证补铁剂中铁元素的含量,可以将补铁剂碾碎,然后向其中加入足量盐酸,使二者充分接触发生反应,然后过滤除去不溶性杂质,再向滤液中加入足量H2O2,将Fe2+氧化为Fe3+,然后加入足量NaOH溶液,使溶液中的Fe3+转化为Fe(OH)3红褐色沉淀,将沉淀洗涤、灼烧,分解产生Fe2O3,根据Fe2O3的质量,利用Fe元素可计算出补铁剂中铁元素的含量,据此分析解题。
(1)
由分析可知,试剂2是KSCN溶液。
(2)
能证明溶液①中含有Fe2+的实验现象是:加入H2O2溶液后,溶液②由浅红色变成深红色,说明溶液中有更多的Fe3+生成,是Fe2+被H2O2氧化产生的。
(3)
在该反应中Fe元素化合价由反应前Fe2+中的+2价变为反应后Fe3+的+3价,升高1价;O元素化合价由反应前H2O2中的-1价变为反应后H2O中的-2价,化合价降低1×2=2价,化合价升降最小公倍数是2,所以Fe2+、Fe3+的系数是2,H2O2的系数是1,然后根据电荷守恒可知H+的系数是2,最后根据原子守恒可知H2O的系数是2,则配平后的离子方程式为:2H++2Fe2++H2O2=2Fe3++2H2O。
(4)
SCN-中硫元素为-2价,具有还原性,H2O2中氧元素为-1价,具有氧化性,二者可发生氧化还原反应消耗SCN-,导致溶液红色褪去,因此深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。
(5)
维生素C具有较强还原性,能够与Fe3+反应产生Fe2+,从而可防止Fe2+被氧化而导致失效变质,因此可在服用该补铁剂时,同时服用维生素C。
(6)
m 片补铁剂经上述处理后反应产生Fe2O3质量是a g,则其中Fe元素的质量为m(Fe)==g,故每一片补铁剂中含有铁元素的质量为 g。
19. 盐酸 KSCN 2Fe2+ + Cl2 == 2Fe3+ + 2Cl- 还原性 4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3 白色沉淀迅速变为灰绿色,最终变为红褐色
【来源】安徽省蚌埠市第二中学2019-2020学年高一上学期期中考试化学试题
【分析】(1)根据“琥珀酸亚铁不溶于水但能溶于人体中的胃酸”分析,应用盐酸溶解琥珀酸亚铁;淡黄色溶液加入试剂2变为淡红色,加入新制氯水后溶液变血红色,则加入的试剂2是KSCN;
(2)加入新制氯水后溶液变为血红色,说明Fe2+被氧化为Fe3+;
(3)Vc可使食物中的Fe3+转化成Fe2+,Fe元素的化合价降低,所以Fe3+是氧化剂,Vc是还原剂,则Vc具有还原性;
(4)碱性环境中Fe(OH)2被O2氧化为氢氧化铁;现象为白色沉淀迅速变为灰绿色,最终变为红褐色。
【详解】(1)根据“琥珀酸亚铁不溶于水但能溶于人体中的胃酸”,用盐酸溶解琥珀酸亚铁,所以试剂1是盐酸;淡黄色溶液加入试剂2变为淡红色,加入新制氯水后溶液变血红色,则加入的试剂2是KSCN溶液;
故答案为盐酸;KSCN;
(2)加入新制氯水后溶液变为血红色,说明Fe2+被氧化为Fe3+,溶液中发生反应的离子方程式是2Fe2+ + Cl2 == 2Fe3+ + 2Cl-;
故答案为2Fe2+ + Cl2 == 2Fe3+ + 2Cl-;
(3)Vc可使食物中的Fe3+转化成Fe2+,Fe元素的化合价降低,所以Fe3+是氧化剂,Vc是还原剂,则Vc具有还原性;
故答案为还原性;
(4)碱性环境中Fe(OH)2被O2氧化为氢氧化铁,反应方程式为4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3;现象为白色沉淀迅速变为灰绿色,最终变为红褐色;
故答案为4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3;白色沉淀迅速变为灰绿色,最终变为红褐色。
20. 分液漏斗的塞子没有取下来 MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 品红褪色 品红褪色 褪色的品红又恢复成红色 无明显现象 Cl2+SO2+2H2O= 2HCl+H2SO4 2Na2O2+2H2O = 4NaOH+O2↑ H2O2 Na2O2+2H2O= 2NaOH+H2O2 2H2O2= 2H2O+O2↑ BD
【来源】安徽省安庆市太湖县太湖中学2019-2020学年高一上学期期末考试化学试题
【分析】实验室用亚硫酸钠和浓硫酸反应生成二氧化硫,二氧化硫具有漂白性,通入品红溶液,品红溶液褪色,加热褪色后的溶液,又变为红色,说明二氧化硫的漂白是可逆性的漂白;实验室用二氧化锰和浓盐酸加热反应生成氯气,氯气通入到品红中,品红溶液褪色,并不是氯气有漂白性,而是氯气与水反应生成次氯酸,次氯酸具有漂白性,加热褪色的溶液,无现象,说明次氯酸的漂白是永久性漂白。
过氧化钠与水反应,滴加酚酞溶液,溶液先变红后褪色,说明不仅生成了碱,还生成了具有漂白性的物质,根据质量守恒得到NaOH溶液和过氧化氢。
【详解】⑴塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,造成分液漏斗内的压强小于大气压强,液体无法流出,故答案为:分液漏斗的玻璃塞没有取下来。
⑵实验室用装置E制备Cl2,其反应的化学化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
⑶①SO2具有漂白性,二氧化硫通入品红溶液中,品红褪色;氯气和水反应生成的次氯酸具有漂白性,因而氯气通入品红溶液中也能使品红褪色;故答案为:品红褪色;品红褪色。
②SO2的漂白具有可逆性,褪色后的溶液加热时又恢复原来的红色;次氯酸的漂白不可逆,加热时,不能恢复红色;故答案为:褪色的品红又恢复成红色;无明显现象。
⑷氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者1:1发生反应:Cl2+SO2+2H2O═2HCl+H2SO4,生成物都无漂白性,因而SO2和Cl2按1:1同时通入到品红溶液时,品红溶液并不褪色;故答案为:Cl2+SO2+2H2O==2HCl+H2SO4。
⑸过氧化钠与水反应生成氢氧化钠和氧气生成,反应方程式为:2Na2O2+2H2O = 4NaOH + O2↑;故答案为:2Na2O2+2H2O = 4NaOH+O2↑。
⑹过氧化钠与水反应过程中,钠元素形成了稳定的化合物,其它元素组合形成的不很稳定、具有漂白性的物质X,X只能为具有强氧化性的H2O2;故答案为:H2O2。
⑺根据实验现象及其质量守恒定律可以推知中间产物为具有氧化性的过氧化氢,双氧水不稳定,分解生成水和氧气,因此反应方程式分别为:Na2O2+2H2O = 2NaOH+H2O2;2H2O2= 2H2O+O2↑;故答案为:Na2O2+2H2O = 2NaOH+H2O2;2H2O2= 2H2O+O2↑。
⑻A. SO2具有还原性,能使酸性高锰酸钾溶液褪色,与SO2的漂白性无关系,故A错误;
B. 漂白粉的有效成分是次氯酸钙,漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂,故B正确;
C. 氯气没有漂白性,真正起漂白剂作用的是氯气与水反应生成的次氯酸,因此液氯没有漂白性,故C错误;
D. 活性炭漂白的本质原因是由于活性炭的比表面积很大,具有很强的吸附能力,所以制造白糖工业中可用活性炭做脱色剂,是利用了活性炭的物理吸附能力,故D正确;
E. 臭氧和双氧水漂白都利用了强氧化性,故漂白原理相同,故E错误;
综上所述,答案为BD。
【点睛】化学实验探究是常考题型,主要考查学生动手实验的操作能力、考查学生通过所学知识推理能力,遇见新问题、新的现象分析问题的能力。
21.(1)2H2SO4(浓)+Zn=ZnSO4+SO2↑+2H2O
(2)A、D、B、F、C、E
(3)防止空气中的水进入干扰实验
(4)CuO由黑色变为红色,且无水CuSO4变蓝
【来源】天津市第二十中学2022-2023学年高一下学期3月月考化学试题
【详解】(1)浓硫酸中S为+6具有强氧化性,被还原为SO2。答案为2H2SO4(浓)+Zn=ZnSO4+2H2O+SO2↑;
(2)SO2用品红检验,H2O用无水硫酸铜检验,而H2利用还原CuO产生水最终检验水来确定。但SO2的检验代入了水,所以先检验H2O再检验SO2,且验完SO2需用酸性KMnO4除去并干燥以免加热不纯的H2爆炸。答案为A、D、B、F、C、E;
(3)空气中含有水汽会干扰水的检验,加入装置进行隔绝。答案防止空气中的水进入CuSO4中干扰实验;
(4)H2具有还原性加热条件下可将CuO还原为Cu,且产生H2O。答案为CuO由黑色变为红色,且无水CuSO4变蓝。
