1.1物质的分类及转化同步练习题(含解析))高一上学期人教版(2019)化学必修一
文档属性
| 名称 | 1.1物质的分类及转化同步练习题(含解析))高一上学期人教版(2019)化学必修一 |  | |
| 格式 | docx | ||
| 文件大小 | 467.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-08 20:59:20 | ||
图片预览




文档简介
1.1 物质的分类及转化 同步练习题
一、选择题
1.下列物质按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合中,正确的是
选项 强电解质 弱电解质 酸性氧化物 碱性氧化物
A H2SO4 CH3COOH NO2 Na2O
B BaSO4 HClO Mn2O7 CaO
C NaCl 氨水 SO2 MnO2
D HI HF CO2 Na2O2
A.A B.B C.C D.D
2.下列说法不正确的组合为
①只含有一种元素的物质一定是纯净物
②生石灰做干燥剂包含化学变化
③是酸性氧化物,硫酸是它与水反应形成的水化物
④碱性氧化物一定是金属氧化物
⑤用纳米铁粉除去废水中的、、、等金属离子发生了化学变化
⑥能与酸反应生成盐和水的氧化物一定是碱性氧化物
⑦用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化
A.①③⑥ B.①②③④⑥ C.②④⑤⑦ D.②④⑥
3.下表中关于物质的分类正确的是
酸 碱 碱性氧化物 酸性氧化物
A H2SO4 NaOH Na2O CO2
B 盐酸 纯碱 CaO SO2
C 醋酸 KOH Mn2O7 SO3
D NaHSO4 Ba(OH)2 CuO P2O5
A.A B.B C.C D.D
4.“绿蚁新醅酒,红泥小火炉”、“酥暖薤白酒,乳和地黄粥”是唐代诗人白居易的著名诗句。下列说法错误的是
A.红泥的颜色主要来自氧化铁 B.乳和粥的分散质是蛋白质
C.酿酒发酵时有二氧化碳生成 D.酒在人体内被氧化释放能量
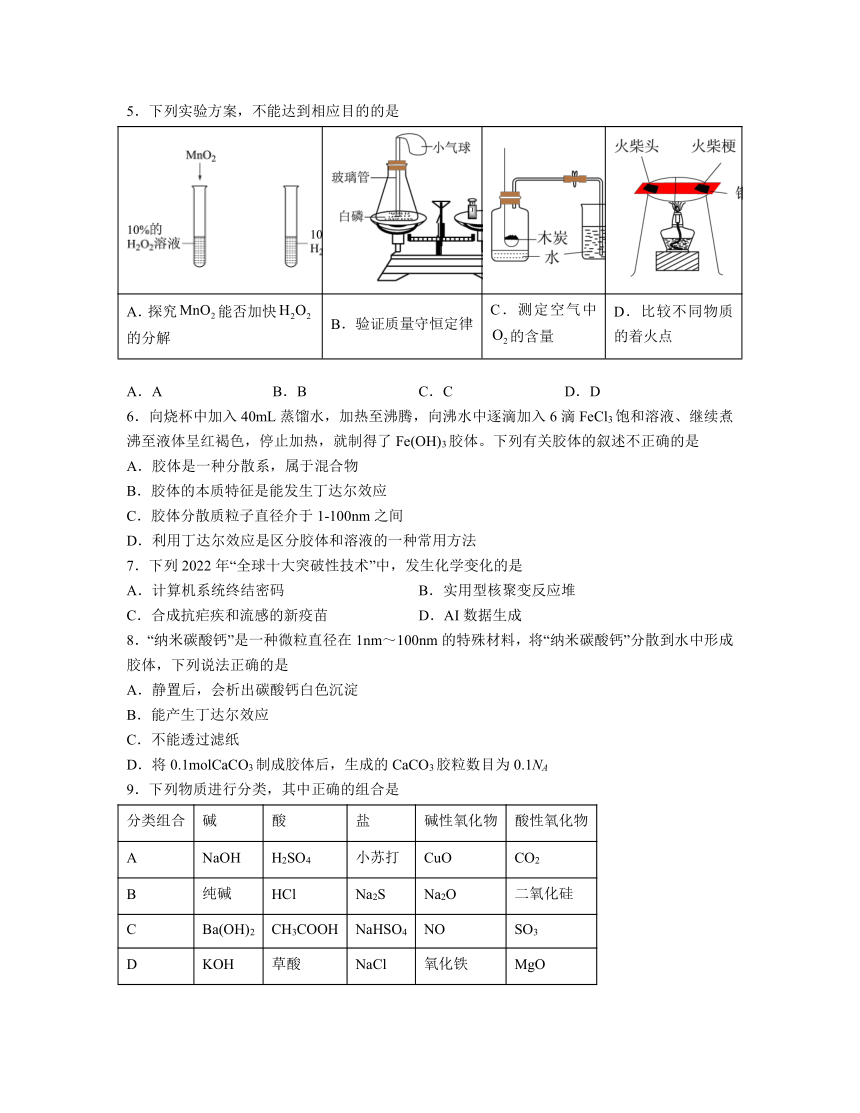
5.下列实验方案,不能达到相应目的的是
A.探究能否加快的分解 B.验证质量守恒定律 C.测定空气中的含量 D.比较不同物质的着火点
A.A B.B C.C D.D
6.向烧杯中加入40mL蒸馏水,加热至沸腾,向沸水中逐滴加入6滴FeCl3饱和溶液、继续煮沸至液体呈红褐色,停止加热,就制得了Fe(OH)3胶体。下列有关胶体的叙述不正确的是
A.胶体是一种分散系,属于混合物
B.胶体的本质特征是能发生丁达尔效应
C.胶体分散质粒子直径介于1-100nm之间
D.利用丁达尔效应是区分胶体和溶液的一种常用方法
7.下列2022年“全球十大突破性技术”中,发生化学变化的是
A.计算机系统终结密码 B.实用型核聚变反应堆
C.合成抗疟疾和流感的新疫苗 D.AI数据生成
8.“纳米碳酸钙”是一种微粒直径在1nm~100nm的特殊材料,将“纳米碳酸钙”分散到水中形成胶体,下列说法正确的是
A.静置后,会析出碳酸钙白色沉淀
B.能产生丁达尔效应
C.不能透过滤纸
D.将0.1molCaCO3制成胶体后,生成的CaCO3胶粒数目为0.1NA
9.下列物质进行分类,其中正确的组合是
分类组合 碱 酸 盐 碱性氧化物 酸性氧化物
A NaOH H2SO4 小苏打 CuO CO2
B 纯碱 HCl Na2S Na2O 二氧化硅
C Ba(OH)2 CH3COOH NaHSO4 NO SO3
D KOH 草酸 NaCl 氧化铁 MgO
A.A B.B C.C D.D
10.中华文化源远流长,三星堆考古出土了大量文物,如黄金面具、丝绸“黑炭”、青铜神树、陶瓷碎片等。下列有关说法正确的是
A.可以用碳的一种核素测定出土文物的年代
B.金刚石转化为黑炭的过程属于物理变化
C.黄金易被氧化,出土后的黄金制品要密闭保存
D.青铜器上的铜锈的主要成分为
11.物质分类是化学研究的重要方法之一。化学工作者经常根据物质的组成对物质进行分类研究。近年来发现,在金星大气层中存在三氧化二碳。下列物质与它属于同类的是
A.H2、O3 B.H2SO4、H2CO3 C.SO2、NO D.Na2SO3、KClO3
12.分类是认识和研究物质及其变化的常用的科学方法,如物质可分为纯净物和混合物。下列物质属于化合物的是
A.稀硫酸 B.镁铝合金 C.氢氧化钠 D.氮气
13.有关胶体的说法,下列叙述正确的是
A.胶体的本质特征是具有丁达尔效应
B.依据分散质粒子的直径大小可将分散系分为溶液、胶体与浊液
C.向饱和 FeCl3 溶液中滴加过量的 NaOH 溶液可以制备 Fe(OH)3 胶体
D.胶体微粒可以透过半透膜而不能透过滤纸
14.下列有关胶体的叙述不正确的是
A.胶体属于混合物
B.一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞
C.FeCl3溶液与Fe(OH)3胶体的本质区别是分散质微粒种类不同
D.可以用渗析的方法净化胶体
15.奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足图中阴影部分关系的是
① ② ③ ④
A NaCl K2SO4 KCl
B Na2SO4 K2SO4 KCl NH4Cl
C NaCl K2SO4 KCl NH4Cl
D Na2SO4 KCl K2SO4 NH4Cl
A.A B.B C.C D.D
二、填空题
16.元素是构成化学物质的基本单元,也对物质的化学性质起着重要作用。往往含有相同元素的物质都具有类似的化学性质。现有H、O、Cl、Na、Fe五种元素,按要求回答下列问题:
(1)写出仅由上述元素组成的且符合对应条件的物质的化学式(均只需写一种)酸:___________;碱___________;碱性氧化物___________;具有氧化性的气体单质___________。
(2)写出仅由上述元素组成的物质间发生符合要求的反应的化学方程式(均只需写一个):生成沉淀的反应___________;生成气体的反应___________。
(3)写出仅由上述元素组成的物质间发生符合要求的反应的化学方程式(均只需写一个):属于复分解反应的反应___________;属于化合反应的反应___________。
17.对于数以万计的化学物质和化学反应,分类法的作用几乎是无可替代的。
(1)现有下列5种物质:CuO、CO、MgO、Na2O、FeO,按照不同的分类标准,它们中有1种物质与其他4种物质有明显的不同,这种物质是_______,并写出两种依据:①_______②_______
(2)下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和Na2CO3五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:
①分类标准代号A表示_______。
a.两物质都是氧化物 b.两物质都可溶于水 c.两物质都是含碳化合物
②上述五种物质中的某一物质能与BaCl2反应,溶液中会有白色沉淀产生,该反应的化学方程式为:_______。
③上述五种物质中的某一物质能与澄清石灰水反应,且随着加入量的不同现象表现出差异,请写出相关现象_______以及与之相应的化学方程式:_______。
18.写出表中各物质加横线元素的化合价:
物质 NH3 H2O2 O2 HClO SO2
化合价 _______ _______ _______ _______ _______
三、元素或物质推断题
19.给下图中①~⑤选择适当的物质,使有连线的两物质能发生反应。供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉。
(1)请推断它们的化学式分别为①________;
②________;③________;④________;⑤________。
(2)写出下列序号之间的化学方程式:
①和②:_____________________________________________________;
②和④:_____________________________________________________;
②和⑤:_____________________________________________________;
③和④:____________________________________________________。
四、实验题
20.某化学兴趣小组在实验室中以烧杯为容器,用饱和FeCl3溶液制备Fe(OH)3胶体,并对其性质做了如下探究:
【实验制备】
(1)将FeCl3溶液加到沸水中,加热至整个体系呈______________色为止,即制得Fe(OH)3胶体。
(2)制备过程中,发生化学反应的方程式为______________。
(3)小甲同学在制备时,加热时间过久,结果未能得到胶体。小甲得到的是______________,该物质属于______________(请选择)
A.酸 B.碱 C.盐
【性质探究】
(4)小乙同学想证明Fe(OH)3胶体已经制备成功,他可以利用______________(最简单的方法)进行鉴别。
(5)小丙同学利用______________(下图)方法对Fe(OH)3胶体提纯。
(6)小丁同学将提纯后的Fe(OH)3胶体置于U型管中(下图),通入直流电一段时间后,观察到与电源______________极附近的颜色变深,说明_____________。
【参考答案】
一、选择题
1.B
解析:A.NO2和氢氧化钠反应生成NaNO2、NaNO3两种盐,NO2不是酸性氧化物,故A错误;
B.BaSO4溶于水的部分能完全电离,BaSO4是强电解质;HClO在水溶液中部分电离,HClO是弱电解质;Mn2O7能与碱反应,Mn2O7是酸性氧化物;CaO能与酸反应,CaO是碱性氧化物,故B正确;
C.氨水是混合物,既不是电解质又不是非电解质,故C错误;
D.Na2O2能与盐酸反应生成氯化钠、氧气、水,Na2O2不是碱性氧化物,故D错误;
选B。
2.A
解析:①
只含有一种元素的物质不一定是纯净物,比如含氧元素的氧气和臭氧混合物,因此①不正确;
②生石灰做干燥剂包含化学变化,生石灰吸收水,与水反应,是化学变化,因此②正确;
③SO2与水反应形成亚硫酸而不是生成硫酸,硫酸不是它与水反应形成的水化物,而是由SO3与水反应而得的,因此③不正确;
④碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物,因此④正确;
⑤用纳米铁粉除去废水中的、、、等金属离子是铁将它们置换出来,发生了化学变化,因此⑤正确;
⑥能与酸反应生成盐和水的氧化物不一定是碱性氧化物,比如过氧化钠与亚硫酸反应,因此⑥不正确;
⑦用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐为渗析过程,没有新物质生成是物理变化,因此⑦正确;
综上,不正确的有①③⑥;
答案选A。
3.A
解析:A.选项中各种物质符合物质分类标准,A正确;
B.盐酸是HCl的水溶液,属于混合物,不是化合物,因此不属于酸;纯碱是Na2CO3,该物质属于盐,而不是碱,B错误;
C.Mn2O7属于酸性氧化物,而不是碱性氧化物,C错误;
D.NaHSO4是盐,不属于酸,D错误;
故合理选项是A。
4.B
解析:A.氧化铁为红色,红泥中含有氧化铁,A项正确;
B.乳分散质为蛋白质,粥分散质为淀粉,B项错误;
C.酿酒的反应为,C项正确;
D.乙醇在酶的作用下被氧化为乙酸和乙醛,最终代谢为CO2和H2O释放能量,D项正确;
故选B。
5.C
解析:A.图中实验,加入二氧化锰的试管中过氧化氢分解的速率快,可探究MnO2能否加快H2O2的分解,故A正确;
B.白磷与氧气反应生成五氧化二磷,没有物质逸出,反应前后容器中物质的总质量不变,能直接用于验证质量守恒定律,故B正确;
C.木炭在空气中燃烧生成二氧化碳气体,虽除去氧气,但增加了新的气体,没有形成压强差,不能用来测定空气中氧气含量,故C错误;
D.图中实验,火柴头先燃烧,火柴梗后燃烧,可用于比较不同物质的着火点,故D正确;
故选:C。
6.B
解析:A.分散系由分散质和分散剂组成,胶体是一种分散系,属于混合物,A正确;
B.胶体的本质特征是胶体粒子直径在1-100nm之间,B错误;
C.胶体分散质粒子直径介于1-100nm之间,即10-9-10-7m之间,C正确;
D.丁达尔效应是胶体的特性,可用于区分胶体和溶液,D正确;
故选B。
7.C
【分析】有新物质生成的变化是化学变化,据此解答。
解析:A.计算机系统终结密码过程中没有产生新物质,不是化学变化,A不选;
B.实用型核聚变反应堆过程中没有产生新物质,不是化学变化,B不选;
C.合成抗疟疾和流感的新疫苗过程中产生新物质,属于化学变化,C选;
D.AI数据生成过程中没有产生新物质,不是化学变化,D不选;
答案选C。
8.B
解析:A.“纳米碳酸钙”是一种微粒直径在1nm~100nm的特殊材料,属于胶体粒子的范围,分散到水中形成胶体,故具有介稳性,静置后,不会析出碳酸钙白色沉淀,故A错误;
B.将“纳米碳酸钙”分散到水中形成胶体,能产生丁达尔效应,故B正确;
C.胶体粒子可以透过滤纸,故C错误;
D.胶体粒子为大量CaCO3的集合体,故将0.1molCaCO3制成胶体后,生成的CaCO3胶粒数目小于0.1NA,故D错误;
故选B。
9.A
解析:A.选项中物质分类正确,A正确;
B.纯碱属于盐不是碱,B错误;
C.NO为不成盐氧化物,不是碱性氧化物,C错误;
D.MgO是碱性氧化物,不是酸性氧化物,D错误;
故答案选A。
10.A
解析:A.可以用测定出土文物的年代,其为碳的一种核素,A正确;
B.金刚石和黑炭是两种不同物质,二者的转化发生了化学变化,B错误;
C.黄金活动性很弱,不易被氧化,C错误;
D.铜锈的主要成分是,D错误;
故选A。
11.C
【分析】三氧化二碳属于氧化物。
解析:A.H2、O3属于单质,不是氧化物,A错误;
B.H2SO4和H2CO3属于酸,不是氧化物,B错误;
C.SO2和NO为氧化物,与三氧化二碳属于同类,C正确;
D.Na2SO3和KClO3属于盐,不是氧化物,D错误;
故答案选C。
12.C
【分析】物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;纯净物是由--种物质组成。纯净物又分为单质和化合物。由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物。
解析:A.稀硫酸属于硫酸的水溶液,而溶液则是至少两种物质组成的混合物,所以稀硫酸是混合物,故A错误;
B.镁铝合金属于混合物,故B错误;
C.氢氧化钠是由氢元素、氧元素、钠元素组成的纯净物,属于化合物,故C正确;
D.氮气是由一种元素氮元素组成的纯净物,属于单质,故D错误;
故答案为 C。
13.B
解析:A.胶体的本质特征是分散质粒子的直径大小在1nm—100nm之间,故A错误;
B.依据分散质粒子的直径大小可将分散系分为溶液、胶体与浊液,故B正确;
C.向饱和氯化铁溶液中滴加过量氢氧化钠溶液制得氢氧化铁沉淀,不可能制得氢氧化铁胶体,故C错误;
D.胶体的本质特征是分散质粒子的直径大小在1nm—100nm之间,所以胶体微粒不能透过半透膜而能透过滤纸,故D错误;
故选B。
14.C
解析:A.根据分散系中分散质微粒直径大小,将分散系分为浊液、胶体和溶液,因此胶体属于混合物,A正确;
B.墨水属于胶体,不同品牌墨水的胶体的分散质微粒吸附的电荷种类可能不同,当混合使用时,胶体发生聚沉而形成沉淀而更容易堵塞笔尖,则一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞,B正确;
C.FeCl3溶液与Fe(OH)3胶体的本质区别是分散质微粒直径大小不同,而不是分散质微粒的种类不同,C错误;
D.胶体的分散质微粒不能通过半透膜,而溶液的溶质分子及离子可以通过半透膜,因此可以用渗析的方法提纯净化胶体,D正确;
故合理选项是C。
15.B
解析:A.NaCl属于钠盐,但不属于硫酸盐,属于铵盐,但不属于盐酸盐,A项错误;
B.B中所属分类均正确,B项正确;
C.NaCl属于钠盐,但不属于硫酸盐,C项错误;
D.KCl属于钾盐,但不属于硫酸盐,K2SO4属于钾盐,但不属于盐酸盐,D项错误;
答案选B。
二、填空题
16.(1) HCl NaOH Na2O O2
(2) FeCl2+2NaOH=Fe(OH)2↓+2NaCl Fe+2HCl=FeCl2+H2↑
(3) HCl+NaOH=NaCl+H2O 2H2+O22H2O
解析:(1)电解质电离时所生成的阳离子全部是氢离子的化合物是酸, 电解质电离时生成的阴离子全部是氢氧根离子的化合物是碱,与酸反应生成盐和水的氧化物为碱性氧化物,仅由H、O、Cl、Na、Fe五种元素组成的酸有HCl或HClO等,碱有NaOH或Fe(OH)3等,碱性氧化物有Na2O或FeO等,仅由H、O、Cl、Na、Fe五种元素组成的气体单质有H2或Cl2或O2,其中具有氧化性的有Cl2或O2。
(2)仅由H、O、Cl、Na、Fe五种组成的物质中,氯化亚铁能与氢氧化钠溶液反应生成氢氧化亚铁沉淀和氯化钠,反应的化学方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,氯化铁能与氢氧化钠溶液反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,铁能与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑,钠能与盐酸反应生成氯化钠和氢气,反应的化学方程式为:2Na+2HCl=2NaCl+H2↑。
(3)酸碱的中和反应为复分解反应,盐和碱反应生成新盐和新碱的反应为复分解反应,因此仅由H、O、Cl、Na、Fe五种元素组成的物质中,发生复分解反应的反应有:HCl+NaOH=NaCl+H2O或2HCl+Fe(OH)2=FeCl2+2H2O或FeCl3+3NaOH=3NaCl+Fe(OH)3↓或FeCl2+2NaOH=Fe(OH)2↓+2NaCl,由两种或两种以上物质反应生成一种物质的反应为化合反应,仅由H、O、Cl、Na、Fe五种元素组成的物质中,发生化合反应的反应有:2H2+O22H2O或H2+Cl22HCl或4Na+O2=2Na2O。
17.(1) CO 常温常压下是气体,其余是固体 非金属氧化物,其余是金属氧化物
(2) bc Na2CO3+BaCl2=BaCO3↓+2NaCl 澄清石灰水先变浑浊,后变澄清 CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+H2O+CO2=Ca(HCO3)2
解析:(1)CO在常温常压下是气体,而CuO、MgO、Na2O、FeO是固体;CO是非金属氧化物,而CuO、MgO、Na2O、FeO是金属氧化物;
(2)①乙醇和二氧化碳均能溶于水,且二者均是含碳化合物,答案选bc;
②Na2CO3和BaCl2反应生成BaCO3沉淀,化学方程式为Na2CO3+BaCl2=BaCO3↓+2NaCl;
③将CO2通入澄清石灰水中,CO2先和Ca(OH)2反应生成CaCO3沉淀,Ca(OH)2被完全反应后,CO2再和CaCO3反应生成Ca(HCO3)2,现象为澄清石灰水先变浑浊,后变澄清;化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+H2O+CO2=Ca(HCO3)2。
18. -3 -1 0 +1 +4
解析:氨气分子中氢元素是+1价,则根据化合价代数和为0可知氮元素是-3价;双氧水中氢元素是+1价,则根据化合价代数和为0可知氧元素是-1价;氧气是单质,氧元素化合价是0价;次氯酸分子中氢元素是+1价,氧元素是-2价,则根据化合价代数和为0可知氯元素是+1价;二氧化硫分子中氧元素是-2价,则根据化合价代数和为0可知硫元素是+4价。
三、元素或物质推断题
19. Fe H2SO4 CO2 CaO Na2CO3 Fe+H2SO4FeSO4+H2↑ CaO+H2SO4CaSO4+H2O H2SO4+Na2CO3Na2SO4+H2O+CO2↑ CO2+CaOCaCO3
【分析】根据可供选择的试剂(稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉)可知,其中属于酸的只有硫酸,能与硫酸反应的单质是铁片,能与硫酸反应的盐和氧化物分别为纯碱和生石灰,能与生石灰反应的氧化物为二氧化碳。
解析:(1) 由分析可知,属于酸的只有硫酸,能与硫酸反应的单质是铁片,能与硫酸反应的盐和氧化物分别为纯碱和生石灰,能与生石灰反应的氧化物为二氧化碳。因此,它们的化学式分别为①Fe;②H2SO4;③CO2;④CaO;⑤Na2CO3。
(2)①和②之间的化学方程式为Fe+H2SO4FeSO4+H2↑;
②和④之间的化学方程式为CaO+H2SO4CaSO4+H2O;
②和⑤之间的化学方程式为H2SO4+Na2CO3Na2SO4+H2O+CO2↑;
③和④之间的化学方程式为CO2+CaOCaCO3。
四、实验题
20.(1)红褐色
(2)
(3) Fe(OH)3沉淀 B
(4)丁达尔效应
(5)渗析
(6) 负极连接的阴极 Fe(OH)3胶粒带正电荷
【分析】FeCl3溶液加到沸水中,加热至整个体系呈红褐色为止,即制得Fe(OH)3胶体,实验过程中不宜加热过久,否则胶体容易发生聚沉,形成浊液,胶体具有丁达尔效应,可用此方法来鉴别;据此分析解答。
解析:(1)FeCl3溶液加到沸水中,加热至整个体系呈红褐色为止,即制得Fe(OH)3胶体;
(2)制备过程中,发生化学反应的方程式为;
(3)制得Fe(OH)3胶体时不宜加热过久,否则胶体容易发生聚沉,形成浊液,故小甲同学得到的是Fe(OH)3沉淀,Fe(OH)3属于碱;
(4)最简单的鉴别胶体的方法为丁达尔效应,当用激光笔照射时,会有一道明亮的光路,证明Fe(OH)3胶体已经制成;
(5)溶液能透过半透膜,胶粒不能够透过半透膜,利用渗析能提纯胶体;
(6)通电时,带正电荷的粒子向阴极移动,带负电荷的离子向阳极移动,可观察到与电源负极连接的阴极附近的颜色变深,说明Fe(OH)3胶粒带正电荷。
一、选择题
1.下列物质按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合中,正确的是
选项 强电解质 弱电解质 酸性氧化物 碱性氧化物
A H2SO4 CH3COOH NO2 Na2O
B BaSO4 HClO Mn2O7 CaO
C NaCl 氨水 SO2 MnO2
D HI HF CO2 Na2O2
A.A B.B C.C D.D
2.下列说法不正确的组合为
①只含有一种元素的物质一定是纯净物
②生石灰做干燥剂包含化学变化
③是酸性氧化物,硫酸是它与水反应形成的水化物
④碱性氧化物一定是金属氧化物
⑤用纳米铁粉除去废水中的、、、等金属离子发生了化学变化
⑥能与酸反应生成盐和水的氧化物一定是碱性氧化物
⑦用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化
A.①③⑥ B.①②③④⑥ C.②④⑤⑦ D.②④⑥
3.下表中关于物质的分类正确的是
酸 碱 碱性氧化物 酸性氧化物
A H2SO4 NaOH Na2O CO2
B 盐酸 纯碱 CaO SO2
C 醋酸 KOH Mn2O7 SO3
D NaHSO4 Ba(OH)2 CuO P2O5
A.A B.B C.C D.D
4.“绿蚁新醅酒,红泥小火炉”、“酥暖薤白酒,乳和地黄粥”是唐代诗人白居易的著名诗句。下列说法错误的是
A.红泥的颜色主要来自氧化铁 B.乳和粥的分散质是蛋白质
C.酿酒发酵时有二氧化碳生成 D.酒在人体内被氧化释放能量
5.下列实验方案,不能达到相应目的的是
A.探究能否加快的分解 B.验证质量守恒定律 C.测定空气中的含量 D.比较不同物质的着火点
A.A B.B C.C D.D
6.向烧杯中加入40mL蒸馏水,加热至沸腾,向沸水中逐滴加入6滴FeCl3饱和溶液、继续煮沸至液体呈红褐色,停止加热,就制得了Fe(OH)3胶体。下列有关胶体的叙述不正确的是
A.胶体是一种分散系,属于混合物
B.胶体的本质特征是能发生丁达尔效应
C.胶体分散质粒子直径介于1-100nm之间
D.利用丁达尔效应是区分胶体和溶液的一种常用方法
7.下列2022年“全球十大突破性技术”中,发生化学变化的是
A.计算机系统终结密码 B.实用型核聚变反应堆
C.合成抗疟疾和流感的新疫苗 D.AI数据生成
8.“纳米碳酸钙”是一种微粒直径在1nm~100nm的特殊材料,将“纳米碳酸钙”分散到水中形成胶体,下列说法正确的是
A.静置后,会析出碳酸钙白色沉淀
B.能产生丁达尔效应
C.不能透过滤纸
D.将0.1molCaCO3制成胶体后,生成的CaCO3胶粒数目为0.1NA
9.下列物质进行分类,其中正确的组合是
分类组合 碱 酸 盐 碱性氧化物 酸性氧化物
A NaOH H2SO4 小苏打 CuO CO2
B 纯碱 HCl Na2S Na2O 二氧化硅
C Ba(OH)2 CH3COOH NaHSO4 NO SO3
D KOH 草酸 NaCl 氧化铁 MgO
A.A B.B C.C D.D
10.中华文化源远流长,三星堆考古出土了大量文物,如黄金面具、丝绸“黑炭”、青铜神树、陶瓷碎片等。下列有关说法正确的是
A.可以用碳的一种核素测定出土文物的年代
B.金刚石转化为黑炭的过程属于物理变化
C.黄金易被氧化,出土后的黄金制品要密闭保存
D.青铜器上的铜锈的主要成分为
11.物质分类是化学研究的重要方法之一。化学工作者经常根据物质的组成对物质进行分类研究。近年来发现,在金星大气层中存在三氧化二碳。下列物质与它属于同类的是
A.H2、O3 B.H2SO4、H2CO3 C.SO2、NO D.Na2SO3、KClO3
12.分类是认识和研究物质及其变化的常用的科学方法,如物质可分为纯净物和混合物。下列物质属于化合物的是
A.稀硫酸 B.镁铝合金 C.氢氧化钠 D.氮气
13.有关胶体的说法,下列叙述正确的是
A.胶体的本质特征是具有丁达尔效应
B.依据分散质粒子的直径大小可将分散系分为溶液、胶体与浊液
C.向饱和 FeCl3 溶液中滴加过量的 NaOH 溶液可以制备 Fe(OH)3 胶体
D.胶体微粒可以透过半透膜而不能透过滤纸
14.下列有关胶体的叙述不正确的是
A.胶体属于混合物
B.一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞
C.FeCl3溶液与Fe(OH)3胶体的本质区别是分散质微粒种类不同
D.可以用渗析的方法净化胶体
15.奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足图中阴影部分关系的是
① ② ③ ④
A NaCl K2SO4 KCl
B Na2SO4 K2SO4 KCl NH4Cl
C NaCl K2SO4 KCl NH4Cl
D Na2SO4 KCl K2SO4 NH4Cl
A.A B.B C.C D.D
二、填空题
16.元素是构成化学物质的基本单元,也对物质的化学性质起着重要作用。往往含有相同元素的物质都具有类似的化学性质。现有H、O、Cl、Na、Fe五种元素,按要求回答下列问题:
(1)写出仅由上述元素组成的且符合对应条件的物质的化学式(均只需写一种)酸:___________;碱___________;碱性氧化物___________;具有氧化性的气体单质___________。
(2)写出仅由上述元素组成的物质间发生符合要求的反应的化学方程式(均只需写一个):生成沉淀的反应___________;生成气体的反应___________。
(3)写出仅由上述元素组成的物质间发生符合要求的反应的化学方程式(均只需写一个):属于复分解反应的反应___________;属于化合反应的反应___________。
17.对于数以万计的化学物质和化学反应,分类法的作用几乎是无可替代的。
(1)现有下列5种物质:CuO、CO、MgO、Na2O、FeO,按照不同的分类标准,它们中有1种物质与其他4种物质有明显的不同,这种物质是_______,并写出两种依据:①_______②_______
(2)下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和Na2CO3五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:
①分类标准代号A表示_______。
a.两物质都是氧化物 b.两物质都可溶于水 c.两物质都是含碳化合物
②上述五种物质中的某一物质能与BaCl2反应,溶液中会有白色沉淀产生,该反应的化学方程式为:_______。
③上述五种物质中的某一物质能与澄清石灰水反应,且随着加入量的不同现象表现出差异,请写出相关现象_______以及与之相应的化学方程式:_______。
18.写出表中各物质加横线元素的化合价:
物质 NH3 H2O2 O2 HClO SO2
化合价 _______ _______ _______ _______ _______
三、元素或物质推断题
19.给下图中①~⑤选择适当的物质,使有连线的两物质能发生反应。供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉。
(1)请推断它们的化学式分别为①________;
②________;③________;④________;⑤________。
(2)写出下列序号之间的化学方程式:
①和②:_____________________________________________________;
②和④:_____________________________________________________;
②和⑤:_____________________________________________________;
③和④:____________________________________________________。
四、实验题
20.某化学兴趣小组在实验室中以烧杯为容器,用饱和FeCl3溶液制备Fe(OH)3胶体,并对其性质做了如下探究:
【实验制备】
(1)将FeCl3溶液加到沸水中,加热至整个体系呈______________色为止,即制得Fe(OH)3胶体。
(2)制备过程中,发生化学反应的方程式为______________。
(3)小甲同学在制备时,加热时间过久,结果未能得到胶体。小甲得到的是______________,该物质属于______________(请选择)
A.酸 B.碱 C.盐
【性质探究】
(4)小乙同学想证明Fe(OH)3胶体已经制备成功,他可以利用______________(最简单的方法)进行鉴别。
(5)小丙同学利用______________(下图)方法对Fe(OH)3胶体提纯。
(6)小丁同学将提纯后的Fe(OH)3胶体置于U型管中(下图),通入直流电一段时间后,观察到与电源______________极附近的颜色变深,说明_____________。
【参考答案】
一、选择题
1.B
解析:A.NO2和氢氧化钠反应生成NaNO2、NaNO3两种盐,NO2不是酸性氧化物,故A错误;
B.BaSO4溶于水的部分能完全电离,BaSO4是强电解质;HClO在水溶液中部分电离,HClO是弱电解质;Mn2O7能与碱反应,Mn2O7是酸性氧化物;CaO能与酸反应,CaO是碱性氧化物,故B正确;
C.氨水是混合物,既不是电解质又不是非电解质,故C错误;
D.Na2O2能与盐酸反应生成氯化钠、氧气、水,Na2O2不是碱性氧化物,故D错误;
选B。
2.A
解析:①
只含有一种元素的物质不一定是纯净物,比如含氧元素的氧气和臭氧混合物,因此①不正确;
②生石灰做干燥剂包含化学变化,生石灰吸收水,与水反应,是化学变化,因此②正确;
③SO2与水反应形成亚硫酸而不是生成硫酸,硫酸不是它与水反应形成的水化物,而是由SO3与水反应而得的,因此③不正确;
④碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物,因此④正确;
⑤用纳米铁粉除去废水中的、、、等金属离子是铁将它们置换出来,发生了化学变化,因此⑤正确;
⑥能与酸反应生成盐和水的氧化物不一定是碱性氧化物,比如过氧化钠与亚硫酸反应,因此⑥不正确;
⑦用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐为渗析过程,没有新物质生成是物理变化,因此⑦正确;
综上,不正确的有①③⑥;
答案选A。
3.A
解析:A.选项中各种物质符合物质分类标准,A正确;
B.盐酸是HCl的水溶液,属于混合物,不是化合物,因此不属于酸;纯碱是Na2CO3,该物质属于盐,而不是碱,B错误;
C.Mn2O7属于酸性氧化物,而不是碱性氧化物,C错误;
D.NaHSO4是盐,不属于酸,D错误;
故合理选项是A。
4.B
解析:A.氧化铁为红色,红泥中含有氧化铁,A项正确;
B.乳分散质为蛋白质,粥分散质为淀粉,B项错误;
C.酿酒的反应为,C项正确;
D.乙醇在酶的作用下被氧化为乙酸和乙醛,最终代谢为CO2和H2O释放能量,D项正确;
故选B。
5.C
解析:A.图中实验,加入二氧化锰的试管中过氧化氢分解的速率快,可探究MnO2能否加快H2O2的分解,故A正确;
B.白磷与氧气反应生成五氧化二磷,没有物质逸出,反应前后容器中物质的总质量不变,能直接用于验证质量守恒定律,故B正确;
C.木炭在空气中燃烧生成二氧化碳气体,虽除去氧气,但增加了新的气体,没有形成压强差,不能用来测定空气中氧气含量,故C错误;
D.图中实验,火柴头先燃烧,火柴梗后燃烧,可用于比较不同物质的着火点,故D正确;
故选:C。
6.B
解析:A.分散系由分散质和分散剂组成,胶体是一种分散系,属于混合物,A正确;
B.胶体的本质特征是胶体粒子直径在1-100nm之间,B错误;
C.胶体分散质粒子直径介于1-100nm之间,即10-9-10-7m之间,C正确;
D.丁达尔效应是胶体的特性,可用于区分胶体和溶液,D正确;
故选B。
7.C
【分析】有新物质生成的变化是化学变化,据此解答。
解析:A.计算机系统终结密码过程中没有产生新物质,不是化学变化,A不选;
B.实用型核聚变反应堆过程中没有产生新物质,不是化学变化,B不选;
C.合成抗疟疾和流感的新疫苗过程中产生新物质,属于化学变化,C选;
D.AI数据生成过程中没有产生新物质,不是化学变化,D不选;
答案选C。
8.B
解析:A.“纳米碳酸钙”是一种微粒直径在1nm~100nm的特殊材料,属于胶体粒子的范围,分散到水中形成胶体,故具有介稳性,静置后,不会析出碳酸钙白色沉淀,故A错误;
B.将“纳米碳酸钙”分散到水中形成胶体,能产生丁达尔效应,故B正确;
C.胶体粒子可以透过滤纸,故C错误;
D.胶体粒子为大量CaCO3的集合体,故将0.1molCaCO3制成胶体后,生成的CaCO3胶粒数目小于0.1NA,故D错误;
故选B。
9.A
解析:A.选项中物质分类正确,A正确;
B.纯碱属于盐不是碱,B错误;
C.NO为不成盐氧化物,不是碱性氧化物,C错误;
D.MgO是碱性氧化物,不是酸性氧化物,D错误;
故答案选A。
10.A
解析:A.可以用测定出土文物的年代,其为碳的一种核素,A正确;
B.金刚石和黑炭是两种不同物质,二者的转化发生了化学变化,B错误;
C.黄金活动性很弱,不易被氧化,C错误;
D.铜锈的主要成分是,D错误;
故选A。
11.C
【分析】三氧化二碳属于氧化物。
解析:A.H2、O3属于单质,不是氧化物,A错误;
B.H2SO4和H2CO3属于酸,不是氧化物,B错误;
C.SO2和NO为氧化物,与三氧化二碳属于同类,C正确;
D.Na2SO3和KClO3属于盐,不是氧化物,D错误;
故答案选C。
12.C
【分析】物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;纯净物是由--种物质组成。纯净物又分为单质和化合物。由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物。
解析:A.稀硫酸属于硫酸的水溶液,而溶液则是至少两种物质组成的混合物,所以稀硫酸是混合物,故A错误;
B.镁铝合金属于混合物,故B错误;
C.氢氧化钠是由氢元素、氧元素、钠元素组成的纯净物,属于化合物,故C正确;
D.氮气是由一种元素氮元素组成的纯净物,属于单质,故D错误;
故答案为 C。
13.B
解析:A.胶体的本质特征是分散质粒子的直径大小在1nm—100nm之间,故A错误;
B.依据分散质粒子的直径大小可将分散系分为溶液、胶体与浊液,故B正确;
C.向饱和氯化铁溶液中滴加过量氢氧化钠溶液制得氢氧化铁沉淀,不可能制得氢氧化铁胶体,故C错误;
D.胶体的本质特征是分散质粒子的直径大小在1nm—100nm之间,所以胶体微粒不能透过半透膜而能透过滤纸,故D错误;
故选B。
14.C
解析:A.根据分散系中分散质微粒直径大小,将分散系分为浊液、胶体和溶液,因此胶体属于混合物,A正确;
B.墨水属于胶体,不同品牌墨水的胶体的分散质微粒吸附的电荷种类可能不同,当混合使用时,胶体发生聚沉而形成沉淀而更容易堵塞笔尖,则一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞,B正确;
C.FeCl3溶液与Fe(OH)3胶体的本质区别是分散质微粒直径大小不同,而不是分散质微粒的种类不同,C错误;
D.胶体的分散质微粒不能通过半透膜,而溶液的溶质分子及离子可以通过半透膜,因此可以用渗析的方法提纯净化胶体,D正确;
故合理选项是C。
15.B
解析:A.NaCl属于钠盐,但不属于硫酸盐,属于铵盐,但不属于盐酸盐,A项错误;
B.B中所属分类均正确,B项正确;
C.NaCl属于钠盐,但不属于硫酸盐,C项错误;
D.KCl属于钾盐,但不属于硫酸盐,K2SO4属于钾盐,但不属于盐酸盐,D项错误;
答案选B。
二、填空题
16.(1) HCl NaOH Na2O O2
(2) FeCl2+2NaOH=Fe(OH)2↓+2NaCl Fe+2HCl=FeCl2+H2↑
(3) HCl+NaOH=NaCl+H2O 2H2+O22H2O
解析:(1)电解质电离时所生成的阳离子全部是氢离子的化合物是酸, 电解质电离时生成的阴离子全部是氢氧根离子的化合物是碱,与酸反应生成盐和水的氧化物为碱性氧化物,仅由H、O、Cl、Na、Fe五种元素组成的酸有HCl或HClO等,碱有NaOH或Fe(OH)3等,碱性氧化物有Na2O或FeO等,仅由H、O、Cl、Na、Fe五种元素组成的气体单质有H2或Cl2或O2,其中具有氧化性的有Cl2或O2。
(2)仅由H、O、Cl、Na、Fe五种组成的物质中,氯化亚铁能与氢氧化钠溶液反应生成氢氧化亚铁沉淀和氯化钠,反应的化学方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,氯化铁能与氢氧化钠溶液反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,铁能与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑,钠能与盐酸反应生成氯化钠和氢气,反应的化学方程式为:2Na+2HCl=2NaCl+H2↑。
(3)酸碱的中和反应为复分解反应,盐和碱反应生成新盐和新碱的反应为复分解反应,因此仅由H、O、Cl、Na、Fe五种元素组成的物质中,发生复分解反应的反应有:HCl+NaOH=NaCl+H2O或2HCl+Fe(OH)2=FeCl2+2H2O或FeCl3+3NaOH=3NaCl+Fe(OH)3↓或FeCl2+2NaOH=Fe(OH)2↓+2NaCl,由两种或两种以上物质反应生成一种物质的反应为化合反应,仅由H、O、Cl、Na、Fe五种元素组成的物质中,发生化合反应的反应有:2H2+O22H2O或H2+Cl22HCl或4Na+O2=2Na2O。
17.(1) CO 常温常压下是气体,其余是固体 非金属氧化物,其余是金属氧化物
(2) bc Na2CO3+BaCl2=BaCO3↓+2NaCl 澄清石灰水先变浑浊,后变澄清 CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+H2O+CO2=Ca(HCO3)2
解析:(1)CO在常温常压下是气体,而CuO、MgO、Na2O、FeO是固体;CO是非金属氧化物,而CuO、MgO、Na2O、FeO是金属氧化物;
(2)①乙醇和二氧化碳均能溶于水,且二者均是含碳化合物,答案选bc;
②Na2CO3和BaCl2反应生成BaCO3沉淀,化学方程式为Na2CO3+BaCl2=BaCO3↓+2NaCl;
③将CO2通入澄清石灰水中,CO2先和Ca(OH)2反应生成CaCO3沉淀,Ca(OH)2被完全反应后,CO2再和CaCO3反应生成Ca(HCO3)2,现象为澄清石灰水先变浑浊,后变澄清;化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+H2O+CO2=Ca(HCO3)2。
18. -3 -1 0 +1 +4
解析:氨气分子中氢元素是+1价,则根据化合价代数和为0可知氮元素是-3价;双氧水中氢元素是+1价,则根据化合价代数和为0可知氧元素是-1价;氧气是单质,氧元素化合价是0价;次氯酸分子中氢元素是+1价,氧元素是-2价,则根据化合价代数和为0可知氯元素是+1价;二氧化硫分子中氧元素是-2价,则根据化合价代数和为0可知硫元素是+4价。
三、元素或物质推断题
19. Fe H2SO4 CO2 CaO Na2CO3 Fe+H2SO4FeSO4+H2↑ CaO+H2SO4CaSO4+H2O H2SO4+Na2CO3Na2SO4+H2O+CO2↑ CO2+CaOCaCO3
【分析】根据可供选择的试剂(稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉)可知,其中属于酸的只有硫酸,能与硫酸反应的单质是铁片,能与硫酸反应的盐和氧化物分别为纯碱和生石灰,能与生石灰反应的氧化物为二氧化碳。
解析:(1) 由分析可知,属于酸的只有硫酸,能与硫酸反应的单质是铁片,能与硫酸反应的盐和氧化物分别为纯碱和生石灰,能与生石灰反应的氧化物为二氧化碳。因此,它们的化学式分别为①Fe;②H2SO4;③CO2;④CaO;⑤Na2CO3。
(2)①和②之间的化学方程式为Fe+H2SO4FeSO4+H2↑;
②和④之间的化学方程式为CaO+H2SO4CaSO4+H2O;
②和⑤之间的化学方程式为H2SO4+Na2CO3Na2SO4+H2O+CO2↑;
③和④之间的化学方程式为CO2+CaOCaCO3。
四、实验题
20.(1)红褐色
(2)
(3) Fe(OH)3沉淀 B
(4)丁达尔效应
(5)渗析
(6) 负极连接的阴极 Fe(OH)3胶粒带正电荷
【分析】FeCl3溶液加到沸水中,加热至整个体系呈红褐色为止,即制得Fe(OH)3胶体,实验过程中不宜加热过久,否则胶体容易发生聚沉,形成浊液,胶体具有丁达尔效应,可用此方法来鉴别;据此分析解答。
解析:(1)FeCl3溶液加到沸水中,加热至整个体系呈红褐色为止,即制得Fe(OH)3胶体;
(2)制备过程中,发生化学反应的方程式为;
(3)制得Fe(OH)3胶体时不宜加热过久,否则胶体容易发生聚沉,形成浊液,故小甲同学得到的是Fe(OH)3沉淀,Fe(OH)3属于碱;
(4)最简单的鉴别胶体的方法为丁达尔效应,当用激光笔照射时,会有一道明亮的光路,证明Fe(OH)3胶体已经制成;
(5)溶液能透过半透膜,胶粒不能够透过半透膜,利用渗析能提纯胶体;
(6)通电时,带正电荷的粒子向阴极移动,带负电荷的离子向阳极移动,可观察到与电源负极连接的阴极附近的颜色变深,说明Fe(OH)3胶粒带正电荷。
