第八单元金属和金属材料复习学情训练卷(含答案)---2022-2023学年九年级化学人教版下册
文档属性
| 名称 | 第八单元金属和金属材料复习学情训练卷(含答案)---2022-2023学年九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-08 20:28:23 | ||
图片预览


文档简介
2022~2023学年第八单元《金属和金属材料》复习学情训练卷
附相对原子质量:H-1;C-12;N-14;O-16;Zn-65;
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、下列变化中,不涉及化学变化的是( )
A.蜡炬成灰 B.百炼成钢 C.粮食酿酯 D.干冰升华
2、铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑材料,主要用于制作窗框、卷帘门、防护栏等。下列性质与这些用途无关的是( )
A.导热性好 B.不易生锈 C.密度小 D.强度高
3、铟是制造低熔合金、轴承合金、半导体、电光源等的原料之一。右图为铟元素的相关信息。下列说法正确的是( )
A.铟原子核内有49个电子 B.相对原子质量为114.8g
C.含铟的轴承合金其硬度比纯铟的小 D.In既能表示铟元素,也可表示铟原子
4、下列有关实验现象的描述中正确的是( )
A.硫在空气中燃烧生成二氧化硫
B.铁丝在空气中剧烈燃烧、火星四射、生成黑色固体
C.将黄铜片和纯铜片互相刻划,在纯铜片上留下明显划痕
D.向盛有蒸馏水的试管中滴加肥皂水,振荡后产生大量浮渣
5、下列措施有利于防止铁制品锈蚀的是( )
A.自行车链条上的铁锈不及时除去
B.切过咸菜的菜刀不及时清洗
C.工地上的钢管堆放在潮湿的地方
D.家用剪刀不用时,涂上油并放在干燥处
6、化学为航空航天领域的发展提供强有力的支撑。载人航天器中处理二氧化碳的一种方法是将二氧化碳与氢气反应,该反应的微观示意图如下:( )
下列说法正确的是
A.该反应中有三种氧化物 B.丙的相对分子质量为16
C.该反应属于置换反应 D.参加反应的甲和乙分子个数比为4:1
7、针对下列事实解释不正确的是( )
选项 事实 解释
A 奥运火炬可以水下燃烧 燃烧不需要氧气
B 液态酒精和酒精蒸气都有可燃性 同种分子化学性质相同
C 走进花园可闻到花的香味 分子总是在不断运动着
D 金属钨可作白炽灯灯丝 钨有良好的导电性且熔点高
A.A B.B C.C D.D
8、幸福需要辛勤的劳动来创造。下列劳动项目与所涉及的化学知识不相符的是( )
选项 劳动项目 化学知识
A 用铅笔芯作简易电池的电极材料 铅笔芯中的石墨具有导电性
B 餐后将洗净的铁锅擦干 铁在潮湿环境中易生锈
C 把水煮沸后饮用 煮沸可以降低水的硬度
D 炒菜时油锅着火,用大叶蔬菜扑灭 降低油的着火点
A.A B.B C.C D.D
9、甲、乙、丙三种金属,只有丙在自然界以单质形式存在,乙能与稀盐酸反应产生气泡,甲却不能。三种金属的活动性由强到弱的顺序是( )
A.乙>丙>甲 B.甲>乙>丙
C.乙>甲>丙 D.甲>丙>乙
10、下列数轴表示正确的是( )
A.年产量 B.空气中的含量
C.原子序数 D.含碳量(%)
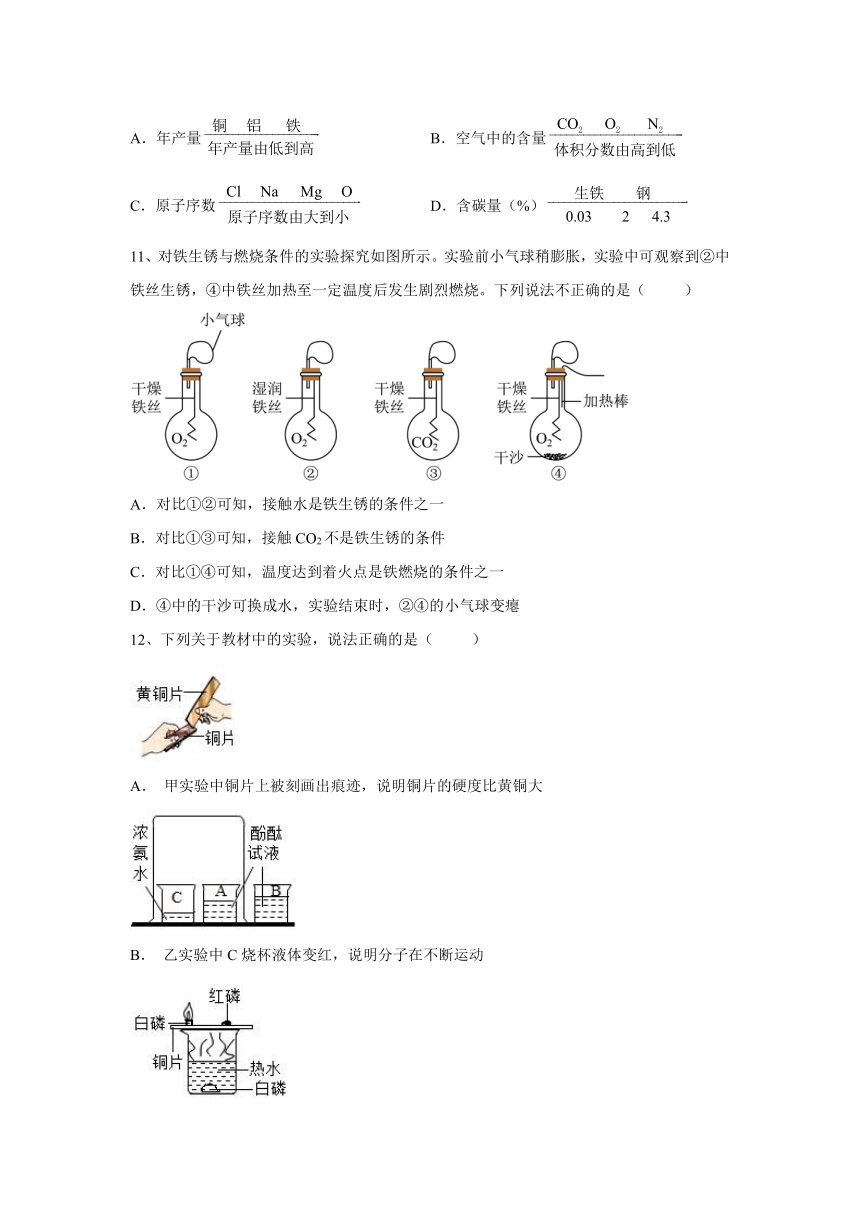
11、对铁生锈与燃烧条件的实验探究如图所示。实验前小气球稍膨胀,实验中可观察到②中铁丝生锈,④中铁丝加热至一定温度后发生剧烈燃烧。下列说法不正确的是( )
A.对比①②可知,接触水是铁生锈的条件之一
B.对比①③可知,接触CO2不是铁生锈的条件
C.对比①④可知,温度达到着火点是铁燃烧的条件之一
D.④中的干沙可换成水,实验结束时,②④的小气球变瘪
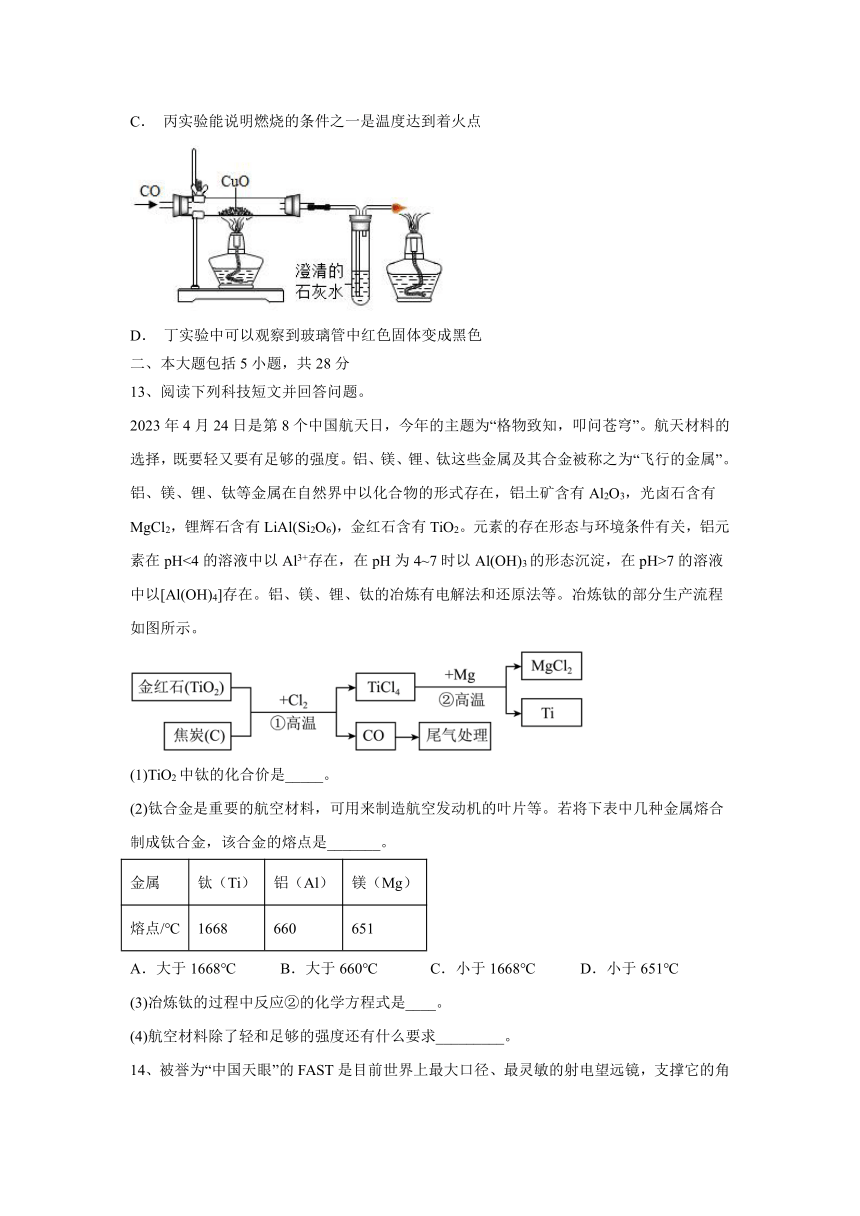
12、下列关于教材中的实验,说法正确的是( )
A. 甲实验中铜片上被刻画出痕迹,说明铜片的硬度比黄铜大
B. 乙实验中C烧杯液体变红,说明分子在不断运动
C. 丙实验能说明燃烧的条件之一是温度达到着火点
D. 丁实验中可以观察到玻璃管中红色固体变成黑色
二、本大题包括5小题,共28分
13、阅读下列科技短文并回答问题。
2023年4月24日是第8个中国航天日,今年的主题为“格物致知,叩问苍穹”。航天材料的选择,既要轻又要有足够的强度。铝、镁、锂、钛这些金属及其合金被称之为“飞行的金属”。铝、镁、锂、钛等金属在自然界中以化合物的形式存在,铝土矿含有Al2O3,光卤石含有MgCl2,锂辉石含有LiAl(Si2O6),金红石含有TiO2。元素的存在形态与环境条件有关,铝元素在pH<4的溶液中以Al3+存在,在pH为4~7时以Al(OH)3的形态沉淀,在pH>7的溶液中以[Al(OH)4]存在。铝、镁、锂、钛的冶炼有电解法和还原法等。冶炼钛的部分生产流程如图所示。
(1)TiO2中钛的化合价是_____。
(2)钛合金是重要的航空材料,可用来制造航空发动机的叶片等。若将下表中几种金属熔合制成钛合金,该合金的熔点是_______。
金属 钛(Ti) 铝(Al) 镁(Mg)
熔点/℃ 1668 660 651
A.大于1668℃ B.大于660℃ C.小于1668℃ D.小于651℃
(3)冶炼钛的过程中反应②的化学方程式是____。
(4)航空材料除了轻和足够的强度还有什么要求_________。
14、被誉为“中国天眼”的FAST是目前世界上最大口径、最灵敏的射电望远镜,支撑它的角钢塔架中含有铁、铜、锰(Mn化合价为+2价),科学小组的同学决定探究这三种金属的活动性强弱,进行了如下图的实验:
(1)从微观角度看,铁、铜、锰三种金属都是由_______________(填“分子”、“原子”或“离子”)构成的;
(2)请写出实验②中的现象是_______________。
(3)实验过程中,科学小组同学发现只有实验①无明显现象,由此可得出三种金属的活动性由强到弱的顺序是_______________,写出试管④中反应的化学方程式_______________。
(4)通过实验现象及分析发现,不需要进行实验______________(选填①②③④)就能够得出结论。
15、黄铜是由铜和锌组成的合金,可用于制造钱币、机器零件等。利用黄铜制造各种物品的过程中,会产生大量的黄铜渣,主要含有Zn、Cu、ZnO、CuO。一种利用黄铜渣获取金属铜和硫酸锌溶液的实验流程如图:
(1)过滤操作需用到的玻璃仪器有漏斗、烧杯和________。
(2)“酸溶”过程中需加入某酸,该酸的化学式为_________。
(3)写出“置换”过程中发生反应的化学方程式________,该过程中需要加入过量Zn的目的是________。
(4)上述流程中,能判断锌的金属活动性比铜强的一个事实是_________。
16、一种“贴身暖宝宝”袋内的主要成分:铁粉、活性炭、食盐等,某化学兴趣小组围绕袋内物质展开探究。
(1)请回答下列问题。
序号 实验操作 实验现象 实验结论
1 取出袋内粉末于滤纸上,与磁铁充分接触 磁铁吸出少量的粉末 袋内含有_____
2 将少量磁铁吸出的粉末加入足量稀硫酸中 剧烈反应得到浅绿色溶液、同时_____
3 少许铁粉撒在酒精灯火焰上 剧烈燃烧、火星四射 铁粉燃烧的化学方程式为_____;铁丝在空气中不能燃烧的原因_____
【拓展探究】用不同燃料测定空气里氧气的含量:分别在图甲所示装置的燃烧匙内放置铁粉、红磷(均足量),电加热引燃。氧气含量随时间变化情况如图乙、图丙。
(2)温度传感器显示,实验过程中瓶内温度均_____(填“升高”或“降低”)。
(3)待铁粉熄灭并恢复至室温后,打开弹簧夹,进入瓶内的水约占原水面上方空间体积的_______。
(4)分析图乙、图丙可知,实验中消耗氧气更彻底的是_______(填“铁粉”或“红磷”,下同),消耗氧气速率更快的是_______。
17、欲测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器,并进行了如图所示的实验。
(1)你认为不能测出Cu-Ag合金中铜的质量分数原因是___________。
(2)计算该合金中铜的质量分数。
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1 2 3 4 5 6 7 8 9 10
D A D C D D A D C A
11 12
B C
二、本大题包括5小题,共28分
13、(1)+4; (2)D;
(3) TiCl4+2MgTi+2MgCl2;
(4)耐高温、耐腐蚀(合理即可)。
14、(1)原子;(2)铁片逐渐溶解,有气体生成,溶液变为浅绿色;
(3) 锰>铁>铜 ; Mn+CuSO4=MnSO4+Cu; (4)④。
15、(1)玻璃棒; (2)H2SO4;
(3) CuSO4+ Zn= ZnSO4+Cu; 使硫酸铜完全反应;
(4)“酸溶”过程中 Zn能与稀硫酸反应,而铜不能反应(或“置换”过程中锌能置换出硫酸铜溶液中的铜)。
16、(1) Fe(铁粉);有气泡产生; 3Fe+2O2Fe3O4 ;氧气浓度低;
(2)升高;
(3)1/5(五分之一);
(4) 铁粉 ; 铁粉。
17、(1)Cu和Ag都不与稀硫酸反应;
(2)解:产生氢气的质量为:26g+98g-123.8g=0.2g,
设合金中锌的质量为x
x=6.5g
故合金中锌的质量为6.5g,铜的质量为26g-6.5g=19.5g,
故合金中铜的质量分数为
答:合金中铜的质量分数为75%
附相对原子质量:H-1;C-12;N-14;O-16;Zn-65;
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、下列变化中,不涉及化学变化的是( )
A.蜡炬成灰 B.百炼成钢 C.粮食酿酯 D.干冰升华
2、铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑材料,主要用于制作窗框、卷帘门、防护栏等。下列性质与这些用途无关的是( )
A.导热性好 B.不易生锈 C.密度小 D.强度高
3、铟是制造低熔合金、轴承合金、半导体、电光源等的原料之一。右图为铟元素的相关信息。下列说法正确的是( )
A.铟原子核内有49个电子 B.相对原子质量为114.8g
C.含铟的轴承合金其硬度比纯铟的小 D.In既能表示铟元素,也可表示铟原子
4、下列有关实验现象的描述中正确的是( )
A.硫在空气中燃烧生成二氧化硫
B.铁丝在空气中剧烈燃烧、火星四射、生成黑色固体
C.将黄铜片和纯铜片互相刻划,在纯铜片上留下明显划痕
D.向盛有蒸馏水的试管中滴加肥皂水,振荡后产生大量浮渣
5、下列措施有利于防止铁制品锈蚀的是( )
A.自行车链条上的铁锈不及时除去
B.切过咸菜的菜刀不及时清洗
C.工地上的钢管堆放在潮湿的地方
D.家用剪刀不用时,涂上油并放在干燥处
6、化学为航空航天领域的发展提供强有力的支撑。载人航天器中处理二氧化碳的一种方法是将二氧化碳与氢气反应,该反应的微观示意图如下:( )
下列说法正确的是
A.该反应中有三种氧化物 B.丙的相对分子质量为16
C.该反应属于置换反应 D.参加反应的甲和乙分子个数比为4:1
7、针对下列事实解释不正确的是( )
选项 事实 解释
A 奥运火炬可以水下燃烧 燃烧不需要氧气
B 液态酒精和酒精蒸气都有可燃性 同种分子化学性质相同
C 走进花园可闻到花的香味 分子总是在不断运动着
D 金属钨可作白炽灯灯丝 钨有良好的导电性且熔点高
A.A B.B C.C D.D
8、幸福需要辛勤的劳动来创造。下列劳动项目与所涉及的化学知识不相符的是( )
选项 劳动项目 化学知识
A 用铅笔芯作简易电池的电极材料 铅笔芯中的石墨具有导电性
B 餐后将洗净的铁锅擦干 铁在潮湿环境中易生锈
C 把水煮沸后饮用 煮沸可以降低水的硬度
D 炒菜时油锅着火,用大叶蔬菜扑灭 降低油的着火点
A.A B.B C.C D.D
9、甲、乙、丙三种金属,只有丙在自然界以单质形式存在,乙能与稀盐酸反应产生气泡,甲却不能。三种金属的活动性由强到弱的顺序是( )
A.乙>丙>甲 B.甲>乙>丙
C.乙>甲>丙 D.甲>丙>乙
10、下列数轴表示正确的是( )
A.年产量 B.空气中的含量
C.原子序数 D.含碳量(%)
11、对铁生锈与燃烧条件的实验探究如图所示。实验前小气球稍膨胀,实验中可观察到②中铁丝生锈,④中铁丝加热至一定温度后发生剧烈燃烧。下列说法不正确的是( )
A.对比①②可知,接触水是铁生锈的条件之一
B.对比①③可知,接触CO2不是铁生锈的条件
C.对比①④可知,温度达到着火点是铁燃烧的条件之一
D.④中的干沙可换成水,实验结束时,②④的小气球变瘪
12、下列关于教材中的实验,说法正确的是( )
A. 甲实验中铜片上被刻画出痕迹,说明铜片的硬度比黄铜大
B. 乙实验中C烧杯液体变红,说明分子在不断运动
C. 丙实验能说明燃烧的条件之一是温度达到着火点
D. 丁实验中可以观察到玻璃管中红色固体变成黑色
二、本大题包括5小题,共28分
13、阅读下列科技短文并回答问题。
2023年4月24日是第8个中国航天日,今年的主题为“格物致知,叩问苍穹”。航天材料的选择,既要轻又要有足够的强度。铝、镁、锂、钛这些金属及其合金被称之为“飞行的金属”。铝、镁、锂、钛等金属在自然界中以化合物的形式存在,铝土矿含有Al2O3,光卤石含有MgCl2,锂辉石含有LiAl(Si2O6),金红石含有TiO2。元素的存在形态与环境条件有关,铝元素在pH<4的溶液中以Al3+存在,在pH为4~7时以Al(OH)3的形态沉淀,在pH>7的溶液中以[Al(OH)4]存在。铝、镁、锂、钛的冶炼有电解法和还原法等。冶炼钛的部分生产流程如图所示。
(1)TiO2中钛的化合价是_____。
(2)钛合金是重要的航空材料,可用来制造航空发动机的叶片等。若将下表中几种金属熔合制成钛合金,该合金的熔点是_______。
金属 钛(Ti) 铝(Al) 镁(Mg)
熔点/℃ 1668 660 651
A.大于1668℃ B.大于660℃ C.小于1668℃ D.小于651℃
(3)冶炼钛的过程中反应②的化学方程式是____。
(4)航空材料除了轻和足够的强度还有什么要求_________。
14、被誉为“中国天眼”的FAST是目前世界上最大口径、最灵敏的射电望远镜,支撑它的角钢塔架中含有铁、铜、锰(Mn化合价为+2价),科学小组的同学决定探究这三种金属的活动性强弱,进行了如下图的实验:
(1)从微观角度看,铁、铜、锰三种金属都是由_______________(填“分子”、“原子”或“离子”)构成的;
(2)请写出实验②中的现象是_______________。
(3)实验过程中,科学小组同学发现只有实验①无明显现象,由此可得出三种金属的活动性由强到弱的顺序是_______________,写出试管④中反应的化学方程式_______________。
(4)通过实验现象及分析发现,不需要进行实验______________(选填①②③④)就能够得出结论。
15、黄铜是由铜和锌组成的合金,可用于制造钱币、机器零件等。利用黄铜制造各种物品的过程中,会产生大量的黄铜渣,主要含有Zn、Cu、ZnO、CuO。一种利用黄铜渣获取金属铜和硫酸锌溶液的实验流程如图:
(1)过滤操作需用到的玻璃仪器有漏斗、烧杯和________。
(2)“酸溶”过程中需加入某酸,该酸的化学式为_________。
(3)写出“置换”过程中发生反应的化学方程式________,该过程中需要加入过量Zn的目的是________。
(4)上述流程中,能判断锌的金属活动性比铜强的一个事实是_________。
16、一种“贴身暖宝宝”袋内的主要成分:铁粉、活性炭、食盐等,某化学兴趣小组围绕袋内物质展开探究。
(1)请回答下列问题。
序号 实验操作 实验现象 实验结论
1 取出袋内粉末于滤纸上,与磁铁充分接触 磁铁吸出少量的粉末 袋内含有_____
2 将少量磁铁吸出的粉末加入足量稀硫酸中 剧烈反应得到浅绿色溶液、同时_____
3 少许铁粉撒在酒精灯火焰上 剧烈燃烧、火星四射 铁粉燃烧的化学方程式为_____;铁丝在空气中不能燃烧的原因_____
【拓展探究】用不同燃料测定空气里氧气的含量:分别在图甲所示装置的燃烧匙内放置铁粉、红磷(均足量),电加热引燃。氧气含量随时间变化情况如图乙、图丙。
(2)温度传感器显示,实验过程中瓶内温度均_____(填“升高”或“降低”)。
(3)待铁粉熄灭并恢复至室温后,打开弹簧夹,进入瓶内的水约占原水面上方空间体积的_______。
(4)分析图乙、图丙可知,实验中消耗氧气更彻底的是_______(填“铁粉”或“红磷”,下同),消耗氧气速率更快的是_______。
17、欲测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器,并进行了如图所示的实验。
(1)你认为不能测出Cu-Ag合金中铜的质量分数原因是___________。
(2)计算该合金中铜的质量分数。
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1 2 3 4 5 6 7 8 9 10
D A D C D D A D C A
11 12
B C
二、本大题包括5小题,共28分
13、(1)+4; (2)D;
(3) TiCl4+2MgTi+2MgCl2;
(4)耐高温、耐腐蚀(合理即可)。
14、(1)原子;(2)铁片逐渐溶解,有气体生成,溶液变为浅绿色;
(3) 锰>铁>铜 ; Mn+CuSO4=MnSO4+Cu; (4)④。
15、(1)玻璃棒; (2)H2SO4;
(3) CuSO4+ Zn= ZnSO4+Cu; 使硫酸铜完全反应;
(4)“酸溶”过程中 Zn能与稀硫酸反应,而铜不能反应(或“置换”过程中锌能置换出硫酸铜溶液中的铜)。
16、(1) Fe(铁粉);有气泡产生; 3Fe+2O2Fe3O4 ;氧气浓度低;
(2)升高;
(3)1/5(五分之一);
(4) 铁粉 ; 铁粉。
17、(1)Cu和Ag都不与稀硫酸反应;
(2)解:产生氢气的质量为:26g+98g-123.8g=0.2g,
设合金中锌的质量为x
x=6.5g
故合金中锌的质量为6.5g,铜的质量为26g-6.5g=19.5g,
故合金中铜的质量分数为
答:合金中铜的质量分数为75%
同课章节目录
