第三章第一节电离平衡同步练习(含解析)高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 第三章第一节电离平衡同步练习(含解析)高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 388.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-09 07:18:09 | ||
图片预览




文档简介
第三章第一节电离平衡同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.肼(N2H4)又称联氨,为二元弱碱,在水中的电离与氨类似。已知常温下,N2H4第一步电离平衡 。下列说法错误的是
A.N2H4的水溶液中存在:
B.反应的平衡常数
C.联氨与硫酸形成酸式盐的化学式为N2H6(HSO4)2
D.向N2H4的水溶液中加水,减小
2.下列电离方程式书写正确的是
A.
B.
C.
D.
3.下列关于醋酸性质的描述,不能证明它是弱电解质的是
A.0.1mol·L-1的醋酸溶液中H+浓度约为10-3mol·L-1
B.醋酸溶液中存在CH3COOH分子
C.CH3COONa溶液pH大于7
D.5mL0.1mol·L-1的醋酸溶液与5mL0.1mol·L-1的KOH溶液恰好完全中和
4.从下列实验事实所引出的相应结论正确的是
选项 实验事实 结论
A 其他条件相同,Na2S2O3溶液浓度越大,析出S沉淀所需时间越短 当其他条件不变时,增大反应物浓度,化学反应速率加快
B 在化学反应前后,催化剂的质量和化学性质都没有发生改变 催化剂一定不参与化学反应
C 物质的量浓度相同的盐酸和醋酸分别与等质量的、形状相同的锌粒反应 反应开始时速率相同
D 在容积可变的密闭容器中发生反应H2(g)+I2(g) 2HI(g),把容积缩小一倍 正反应速率加快,逆反应速率不变
A.A B.B C.C D.D
5.下列实验事实不能证明醋酸是弱电解质的是
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
D.相同浓度的盐酸和醋酸,醋酸溶液的导电性比盐酸的弱
6.在溶液中存在:,对于该平衡,下列叙述错误的是
A.加入少量冰醋酸,电离平衡向正向移动,保持不变
B.加入少量固体,溶液中浓度减小
C.升高温度,醋酸的电离程度增大,溶液减小
D.加入少量固体,减小
7.乙酸的下列性质中,可以证明它是弱电解质的是
A.乙酸以任意比与水互溶
B.0.1mol/L乙酸溶液的c(H+)=10-3mol/L
C.10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应
D.乙酸溶液的导电性比一元强酸溶液的弱
8.常温下,0.1 mol L 1下列溶液:①HCl、②H2SO4、③CH3COOH,导电能力强弱顺序是
A.②>①>③ B.①=②>③ C.①>②>③ D.①=②=③
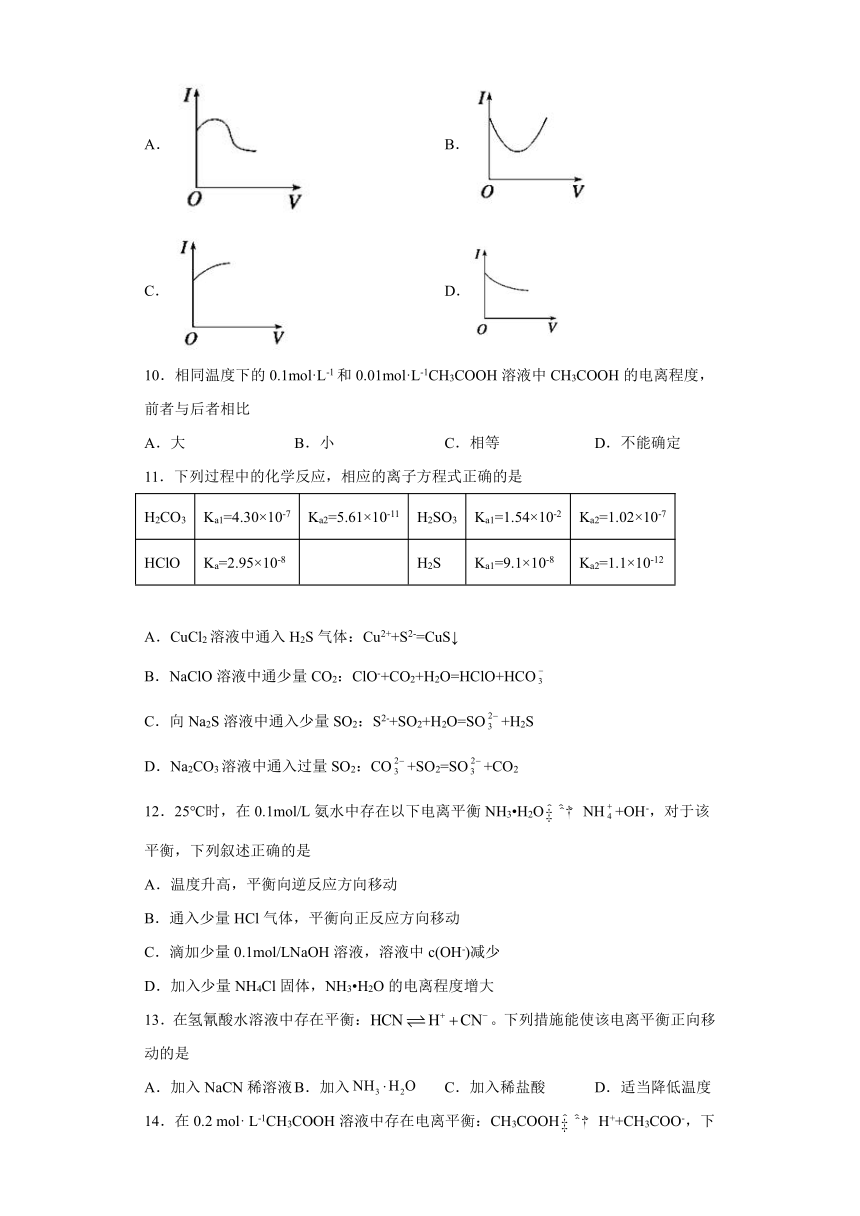
9.在CH3COOH溶液中滴入过量稀氨水,溶液的导电能力发生变化,其电流强度(I)随氨水的加入体积(V)的变化曲线(如图)是
A. B.
C. D.
10.相同温度下的0.1mol·L-1和0.01mol·L-1CH3COOH溶液中CH3COOH的电离程度,前者与后者相比
A.大 B.小 C.相等 D.不能确定
11.下列过程中的化学反应,相应的离子方程式正确的是
H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11 H2SO3 Ka1=1.54×10-2 Ka2=1.02×10-7
HClO Ka=2.95×10-8 H2S Ka1=9.1×10-8 Ka2=1.1×10-12
A.CuCl2溶液中通入H2S气体:Cu2++S2-=CuS↓
B.NaClO溶液中通少量CO2:ClO-+CO2+H2O=HClO+HCO
C.向Na2S溶液中通入少量SO2:S2-+SO2+H2O=SO+H2S
D.Na2CO3溶液中通入过量SO2:CO+SO2=SO+CO2
12.25℃时,在0.1mol/L氨水中存在以下电离平衡NH3 H2ONH+OH-,对于该平衡,下列叙述正确的是
A.温度升高,平衡向逆反应方向移动
B.通入少量HCl气体,平衡向正反应方向移动
C.滴加少量0.1mol/LNaOH溶液,溶液中c(OH-)减少
D.加入少量NH4Cl固体,NH3 H2O的电离程度增大
13.在氢氰酸水溶液中存在平衡:。下列措施能使该电离平衡正向移动的是
A.加入NaCN稀溶液 B.加入 C.加入稀盐酸 D.适当降低温度
14.在0.2 mol· L-1CH3COOH溶液中存在电离平衡:CH3COOHH++CH3COO-,下列叙述正确的是
A.加水稀释,CH3COOH的电离程度减小
B.加入少量NaOH固体,溶液导电性增强
C.滴加少量0.2 mol·L-1盐酸,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
二、多选题
15.下列电离方程式中,正确的是
A. B.
C. D.
三、填空题
16.现有下列物质 ①熔化的NaCl ②盐酸 ③氯气 ④冰醋酸 ⑤铜 ⑥酒精 ⑦硫酸氢钠 ⑧液氨 ⑨SO2,请按要求回答下列问题。
(1)属于强电解质的是_______(填序号)
(2)在上述状态下能导电的是_______(填序号)
(3)属于弱电解质的是_______(填序号)
(4)属于非电解质,但溶于水后的水溶液能导电的是_______(填序号)
(5)可以证明④是弱酸的事实是_______(填序号)
A.乙酸和水能以任意比例混溶
B.在乙酸水溶液中含有未电离的乙酸分子
C.乙酸与Na2CO3溶液反应放出CO2气体
D.1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色
(6)有下列物质的溶液:a.CH3COOH、b.HCl、c.H2SO4、d.NaHSO4,若四种溶液的物质的量浓度相同,其由水电离c(H+)由大到小顺序为_______(用字母序号表示,下同)。若四种溶液的c(H+)相同,其物质的量浓度由大到小顺序为_______。
(7)常温下,有相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______(填字母)。(①表示盐酸,②表示醋酸)
a. b. c. d.
17.按要求填空。
(1)现有以下物质:①NaCl晶体;②SO2;③液态醋酸;④铜;⑤固体BaSO4;⑥纯蔗糖(C12H22O11);⑦酒精(C2H5OH);⑧熔化的KHSO4;⑨氨水;⑩液氮。请回答下列问题。(填相应序号)
①以上物质能导电的是____。
②以上物质属于非电解质的是____。
③以上物质属于强电解质的是____。
④写出⑧的电离方程式:____。
(2)25℃时H2S的Ka1=1.0×10-7,此温度下0.1mol·L-1H2S溶液的c(H+)为____mol·L-1。
(3)25℃时,amol·L-1CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=____。
(4)已知25℃时,几种弱酸的电离平衡常数如下:HCOOH:Ka=1.77×10-4,HCN:Ka=4.9×10-10,H2CO3:Ka1=4.30×10-7,Ka2=5.61×10-11,则以下反应不能自发进行的是____(填字母)。
a.HCOOH+NaCN=HCOONa+HCN
b.NaHCO3+NaCN=Na2CO3+HCN
c.NaCN+H2O+CO2=HCN+NaHCO3
d.2HCOOH+CO=2HCOO-+H2O+CO2↑
e.H2O+CO2+2CN-=2HCN+CO
四、原理综合题
18.弱电解质有许多如:醋酸、碳酸、氢氰酸、一水合氨等,已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如表:
氢氰酸 碳酸 醋酸
Ka=6.2×10-10 Ka1=4.2×10-7Ka2=5.6×10-11 Ka=1.7×10-5
(1)25℃时,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为__。(填序号)
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为__。
(3)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,则混合溶液中c(H+)___c(OH-)。(用“<”或“>”或“=”填空)
(4)常温下,向浓度为0.1mol L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
①该温度时NH3 H2O的电离常数K=___。
②比较b、c、d三点时的溶液中,由水电离出的c(H+)由大到小顺序为__。(填字母,下同)
③滴定时,由b点到c点的过程中,下列各选项中数值保持不变的__。
A.c(H+) c(OH-) B.
C. D.
19.在一定温度下,有a、盐酸b、硫酸c、醋酸三种酸(用a、b、c填空):
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是__。
(2)若三者pH相同时,中和等体积的该三种溶液所需NaOH的物质的量由大到小的顺序是___。
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是__。
(4)在25℃下,将amol/L的醋酸与0.01mol/L的NaOH溶液等体积混合后溶液的pH=7,用含a的代数式表示25℃时CH3COOH的电离常数Ka=__。
(5)设计一个实验证明醋酸是弱电解质:
操作:__;
现象:__;
结论:醋酸是弱电解质。
参考答案:
1.D
【详解】A.N2H4的水溶液中发生电离,生成、、OH-、H+,则溶液中存在电荷守恒:,A正确;
B.反应的平衡常数,B正确;
C.联氨与硫酸形成酸式盐时,发生反应N2H4+2H2SO4=N2H6(HSO4)2,则产物的化学式为N2H6(HSO4)2,C正确;
D.N2H4溶于水后发生两步电离,Kb1=、Kb2=,则=,向N2H4的水溶液中加水,N2H4的电离常数不变,则不变,D错误;
故选D。
2.B
【详解】A.碳酸是弱酸,碳酸氢根离子不拆,NaHCO3在水中全部电离,电离方程式为:NaHCO3=Na++,故A错误;
B.氢氟酸是弱酸,在水中部分电离,,故B正确;
C.硫酸是强酸,在水中全部电离,H2SO4=2H++SO,故C错误;
D.CH3COONH4是强电解质,在水中全部电离,应为:CH3COONH4=CH3COO-+NH,故D错误;
故选B。
3.D
【详解】A.0.1 mol·L-1的醋酸溶液中H+浓度约为10-3 mol·L-1,说明不完全电离,说明其为弱电解质 ,A不符合题意;
B.醋酸溶液中存在CH3COOH分子,说明没有完全电离,说明是弱电解质,B不符合题意;
C.室温时,CH3COONa溶液的pH大于7说明该物质为强碱弱酸盐,醋酸是弱电解质,C不符合题意;
D.5mL 0.1 mol·L-1的醋酸溶液与5mL 0.1mol·L-1的KOH溶液恰好完全中和说明其为一元酸,不能说明其为弱电解质,D符合题意;
故选D。
4.A
【详解】A.增大反应物浓度,化学反应速率加快,A项正确;
B.催化剂参与反应,但反应前后催化剂的质量和化学性质不变,B项错误;
C.浓度相同的盐酸和醋酸溶液中起始氢离子浓度不同,因此开始时盐酸速率大于醋酸,C项错误;
D.缩小容积,正、逆反应速率同时增大,D项错误;
答案选A。
5.A
【详解】A.醋酸溶液和盐酸pH相同,则溶液中c(H+)相同,因此分别与同样颗粒大小的锌反应时,产生H2的起始速率相等,这不能证明醋酸是弱电解质,A符合题意;
B.常温下,测得0.1 mol/L醋酸溶液的pH=4,c(H+)=10-4 mol/L<0.1 mol/L,因此可证明醋酸是弱酸,存在电离平衡,B不符合题意;
C.常温下,将pH=1的醋酸溶液稀释1000倍,若醋酸是强酸,则稀释后c(H+)=10-4 mol/L,pH=4,现在测得pH<4,c(H+)>10-4 mol/L,说明又有一部分醋酸分子发生电离产生H+,使溶液中c(H+)增大,故可以证明醋酸是弱酸,C不符合题意;
D.在相同条件下,相同浓度醋酸溶液的导电性比盐酸的弱,说明醋酸溶液中电离产生的自由移动的离子浓度比HCl小,因此可以说明醋酸是弱酸,D不符合题意;
故合理选项是A。
6.D
【详解】A.加入少量冰醋酸,浓度增大,电离平衡正向移动,只与温度有关,温度不变,不变,A正确;
B.加入少量固体,中和溶液中的氢离子,使溶液中浓度减小,B正确;
C.升高温度,促进电离,醋酸的电离程度增大,增大,减小,C正确;
D.,加入少量固体,电离平衡逆向移动,减小,不变,则增大,D错误;
故答案选:D。
7.B
【详解】A.乙酸水溶性是物理性质,不能证明是弱电解质,故A错误;
B.0.1mol/L的乙酸溶液的c(H+)约为10-3mol/L说明乙酸不能完全电离,可以证明是弱电解质,故B正确;
C.根据方程式可知不论酸碱强弱,只有一元酸与一元碱物质的量相等则恰好发生酸碱中和,完全反应,故C错误;
D.缺少条件,由于溶液浓度不确定,乙酸溶液的导电性比盐酸溶液可能强也可能弱,故D错误;
故答案选B。
8.A
【详解】①HCl是一元强酸,②H2SO4是二元强酸,二元强酸电离出的离子浓度大于一元强酸电离出的离子浓度大,因此二者相比②H2SO4导电能力强;①HCl是一元强酸,③CH3COOH是一元弱酸,相同浓度的一元强酸电离出的离子浓度大于一元弱酸电离出的离子浓度,因此二者相比①HCl导电能力强,常温下,0.1 mol L 1的三者溶液导电能力强弱顺序是②>①>③,故A符合题意;
综上所述,答案为A。
9.A
【详解】醋酸是一元弱酸,在溶液中部分电离,溶液中离子浓度小,导电性弱,向溶液中加入稀氨水时,醋酸溶液与氨水反应生成醋酸铵,溶液中离子浓度增大,导电能力增强,当醋酸溶液恰好完全反应时,溶液中离子浓度最大,导电性最大,若继续滴入氨水,溶液体积增大,一水合氨在溶液中部分电离,溶液的离子浓度减小,导电能力减弱,则图A的曲线符合醋酸溶液中滴入过量稀氨水时,电流强度随氨水的加入体积的变化,故选A。
10.B
【详解】CH3COOH溶液中加水不断促进电离平衡CH3COOH=CH3COO-+H+正向移动,即溶液越稀越电离,故0.1mol·L-1的CH3COOH溶液的电离程度小于0.01mol·L-1CH3COOH溶液的电离程度;
故选B。
11.B
【详解】A.CuCl2溶液中通入H2S气体的离子方程式为Cu2++H2S=CuS↓+2H+,故A错误;
B.NaClO溶液中通少量CO2生成次氯酸钠和碳酸氢钠,故离子方程式为ClO-+CO2+H2O=HClO+HCO,故B正确;
C.向Na2S溶液中通入少量SO2,发生反应的离子方程式为2H2O+2S2-+SO2=4OH-+3S↓,故C错误;
D.Na2CO3溶液中通入过量SO2生成NaHSO3和CO2,故离子方程式为CO+2SO2+H2O=2HSO+CO2,故D错误;
故选B。
12.B
【详解】A.电离吸热,温度升高,平衡向正反应方向移动,故A错误;
B.通入少量HCl气体,氢氧根离子浓度减小,平衡向正反应方向移动,故B正确;
C.氨水是弱碱,在0.1mol/L氨水中氢氧根离子的浓度小于0.1mol/L,滴加少量0.1mol/LNaOH溶液,氢氧根离子的浓度增大,故C错误;
D.加入少量NH4Cl固体,铵根离子浓度增大,电离平衡NH3 H2ONH+OH-逆向移动,NH3 H2O的电离程度减小,故D错误;
选B。
13.B
【详解】A. NaCN是强电解质,加入NaCN稀溶液,通常CN-浓度增大,HCN电离平衡左移,A错误;
B. 为弱碱,加入到HCN溶液中发生中和反应,氢离子浓度减小,HCN电离平衡右移,B正确;
C. 加入稀盐酸,氢离子浓度增大,HCN电离平衡左移,C错误;
D.弱电解质电离吸热,适当降低温度HCN电离平衡左移,D错误;
答案选B。
14.B
【详解】A.加水稀释,促进弱电解质的电离,CH3COOH的电离程度增大,A错误;
B.滴入NaOH固体,生成CH3COONa,发生完全电离,增大了溶液中的离子浓度,从而使溶液的导电性增强,B正确;
C.滴加少量0.2 mol·L-1盐酸,虽抑制了醋酸的电离,但根据勒夏特列原理,溶液中c(H+)增大,C错误;
D.加入少量CH3COONa固体,c(CH3COO-)增大,平衡向逆反应方向移动,D错误;
答案选B。
15.CD
【详解】A.氢氧化钾电离成钾离子和氢氧根离子,,故A错误;
B.碳酸是弱酸,碳酸氢根部分电离,,故B错误;
C.硫酸是强酸,完全电离,,故C正确;
D.硫酸铁是强电解质,完全电离,,故D正确;
故选CD。
16.(1)①⑦
(2)①②⑤
(3)④
(4)⑧⑨
(5)B
(6) a>b=d>c a>b=d>c
(7)c
【分析】电解质是溶于水或在熔融状态下能够导电的化合物;非电解质是溶于水或在熔融状态下不能够导电的化合物;溶液导电的原因是存在自由移动的离子,金属导电的原因是存在自由移动的电子;
强电解质是指在水溶液中或熔融状态下,能够完全电离的化合物,即溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物,一般是强酸、强碱和大部分盐类;弱电解质是指在水溶液里部分电离的电解质,包括弱酸、弱碱、水与少数盐。
【详解】(1)①熔化的NaCl为强电解质,存在自由移动的离子,可以导电;
②盐酸是混合物,溶液中存在自由移动的离子,可以导电;
③氯气为气体单质,不导电;
④冰醋酸为弱电解质,本身不导电,水溶液导电;
⑤铜为金属单质,导电;
⑥酒精为非电解质,不导电;
⑦硫酸氢钠为强电解质,本身不导电,水溶液或熔融状态导电;
⑧液氨为非电解质,不导电;
⑨SO2为非电解质,不导电;
故属于强电解质的是①⑦;
(2)在上述状态下能导电的是①②⑤;
(3)属于弱电解质的是④;
(4)属于非电解质,但溶于水后的水溶液能导电的是⑧⑨;
(5)A.乙酸和水能以任意比例混溶,溶解性不能说明乙酸是弱酸,A错误;
B.在乙酸水溶液中含有未电离的乙酸分子,说明存在电离平衡,说明乙酸是弱酸,B正确;
C.乙酸与Na2CO3溶液反应放出CO2气体,不能说明乙酸是否部分电离,C错误;
D.1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色,说明溶液存在氢离子,不能说明乙酸是否部分电离,D错误;
故选B;
(6)a.CH3COOH b.HCl c.H2SO4 d.NaHSO4。若四种溶液的物质的量浓度相同,硫酸为二元强酸,氢离子浓度最大;HCl、NaHSO4均为强电解质,完全电离,氢离子浓度相同;CH3COOH为弱酸,部分电离,氢离子浓度最小;故其c(H+)由大到小顺序为c>b=d>a,四种溶液对水的电离都起抑制作用,其由水电离c(H+)由大到小顺序为a>b=d>c;若四种溶液的c(H+)相同,其物质的量浓度由大到小顺序为a>b=d>c;
(7)常温下,有c(H+)相同、体积相同的醋酸和盐酸两种溶液,醋酸为弱酸部分电离,盐酸为强酸完全电离,则醋酸浓度远大于盐酸,故一段时间后醋酸反应速率更快且得到氢气更多,故选c。
17.(1) ④⑧⑨ ②⑥⑦ ①⑤⑧ KHSO4=K++HSO
(2)1.0×10-4
(3)
(4)be
【分析】①NaCl晶体,在熔融状态和水溶液中能完全电离生成钠离子和氯离子,属于强电解质,但氯化钠晶体不含自由移动的离子,不导电;
②SO2,在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
③液态醋酸,溶于水时能部分电离生成醋酸根离子和氢离子,属于弱电解质,但液态醋酸不含自由移动的离子,不导电;
④铜为单质,既不是电解质也不是非电解质,但铜含自由移动的电子,能导电;
⑤固体BaSO4,在熔融状态和水溶液中能完全电离生成钡离子和硫酸根离子,属于强电解质,但固体BaSO4不含自由移动的离子,不导电;
⑥纯蔗糖(C12H22O11),在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
⑦酒精(C2H5OH),在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
⑧熔化的KHSO4,能完全电离生成钾离子和硫酸氢根离子,属于强电解质,含自由移动的离子,能导电;
⑨氨水为混合物,既不是电解质也不是非电解质,但溶液中含自由移动的离子,能导电;
⑩液氮为单质,既不是电解质也不是非电解质,不含自由移动的电子或离子,不导电;
(1)
①由分析可知,以上物质能导电的是:④⑧⑨;
②由分析可知,以上物质属于非电解质的是:②⑥⑦;
③由分析可知,以上物质属于强电解质的是:①⑤⑧;
④熔化的KHSO4,完全电离生成钾离子和硫酸氢根离子,其电离方程式为:KHSO4=K++HSO;
(2)
设H2S第一步电离出的氢离子浓度为x,列三段式:
Ka1==≈=1.0×10-7,解得x=1.0×10-4,相对于第一步电离,第二步电离和水电离生成的氢离子可以忽略不记,则此温度下0.1mol·L-1H2S溶液的c(H+)为1.0×10-4mol/L;
(3)
amol/LCH3COOH溶液的pH=b,c(H+)=10-bmol/L,由CH3COOH CH3COO-+H+可知,Ka===;
(4)
酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据电离平衡常数知,酸性:HCOOH>H2CO3>HCN>HCO,
a.酸性:HCOOH>HCN,反应HCOOH+NaCN=HCOONa+HCN能发生,a不符合题意;
b.酸性:HCN>HCO,反应NaHCO3+NaCN=Na2CO3+HCN不能发生,b符合题意;
c.酸性:H2CO3>HCN ,反应NaCN+H2O+CO2=HCN+NaHCO3能发生,c不符合题意;
d.酸性:HCOOH>H2CO3,反应2HCOOH+CO=2HCOO-+H2O+CO2↑能发生,d不符合题意;
e.酸性:H2CO3>HCN>HCO,反应H2O+CO2+2CN-=2HCN+CO不能发生,e符合题意;
答案选be。
18. ①>③>② CN-+CO2+H2O=HCO+HCN < 10-5 d>c>b ACD
【详解】(1)由图表数据可知,酸性:CH3COOH>H2CO3>HCN>HCO,则水解程度:②Na2CO3溶液>③NaCN溶液>NaHCO3溶液>①CH3COONa溶液,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为:①>③>②,故答案为:①>③>②;
(2)向NaCN溶液中通入少量CO2,酸性:H2CO3>HCN>HCO,所以反应生成氰酸和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3,离子方程式为:CN-+CO2+H2O=HCO+HCN,故答案为:CN-+CO2+H2O=HCO+HCN;
(3)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,得到等浓度的HCN和NaCN混合溶液,CN-+H2O HCN+OH-,CN-的平衡常数Kh===1.6×10-5>Ka=6.2×10-10,CN-水解程度大于HCN的电离程度,溶于显碱性,c(H+)<c(OH-),故答案为:<;
(4)①滴定前氨水中c(H+)=10-11mol/L,利用水的离子积得c(OH-) =10-3mol/L,一水合氨的电离平衡常数K==≈10-5,故答案为:10-5;
②在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用;在c点时,溶质为氨水和氯化铵,氨水的电离程度等于氯化铵的水解程度,溶液为中性,对水的电离平衡几乎无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡起促进作用,所以b、c、d三点时的溶液中,水电离的c(H+)大小顺序是d>c>b,故答案为:d>c>b;
③A. c(H+) c(OH-)=Kw,温度不变,水的离子积不变,故A选;
B.b到c的过程中,随着盐酸的加入,溶液中氢离子浓度逐渐增大,氢氧根离子浓度逐渐减小,则的比值逐渐增大,故B不选;
C. =Kb,温度不变,NH3 H2O的电离平衡常数不变,故C选;
D. = Kh,为铵根离子的水解平衡常数,温度不变,则该比值不变,故D选,故答案为:ACD。
19. b>a>c c>a=b a=b>c 测0.1mol/L醋酸溶液的pH pH>1
【详解】(1)盐酸是一元强酸完全电离,氢离子浓度等于酸的浓度;硫酸是二元强酸完全电离,硫酸中氢离子浓度为酸的二倍;醋酸是弱酸部分电离,氢离子的浓度小于酸的浓度;所以c(H+)由大到小的顺序是b>a>c,故答案为:b>a>c;
(2)若三者pH相同时,c(H+)相同、体积相同时,醋酸浓度最大,硫酸和盐酸溶液中氢离子物质的量相同,中和等体积的该三种溶液所需NaOH的物质的量由大到小的顺序是c>a=b,故答案为:c>a=b;
(3)醋酸是弱电解质,加水稀释能促进醋酸的电离,所以醋酸中氢离子浓度变化小,即醋酸中氢离子浓度大,所以将c(H+)相同的三种酸均稀释100倍后,c(H+)由大到小的顺序是c>a=b,pH由大到小的顺序是a=b>c,故答案为:a=b>c;
(4)在25℃下,将amol L-1的稀醋酸与0.01mol L-1的NaOH溶液等体积混合,溶液pH=7,溶液显中性,反应平衡时溶液中c(CH3COO-)=c(Na+)=0.005mol/L,根据电荷守恒可得c(OH-)= c(H+),所以溶液显中性,常温下的中性溶液中c(OH-)= c(H+)=10-7mol/L,根据物料守恒可得,c(CH3COOH)=0.5amo/L-0.005mol/L=(0.5a-0.005)mol/L,醋酸的电离平衡常数为:Ka===,故答案为:;
(5)配制0.10mol/LCH3COOH溶液,测溶液的pH,若pH大于1,氢离子浓度小于醋酸浓度,说明醋酸部分电离,则可证明醋酸为弱电解质,操作:测0.1mol/L醋酸溶液的pH,结论:pH>1,故答案为:测0.1mol/L醋酸溶液的pH;pH>1。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.肼(N2H4)又称联氨,为二元弱碱,在水中的电离与氨类似。已知常温下,N2H4第一步电离平衡 。下列说法错误的是
A.N2H4的水溶液中存在:
B.反应的平衡常数
C.联氨与硫酸形成酸式盐的化学式为N2H6(HSO4)2
D.向N2H4的水溶液中加水,减小
2.下列电离方程式书写正确的是
A.
B.
C.
D.
3.下列关于醋酸性质的描述,不能证明它是弱电解质的是
A.0.1mol·L-1的醋酸溶液中H+浓度约为10-3mol·L-1
B.醋酸溶液中存在CH3COOH分子
C.CH3COONa溶液pH大于7
D.5mL0.1mol·L-1的醋酸溶液与5mL0.1mol·L-1的KOH溶液恰好完全中和
4.从下列实验事实所引出的相应结论正确的是
选项 实验事实 结论
A 其他条件相同,Na2S2O3溶液浓度越大,析出S沉淀所需时间越短 当其他条件不变时,增大反应物浓度,化学反应速率加快
B 在化学反应前后,催化剂的质量和化学性质都没有发生改变 催化剂一定不参与化学反应
C 物质的量浓度相同的盐酸和醋酸分别与等质量的、形状相同的锌粒反应 反应开始时速率相同
D 在容积可变的密闭容器中发生反应H2(g)+I2(g) 2HI(g),把容积缩小一倍 正反应速率加快,逆反应速率不变
A.A B.B C.C D.D
5.下列实验事实不能证明醋酸是弱电解质的是
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
D.相同浓度的盐酸和醋酸,醋酸溶液的导电性比盐酸的弱
6.在溶液中存在:,对于该平衡,下列叙述错误的是
A.加入少量冰醋酸,电离平衡向正向移动,保持不变
B.加入少量固体,溶液中浓度减小
C.升高温度,醋酸的电离程度增大,溶液减小
D.加入少量固体,减小
7.乙酸的下列性质中,可以证明它是弱电解质的是
A.乙酸以任意比与水互溶
B.0.1mol/L乙酸溶液的c(H+)=10-3mol/L
C.10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应
D.乙酸溶液的导电性比一元强酸溶液的弱
8.常温下,0.1 mol L 1下列溶液:①HCl、②H2SO4、③CH3COOH,导电能力强弱顺序是
A.②>①>③ B.①=②>③ C.①>②>③ D.①=②=③
9.在CH3COOH溶液中滴入过量稀氨水,溶液的导电能力发生变化,其电流强度(I)随氨水的加入体积(V)的变化曲线(如图)是
A. B.
C. D.
10.相同温度下的0.1mol·L-1和0.01mol·L-1CH3COOH溶液中CH3COOH的电离程度,前者与后者相比
A.大 B.小 C.相等 D.不能确定
11.下列过程中的化学反应,相应的离子方程式正确的是
H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11 H2SO3 Ka1=1.54×10-2 Ka2=1.02×10-7
HClO Ka=2.95×10-8 H2S Ka1=9.1×10-8 Ka2=1.1×10-12
A.CuCl2溶液中通入H2S气体:Cu2++S2-=CuS↓
B.NaClO溶液中通少量CO2:ClO-+CO2+H2O=HClO+HCO
C.向Na2S溶液中通入少量SO2:S2-+SO2+H2O=SO+H2S
D.Na2CO3溶液中通入过量SO2:CO+SO2=SO+CO2
12.25℃时,在0.1mol/L氨水中存在以下电离平衡NH3 H2ONH+OH-,对于该平衡,下列叙述正确的是
A.温度升高,平衡向逆反应方向移动
B.通入少量HCl气体,平衡向正反应方向移动
C.滴加少量0.1mol/LNaOH溶液,溶液中c(OH-)减少
D.加入少量NH4Cl固体,NH3 H2O的电离程度增大
13.在氢氰酸水溶液中存在平衡:。下列措施能使该电离平衡正向移动的是
A.加入NaCN稀溶液 B.加入 C.加入稀盐酸 D.适当降低温度
14.在0.2 mol· L-1CH3COOH溶液中存在电离平衡:CH3COOHH++CH3COO-,下列叙述正确的是
A.加水稀释,CH3COOH的电离程度减小
B.加入少量NaOH固体,溶液导电性增强
C.滴加少量0.2 mol·L-1盐酸,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
二、多选题
15.下列电离方程式中,正确的是
A. B.
C. D.
三、填空题
16.现有下列物质 ①熔化的NaCl ②盐酸 ③氯气 ④冰醋酸 ⑤铜 ⑥酒精 ⑦硫酸氢钠 ⑧液氨 ⑨SO2,请按要求回答下列问题。
(1)属于强电解质的是_______(填序号)
(2)在上述状态下能导电的是_______(填序号)
(3)属于弱电解质的是_______(填序号)
(4)属于非电解质,但溶于水后的水溶液能导电的是_______(填序号)
(5)可以证明④是弱酸的事实是_______(填序号)
A.乙酸和水能以任意比例混溶
B.在乙酸水溶液中含有未电离的乙酸分子
C.乙酸与Na2CO3溶液反应放出CO2气体
D.1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色
(6)有下列物质的溶液:a.CH3COOH、b.HCl、c.H2SO4、d.NaHSO4,若四种溶液的物质的量浓度相同,其由水电离c(H+)由大到小顺序为_______(用字母序号表示,下同)。若四种溶液的c(H+)相同,其物质的量浓度由大到小顺序为_______。
(7)常温下,有相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______(填字母)。(①表示盐酸,②表示醋酸)
a. b. c. d.
17.按要求填空。
(1)现有以下物质:①NaCl晶体;②SO2;③液态醋酸;④铜;⑤固体BaSO4;⑥纯蔗糖(C12H22O11);⑦酒精(C2H5OH);⑧熔化的KHSO4;⑨氨水;⑩液氮。请回答下列问题。(填相应序号)
①以上物质能导电的是____。
②以上物质属于非电解质的是____。
③以上物质属于强电解质的是____。
④写出⑧的电离方程式:____。
(2)25℃时H2S的Ka1=1.0×10-7,此温度下0.1mol·L-1H2S溶液的c(H+)为____mol·L-1。
(3)25℃时,amol·L-1CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=____。
(4)已知25℃时,几种弱酸的电离平衡常数如下:HCOOH:Ka=1.77×10-4,HCN:Ka=4.9×10-10,H2CO3:Ka1=4.30×10-7,Ka2=5.61×10-11,则以下反应不能自发进行的是____(填字母)。
a.HCOOH+NaCN=HCOONa+HCN
b.NaHCO3+NaCN=Na2CO3+HCN
c.NaCN+H2O+CO2=HCN+NaHCO3
d.2HCOOH+CO=2HCOO-+H2O+CO2↑
e.H2O+CO2+2CN-=2HCN+CO
四、原理综合题
18.弱电解质有许多如:醋酸、碳酸、氢氰酸、一水合氨等,已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如表:
氢氰酸 碳酸 醋酸
Ka=6.2×10-10 Ka1=4.2×10-7Ka2=5.6×10-11 Ka=1.7×10-5
(1)25℃时,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为__。(填序号)
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为__。
(3)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,则混合溶液中c(H+)___c(OH-)。(用“<”或“>”或“=”填空)
(4)常温下,向浓度为0.1mol L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
①该温度时NH3 H2O的电离常数K=___。
②比较b、c、d三点时的溶液中,由水电离出的c(H+)由大到小顺序为__。(填字母,下同)
③滴定时,由b点到c点的过程中,下列各选项中数值保持不变的__。
A.c(H+) c(OH-) B.
C. D.
19.在一定温度下,有a、盐酸b、硫酸c、醋酸三种酸(用a、b、c填空):
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是__。
(2)若三者pH相同时,中和等体积的该三种溶液所需NaOH的物质的量由大到小的顺序是___。
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是__。
(4)在25℃下,将amol/L的醋酸与0.01mol/L的NaOH溶液等体积混合后溶液的pH=7,用含a的代数式表示25℃时CH3COOH的电离常数Ka=__。
(5)设计一个实验证明醋酸是弱电解质:
操作:__;
现象:__;
结论:醋酸是弱电解质。
参考答案:
1.D
【详解】A.N2H4的水溶液中发生电离,生成、、OH-、H+,则溶液中存在电荷守恒:,A正确;
B.反应的平衡常数,B正确;
C.联氨与硫酸形成酸式盐时,发生反应N2H4+2H2SO4=N2H6(HSO4)2,则产物的化学式为N2H6(HSO4)2,C正确;
D.N2H4溶于水后发生两步电离,Kb1=、Kb2=,则=,向N2H4的水溶液中加水,N2H4的电离常数不变,则不变,D错误;
故选D。
2.B
【详解】A.碳酸是弱酸,碳酸氢根离子不拆,NaHCO3在水中全部电离,电离方程式为:NaHCO3=Na++,故A错误;
B.氢氟酸是弱酸,在水中部分电离,,故B正确;
C.硫酸是强酸,在水中全部电离,H2SO4=2H++SO,故C错误;
D.CH3COONH4是强电解质,在水中全部电离,应为:CH3COONH4=CH3COO-+NH,故D错误;
故选B。
3.D
【详解】A.0.1 mol·L-1的醋酸溶液中H+浓度约为10-3 mol·L-1,说明不完全电离,说明其为弱电解质 ,A不符合题意;
B.醋酸溶液中存在CH3COOH分子,说明没有完全电离,说明是弱电解质,B不符合题意;
C.室温时,CH3COONa溶液的pH大于7说明该物质为强碱弱酸盐,醋酸是弱电解质,C不符合题意;
D.5mL 0.1 mol·L-1的醋酸溶液与5mL 0.1mol·L-1的KOH溶液恰好完全中和说明其为一元酸,不能说明其为弱电解质,D符合题意;
故选D。
4.A
【详解】A.增大反应物浓度,化学反应速率加快,A项正确;
B.催化剂参与反应,但反应前后催化剂的质量和化学性质不变,B项错误;
C.浓度相同的盐酸和醋酸溶液中起始氢离子浓度不同,因此开始时盐酸速率大于醋酸,C项错误;
D.缩小容积,正、逆反应速率同时增大,D项错误;
答案选A。
5.A
【详解】A.醋酸溶液和盐酸pH相同,则溶液中c(H+)相同,因此分别与同样颗粒大小的锌反应时,产生H2的起始速率相等,这不能证明醋酸是弱电解质,A符合题意;
B.常温下,测得0.1 mol/L醋酸溶液的pH=4,c(H+)=10-4 mol/L<0.1 mol/L,因此可证明醋酸是弱酸,存在电离平衡,B不符合题意;
C.常温下,将pH=1的醋酸溶液稀释1000倍,若醋酸是强酸,则稀释后c(H+)=10-4 mol/L,pH=4,现在测得pH<4,c(H+)>10-4 mol/L,说明又有一部分醋酸分子发生电离产生H+,使溶液中c(H+)增大,故可以证明醋酸是弱酸,C不符合题意;
D.在相同条件下,相同浓度醋酸溶液的导电性比盐酸的弱,说明醋酸溶液中电离产生的自由移动的离子浓度比HCl小,因此可以说明醋酸是弱酸,D不符合题意;
故合理选项是A。
6.D
【详解】A.加入少量冰醋酸,浓度增大,电离平衡正向移动,只与温度有关,温度不变,不变,A正确;
B.加入少量固体,中和溶液中的氢离子,使溶液中浓度减小,B正确;
C.升高温度,促进电离,醋酸的电离程度增大,增大,减小,C正确;
D.,加入少量固体,电离平衡逆向移动,减小,不变,则增大,D错误;
故答案选:D。
7.B
【详解】A.乙酸水溶性是物理性质,不能证明是弱电解质,故A错误;
B.0.1mol/L的乙酸溶液的c(H+)约为10-3mol/L说明乙酸不能完全电离,可以证明是弱电解质,故B正确;
C.根据方程式可知不论酸碱强弱,只有一元酸与一元碱物质的量相等则恰好发生酸碱中和,完全反应,故C错误;
D.缺少条件,由于溶液浓度不确定,乙酸溶液的导电性比盐酸溶液可能强也可能弱,故D错误;
故答案选B。
8.A
【详解】①HCl是一元强酸,②H2SO4是二元强酸,二元强酸电离出的离子浓度大于一元强酸电离出的离子浓度大,因此二者相比②H2SO4导电能力强;①HCl是一元强酸,③CH3COOH是一元弱酸,相同浓度的一元强酸电离出的离子浓度大于一元弱酸电离出的离子浓度,因此二者相比①HCl导电能力强,常温下,0.1 mol L 1的三者溶液导电能力强弱顺序是②>①>③,故A符合题意;
综上所述,答案为A。
9.A
【详解】醋酸是一元弱酸,在溶液中部分电离,溶液中离子浓度小,导电性弱,向溶液中加入稀氨水时,醋酸溶液与氨水反应生成醋酸铵,溶液中离子浓度增大,导电能力增强,当醋酸溶液恰好完全反应时,溶液中离子浓度最大,导电性最大,若继续滴入氨水,溶液体积增大,一水合氨在溶液中部分电离,溶液的离子浓度减小,导电能力减弱,则图A的曲线符合醋酸溶液中滴入过量稀氨水时,电流强度随氨水的加入体积的变化,故选A。
10.B
【详解】CH3COOH溶液中加水不断促进电离平衡CH3COOH=CH3COO-+H+正向移动,即溶液越稀越电离,故0.1mol·L-1的CH3COOH溶液的电离程度小于0.01mol·L-1CH3COOH溶液的电离程度;
故选B。
11.B
【详解】A.CuCl2溶液中通入H2S气体的离子方程式为Cu2++H2S=CuS↓+2H+,故A错误;
B.NaClO溶液中通少量CO2生成次氯酸钠和碳酸氢钠,故离子方程式为ClO-+CO2+H2O=HClO+HCO,故B正确;
C.向Na2S溶液中通入少量SO2,发生反应的离子方程式为2H2O+2S2-+SO2=4OH-+3S↓,故C错误;
D.Na2CO3溶液中通入过量SO2生成NaHSO3和CO2,故离子方程式为CO+2SO2+H2O=2HSO+CO2,故D错误;
故选B。
12.B
【详解】A.电离吸热,温度升高,平衡向正反应方向移动,故A错误;
B.通入少量HCl气体,氢氧根离子浓度减小,平衡向正反应方向移动,故B正确;
C.氨水是弱碱,在0.1mol/L氨水中氢氧根离子的浓度小于0.1mol/L,滴加少量0.1mol/LNaOH溶液,氢氧根离子的浓度增大,故C错误;
D.加入少量NH4Cl固体,铵根离子浓度增大,电离平衡NH3 H2ONH+OH-逆向移动,NH3 H2O的电离程度减小,故D错误;
选B。
13.B
【详解】A. NaCN是强电解质,加入NaCN稀溶液,通常CN-浓度增大,HCN电离平衡左移,A错误;
B. 为弱碱,加入到HCN溶液中发生中和反应,氢离子浓度减小,HCN电离平衡右移,B正确;
C. 加入稀盐酸,氢离子浓度增大,HCN电离平衡左移,C错误;
D.弱电解质电离吸热,适当降低温度HCN电离平衡左移,D错误;
答案选B。
14.B
【详解】A.加水稀释,促进弱电解质的电离,CH3COOH的电离程度增大,A错误;
B.滴入NaOH固体,生成CH3COONa,发生完全电离,增大了溶液中的离子浓度,从而使溶液的导电性增强,B正确;
C.滴加少量0.2 mol·L-1盐酸,虽抑制了醋酸的电离,但根据勒夏特列原理,溶液中c(H+)增大,C错误;
D.加入少量CH3COONa固体,c(CH3COO-)增大,平衡向逆反应方向移动,D错误;
答案选B。
15.CD
【详解】A.氢氧化钾电离成钾离子和氢氧根离子,,故A错误;
B.碳酸是弱酸,碳酸氢根部分电离,,故B错误;
C.硫酸是强酸,完全电离,,故C正确;
D.硫酸铁是强电解质,完全电离,,故D正确;
故选CD。
16.(1)①⑦
(2)①②⑤
(3)④
(4)⑧⑨
(5)B
(6) a>b=d>c a>b=d>c
(7)c
【分析】电解质是溶于水或在熔融状态下能够导电的化合物;非电解质是溶于水或在熔融状态下不能够导电的化合物;溶液导电的原因是存在自由移动的离子,金属导电的原因是存在自由移动的电子;
强电解质是指在水溶液中或熔融状态下,能够完全电离的化合物,即溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物,一般是强酸、强碱和大部分盐类;弱电解质是指在水溶液里部分电离的电解质,包括弱酸、弱碱、水与少数盐。
【详解】(1)①熔化的NaCl为强电解质,存在自由移动的离子,可以导电;
②盐酸是混合物,溶液中存在自由移动的离子,可以导电;
③氯气为气体单质,不导电;
④冰醋酸为弱电解质,本身不导电,水溶液导电;
⑤铜为金属单质,导电;
⑥酒精为非电解质,不导电;
⑦硫酸氢钠为强电解质,本身不导电,水溶液或熔融状态导电;
⑧液氨为非电解质,不导电;
⑨SO2为非电解质,不导电;
故属于强电解质的是①⑦;
(2)在上述状态下能导电的是①②⑤;
(3)属于弱电解质的是④;
(4)属于非电解质,但溶于水后的水溶液能导电的是⑧⑨;
(5)A.乙酸和水能以任意比例混溶,溶解性不能说明乙酸是弱酸,A错误;
B.在乙酸水溶液中含有未电离的乙酸分子,说明存在电离平衡,说明乙酸是弱酸,B正确;
C.乙酸与Na2CO3溶液反应放出CO2气体,不能说明乙酸是否部分电离,C错误;
D.1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色,说明溶液存在氢离子,不能说明乙酸是否部分电离,D错误;
故选B;
(6)a.CH3COOH b.HCl c.H2SO4 d.NaHSO4。若四种溶液的物质的量浓度相同,硫酸为二元强酸,氢离子浓度最大;HCl、NaHSO4均为强电解质,完全电离,氢离子浓度相同;CH3COOH为弱酸,部分电离,氢离子浓度最小;故其c(H+)由大到小顺序为c>b=d>a,四种溶液对水的电离都起抑制作用,其由水电离c(H+)由大到小顺序为a>b=d>c;若四种溶液的c(H+)相同,其物质的量浓度由大到小顺序为a>b=d>c;
(7)常温下,有c(H+)相同、体积相同的醋酸和盐酸两种溶液,醋酸为弱酸部分电离,盐酸为强酸完全电离,则醋酸浓度远大于盐酸,故一段时间后醋酸反应速率更快且得到氢气更多,故选c。
17.(1) ④⑧⑨ ②⑥⑦ ①⑤⑧ KHSO4=K++HSO
(2)1.0×10-4
(3)
(4)be
【分析】①NaCl晶体,在熔融状态和水溶液中能完全电离生成钠离子和氯离子,属于强电解质,但氯化钠晶体不含自由移动的离子,不导电;
②SO2,在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
③液态醋酸,溶于水时能部分电离生成醋酸根离子和氢离子,属于弱电解质,但液态醋酸不含自由移动的离子,不导电;
④铜为单质,既不是电解质也不是非电解质,但铜含自由移动的电子,能导电;
⑤固体BaSO4,在熔融状态和水溶液中能完全电离生成钡离子和硫酸根离子,属于强电解质,但固体BaSO4不含自由移动的离子,不导电;
⑥纯蔗糖(C12H22O11),在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
⑦酒精(C2H5OH),在熔融状态和水溶液中都不能导电,属于非电解质,不导电;
⑧熔化的KHSO4,能完全电离生成钾离子和硫酸氢根离子,属于强电解质,含自由移动的离子,能导电;
⑨氨水为混合物,既不是电解质也不是非电解质,但溶液中含自由移动的离子,能导电;
⑩液氮为单质,既不是电解质也不是非电解质,不含自由移动的电子或离子,不导电;
(1)
①由分析可知,以上物质能导电的是:④⑧⑨;
②由分析可知,以上物质属于非电解质的是:②⑥⑦;
③由分析可知,以上物质属于强电解质的是:①⑤⑧;
④熔化的KHSO4,完全电离生成钾离子和硫酸氢根离子,其电离方程式为:KHSO4=K++HSO;
(2)
设H2S第一步电离出的氢离子浓度为x,列三段式:
Ka1==≈=1.0×10-7,解得x=1.0×10-4,相对于第一步电离,第二步电离和水电离生成的氢离子可以忽略不记,则此温度下0.1mol·L-1H2S溶液的c(H+)为1.0×10-4mol/L;
(3)
amol/LCH3COOH溶液的pH=b,c(H+)=10-bmol/L,由CH3COOH CH3COO-+H+可知,Ka===;
(4)
酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据电离平衡常数知,酸性:HCOOH>H2CO3>HCN>HCO,
a.酸性:HCOOH>HCN,反应HCOOH+NaCN=HCOONa+HCN能发生,a不符合题意;
b.酸性:HCN>HCO,反应NaHCO3+NaCN=Na2CO3+HCN不能发生,b符合题意;
c.酸性:H2CO3>HCN ,反应NaCN+H2O+CO2=HCN+NaHCO3能发生,c不符合题意;
d.酸性:HCOOH>H2CO3,反应2HCOOH+CO=2HCOO-+H2O+CO2↑能发生,d不符合题意;
e.酸性:H2CO3>HCN>HCO,反应H2O+CO2+2CN-=2HCN+CO不能发生,e符合题意;
答案选be。
18. ①>③>② CN-+CO2+H2O=HCO+HCN < 10-5 d>c>b ACD
【详解】(1)由图表数据可知,酸性:CH3COOH>H2CO3>HCN>HCO,则水解程度:②Na2CO3溶液>③NaCN溶液>NaHCO3溶液>①CH3COONa溶液,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为:①>③>②,故答案为:①>③>②;
(2)向NaCN溶液中通入少量CO2,酸性:H2CO3>HCN>HCO,所以反应生成氰酸和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3,离子方程式为:CN-+CO2+H2O=HCO+HCN,故答案为:CN-+CO2+H2O=HCO+HCN;
(3)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,得到等浓度的HCN和NaCN混合溶液,CN-+H2O HCN+OH-,CN-的平衡常数Kh===1.6×10-5>Ka=6.2×10-10,CN-水解程度大于HCN的电离程度,溶于显碱性,c(H+)<c(OH-),故答案为:<;
(4)①滴定前氨水中c(H+)=10-11mol/L,利用水的离子积得c(OH-) =10-3mol/L,一水合氨的电离平衡常数K==≈10-5,故答案为:10-5;
②在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用;在c点时,溶质为氨水和氯化铵,氨水的电离程度等于氯化铵的水解程度,溶液为中性,对水的电离平衡几乎无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡起促进作用,所以b、c、d三点时的溶液中,水电离的c(H+)大小顺序是d>c>b,故答案为:d>c>b;
③A. c(H+) c(OH-)=Kw,温度不变,水的离子积不变,故A选;
B.b到c的过程中,随着盐酸的加入,溶液中氢离子浓度逐渐增大,氢氧根离子浓度逐渐减小,则的比值逐渐增大,故B不选;
C. =Kb,温度不变,NH3 H2O的电离平衡常数不变,故C选;
D. = Kh,为铵根离子的水解平衡常数,温度不变,则该比值不变,故D选,故答案为:ACD。
19. b>a>c c>a=b a=b>c 测0.1mol/L醋酸溶液的pH pH>1
【详解】(1)盐酸是一元强酸完全电离,氢离子浓度等于酸的浓度;硫酸是二元强酸完全电离,硫酸中氢离子浓度为酸的二倍;醋酸是弱酸部分电离,氢离子的浓度小于酸的浓度;所以c(H+)由大到小的顺序是b>a>c,故答案为:b>a>c;
(2)若三者pH相同时,c(H+)相同、体积相同时,醋酸浓度最大,硫酸和盐酸溶液中氢离子物质的量相同,中和等体积的该三种溶液所需NaOH的物质的量由大到小的顺序是c>a=b,故答案为:c>a=b;
(3)醋酸是弱电解质,加水稀释能促进醋酸的电离,所以醋酸中氢离子浓度变化小,即醋酸中氢离子浓度大,所以将c(H+)相同的三种酸均稀释100倍后,c(H+)由大到小的顺序是c>a=b,pH由大到小的顺序是a=b>c,故答案为:a=b>c;
(4)在25℃下,将amol L-1的稀醋酸与0.01mol L-1的NaOH溶液等体积混合,溶液pH=7,溶液显中性,反应平衡时溶液中c(CH3COO-)=c(Na+)=0.005mol/L,根据电荷守恒可得c(OH-)= c(H+),所以溶液显中性,常温下的中性溶液中c(OH-)= c(H+)=10-7mol/L,根据物料守恒可得,c(CH3COOH)=0.5amo/L-0.005mol/L=(0.5a-0.005)mol/L,醋酸的电离平衡常数为:Ka===,故答案为:;
(5)配制0.10mol/LCH3COOH溶液,测溶液的pH,若pH大于1,氢离子浓度小于醋酸浓度,说明醋酸部分电离,则可证明醋酸为弱电解质,操作:测0.1mol/L醋酸溶液的pH,结论:pH>1,故答案为:测0.1mol/L醋酸溶液的pH;pH>1。
