第七章有机化合物测试题(含解析)高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第七章有机化合物测试题(含解析)高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 746.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-09 07:26:45 | ||
图片预览



文档简介
第七章《有机化合物》测试题
一、单选题(共12题)
1.下列说法不正确的是
A.煤的干馏发生了化学变化
B.淀粉和纤维素互为同分异构体
C.羊毛、塑料、合成橡胶都属于有机高分子材料
D.利用油脂在碱性条件下的水解,可以制得肥皂
2.下列物质中,在一定条件下既能发生加成反应,又能发生取代反应,但不能使酸性KMnO4溶液褪色的是( )
A.甲烷 B.苯
C.乙烯 D.乙烷
3.下列化学用语表述正确的是
A.N2分子的结构式:N≡N B.CH4的比例模型:
C.18O2- 的结构示意图: D.CO2的球棍模型:
4.已知苯环上的羟基具有酸性。下列关于有机化合物M和N的说法正确的是( )
A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.M、N分子中都含有苯环
5.下列有关除去杂质(括号中为杂质)的操作中,正确的是
A.乙烯():通入酸性高锰酸钾溶液中洗气
B.乙醇(乙酸):加生石灰,过滤
C.甲烷(乙烯):通入溴水中洗气
D.乙酸乙酯(乙酸):加入氢氧化钠溶液,充分振荡,分液,弃水层
6.下列方法中不能用来鉴别乙烯和乙烷的
A.在空气中燃烧 B.分别通入酸性高锰酸钾溶液中
C.分别通入溴水中 D.把燃烧后的产物分别通入澄清的石灰水中
7.以下物质的工业制备所用主要原料(括号内物质)不符合事实的是
A.乙烯(乙醇) B.顺丁橡胶(石油裂解气)
C.碘(海带) D.溴(海水晒盐后的余液)
8.某兴趣小组用如图装置探究甲烷与氯气反应同时收集副产品盐酸,下列说法不正确的是
A.B装置能够起到干燥、混合气体等作用,E装置作用是吸收氯化氢和防倒吸
B.若有200mL 8mol·L-1盐酸与足量二氧化锰反应,E中最多可得2mol·L-1盐酸200mL
C.D中石棉上混有潮湿的碘化钾粉末,用于吸收氯气
D.光照一段时间,装置C硬质玻璃管内壁出现的黑色小颗粒可能是碳
9.2021年12月9日,神舟十三号航天员在太空授课。搭载神舟十三号载人飞船的长征二号F遥十三运载火箭发动机工作时发生的反应为:。下列有关说法错误的是
A.的电子式
B.二氧化碳的填充模型:
C.中子数为10的氧原子:
D.偏二甲肼()的结构简式:
10.食品分类的一种方法如下表.以下属于白色食品的是
食品类型 绿色食品 蓝色食品 白色食品
分类依据 绿色植物通过光合作用转化而来 由海洋提供 通过微生物发酵制得
A.精制面粉 B.精制豆油 C.新鲜海带 D.酿制米酒
11.反应NH4Cl+NaNO2==NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语不正确的是( )
A.中子数为18的氯原子:Cl B.N2的电子式:
C.Na+的结构示意图: D.H2O分子的比例模型:
12.对实验:①中和滴定、②中和热的测定、③实验室制备乙烯、④乙酸乙酯的制取,叙述正确的是
A.①④必须加热 B.②③必须隔热
C.①②必须用指示剂 D.③④必须用催化剂
二、非选择题(共10题)
13.玫瑰的香味物质中包含苧烯,苧烯的结构为。
(1)下列有关苧烯的说法正确的是_____。
A.苧烯属于芳香烃 B.苧烯与1,3-丁二烯互为同系物
C.苧烯分子中键角均为120° D.苧烯不能发生1,4-加成反应
(2)写出苧烯跟等物质的量的Br2发生加成反应所得产物可能有_____种。
(3)有机物A是苧烯的同分异构体,分子结构可表示为(R代表烃基),写出A可能的两种结构简式_____。
(4)写出A(用表示)和Cl2发生1,4-加成反应的化学方程式: _____。
14.请结合如图显示的4个碳原子相互结合的几种方式,分析以碳为骨架的有机物种类繁多的原因____。
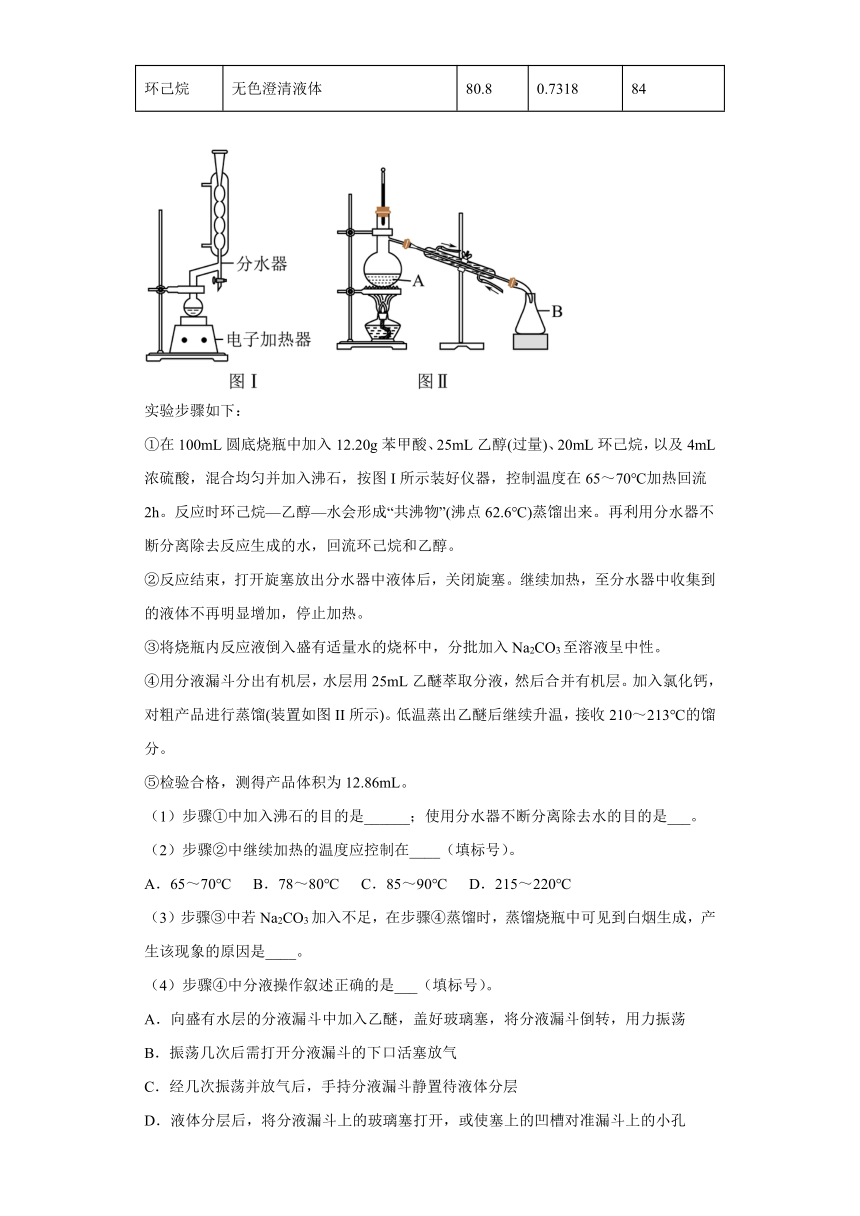
15.苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为
+C2H5OH+H2O
已知:
物质 颜色、状态 沸点(℃) 密度(g·cm-3) 相对分子质量
苯甲酸 无色、片状晶体;100℃会迅速升华 249 1.2659 122
苯甲酸乙酯 无色澄清液体 212.6 1.05 150
乙醇 无色澄清液体 78.3 0.7893 46
环己烷 无色澄清液体 80.8 0.7318 84
实验步骤如下:
①在100mL圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按图I所示装好仪器,控制温度在65~70℃加热回流2h。反应时环己烷—乙醇—水会形成“共沸物”(沸点62.6℃)蒸馏出来。再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并有机层。加入氯化钙,对粗产品进行蒸馏(装置如图II所示)。低温蒸出乙醚后继续升温,接收210~213℃的馏分。
⑤检验合格,测得产品体积为12.86mL。
(1)步骤①中加入沸石的目的是______;使用分水器不断分离除去水的目的是___。
(2)步骤②中继续加热的温度应控制在____(填标号)。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(3)步骤③中若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是____。
(4)步骤④中分液操作叙述正确的是___(填标号)。
A.向盛有水层的分液漏斗中加入乙醚,盖好玻璃塞,将分液漏斗倒转,用力振荡
B.振荡几次后需打开分液漏斗的下口活塞放气
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.液体分层后,将分液漏斗上的玻璃塞打开,或使塞上的凹槽对准漏斗上的小孔
E.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
(5)图II中仪器A的名称是___,步骤④中氯化钙的作用是___。
(6)该实验产品的产率为___(结果保留三位有效数字)。
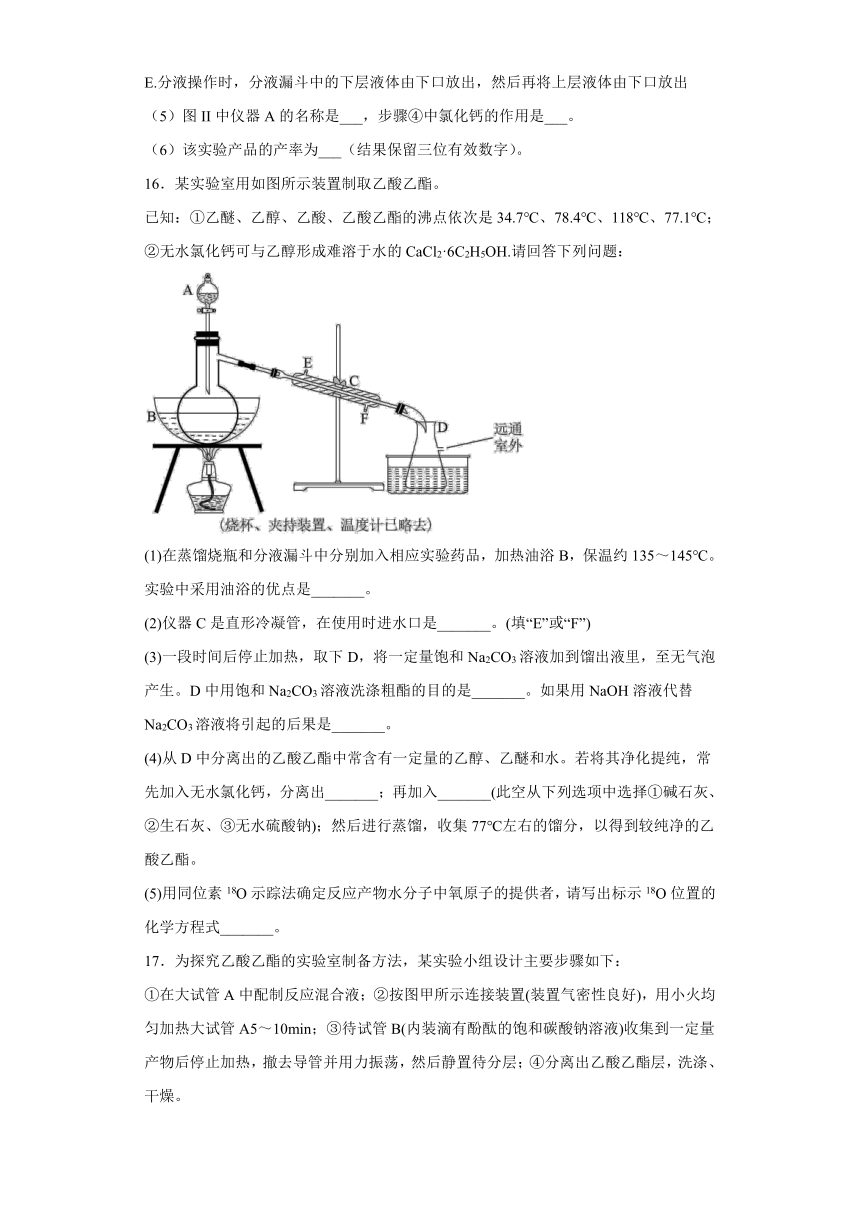
16.某实验室用如图所示装置制取乙酸乙酯。
已知:①乙醚、乙醇、乙酸、乙酸乙酯的沸点依次是34.7℃、78.4℃、118℃、77.1℃;
②无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH.请回答下列问题:
(1)在蒸馏烧瓶和分液漏斗中分别加入相应实验药品,加热油浴B,保温约135~145℃。实验中采用油浴的优点是_______。
(2)仪器C是直形冷凝管,在使用时进水口是_______。(填“E”或“F”)
(3)一段时间后停止加热,取下D,将一定量饱和Na2CO3溶液加到馏出液里,至无气泡产生。D中用饱和Na2CO3溶液洗涤粗酯的目的是_______。如果用NaOH溶液代替Na2CO3溶液将引起的后果是_______。
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水。若将其净化提纯,常先加入无水氯化钙,分离出_______;再加入_______(此空从下列选项中选择①碱石灰、②生石灰、③无水硫酸钠);然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
(5)用同位素18O示踪法确定反应产物水分子中氧原子的提供者,请写出标示18O位置的化学方程式_______。
17.为探究乙酸乙酯的实验室制备方法,某实验小组设计主要步骤如下:
①在大试管A中配制反应混合液;②按图甲所示连接装置(装置气密性良好),用小火均匀加热大试管A5~10min;③待试管B(内装滴有酚酞的饱和碳酸钠溶液)收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置待分层;④分离出乙酸乙酯层,洗涤、干燥。
乙醇可与氯化钙反应,生成微溶于水的CaCl2 6C2H5OH。有关试剂部分数据如表:
物质 熔点/℃ 沸点/℃ 密度/(g cm-3)
乙醇 -117.3 78.5 0.789
乙酸 16.6 117.9 1.05
乙酸乙酯 -83.6 77.5 0.90
浓硫酸(98%) — 338.0 1.84
(1)配制反应混合液的主要操作步骤为______(不必指出液体体积);写出制取乙酸乙酯的化学方程式______。
(2)步骤②必须小火均匀加热,一个主要原因是温度过高会发生副反应,另一个原因是______。
(3)写出步骤③中观察到的实验现象______。
(4)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤.通过洗涤可除去的杂质是______(填名称);干燥乙酸乙酯最适宜的干燥剂为______(填字母)。
a.P2O5 b.无水硫酸钠 c.碱石灰 d.NaOH固体
(5)某化学课外小组设计了图乙所示的装置(图中铁架台,铁夹,加热装置均已略去)制取乙酸乙酯,与图甲装置相比,图乙装置的主要优点有______。
a.增加了温度计,有利于控制反应温度
b.增加了分液漏斗,能随时补充反应混合液
c.增加了冷凝装置,有利于收集产物
d.反应容器容积大,容纳反应物的量多,反应速率加快
18.完成下列两个小题
(1)将2.56gCu放入10.0mL浓HNO3中正好完全反应。随着Cu的不断减少,反应生成气体的颜色逐渐变浅,最终共生成气体1.12L(标准状况)。则该浓硝酸的物质的量浓度是_____mol/L;若将生成的气体溶于水被全部吸收,还需要消耗标准状况下O2_____mL。
(2)标准状况下,某气态烷烃和乙烯的混合气体11.2L,质量为10.4g。则混合气体中烷烃的分子式为_______;若将该混合气体通入足量的溴水,溴水的质量将增加_______g。
19.取一定质量的某烃在200℃下在过量氧气中充分燃烧,将燃烧后生成的气体依次通过装有足量的浓硫酸和碱石灰的洗气瓶,两者分别增重2.7 g和5.5 g。
(1)该烃的分子式为___________。
(2)其所有可能的结构简式___________ 。
(3)推断分子式的计算过程___________。
20.下表为元素周期表的一部分,针对表中的①~⑨九种元素,请回答有关问题:
(1)⑨的元素符号是__________
(2)在这些元素中,化学性质最不活泼的原子结构示意图为_______
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是_______(填化学式,下同),碱性最强的是_______,显两性的是_______。
(4)将元素①与氢元素组成的最简单有机物和⑥的单质按1:1混合后的气体在光照条件下放置一段时间,最多能得到_____产物。
(5)用电子式表示④和⑥两元素形成化合物的过程为__________________。
21.A、B、C、D、E五种原子序数逐渐增大的短周期元素,A是周期表中原子半径最小的元素,其中B、C同周期,A与D、B与E同主族,E原子核内质子数等于B、C原子电子数之和,E的单质是应用最为广泛的半导体材料。试回答:
(1)B在元素周期表中的位置是_______,C、D形成的简单离子半径大小关系是_______(用离子符号表示)。
(2)A与B形成的含有18个电子的物质甲的结构式是_______,C与D形成的原子个数比为1:1的化合物乙的电子式是_______,乙物质中含有_______(填“极性键”或“非极性键”)。
(3)常温下B的最简单氢化物与氯气反应生成两种气态物质的化学方程式为_______。
(4)A和B形成的化合物中,丙是一种重要的基本化工原料,其产量可以用来衡量一个国家的石油化工发展水平,写出由丙制得高聚物的反应方程式_______,该反应类型是_______。
(5)工业上利用E的氧化物与B的单质高温条件下反应制备新型陶瓷材料EB,同时生成B的二元化合物,写出制备新型陶瓷材料EB的化学方程式_______。
22.短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)D、E两种元素的单质反应生成的两种离子化合物分别是________、___________。
(2)化学组成为BDF2的电子式为:_______,A、C、F三种元素形成的化合物CA4F为_________化合物(填 “离子”或“共价”)。
(3)化合物甲、乙由A,B,D,E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为:_______________________________。
(4)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是_________________ (用元素离子符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_________于F(填“强”或“弱”),并用化学方程式证明上述结论_______________________________。
参考答案:
1.B
A.煤的干馏是指在隔绝空气条件下加热、分解,生成焦炭、煤焦油、粗苯、煤气等产物的过程,属于化学变化,故A正确,但不符合题意;
B. 淀粉和纤维素都为高聚物,聚合度介于较大范围之间,没有固定的值,则二者分子式不同,不是同分异构体,故B错误,符合题意;
C. 羊毛、塑料、合成橡胶的相对分子质量均在10000以上,均为有机高分子材料,故C正确,但不符合题意;
D. 肥皂是高级脂肪酸金属盐,油脂在碱性条件下的水解生成高级脂肪酸盐与甘油,称为皂化反应,可以制得肥皂和甘油,故D正确,但不符合题意;
故选:B。
2.B
A. 甲烷不能发生加成反应,也不能使酸性高锰酸钾溶液氧化,A错误;
B. 苯既能发生加成反应,又能发生取代反应,但不能使酸性高锰酸钾溶液氧化,B正确;
C. 乙烯含有碳碳双键,能使酸性高锰酸钾溶液氧化,C错误;
D. 乙烷不能发生加成反应,也不能使酸性高锰酸钾溶液氧化,D错误;
答案选B。
3.A
A.N2 分子含有氮氮三键,其结构式为N≡N,故A正确;
B.是甲烷的球棍模型,故B错误;
C.O的核电荷数为8而不是10,故C错误;
D.用小球和小棍表示的模型为球棍模型,二氧化碳分子是直线形分子,其中的碳原子在中间,因为氧原子的半径小于碳原子的半径,故不是表示二氧化碳分子的球棍模型,故D错误。
答案选A。
4.C
A.酚羟基、羧基均能和氢氧化钠反应,但醇羟基和氢氧化钠不反应;
B.M、N含相同的C原子数,不同的H原子数;
C.含-OH、-COOH,结合醇、酚、羧酸的性质分析;
D.看图可知。
A.酚羟基、羧基均能和氢氧化钠反应,但醇羟基和氢氧化钠不反应,所以等物质的量的两种酸分别能消耗氢氧化钠的物质的量之比为1:4,故A错误;
B.M、N含相同的C原子数,不同的H原子数,则完全燃烧等物质的量的两种物质生成二氧化碳的量相等,但水的量不同,故B错误;
C.含-OH、-COOH,均能发生酯化反应,含-OH或酚-OH,均能发生氧化反应,故C正确;
D. M分子中不含苯环,N分子中含有苯环,故D错误;
答案选C。
5.C
A.乙烯与杂质都能够被酸性高锰酸钾溶液氧化,因此不能通过洗气除去杂质,A错误;
B.乙酸与生石灰反应生成乙酸钙属于盐,乙醇沸点低,应通过蒸馏使乙醇变为气态与乙酸钙分离,B错误;
C.乙烯可与溴水中的溴发生加成反应而被吸收,甲烷不可以,故可以通入溴水中洗气来除去甲烷中的乙烯,C正确;
D.乙酸乙酯和杂质乙酸都能够与NaOH发生反应,因此不能用加入氢氧化钠溶液,然后通过分液方法除杂,D错误;
答案选C。
6.D
乙烯中含有碳碳双键,可以发生加成、氧化反应;
A.在空气中燃烧,有黑烟生成的是乙烯,可以鉴别两种气体,不符合题意,A项错误;
B.使酸性高锰酸钾溶液褪色的是乙烯,可以鉴别两种气体,不符合题意,B项错误;
C.使溴水褪色的是乙烯,可以鉴别两种气体,不符合题意,C项错误;
D.二者燃烧后的产物均有二氧化碳,分别通入澄清的石灰水中均有白色沉淀生成,无法鉴别两种气体,D项正确;
答案选D。
7.A
A.在实验室是以乙醇为原料制取乙烯的,在工业上是以石油为原料裂解产生的气体,选项A错误;
B.顺丁橡胶是以石油裂解气为原料通过发生加聚反应形成,选项B正确;
C.海带中含有碘元素,以I-存在,先将海带灼烧,然后过滤,向滤液中通入氯气,发生置换反应产生I2,然后用有机溶剂萃取就得到碘的有机溶液,再蒸馏分离得到碘单质,选项C正确;
D.海水晒盐后的余液中含有NaBr,向该溶液中通入氯气,发生置换反应产生溴,选项D正确。
答案选A。
8.B
A.观察装置可知,浓硫酸不仅可以干燥混合气,还可以使气体混合均匀同时能够通过观察气泡判断流速,E装置可以吸收反应生成的氯化氢,采用干燥管同时能起到防倒吸作用,A项正确;
B.随着反应进行,盐酸浓度变小,与二氧化锰不再反应,B项错误;
C.氯气和碘化钾能反应,C项正确;
D.由组成元素分析,黑色小颗粒只能是碳, D项正确;
故选B。
9.B
A.中2个N原子之间共用3对电子,A正确;
B.二氧化碳分子为直线形,B错误;
C.氧原子质子数为8,中子数为10的核素为,C正确;
D.N原子能形成3个共价键,偏二甲肼的结构简式为,D正确;
故答案为B
10.D
精制面粉,精制豆油是通过反复提炼而来,新鲜海带属蓝色食品,而米酒则是通过糯米发酵而来,所以答案应选D。
11.B
A. 中子数为18的Cl原子的质量数为18+17=35,可表示为Cl,A正确;
B. N2的电子式为,B错误;
C. Na+为Na原子失去最外层一个电子得到的微粒,其结构示意图为,C正确;
D. H2O分子的比例模型为,D正确;
故答案选B。
12.D
A.中和滴定不需要加热,故A错误;
B.中和热的测定需要隔热,实验室制乙烯需在浓硫酸作用下加热至170℃,不需要隔热,故B错误;
C.中和热的测定不需要用指示剂,故C错误;
D.实验室制备乙烯需要用浓硫酸作催化剂;乙醇和乙酸发生酯化反应需要浓硫酸作催化剂,因此实验③④都需要使用浓硫酸作催化剂,故D正确;
故选D。
13. D 2 、、、 +Cl2→
(1)A.苧烯不含有苯环,不属于芳香烃,A不正确;
B.苧烯的不饱和度为3,1,3-丁二烯的不饱和度为2,二者不互为同系物,B不正确;
C.苧烯分子中存在5个四面体结构的碳原子,它们的键角都不是120°,C不正确;
D.苧烯分子中的两个双键碳原子不是直接相连,不能发生1,4-加成反应,D正确;
故选D。答案为:D;
(2)苧烯分子中两个双键都能与Br2发生等物质的量加成反应,所以加成反应所得产物可能有2种。答案为:2;
(3)有机物A是苧烯的同分异构体,分子结构可表示为(R代表烃基),根据原子守恒可知R表示C4H9-,则异构体主要由C4H9-产生异构,分别为、、、。答案为:、、、;
(4)A(用表示)和Cl2发生1,4-加成反应,生成,反应方程式为+Cl2→。答案为:+Cl2→。
14.碳原子最外层含4个电子,可以和碳原子及其他原子形成4个共价键,碳原子间可以以单键、双键或三键相结合,也可以形成碳链或碳环等碳骨架
碳原子最外层含4个电子,能与其他原子形成四个共价键,碳原子间可以以单键、双键或三键相结合,且碳原子之间也能相互成键,碳原子可以成碳链,可以成碳环,含碳的有机物存在同分异构现象,因此以碳为骨架的有机物种类繁多。
15. 防止暴沸 有利于平衡不断向正反应方向移动,提高苯甲酸乙酯产率 C 苯甲酸乙酯中混有苯甲酸,在受热至100℃时发生升华 ABD 蒸馏烧瓶 干燥有机层 90.0%
本题考查苯甲酸乙酯的制备。在圆底烧瓶中加入原料,经浓硫酸催化后生成苯甲酸乙酯和水,利用“环己烷—乙醇—水”这个共沸物将水带出,使酯化反应继续进行;随后利用碳酸钠溶液除去混合溶液中的苯甲酸和硫酸;随后利用乙醚将有机物萃取出来,经蒸馏得到苯甲酸乙酯,称量后计算产率。
(1)反应过程中加入沸石的目的是防止暴沸;反应 +C2H5OH+H2O为可逆反应,使用分水器不断分离除去水,减小生成物浓度,有利于平衡不断向正反应方向移动,提高苯甲酸乙酯的产率;
(2)根据题意,反应时环己烷—乙醇—水会形成“共沸物”蒸馏出来。烧瓶内的苯甲酸乙酯中混有乙醇、环己烷、苯甲酸和硫酸,步骤②继续加热蒸出苯甲酸乙酯中的乙醇、环己烷,乙醇的沸点为78.3℃,环己烷的沸点为80.8℃,苯甲酸乙酯的沸点为212.6℃,所以步骤②应控制馏分的温度在85~90℃,答案选C;
(3)步骤③中加入Na2CO3除去苯甲酸乙酯中混有的苯甲酸和硫酸,若Na2CO3加入不足,苯甲酸没有完全除去,步骤④蒸馏时蒸馏烧瓶中可见白烟的原因是:苯甲酸乙酯中混有苯甲酸,苯甲酸在受热至100℃时发生升华;
(4)A选项,为了使乙醚和水溶液充分接触,水溶液中加入乙醚转移至分液漏斗中后,需塞上玻璃塞,将分液漏斗倒转用力振摇,A项正确;
B选项,为防止分液漏斗中气压过大将玻璃塞弹出,振摇几次后需打开分液漏斗下口的玻璃塞放气,B项正确;
C选项,经几次振荡并放气后,分液漏斗应放置在带铁圈的铁架台上静置待液体分层,C错误;
D选项,液体分层后,将分液漏斗上的玻璃塞打开,或使塞上的凹槽对准漏斗上的小孔,以保证分液漏斗内外压强相等,内部液体顺利流出,D正确
E选项,分液操作时,分液漏斗中的下层液体由下口放出,然后将上层液体从上口倾倒出来,D项错误;
答案选ABD;
(5)蒸馏装置图中仪器A的名称是蒸馏烧瓶;在步骤④中加入CaCl2的作用是作为吸水剂,干燥有机层;
(6)由于乙醇过量,以苯甲酸计算理论生成的苯甲酸乙酯,n(苯甲酸乙酯)理论=n(苯甲酸)==0.1mol,m(苯甲酸乙酯)理论=0.1mol×150g/mol=15g,该实验产品的产率==90.0%。
16. 受热均匀,温度比水浴高,容易控制温度 F 中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度 氢氧化钠碱性强,促进乙酸乙酯水解 乙醇 ③ CH3COOH+H18OCH2CH3CH3CO18OCH2CH3+H2O
(1) 该反应温度约135~145℃,水的沸点是100℃,水浴达不到加热温度,实验中采用油浴的优点是受热均匀,温度比水浴高,容易控制温度;
(2) 冷凝水‘下进上出’,进水口是F;
(3) 饱和Na2CO3溶液洗涤粗酯的目的是中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度;若用NaOH溶液会与乙酸乙酯发生水解反应;
(4) 用氯化钙除去少量乙醇,用无水硫酸钠除去少量的水,故选③;
(5)酯化反应的机理是‘酸脱羟基醇脱氢’,用18O标记乙醇的氧元素,产物的乙酸乙酯中出现18O,反应的化学方程式为:CH3COOH+H18OCH2CH3CH3CO18OCH2CH3+H2O。
17.(1) 在大试管A中加入乙醇,再分别慢慢加入浓硫酸和乙酸,边加边振荡试管使之混合均匀 CH3COOH+C2H5OHCH3COOC2H5+H2O
(2)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物会随产物蒸发而损失
(3)试管B中的液体分为上下两层,上层为无色油状液体,可闻到水果香味,下层为红色液体,振荡后颜色变浅,有气泡产生
(4) 乙醇 b
(5)abc
(1)为防止浓硫酸溶解放热,造成液体迸溅,在大试管A中先加入乙醇,再分别慢慢加入浓硫酸和乙酸,边加边振荡试管使之混合均匀。乙醇、乙酸在浓硫酸作用下加热生成乙酸乙酯和水,反应方程式为CH3COOH+C2H5OHCH3COOC2H5+H2O;
(2)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物会随产物蒸发而损失,所以步骤②必须小火均匀加热。
(3)乙酸乙酯难溶与饱和碳酸钠,乙酸和碳酸钠反应生成乙酸钠、二氧化碳、水。收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置,试管B中的液体分为上下两层,上层为无色油状液体,可闻到水果香味,下层为红色液体,振荡后颜色变浅,有气泡产生。
(4)乙醇可与氯化钙反应,生成微溶于水的CaCl2 6C2H5OH,所以用饱和CaCl2溶液洗涤可除去的杂质是乙醇;乙酸乙酯在碱性、酸性条件下能水解,可以用中性干燥剂干燥乙酸乙酯,所以最适宜的干燥剂为无水硫酸钠,选b。
(5)a.从该装置与传统制备装置的使用的仪器的不同进行分析,增加了温度计,有利于控制发生装置中反应液的温度,a正确;
b.增加了分液漏斗,能随时补充反应混合液,故b正确;
c.增加了冷凝装置,有利于收集乙酸乙酯,c正确;
d.反应容器容积大,容纳反应物的量多,但物质的浓度不变,所以化学反应速率不变,d错误;
选abc;
18. 13.0 448 CH4 5.60
(1)铜和10mL浓硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,则n(NO2)+n(NO)==0.05mol,即被还原的硝酸的物质的量为0.05mol,n(Cu)==0.04mol,则生成n[Cu(NO3)2]=0.04mol,可知表现酸性的硝酸的物质的量为0.04mol×2=0.08mol,则参加反应的硝酸的物质的量为:0.05mol+0.08mol=0.13mol,则物质的量浓度为,若将生成的气体溶于水被全部吸收,消耗氧气的物质的量n(O2)=n(Cu)=0.02mol,则消耗标准状况下O2的体积为0.02mol×22.4L/mol=0.448L=448mL;
(2)由题干信息,标准状况下,某气态烷烃和乙烯的混合气体11.2L,则混合气体的物质的量为0.5mol,则该混合气体的平均相对分子质量为,由于乙烯的相对分子质量为28,则该气态烷烃的相对分子质量应小于20.8,所以该气态烷烃只能是甲烷(CH4),设甲烷的物质的量为x,乙烯的物质的量为y,则由x+y=0.5,16x+28y=10.4,解得x=0.3,y=0.2,即甲烷的物质的量为0.3mol,乙烯的物质的量为0.2mol,将该混合气体通入足量的溴水,乙烯与溴水发生加成反应,溴水增加的质量即为乙烯的质量,即为0.2mol×28g/mol=5.6g。
19. C5H12 CH3CH2CH2CH2CH3、、 浓硫酸吸收水分,增加质量就是H2O的质量,其物质的量是n(H2O)=,则n(H)=2n(H2O)=0.3 mol;碱石灰吸收CO2,其增加质量是CO2的质量,n(CO2)= ,n(C)=n(CO2)=0.125 mol,因此n(C):n(H)=0.125 mol:0.3 mol=5:12,所以实验式是C5H12。由于5个C原子最多可结合12个H原子,因此实验式就是物质的分子式,故该物质分子式是C5H12。
烃中的H反应后变为H2O,烃中的C反应后变为CO2,燃烧产物先通过浓硫酸吸收水,再通过碱石灰吸收CO2气体,由H2O、CO2的质量计算其物质的量,然后利用元素守恒计算其中所含C、H原子的物质的量,可得烃中C、H原子个数比,得到最简式,然后根据最简式中H原子数是否达到该C原子结合H原子的最大数目确定物质的分子式。
(1)浓硫酸吸收水分,增加质量就是H2O的质量,其物质的量是n(H2O)=,则n(H)=2n(H2O)=0.3 mol;碱石灰吸收CO2,其增加质量是CO2的质量,n(CO2)= ,n(C)=n(CO2)=0.125 mol,因此n(C):n(H)=0.125 mol:0.3 mol=5:12,所以实验式是C5H12。由于5个C原子最多可结合12个H原子,因此实验式就是物质的分子式,故该物质分子式是C5H12;
(2)C5H12是戊烷,其所有可能的结构简式是:CH3CH2CH2CH2CH3、、;
(3)由(1)可知计算过程为浓硫酸吸收水分,增加质量就是H2O的质量,其物质的量是n(H2O)=,则n(H)=2n(H2O)=0.3 mol;碱石灰吸收CO2,其增加质量是CO2的质量,n(CO2)= ,n(C)=n(CO2)=0.125 mol,因此n(C):n(H)=0.125 mol:0.3 mol=5:12,所以实验式是C5H12。由于5个C原子最多可结合12个H原子,因此实验式就是物质的分子式,故该物质分子式是C5H12。
20. Br HClO4 KOH Al (OH)3 5
根据元素在周期表中的位置分析元素的种类,根据元素周期律分析物质的性质,书写离子结构示意图和电子式;根据甲烷的取代反应判断产物的种类。
由元素在周期表的位置可以知道,①为C、②为F、③为Na、④为Mg、⑤为Al、⑥为Cl、⑦为Ar、⑧为K、⑨为Br;
(1)⑨的元素符号是Br;
(2)稀有气体Ar化学性质稳定,核外电子数为18,各层电子数为2、8、8,原子结构示意图为:;
(3)根据元素周期律:周期表中从左到右失电子能力逐渐减弱,得电子能力逐渐增强,元素非金属性逐渐增强,从上到下失电子能力逐渐增强,得电子能力逐渐减弱,元素非金属性逐渐减弱,F没有含氧酸,上述元素F除外中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,Al (OH)3为两性氢氧化物,故答案是:HClO4;KOH;Al (OH)3;
(4)甲烷与氯气按1:1混合,光照条件下,因为氯气不足,可发生多步取代反应,生成物有CH3Cl、CH2Cl2、CHCl3、CCl4、HCl,共5种产物;
(5)氯化镁属于离子化合物,用电子式表示其形成过程为:。
21.(1) 第二周期第ⅣA族
(2) 非极性键
(3)
(4) nCH2=CH2 加聚反应
(5)
A、B、C、D、E五种原子序数逐渐增大的短周期元素,A是周期表中原子半径最小的元素,为氢元素, A与D同主族,则D为钠元素,E的单质是应用最为广泛的半导体材料,为硅元素。B与E同主族,B为碳元素。E原子核内质子数等于B、C原子电子数之和,则C为氧元素。据此解答。
(1)B为硅元素,在第二周期第ⅣA族,氧离子和钠离子是电子层结构相同,根据核电荷数越大,半径越小分析,氧离子半径大于钠离子半径。
(2)A与B形成的含有18个电子的物质甲为乙烷,其结构式是,C与D形成的原子个数比为1:1的化合物乙为过氧化钠,其电子式是,乙物质中含有非极性键。
(3)碳的最简单氢化物为甲烷,甲烷和氯气反应生成一氯甲烷和氯化氢,方程式为: ;
(4)乙烯用来衡量一个国家的石油化工发展水平,其加聚生成聚乙烯。方程式为:nCH2=CH2;
(5)二氧化硅和碳反应生成碳化硅和一氧化碳,方程式为:。
22. Na2O Na2O2 离子 OH-+=+H2O Cl->N3->O2->Na+ 弱 Na2CO3+2HClO4=CO2↑+H2O+2NaClO4或NaHCO3+HClO4=CO2↑+H2O+NaClO4
根据B形成的化合物种类繁多,可推断B为碳(C)元素;C、D为空气中含量最多的两种元素,C、D的原子序数依次增大,所以C为氮(N)元素,D为氧(O)元素;D、E形成两种不同的离子化合物,氧元素之后的短周期元素能与氧形成离子化合物的为金属元素,能形成两种的只有Na,则E为Na;F为同周期半径最小的元素,E、F同周期,所以F为Cl元素;它们的原子核外电子层数之和为13,则A为H元素;据以上分析解答。
(1)Na元素与O元素形成两种化合物,分别为:Na2O和Na2O2;
(2)B、D、F分别为碳、氧、氯,三者形成的化合物COCl2,其中C原子共用四对电子,O原子共用两对电子,每个Cl共用一对电子,所以C为中心原子,四个原子均为八电子稳定结构,其电子式为:;A、C、F三种元素形成的化合物CA4F为NH4Cl,属于离子化合物;
(3)化合物甲、乙由A、B、D、E(氢、碳、氧、钠)中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲和乙可能是NaOH和NaHCO3,其反应的离子方程式为:OH-+=+H2O;
(4)C、D、E、F形成的简单离子分别为:N3-、O2-、Na+、Cl-,其中N3-、O2-、Na+的电子层结构相同,均有2个电子层,而Cl-有3个电子层。电子层结构相同的离子,核电荷数越大,半径越小;离子电子层越多,离子半径越大,故C、D、E、F形成的简单离子的离子半径由大到小的顺序是:Cl->N3->O2->Na+;
(5)元素B和F的分别为C、Cl,非金属性C比Cl弱。非金属性越强,其对应的最高价氧化物的水化物酸性越强,利用这一点可以证明非金属性强弱。高氯酸能制备碳酸,则高氯酸的酸性大于碳酸,即非金属性Cl大于C,反应方程式Na2CO3+2HClO4=CO2↑+H2O+2NaClO4或NaHCO3+HClO4=CO2↑+H2O+NaClO4。
一、单选题(共12题)
1.下列说法不正确的是
A.煤的干馏发生了化学变化
B.淀粉和纤维素互为同分异构体
C.羊毛、塑料、合成橡胶都属于有机高分子材料
D.利用油脂在碱性条件下的水解,可以制得肥皂
2.下列物质中,在一定条件下既能发生加成反应,又能发生取代反应,但不能使酸性KMnO4溶液褪色的是( )
A.甲烷 B.苯
C.乙烯 D.乙烷
3.下列化学用语表述正确的是
A.N2分子的结构式:N≡N B.CH4的比例模型:
C.18O2- 的结构示意图: D.CO2的球棍模型:
4.已知苯环上的羟基具有酸性。下列关于有机化合物M和N的说法正确的是( )
A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.M、N分子中都含有苯环
5.下列有关除去杂质(括号中为杂质)的操作中,正确的是
A.乙烯():通入酸性高锰酸钾溶液中洗气
B.乙醇(乙酸):加生石灰,过滤
C.甲烷(乙烯):通入溴水中洗气
D.乙酸乙酯(乙酸):加入氢氧化钠溶液,充分振荡,分液,弃水层
6.下列方法中不能用来鉴别乙烯和乙烷的
A.在空气中燃烧 B.分别通入酸性高锰酸钾溶液中
C.分别通入溴水中 D.把燃烧后的产物分别通入澄清的石灰水中
7.以下物质的工业制备所用主要原料(括号内物质)不符合事实的是
A.乙烯(乙醇) B.顺丁橡胶(石油裂解气)
C.碘(海带) D.溴(海水晒盐后的余液)
8.某兴趣小组用如图装置探究甲烷与氯气反应同时收集副产品盐酸,下列说法不正确的是
A.B装置能够起到干燥、混合气体等作用,E装置作用是吸收氯化氢和防倒吸
B.若有200mL 8mol·L-1盐酸与足量二氧化锰反应,E中最多可得2mol·L-1盐酸200mL
C.D中石棉上混有潮湿的碘化钾粉末,用于吸收氯气
D.光照一段时间,装置C硬质玻璃管内壁出现的黑色小颗粒可能是碳
9.2021年12月9日,神舟十三号航天员在太空授课。搭载神舟十三号载人飞船的长征二号F遥十三运载火箭发动机工作时发生的反应为:。下列有关说法错误的是
A.的电子式
B.二氧化碳的填充模型:
C.中子数为10的氧原子:
D.偏二甲肼()的结构简式:
10.食品分类的一种方法如下表.以下属于白色食品的是
食品类型 绿色食品 蓝色食品 白色食品
分类依据 绿色植物通过光合作用转化而来 由海洋提供 通过微生物发酵制得
A.精制面粉 B.精制豆油 C.新鲜海带 D.酿制米酒
11.反应NH4Cl+NaNO2==NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语不正确的是( )
A.中子数为18的氯原子:Cl B.N2的电子式:
C.Na+的结构示意图: D.H2O分子的比例模型:
12.对实验:①中和滴定、②中和热的测定、③实验室制备乙烯、④乙酸乙酯的制取,叙述正确的是
A.①④必须加热 B.②③必须隔热
C.①②必须用指示剂 D.③④必须用催化剂
二、非选择题(共10题)
13.玫瑰的香味物质中包含苧烯,苧烯的结构为。
(1)下列有关苧烯的说法正确的是_____。
A.苧烯属于芳香烃 B.苧烯与1,3-丁二烯互为同系物
C.苧烯分子中键角均为120° D.苧烯不能发生1,4-加成反应
(2)写出苧烯跟等物质的量的Br2发生加成反应所得产物可能有_____种。
(3)有机物A是苧烯的同分异构体,分子结构可表示为(R代表烃基),写出A可能的两种结构简式_____。
(4)写出A(用表示)和Cl2发生1,4-加成反应的化学方程式: _____。
14.请结合如图显示的4个碳原子相互结合的几种方式,分析以碳为骨架的有机物种类繁多的原因____。
15.苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为
+C2H5OH+H2O
已知:
物质 颜色、状态 沸点(℃) 密度(g·cm-3) 相对分子质量
苯甲酸 无色、片状晶体;100℃会迅速升华 249 1.2659 122
苯甲酸乙酯 无色澄清液体 212.6 1.05 150
乙醇 无色澄清液体 78.3 0.7893 46
环己烷 无色澄清液体 80.8 0.7318 84
实验步骤如下:
①在100mL圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按图I所示装好仪器,控制温度在65~70℃加热回流2h。反应时环己烷—乙醇—水会形成“共沸物”(沸点62.6℃)蒸馏出来。再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并有机层。加入氯化钙,对粗产品进行蒸馏(装置如图II所示)。低温蒸出乙醚后继续升温,接收210~213℃的馏分。
⑤检验合格,测得产品体积为12.86mL。
(1)步骤①中加入沸石的目的是______;使用分水器不断分离除去水的目的是___。
(2)步骤②中继续加热的温度应控制在____(填标号)。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(3)步骤③中若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是____。
(4)步骤④中分液操作叙述正确的是___(填标号)。
A.向盛有水层的分液漏斗中加入乙醚,盖好玻璃塞,将分液漏斗倒转,用力振荡
B.振荡几次后需打开分液漏斗的下口活塞放气
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.液体分层后,将分液漏斗上的玻璃塞打开,或使塞上的凹槽对准漏斗上的小孔
E.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
(5)图II中仪器A的名称是___,步骤④中氯化钙的作用是___。
(6)该实验产品的产率为___(结果保留三位有效数字)。
16.某实验室用如图所示装置制取乙酸乙酯。
已知:①乙醚、乙醇、乙酸、乙酸乙酯的沸点依次是34.7℃、78.4℃、118℃、77.1℃;
②无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH.请回答下列问题:
(1)在蒸馏烧瓶和分液漏斗中分别加入相应实验药品,加热油浴B,保温约135~145℃。实验中采用油浴的优点是_______。
(2)仪器C是直形冷凝管,在使用时进水口是_______。(填“E”或“F”)
(3)一段时间后停止加热,取下D,将一定量饱和Na2CO3溶液加到馏出液里,至无气泡产生。D中用饱和Na2CO3溶液洗涤粗酯的目的是_______。如果用NaOH溶液代替Na2CO3溶液将引起的后果是_______。
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水。若将其净化提纯,常先加入无水氯化钙,分离出_______;再加入_______(此空从下列选项中选择①碱石灰、②生石灰、③无水硫酸钠);然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
(5)用同位素18O示踪法确定反应产物水分子中氧原子的提供者,请写出标示18O位置的化学方程式_______。
17.为探究乙酸乙酯的实验室制备方法,某实验小组设计主要步骤如下:
①在大试管A中配制反应混合液;②按图甲所示连接装置(装置气密性良好),用小火均匀加热大试管A5~10min;③待试管B(内装滴有酚酞的饱和碳酸钠溶液)收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置待分层;④分离出乙酸乙酯层,洗涤、干燥。
乙醇可与氯化钙反应,生成微溶于水的CaCl2 6C2H5OH。有关试剂部分数据如表:
物质 熔点/℃ 沸点/℃ 密度/(g cm-3)
乙醇 -117.3 78.5 0.789
乙酸 16.6 117.9 1.05
乙酸乙酯 -83.6 77.5 0.90
浓硫酸(98%) — 338.0 1.84
(1)配制反应混合液的主要操作步骤为______(不必指出液体体积);写出制取乙酸乙酯的化学方程式______。
(2)步骤②必须小火均匀加热,一个主要原因是温度过高会发生副反应,另一个原因是______。
(3)写出步骤③中观察到的实验现象______。
(4)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤.通过洗涤可除去的杂质是______(填名称);干燥乙酸乙酯最适宜的干燥剂为______(填字母)。
a.P2O5 b.无水硫酸钠 c.碱石灰 d.NaOH固体
(5)某化学课外小组设计了图乙所示的装置(图中铁架台,铁夹,加热装置均已略去)制取乙酸乙酯,与图甲装置相比,图乙装置的主要优点有______。
a.增加了温度计,有利于控制反应温度
b.增加了分液漏斗,能随时补充反应混合液
c.增加了冷凝装置,有利于收集产物
d.反应容器容积大,容纳反应物的量多,反应速率加快
18.完成下列两个小题
(1)将2.56gCu放入10.0mL浓HNO3中正好完全反应。随着Cu的不断减少,反应生成气体的颜色逐渐变浅,最终共生成气体1.12L(标准状况)。则该浓硝酸的物质的量浓度是_____mol/L;若将生成的气体溶于水被全部吸收,还需要消耗标准状况下O2_____mL。
(2)标准状况下,某气态烷烃和乙烯的混合气体11.2L,质量为10.4g。则混合气体中烷烃的分子式为_______;若将该混合气体通入足量的溴水,溴水的质量将增加_______g。
19.取一定质量的某烃在200℃下在过量氧气中充分燃烧,将燃烧后生成的气体依次通过装有足量的浓硫酸和碱石灰的洗气瓶,两者分别增重2.7 g和5.5 g。
(1)该烃的分子式为___________。
(2)其所有可能的结构简式___________ 。
(3)推断分子式的计算过程___________。
20.下表为元素周期表的一部分,针对表中的①~⑨九种元素,请回答有关问题:
(1)⑨的元素符号是__________
(2)在这些元素中,化学性质最不活泼的原子结构示意图为_______
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是_______(填化学式,下同),碱性最强的是_______,显两性的是_______。
(4)将元素①与氢元素组成的最简单有机物和⑥的单质按1:1混合后的气体在光照条件下放置一段时间,最多能得到_____产物。
(5)用电子式表示④和⑥两元素形成化合物的过程为__________________。
21.A、B、C、D、E五种原子序数逐渐增大的短周期元素,A是周期表中原子半径最小的元素,其中B、C同周期,A与D、B与E同主族,E原子核内质子数等于B、C原子电子数之和,E的单质是应用最为广泛的半导体材料。试回答:
(1)B在元素周期表中的位置是_______,C、D形成的简单离子半径大小关系是_______(用离子符号表示)。
(2)A与B形成的含有18个电子的物质甲的结构式是_______,C与D形成的原子个数比为1:1的化合物乙的电子式是_______,乙物质中含有_______(填“极性键”或“非极性键”)。
(3)常温下B的最简单氢化物与氯气反应生成两种气态物质的化学方程式为_______。
(4)A和B形成的化合物中,丙是一种重要的基本化工原料,其产量可以用来衡量一个国家的石油化工发展水平,写出由丙制得高聚物的反应方程式_______,该反应类型是_______。
(5)工业上利用E的氧化物与B的单质高温条件下反应制备新型陶瓷材料EB,同时生成B的二元化合物,写出制备新型陶瓷材料EB的化学方程式_______。
22.短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)D、E两种元素的单质反应生成的两种离子化合物分别是________、___________。
(2)化学组成为BDF2的电子式为:_______,A、C、F三种元素形成的化合物CA4F为_________化合物(填 “离子”或“共价”)。
(3)化合物甲、乙由A,B,D,E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为:_______________________________。
(4)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是_________________ (用元素离子符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_________于F(填“强”或“弱”),并用化学方程式证明上述结论_______________________________。
参考答案:
1.B
A.煤的干馏是指在隔绝空气条件下加热、分解,生成焦炭、煤焦油、粗苯、煤气等产物的过程,属于化学变化,故A正确,但不符合题意;
B. 淀粉和纤维素都为高聚物,聚合度介于较大范围之间,没有固定的值,则二者分子式不同,不是同分异构体,故B错误,符合题意;
C. 羊毛、塑料、合成橡胶的相对分子质量均在10000以上,均为有机高分子材料,故C正确,但不符合题意;
D. 肥皂是高级脂肪酸金属盐,油脂在碱性条件下的水解生成高级脂肪酸盐与甘油,称为皂化反应,可以制得肥皂和甘油,故D正确,但不符合题意;
故选:B。
2.B
A. 甲烷不能发生加成反应,也不能使酸性高锰酸钾溶液氧化,A错误;
B. 苯既能发生加成反应,又能发生取代反应,但不能使酸性高锰酸钾溶液氧化,B正确;
C. 乙烯含有碳碳双键,能使酸性高锰酸钾溶液氧化,C错误;
D. 乙烷不能发生加成反应,也不能使酸性高锰酸钾溶液氧化,D错误;
答案选B。
3.A
A.N2 分子含有氮氮三键,其结构式为N≡N,故A正确;
B.是甲烷的球棍模型,故B错误;
C.O的核电荷数为8而不是10,故C错误;
D.用小球和小棍表示的模型为球棍模型,二氧化碳分子是直线形分子,其中的碳原子在中间,因为氧原子的半径小于碳原子的半径,故不是表示二氧化碳分子的球棍模型,故D错误。
答案选A。
4.C
A.酚羟基、羧基均能和氢氧化钠反应,但醇羟基和氢氧化钠不反应;
B.M、N含相同的C原子数,不同的H原子数;
C.含-OH、-COOH,结合醇、酚、羧酸的性质分析;
D.看图可知。
A.酚羟基、羧基均能和氢氧化钠反应,但醇羟基和氢氧化钠不反应,所以等物质的量的两种酸分别能消耗氢氧化钠的物质的量之比为1:4,故A错误;
B.M、N含相同的C原子数,不同的H原子数,则完全燃烧等物质的量的两种物质生成二氧化碳的量相等,但水的量不同,故B错误;
C.含-OH、-COOH,均能发生酯化反应,含-OH或酚-OH,均能发生氧化反应,故C正确;
D. M分子中不含苯环,N分子中含有苯环,故D错误;
答案选C。
5.C
A.乙烯与杂质都能够被酸性高锰酸钾溶液氧化,因此不能通过洗气除去杂质,A错误;
B.乙酸与生石灰反应生成乙酸钙属于盐,乙醇沸点低,应通过蒸馏使乙醇变为气态与乙酸钙分离,B错误;
C.乙烯可与溴水中的溴发生加成反应而被吸收,甲烷不可以,故可以通入溴水中洗气来除去甲烷中的乙烯,C正确;
D.乙酸乙酯和杂质乙酸都能够与NaOH发生反应,因此不能用加入氢氧化钠溶液,然后通过分液方法除杂,D错误;
答案选C。
6.D
乙烯中含有碳碳双键,可以发生加成、氧化反应;
A.在空气中燃烧,有黑烟生成的是乙烯,可以鉴别两种气体,不符合题意,A项错误;
B.使酸性高锰酸钾溶液褪色的是乙烯,可以鉴别两种气体,不符合题意,B项错误;
C.使溴水褪色的是乙烯,可以鉴别两种气体,不符合题意,C项错误;
D.二者燃烧后的产物均有二氧化碳,分别通入澄清的石灰水中均有白色沉淀生成,无法鉴别两种气体,D项正确;
答案选D。
7.A
A.在实验室是以乙醇为原料制取乙烯的,在工业上是以石油为原料裂解产生的气体,选项A错误;
B.顺丁橡胶是以石油裂解气为原料通过发生加聚反应形成,选项B正确;
C.海带中含有碘元素,以I-存在,先将海带灼烧,然后过滤,向滤液中通入氯气,发生置换反应产生I2,然后用有机溶剂萃取就得到碘的有机溶液,再蒸馏分离得到碘单质,选项C正确;
D.海水晒盐后的余液中含有NaBr,向该溶液中通入氯气,发生置换反应产生溴,选项D正确。
答案选A。
8.B
A.观察装置可知,浓硫酸不仅可以干燥混合气,还可以使气体混合均匀同时能够通过观察气泡判断流速,E装置可以吸收反应生成的氯化氢,采用干燥管同时能起到防倒吸作用,A项正确;
B.随着反应进行,盐酸浓度变小,与二氧化锰不再反应,B项错误;
C.氯气和碘化钾能反应,C项正确;
D.由组成元素分析,黑色小颗粒只能是碳, D项正确;
故选B。
9.B
A.中2个N原子之间共用3对电子,A正确;
B.二氧化碳分子为直线形,B错误;
C.氧原子质子数为8,中子数为10的核素为,C正确;
D.N原子能形成3个共价键,偏二甲肼的结构简式为,D正确;
故答案为B
10.D
精制面粉,精制豆油是通过反复提炼而来,新鲜海带属蓝色食品,而米酒则是通过糯米发酵而来,所以答案应选D。
11.B
A. 中子数为18的Cl原子的质量数为18+17=35,可表示为Cl,A正确;
B. N2的电子式为,B错误;
C. Na+为Na原子失去最外层一个电子得到的微粒,其结构示意图为,C正确;
D. H2O分子的比例模型为,D正确;
故答案选B。
12.D
A.中和滴定不需要加热,故A错误;
B.中和热的测定需要隔热,实验室制乙烯需在浓硫酸作用下加热至170℃,不需要隔热,故B错误;
C.中和热的测定不需要用指示剂,故C错误;
D.实验室制备乙烯需要用浓硫酸作催化剂;乙醇和乙酸发生酯化反应需要浓硫酸作催化剂,因此实验③④都需要使用浓硫酸作催化剂,故D正确;
故选D。
13. D 2 、、、 +Cl2→
(1)A.苧烯不含有苯环,不属于芳香烃,A不正确;
B.苧烯的不饱和度为3,1,3-丁二烯的不饱和度为2,二者不互为同系物,B不正确;
C.苧烯分子中存在5个四面体结构的碳原子,它们的键角都不是120°,C不正确;
D.苧烯分子中的两个双键碳原子不是直接相连,不能发生1,4-加成反应,D正确;
故选D。答案为:D;
(2)苧烯分子中两个双键都能与Br2发生等物质的量加成反应,所以加成反应所得产物可能有2种。答案为:2;
(3)有机物A是苧烯的同分异构体,分子结构可表示为(R代表烃基),根据原子守恒可知R表示C4H9-,则异构体主要由C4H9-产生异构,分别为、、、。答案为:、、、;
(4)A(用表示)和Cl2发生1,4-加成反应,生成,反应方程式为+Cl2→。答案为:+Cl2→。
14.碳原子最外层含4个电子,可以和碳原子及其他原子形成4个共价键,碳原子间可以以单键、双键或三键相结合,也可以形成碳链或碳环等碳骨架
碳原子最外层含4个电子,能与其他原子形成四个共价键,碳原子间可以以单键、双键或三键相结合,且碳原子之间也能相互成键,碳原子可以成碳链,可以成碳环,含碳的有机物存在同分异构现象,因此以碳为骨架的有机物种类繁多。
15. 防止暴沸 有利于平衡不断向正反应方向移动,提高苯甲酸乙酯产率 C 苯甲酸乙酯中混有苯甲酸,在受热至100℃时发生升华 ABD 蒸馏烧瓶 干燥有机层 90.0%
本题考查苯甲酸乙酯的制备。在圆底烧瓶中加入原料,经浓硫酸催化后生成苯甲酸乙酯和水,利用“环己烷—乙醇—水”这个共沸物将水带出,使酯化反应继续进行;随后利用碳酸钠溶液除去混合溶液中的苯甲酸和硫酸;随后利用乙醚将有机物萃取出来,经蒸馏得到苯甲酸乙酯,称量后计算产率。
(1)反应过程中加入沸石的目的是防止暴沸;反应 +C2H5OH+H2O为可逆反应,使用分水器不断分离除去水,减小生成物浓度,有利于平衡不断向正反应方向移动,提高苯甲酸乙酯的产率;
(2)根据题意,反应时环己烷—乙醇—水会形成“共沸物”蒸馏出来。烧瓶内的苯甲酸乙酯中混有乙醇、环己烷、苯甲酸和硫酸,步骤②继续加热蒸出苯甲酸乙酯中的乙醇、环己烷,乙醇的沸点为78.3℃,环己烷的沸点为80.8℃,苯甲酸乙酯的沸点为212.6℃,所以步骤②应控制馏分的温度在85~90℃,答案选C;
(3)步骤③中加入Na2CO3除去苯甲酸乙酯中混有的苯甲酸和硫酸,若Na2CO3加入不足,苯甲酸没有完全除去,步骤④蒸馏时蒸馏烧瓶中可见白烟的原因是:苯甲酸乙酯中混有苯甲酸,苯甲酸在受热至100℃时发生升华;
(4)A选项,为了使乙醚和水溶液充分接触,水溶液中加入乙醚转移至分液漏斗中后,需塞上玻璃塞,将分液漏斗倒转用力振摇,A项正确;
B选项,为防止分液漏斗中气压过大将玻璃塞弹出,振摇几次后需打开分液漏斗下口的玻璃塞放气,B项正确;
C选项,经几次振荡并放气后,分液漏斗应放置在带铁圈的铁架台上静置待液体分层,C错误;
D选项,液体分层后,将分液漏斗上的玻璃塞打开,或使塞上的凹槽对准漏斗上的小孔,以保证分液漏斗内外压强相等,内部液体顺利流出,D正确
E选项,分液操作时,分液漏斗中的下层液体由下口放出,然后将上层液体从上口倾倒出来,D项错误;
答案选ABD;
(5)蒸馏装置图中仪器A的名称是蒸馏烧瓶;在步骤④中加入CaCl2的作用是作为吸水剂,干燥有机层;
(6)由于乙醇过量,以苯甲酸计算理论生成的苯甲酸乙酯,n(苯甲酸乙酯)理论=n(苯甲酸)==0.1mol,m(苯甲酸乙酯)理论=0.1mol×150g/mol=15g,该实验产品的产率==90.0%。
16. 受热均匀,温度比水浴高,容易控制温度 F 中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度 氢氧化钠碱性强,促进乙酸乙酯水解 乙醇 ③ CH3COOH+H18OCH2CH3CH3CO18OCH2CH3+H2O
(1) 该反应温度约135~145℃,水的沸点是100℃,水浴达不到加热温度,实验中采用油浴的优点是受热均匀,温度比水浴高,容易控制温度;
(2) 冷凝水‘下进上出’,进水口是F;
(3) 饱和Na2CO3溶液洗涤粗酯的目的是中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度;若用NaOH溶液会与乙酸乙酯发生水解反应;
(4) 用氯化钙除去少量乙醇,用无水硫酸钠除去少量的水,故选③;
(5)酯化反应的机理是‘酸脱羟基醇脱氢’,用18O标记乙醇的氧元素,产物的乙酸乙酯中出现18O,反应的化学方程式为:CH3COOH+H18OCH2CH3CH3CO18OCH2CH3+H2O。
17.(1) 在大试管A中加入乙醇,再分别慢慢加入浓硫酸和乙酸,边加边振荡试管使之混合均匀 CH3COOH+C2H5OHCH3COOC2H5+H2O
(2)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物会随产物蒸发而损失
(3)试管B中的液体分为上下两层,上层为无色油状液体,可闻到水果香味,下层为红色液体,振荡后颜色变浅,有气泡产生
(4) 乙醇 b
(5)abc
(1)为防止浓硫酸溶解放热,造成液体迸溅,在大试管A中先加入乙醇,再分别慢慢加入浓硫酸和乙酸,边加边振荡试管使之混合均匀。乙醇、乙酸在浓硫酸作用下加热生成乙酸乙酯和水,反应方程式为CH3COOH+C2H5OHCH3COOC2H5+H2O;
(2)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物会随产物蒸发而损失,所以步骤②必须小火均匀加热。
(3)乙酸乙酯难溶与饱和碳酸钠,乙酸和碳酸钠反应生成乙酸钠、二氧化碳、水。收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置,试管B中的液体分为上下两层,上层为无色油状液体,可闻到水果香味,下层为红色液体,振荡后颜色变浅,有气泡产生。
(4)乙醇可与氯化钙反应,生成微溶于水的CaCl2 6C2H5OH,所以用饱和CaCl2溶液洗涤可除去的杂质是乙醇;乙酸乙酯在碱性、酸性条件下能水解,可以用中性干燥剂干燥乙酸乙酯,所以最适宜的干燥剂为无水硫酸钠,选b。
(5)a.从该装置与传统制备装置的使用的仪器的不同进行分析,增加了温度计,有利于控制发生装置中反应液的温度,a正确;
b.增加了分液漏斗,能随时补充反应混合液,故b正确;
c.增加了冷凝装置,有利于收集乙酸乙酯,c正确;
d.反应容器容积大,容纳反应物的量多,但物质的浓度不变,所以化学反应速率不变,d错误;
选abc;
18. 13.0 448 CH4 5.60
(1)铜和10mL浓硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,则n(NO2)+n(NO)==0.05mol,即被还原的硝酸的物质的量为0.05mol,n(Cu)==0.04mol,则生成n[Cu(NO3)2]=0.04mol,可知表现酸性的硝酸的物质的量为0.04mol×2=0.08mol,则参加反应的硝酸的物质的量为:0.05mol+0.08mol=0.13mol,则物质的量浓度为,若将生成的气体溶于水被全部吸收,消耗氧气的物质的量n(O2)=n(Cu)=0.02mol,则消耗标准状况下O2的体积为0.02mol×22.4L/mol=0.448L=448mL;
(2)由题干信息,标准状况下,某气态烷烃和乙烯的混合气体11.2L,则混合气体的物质的量为0.5mol,则该混合气体的平均相对分子质量为,由于乙烯的相对分子质量为28,则该气态烷烃的相对分子质量应小于20.8,所以该气态烷烃只能是甲烷(CH4),设甲烷的物质的量为x,乙烯的物质的量为y,则由x+y=0.5,16x+28y=10.4,解得x=0.3,y=0.2,即甲烷的物质的量为0.3mol,乙烯的物质的量为0.2mol,将该混合气体通入足量的溴水,乙烯与溴水发生加成反应,溴水增加的质量即为乙烯的质量,即为0.2mol×28g/mol=5.6g。
19. C5H12 CH3CH2CH2CH2CH3、、 浓硫酸吸收水分,增加质量就是H2O的质量,其物质的量是n(H2O)=,则n(H)=2n(H2O)=0.3 mol;碱石灰吸收CO2,其增加质量是CO2的质量,n(CO2)= ,n(C)=n(CO2)=0.125 mol,因此n(C):n(H)=0.125 mol:0.3 mol=5:12,所以实验式是C5H12。由于5个C原子最多可结合12个H原子,因此实验式就是物质的分子式,故该物质分子式是C5H12。
烃中的H反应后变为H2O,烃中的C反应后变为CO2,燃烧产物先通过浓硫酸吸收水,再通过碱石灰吸收CO2气体,由H2O、CO2的质量计算其物质的量,然后利用元素守恒计算其中所含C、H原子的物质的量,可得烃中C、H原子个数比,得到最简式,然后根据最简式中H原子数是否达到该C原子结合H原子的最大数目确定物质的分子式。
(1)浓硫酸吸收水分,增加质量就是H2O的质量,其物质的量是n(H2O)=,则n(H)=2n(H2O)=0.3 mol;碱石灰吸收CO2,其增加质量是CO2的质量,n(CO2)= ,n(C)=n(CO2)=0.125 mol,因此n(C):n(H)=0.125 mol:0.3 mol=5:12,所以实验式是C5H12。由于5个C原子最多可结合12个H原子,因此实验式就是物质的分子式,故该物质分子式是C5H12;
(2)C5H12是戊烷,其所有可能的结构简式是:CH3CH2CH2CH2CH3、、;
(3)由(1)可知计算过程为浓硫酸吸收水分,增加质量就是H2O的质量,其物质的量是n(H2O)=,则n(H)=2n(H2O)=0.3 mol;碱石灰吸收CO2,其增加质量是CO2的质量,n(CO2)= ,n(C)=n(CO2)=0.125 mol,因此n(C):n(H)=0.125 mol:0.3 mol=5:12,所以实验式是C5H12。由于5个C原子最多可结合12个H原子,因此实验式就是物质的分子式,故该物质分子式是C5H12。
20. Br HClO4 KOH Al (OH)3 5
根据元素在周期表中的位置分析元素的种类,根据元素周期律分析物质的性质,书写离子结构示意图和电子式;根据甲烷的取代反应判断产物的种类。
由元素在周期表的位置可以知道,①为C、②为F、③为Na、④为Mg、⑤为Al、⑥为Cl、⑦为Ar、⑧为K、⑨为Br;
(1)⑨的元素符号是Br;
(2)稀有气体Ar化学性质稳定,核外电子数为18,各层电子数为2、8、8,原子结构示意图为:;
(3)根据元素周期律:周期表中从左到右失电子能力逐渐减弱,得电子能力逐渐增强,元素非金属性逐渐增强,从上到下失电子能力逐渐增强,得电子能力逐渐减弱,元素非金属性逐渐减弱,F没有含氧酸,上述元素F除外中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,Al (OH)3为两性氢氧化物,故答案是:HClO4;KOH;Al (OH)3;
(4)甲烷与氯气按1:1混合,光照条件下,因为氯气不足,可发生多步取代反应,生成物有CH3Cl、CH2Cl2、CHCl3、CCl4、HCl,共5种产物;
(5)氯化镁属于离子化合物,用电子式表示其形成过程为:。
21.(1) 第二周期第ⅣA族
(2) 非极性键
(3)
(4) nCH2=CH2 加聚反应
(5)
A、B、C、D、E五种原子序数逐渐增大的短周期元素,A是周期表中原子半径最小的元素,为氢元素, A与D同主族,则D为钠元素,E的单质是应用最为广泛的半导体材料,为硅元素。B与E同主族,B为碳元素。E原子核内质子数等于B、C原子电子数之和,则C为氧元素。据此解答。
(1)B为硅元素,在第二周期第ⅣA族,氧离子和钠离子是电子层结构相同,根据核电荷数越大,半径越小分析,氧离子半径大于钠离子半径。
(2)A与B形成的含有18个电子的物质甲为乙烷,其结构式是,C与D形成的原子个数比为1:1的化合物乙为过氧化钠,其电子式是,乙物质中含有非极性键。
(3)碳的最简单氢化物为甲烷,甲烷和氯气反应生成一氯甲烷和氯化氢,方程式为: ;
(4)乙烯用来衡量一个国家的石油化工发展水平,其加聚生成聚乙烯。方程式为:nCH2=CH2;
(5)二氧化硅和碳反应生成碳化硅和一氧化碳,方程式为:。
22. Na2O Na2O2 离子 OH-+=+H2O Cl->N3->O2->Na+ 弱 Na2CO3+2HClO4=CO2↑+H2O+2NaClO4或NaHCO3+HClO4=CO2↑+H2O+NaClO4
根据B形成的化合物种类繁多,可推断B为碳(C)元素;C、D为空气中含量最多的两种元素,C、D的原子序数依次增大,所以C为氮(N)元素,D为氧(O)元素;D、E形成两种不同的离子化合物,氧元素之后的短周期元素能与氧形成离子化合物的为金属元素,能形成两种的只有Na,则E为Na;F为同周期半径最小的元素,E、F同周期,所以F为Cl元素;它们的原子核外电子层数之和为13,则A为H元素;据以上分析解答。
(1)Na元素与O元素形成两种化合物,分别为:Na2O和Na2O2;
(2)B、D、F分别为碳、氧、氯,三者形成的化合物COCl2,其中C原子共用四对电子,O原子共用两对电子,每个Cl共用一对电子,所以C为中心原子,四个原子均为八电子稳定结构,其电子式为:;A、C、F三种元素形成的化合物CA4F为NH4Cl,属于离子化合物;
(3)化合物甲、乙由A、B、D、E(氢、碳、氧、钠)中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲和乙可能是NaOH和NaHCO3,其反应的离子方程式为:OH-+=+H2O;
(4)C、D、E、F形成的简单离子分别为:N3-、O2-、Na+、Cl-,其中N3-、O2-、Na+的电子层结构相同,均有2个电子层,而Cl-有3个电子层。电子层结构相同的离子,核电荷数越大,半径越小;离子电子层越多,离子半径越大,故C、D、E、F形成的简单离子的离子半径由大到小的顺序是:Cl->N3->O2->Na+;
(5)元素B和F的分别为C、Cl,非金属性C比Cl弱。非金属性越强,其对应的最高价氧化物的水化物酸性越强,利用这一点可以证明非金属性强弱。高氯酸能制备碳酸,则高氯酸的酸性大于碳酸,即非金属性Cl大于C,反应方程式Na2CO3+2HClO4=CO2↑+H2O+2NaClO4或NaHCO3+HClO4=CO2↑+H2O+NaClO4。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
