第二章第二节氯及其化合物易错疑难集训(二)(含解析)高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第二章第二节氯及其化合物易错疑难集训(二)(含解析)高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-09 07:39:10 | ||
图片预览



文档简介
人救版(2019)高一必修第一册第二章 海水中的重要元素 第二节 氯及其化合物 易错疑难集训(二)
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列离子方程式的书写正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
B.FeO和稀硝酸的反应:FeO+2H+=Fe2++H2O
C.将Na投入到CuSO4溶液中:2Na+Cu2+=2Na++Cu
D.向Ba(OH)2溶液中滴加NaHSO4溶液,至混合溶液恰好为中性:Ba2++2OH-+2H++SO=BaSO4↓+2H2O
2.下列离子方程式正确的是
A.钠与冷水反应:
B.Fe加到溶液中:
C.氧化铜与盐酸混合:
D.氯气与水反应:
3.下列叙述正确的是
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀
③钠在常温下不容易被氧化
④Na2O2可作供氧剂,而Na2O不行
⑤石蕊试液中加入Na2O2粉末,先变蓝后褪色,并有气泡生成
⑥钠与浓NaCl溶液反应,放出的气体是H2
A.都正确 B.②③④⑤ C.②⑤⑥ D.④⑤⑥
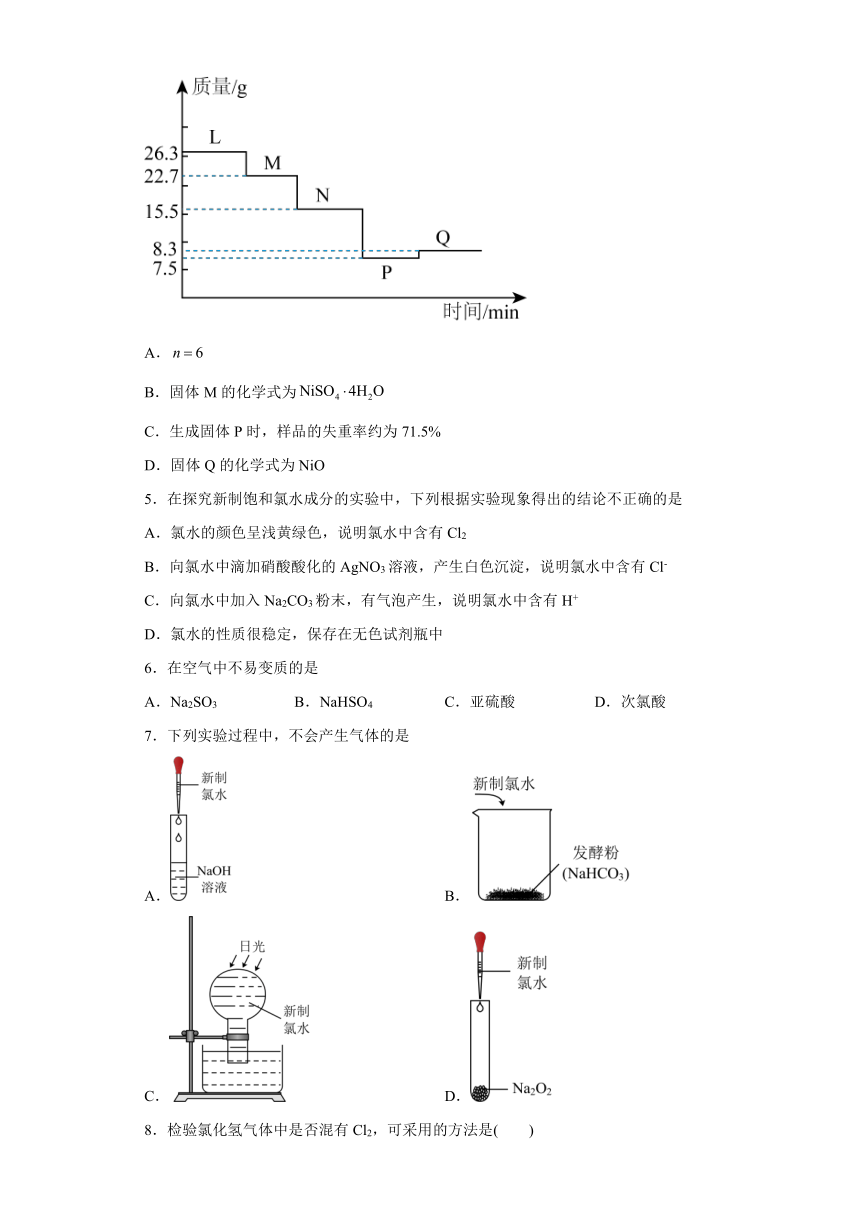
4.将26.3g样品在900℃下煅烧,样品受热过程的热重曲线(样品质量随温度变化的曲线)如图所示。已知:L→N时失掉全部的结晶水。下列说法错误的是
A.
B.固体M的化学式为
C.生成固体P时,样品的失重率约为71.5%
D.固体Q的化学式为NiO
5.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入Na2CO3粉末,有气泡产生,说明氯水中含有H+
D.氯水的性质很稳定,保存在无色试剂瓶中
6.在空气中不易变质的是
A.Na2SO3 B.NaHSO4 C.亚硫酸 D.次氯酸
7.下列实验过程中,不会产生气体的是
A. B.
C. D.
8.检验氯化氢气体中是否混有Cl2,可采用的方法是( )
A.用干燥的蓝色石蕊试纸 B.用干燥有色布条
C.将气体通入AgNO3溶液 D.用湿润的淀粉碘化钾试纸
9.下列叙述正确的是
A.漂白粉中的有效成分是Ca(ClO)2和CaCl2
B.光照新制氯水能够放出氧气
C.溶液和胶体的本质区别是有无丁达尔效应
D.干燥的氯气不能使鲜花褪色
二、填空题
10.A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则A的化学式为_______B的化学式为_______。
(2)A→C反应的化学方程式为_______。
(3)A与水反应的化学方程式_______。
(4)C可用于呼吸面具或潜水艇中氧气的来源,写出所发生的化学方程式 _______。从氧化剂和还原剂的角度分析,在这个反应中C的作用是_______。
11.早前金属钠是由电解熔融碳酸钠制得的。直到1921年实现了电解熔融氯化钠制钠,其反应原理是。回答下列有关单质钠的问题:
(1)下列保存金属钠的方法正确的是___________。
A.放在棕色瓶中 B.放在细沙中 C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后产物的主要成分是___________。
A. B. C.NaOH D.
(3)将小块钠放在水平放置的试管中部,用酒精灯加热使其充分反应(如图I所示,夹持装置已略去),生成物的颜色为___________,请写出该反应的化学方程式:___________。将该试管冷却后直立,滴加几滴水(如图II所示),发生反应的化学方程式为___________。呼吸面具中通常也会用到该生成物,请用化学方程式表示反应原理___________。
三、实验题
12.某同学设计如图所示装置探究氯气能否与水发生反应。已知气体a的主要成分是含有少量水蒸气的氯气。请回答下列问题:
(1)浓硫酸的作用是_________。
(2)证明氯气和水发生反应的实验现象为__________。
(3)该实验设计存在的缺陷是______,为了克服该缺陷,需要补充装置,其中发生反应的离子方程式为______。
13.某化学小组为了证明二氧化硫和氯气的漂白性,设计了如图所示的实验装置:
他们制备二氧化硫和氯气所依据的原理分别是:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
(1)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热_______ (填" B”或“D")试管中无明显现象。
(2)装置C的作用是_______;
(3)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是:_______。
14.84消毒液的有效成分是NaClO,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备NaClO,并探究氯气的性质。经查阅到资料可知:“氯气与水的反应是放热反应,在加热条件下氯气与碱液发生如下反应:3Cl2+6NaOH5NaCl+NaClO3+3H2O。
回答下列问题:
(1)装置A、D中发生反应的离子方程式分别为:A:_______;D:_______;
(2)装置B能否省去的_______(填“能”或“不能”),理由是_______;
(3)装置D中采用冰水浴冷却的目的是_______。
(4)如图是检验Cl2性质的装置图示,完成下列问题。
①装置a中浓H2SO4的作用是_______;该装置能否省去_______(填“能”“不能)
②装置b、c实验现象分别为:b_______;c_______;对比b和c中现象得出的结论是_______。
四、元素或物质推断题
15.如图A、B、C、D、E、F六种物质中除D为单质外其余均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如图所示。
请回答下列问题。
(1)A、B、D的化学式是:A__________,B__________,D________;
(2)C的电子式是____________________;
(3)E和F可相互转化,图中已标明F向E转化的关系,请写出E转化为F的化学方程式:____________________。
16.X、Y、Z三种物质有如图所示转化关系,其中X与稀盐酸不反应:
(1)根据上述转化关系,推断下列物质的化学式:
X____;试剂甲:_____,试剂乙:_____
(2)写出下列各步反应的离子方程式:
①______;③______;④_____
17.A、B、C、D为四种可溶性的盐,它们包含的阳离子和阴离子分别为、、、和、、、(离子在物质中不能重复出现)。
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据实验事实可推断:
(1)化学式为:C_______、D_______;
(2)A与C反应的离子方程式_______;
(3)A溶液中阴离子的检验方法_______。
参考答案:
1.D
【详解】A.FeCl3溶液与Cu反应生成FeCl2和CuCl2,选项中的离子方程式没有配平,正确的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故A错误;
B. FeO有还原性,HNO3有强氧化性,FeO和稀硝酸发生氧化还原反应:3FeO+10H++NO=3Fe3++5H2O+NO↑,故B错误;
C.将Na投入到CuSO4溶液中,Na先和水反应生成NaOH和氢气,然后生成的NaOH再和硫酸铜反应生成氢氧化铜沉淀:2Na+2H2O=2Na++2OH-+H2↑、Cu2++2OH-=Cu(OH)2↓,故C错误;
D.向Ba(OH)2溶液中滴加NaHSO4溶液,至混合溶液恰好为中性,Ba(OH)2和NaHSO4的物质的量之比为1:2:Ba2++2OH-+2H++SO=BaSO4↓+2H2O,故D正确;
故选D。
2.C
【详解】A.钠与冷水反应,生成NaOH和H2,离子方程式为:,A不正确;
B.Fe加到溶液中,生成FeSO4和Cu,离子方程式为:,B不正确;
C.氧化铜与盐酸混合,生成CuCl2和H2O,离子方程式为:,C正确;
D.氯气与水反应,生成盐酸和次氯酸,次氯酸为弱酸,离子方程式为:,D不正确;
故选C。
3.D
【详解】①碱性氧化物与水反应只生成碱,Na2O和水反应只生成碱,是碱性氧化物;Na2O2和水反应生成氢氧化钠和氧气,不是碱性氧化物,①错误;
②Na2CO3溶液和CaCl2溶液反应得到碳酸钙沉淀,NaHCO3溶液与CaCl2溶液不反应,无沉淀生成,②错误;
③钠的性质活泼,在常温下易被氧化生成氧化钠,③错误;
④Na2O2能与二氧化碳反应生成碳酸钠和氧气,Na2O2能与水反应生成氢氧化钠和氧气;而Na2O与二氧化碳和水反应不会产生氧气,因此Na2O2可作供氧剂,而Na2O不行,④正确;
⑤Na2O2粉末与水反应生成氢氧化钠和氧气,所得溶液呈碱性,使石蕊试液变蓝;过氧化钠具有强的氧化性,具有漂白性,可以使石蕊试液褪色,所以石蕊试液中加入Na2O2粉末,先变蓝后褪色,并有气泡生成,⑤正确;
⑥钠与浓的NaCl溶液反应,实质是钠和水反应生成氢氧化钠和氢气,⑥正确;
综上,④⑤⑥正确,答案选D。
4.D
【详解】A.L→N时失掉全部的结晶水,则分解反应为=+,根据图像可知,L→N剩余固体质量是15.5,失去结晶水的质量是26.3-15.5=10.8,则根据~建立等式,,解得n=6,A项正确;
B.L→M时失掉结晶水的质量是3.6g,则失去2个结晶水,则固体M的化学式为,B项正确;
C.失重率等于固体失去的质量与原固体质量的比值,则生成固体P时,样品的失重率=×100%≈71.5%,C项正确;
D.N→P失重后,根据质量比例,可知发生的反应是=NiO+SO3↑,的摩尔质量是155,NiO 的摩尔质量是75,所以P→Q固体质量上升,应该是NiO 被氧化得到NiO2,D项错误。
故答案选D。
5.D
【分析】氯气溶于水,与水发生反应:Cl2+H2OHCl+HClO,氯水中含有氯离子、氢离子、次氯酸根离子、次氯酸、少量氢氧根离子,只有氯气有颜色,为黄绿色,氯水中含有氯气而呈浅黄绿色,溶液中HCl与硝酸银反应产生AgCl白色沉淀,而溶液呈酸性,能与碳酸钠反应生成二氧化碳,溶液中HClO不稳定,光照容易分解。
【详解】A.氯气溶于水,与水发生反应:Cl2+H2OHCl+HClO,氯水中含有氯离子、氢离子、次氯酸根离子、次氯酸、少量氢氧根离子,只有氯气有颜色,为黄绿色,所以氯水的颜色呈浅黄绿色,说明氯水中含有Cl2,A正确;
B.氯水与硝酸银溶液反应产生白色沉淀,只能是Cl-与Ag+反应得到AgCl白色沉淀,说明氯水中含有Cl-,B正确;
C.溶液呈酸性,含有盐酸和次氯酸,次氯酸的酸性比碳酸弱,盐酸与与碳酸钠反应生成二氧化碳,C正确;
D.溶液中含有的HClO不稳定,光照分解产生HCl和O2,所以为防止氯水变质,要把氯水盛放在棕色试剂瓶中,D错误;
故合理选项是D。
【点睛】本题考查氯水的性质,掌握氯气与水的反应,判断氯水中含有的微粒及各种物质的性质是本题解答的关键,侧重考查元素化合物知识的综合理解和运用。
6.B
【详解】A. Na2SO3具有还原性,能被空气中的O2氧化生成Na2SO4而变质,A错误;
B. NaHSO4在空气中能稳定存在,B正确;
C.亚硫酸具有还原性,能被空气中的O2氧化生成H2SO4而变质,C错误;
D.次氯酸见光分解生成HCl和O2而变质,D错误;
故答案选B。
7.A
【详解】A.氯水中的Cl2与NaOH溶液反应生成NaCl、NaClO和水,不会生成气体,故A符合题意;
B.新制氯水中含有HCl,NaHCO3和HCl反应生成CO2气体,故B不符合题意;
C.新制氯水中含有HClO,光照条件下HClO分解生成O2,故C不符合题意;
D.Na2O2与水反应生成O2,故D不符合题意;
答案选A。
8.D
【详解】A.干燥的氯气没有漂白性,且干燥的HCl气体也不能电离出氢离子,无论HCl气体中是否含有氯气,都不会使干燥的蓝色石蕊试纸发生颜色变化,故A错误;
B.干燥的氯气不具有漂白性,无论是否含有氯气都不能使干燥的有色布条发生颜色变化,故B错误;
C.无论是否含有氯气,气体通入硝酸银溶液中均会产生沉淀,故C错误;
D.HCl气体不能使湿润的淀粉碘化钾试纸变色,当混有氯气时,氯气具有强氧化性,可以将碘离子氧化成碘单质,从而使试纸变蓝,故D正确;
故答案为D。
9.B
【详解】A.漂白粉中的主要成分是Ca(ClO)2和CaCl2,有效成分是Ca(ClO)2,A错误;
B.新制的氯水主要是氯气分子、水分子、HCl、HClO在光照条件下HClO会发生分解反应方程式如下:2HClO2HCl+O2↑,B正确;
C.溶液和胶体的本质区别是分散质粒子直径大小不同,C错误;
D.干燥氯气不能使干燥的有色物质褪色,但鲜花中含有水,因此干燥的氯气能使鲜花褪色,D错误;
故选B。
10.(1) Na Na2O
(2)2Na+O2Na2O2
(3)↑
(4) 2Na2O2+2CO2=2Na2CO3+O2 既是氧化剂又是还原剂
【分析】A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下:;若A是一种金属,C是淡黄色固体,可知C为过氧化钠,A为金属钠,B为氧化钠,据以上分析解答。
(1)
由分析可知,C为过氧化钠,A为金属钠,B为氧化钠,A的化学式为Na;B的化学式为Na2O;
(2)
A为金属钠,C为过氧化钠,A→C反应的化学方程式为:2Na+O2Na2O2;
(3)
A为金属钠,Na与水反应的化学方程式↑;
(4)
C是淡黄色固体,可用于呼吸面具或潜水艇中氧气的来源,反应原理是过氧化钠与二氧化碳生成氧气,反应方程式:2Na2O2+2CO2=2Na2CO3+O2;该反应中,Na2O2中-1价的氧部分升高到0价,部分降低到-1价,本身既是氧化剂又是还原剂。
11.(1)D
(2)D
(3) 淡黄色 2Na+O2Na2O2 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=Na2CO3+O2和2Na2O2+2H2O=4NaOH+O2↑
【解析】(1)
钠的化学性质活泼,易与O2、H2O等反应,应密封保存,钠的密度比煤油大,可保存在煤油中,D符合题意;
故选 D。
(2)
钠的性质活泼,易与空气中的氧气反应生成Na2O,反应方程式为:4Na+O2=2Na2O,Na2O可与水反应生成NaOH,反应方程式为:Na2O+ H2O= 2NaOH, NaOH与空气中的水和CO2反应生成Na2CO3·xH2O,Na2CO3·xH2O风化脱水生成Na2CO3,D符合题意;
故选 D。|
(3)
钠与氧气在加热条件下反应生成淡黄色过氧化钠,化学方程式为2Na+O2Na2O2;
将该试管冷却后直立,滴加几滴水,过氧化钠与水反应生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑;呼吸面具利用呼出的二氧化碳和水分别与过氧化钠反应,呼出的二氧化碳与过氧化钠反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=Na2CO3+O2,呼出的水蒸气与过氧化钠反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;
12. 除去氯气中的水蒸气(或干燥氯气) 装置中的有色布条不褪色,装置中的有色布条褪色 没有尾气吸收装置
【分析】气体a的主要成分是含有少量水蒸气的氯气,经过浓硫酸后,水蒸气被吸收,干燥的有色布条不褪色,氯气可以使湿润的有色布条褪色,最后补充装置,用碱液吸收尾气,由此分析。
【详解】(1)探究氯气能否与水发生反应,应先除去氯气中的水蒸气,浓硫酸起到干燥氯气的作用;
(2)装置B中的有色布条不褪色,说明干燥的氯气不能使有色布条褪色,装置中的有色布条褪色,说明氯气与水反应后的生成物使有色布条褪色;
(3)氯气有毒,为防止空气污染,应该有尾气吸收装置,可用碱溶液吸收氯气,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O。
13. D 吸收尾气,防止污染空气 Cl2 + SO2 + 2H2O =2HCl + H2SO4
【分析】装置A没有加热装置,则为制取SO2的装置,之后将SO2通入品红溶液,检验SO2的漂白性,然后用NaOH溶液吸收;装置B为制取氯气的装置,通入品红溶液检验氯气水溶液的漂白性,然后用NaOH溶液吸收。
【详解】(1)氯气溶于水后生成具有漂白性的HClO,HClO的漂白为永久性漂白,SO2的漂白可以恢复,所以D试管中无明显现象;
(2)氯气和SO2都会污染空气,都能和NaOH溶液反应,所以装置C的作用是吸收尾气,防止污染空气;
(3) Cl2 与 SO21:1混合后发生氧化还原反应,生成两种没有漂白作用的酸,应为HCl和H2SO4,化学方程式为 Cl2 + SO2 + 2H2O =2HCl + H2SO4。
14.(1) MnO2 + 4H+ +2Cl-Mn2+ + Cl2↑ + 2H2O Cl2 + 2H2O = Cl- +ClO-+ H2O
(2) 不能 Cl2中混有的HCl与NaOH反应降低NaClO的产率与纯度
(3)避免生成NaClO3
(4) 除去Cl2中的H2O 不能 b中干燥有色布条不褪色 c中红色鲜花褪色 Cl2 本身没有漂白性
【分析】根据装置图可知,装置A中二氧化锰和浓盐酸在加热条件下反应生成氯气,因浓盐酸具有挥发性,制得的氯气中混有HCl气体,则用B中的饱和食盐水除去氯气中混有的HCl,C中浓硫酸用于干燥氯气,氯气再与NaOH反应生成氯化钠、次氯酸钠和水
【详解】(1)A中二氧化锰和浓盐酸在加热条件下反应生成氯气,离子方程式为MnO2 + 4H+ +2Cl-Mn2+ + Cl2↑ + 2H2O,D中氯气与NaOH反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2H2O =Cl-+ClO-+H2O;
(2)装置B中的饱和食盐水除去氯气中混有的HCl,若省去则HCl会与NaOH反应降低NaClO的产率和纯度,故不能省去;
(3)由题干可知,氯气与水的反应是放热反应,而在加热条件下,氯气和NaOH反应生成氯化钠、氯酸钠和水,故采用冰水浴冷却的目的是避免生成KClO3;
(4)①装置a中浓硫酸具有吸水性,作用为除去氯气中的水。干燥的氯气没有漂白性,若省去a装置,则b中红色布条将褪色,无法检验氯气的性质;
②干燥的氯气没有漂白性,则b中干燥的红色布条不褪色,湿润的氯气有漂白性,则c中红色鲜花褪色,对比b、c中现象可以得到的结论是Cl2本身没有漂白性,是其与水反应生成的HClO有漂白性。
15. H2O CO2 O2 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【分析】根据关系,C和A反应生成D和F,C与B反应生成D和E,D为单质,在中学阶段应是过氧化钠与H2O、CO2的反应,推出C为Na2O2,D为O2,B为CO2,A为H2O,E为Na2CO3,F为NaOH,据此分析;
【详解】根据关系,C和A反应生成D和F,C与B反应生成D和E,D为单质,在中学阶段应是过氧化钠与H2O、CO2的反应,推出C为Na2O2,D为O2,B为CO2,A为H2O,E为Na2CO3,F为NaOH,
(1)根据上述分析,A为H2O,B为CO2,D为O2;
(2)过氧化钠的电子式为;
(3)Na2CO3→NaOH,发生的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
16. MgSO4 BaCl2 AgNO3 Ba2++=BaSO4↓ Mg(OH)2+2H+=Mg2++2H2O Ag+ + Cl- = AgCl↓
【分析】反应①为X+Ba(NO3)2→Mg(NO3)2,根据复分解反应发生的条件可知,X为镁盐,由反应②可知Y为Mg(OH)2,由反应③可知Z为MgCl2,根据反应⑤可知X为MgSO4,试剂甲为BaCl2,根据反应④可知,试剂乙为AgNO3。
【详解】(1)由分析可知,X为MgSO4,试剂甲为BaCl2,试剂乙为AgNO3;
(2)反应①是MgSO4和Ba(NO3)2的反应,离子方程式为Ba2++=BaSO4↓;
反应③是Mg(OH)2和HCl的反应,离子方程式为Mg(OH)2+2H+=Mg2++2H2O;
反应④是为MgCl2和AgNO3的反应,离子方程式为Ag+ + Cl- = AgCl↓。
17.(1) CuSO4 Na2CO3
(2)
(3)取少量A溶液于试管中,先加硝酸银溶液有白色沉淀生成再加稀硝酸,沉淀不溶解,则证明A中阴离子为Cl
【分析】8种离子形成四种可溶性物质,其中Ag+不能和、Cl 、三种离子结合,而只能和结合,Ba2+不能和、结合,而只能和、Cl ,则四种物质中一定有BaCl2、AgNO3;Cu2+不能和结合,只能形成CuSO4;Na+对应为Na2CO3,则四种可溶性物质分别为BaCl2、AgNO3、CuSO4、Na2CO3:①四种盐中只有C盐溶液是蓝色的,则C为CuSO4;②向四种物质的溶液中加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出,则B为AgNO3,D为Na2CO3;A为BaCl2,据此分析解。
(1)
由上述分析可知C为CuSO4,D为Na2CO3;
故答案为CuSO4,Na2CO3;
(2)
A为BaCl2,D为Na2CO3,A与C反应的离子方程式;
故答案为;
(3)
A溶液中阴离子为Cl ,检验Cl 的试剂是稀硝酸和硝酸银溶液,具体检验方法是:取少量A溶液于试管中,先加硝酸银溶液有白色沉淀生成再加稀硝酸,沉淀不溶解,则证明A中阴离子为Cl ;
故答案为取少量A溶液于试管中,先加硝酸银溶液有白色沉淀生成再加稀硝酸,沉淀不溶解,则证明A中阴离子为Cl 。
【点睛】本题考查常见离子的性质及检验、无机物的推断及方程式的书写、物质的分类等知识,侧重分析能力、推断能力和灵活运用能力的考查,把握常见离子的性质、离子之间的反应、离子的推断为解答的关键。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列离子方程式的书写正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
B.FeO和稀硝酸的反应:FeO+2H+=Fe2++H2O
C.将Na投入到CuSO4溶液中:2Na+Cu2+=2Na++Cu
D.向Ba(OH)2溶液中滴加NaHSO4溶液,至混合溶液恰好为中性:Ba2++2OH-+2H++SO=BaSO4↓+2H2O
2.下列离子方程式正确的是
A.钠与冷水反应:
B.Fe加到溶液中:
C.氧化铜与盐酸混合:
D.氯气与水反应:
3.下列叙述正确的是
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀
③钠在常温下不容易被氧化
④Na2O2可作供氧剂,而Na2O不行
⑤石蕊试液中加入Na2O2粉末,先变蓝后褪色,并有气泡生成
⑥钠与浓NaCl溶液反应,放出的气体是H2
A.都正确 B.②③④⑤ C.②⑤⑥ D.④⑤⑥
4.将26.3g样品在900℃下煅烧,样品受热过程的热重曲线(样品质量随温度变化的曲线)如图所示。已知:L→N时失掉全部的结晶水。下列说法错误的是
A.
B.固体M的化学式为
C.生成固体P时,样品的失重率约为71.5%
D.固体Q的化学式为NiO
5.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入Na2CO3粉末,有气泡产生,说明氯水中含有H+
D.氯水的性质很稳定,保存在无色试剂瓶中
6.在空气中不易变质的是
A.Na2SO3 B.NaHSO4 C.亚硫酸 D.次氯酸
7.下列实验过程中,不会产生气体的是
A. B.
C. D.
8.检验氯化氢气体中是否混有Cl2,可采用的方法是( )
A.用干燥的蓝色石蕊试纸 B.用干燥有色布条
C.将气体通入AgNO3溶液 D.用湿润的淀粉碘化钾试纸
9.下列叙述正确的是
A.漂白粉中的有效成分是Ca(ClO)2和CaCl2
B.光照新制氯水能够放出氧气
C.溶液和胶体的本质区别是有无丁达尔效应
D.干燥的氯气不能使鲜花褪色
二、填空题
10.A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则A的化学式为_______B的化学式为_______。
(2)A→C反应的化学方程式为_______。
(3)A与水反应的化学方程式_______。
(4)C可用于呼吸面具或潜水艇中氧气的来源,写出所发生的化学方程式 _______。从氧化剂和还原剂的角度分析,在这个反应中C的作用是_______。
11.早前金属钠是由电解熔融碳酸钠制得的。直到1921年实现了电解熔融氯化钠制钠,其反应原理是。回答下列有关单质钠的问题:
(1)下列保存金属钠的方法正确的是___________。
A.放在棕色瓶中 B.放在细沙中 C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后产物的主要成分是___________。
A. B. C.NaOH D.
(3)将小块钠放在水平放置的试管中部,用酒精灯加热使其充分反应(如图I所示,夹持装置已略去),生成物的颜色为___________,请写出该反应的化学方程式:___________。将该试管冷却后直立,滴加几滴水(如图II所示),发生反应的化学方程式为___________。呼吸面具中通常也会用到该生成物,请用化学方程式表示反应原理___________。
三、实验题
12.某同学设计如图所示装置探究氯气能否与水发生反应。已知气体a的主要成分是含有少量水蒸气的氯气。请回答下列问题:
(1)浓硫酸的作用是_________。
(2)证明氯气和水发生反应的实验现象为__________。
(3)该实验设计存在的缺陷是______,为了克服该缺陷,需要补充装置,其中发生反应的离子方程式为______。
13.某化学小组为了证明二氧化硫和氯气的漂白性,设计了如图所示的实验装置:
他们制备二氧化硫和氯气所依据的原理分别是:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
(1)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热_______ (填" B”或“D")试管中无明显现象。
(2)装置C的作用是_______;
(3)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是:_______。
14.84消毒液的有效成分是NaClO,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备NaClO,并探究氯气的性质。经查阅到资料可知:“氯气与水的反应是放热反应,在加热条件下氯气与碱液发生如下反应:3Cl2+6NaOH5NaCl+NaClO3+3H2O。
回答下列问题:
(1)装置A、D中发生反应的离子方程式分别为:A:_______;D:_______;
(2)装置B能否省去的_______(填“能”或“不能”),理由是_______;
(3)装置D中采用冰水浴冷却的目的是_______。
(4)如图是检验Cl2性质的装置图示,完成下列问题。
①装置a中浓H2SO4的作用是_______;该装置能否省去_______(填“能”“不能)
②装置b、c实验现象分别为:b_______;c_______;对比b和c中现象得出的结论是_______。
四、元素或物质推断题
15.如图A、B、C、D、E、F六种物质中除D为单质外其余均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如图所示。
请回答下列问题。
(1)A、B、D的化学式是:A__________,B__________,D________;
(2)C的电子式是____________________;
(3)E和F可相互转化,图中已标明F向E转化的关系,请写出E转化为F的化学方程式:____________________。
16.X、Y、Z三种物质有如图所示转化关系,其中X与稀盐酸不反应:
(1)根据上述转化关系,推断下列物质的化学式:
X____;试剂甲:_____,试剂乙:_____
(2)写出下列各步反应的离子方程式:
①______;③______;④_____
17.A、B、C、D为四种可溶性的盐,它们包含的阳离子和阴离子分别为、、、和、、、(离子在物质中不能重复出现)。
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据实验事实可推断:
(1)化学式为:C_______、D_______;
(2)A与C反应的离子方程式_______;
(3)A溶液中阴离子的检验方法_______。
参考答案:
1.D
【详解】A.FeCl3溶液与Cu反应生成FeCl2和CuCl2,选项中的离子方程式没有配平,正确的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故A错误;
B. FeO有还原性,HNO3有强氧化性,FeO和稀硝酸发生氧化还原反应:3FeO+10H++NO=3Fe3++5H2O+NO↑,故B错误;
C.将Na投入到CuSO4溶液中,Na先和水反应生成NaOH和氢气,然后生成的NaOH再和硫酸铜反应生成氢氧化铜沉淀:2Na+2H2O=2Na++2OH-+H2↑、Cu2++2OH-=Cu(OH)2↓,故C错误;
D.向Ba(OH)2溶液中滴加NaHSO4溶液,至混合溶液恰好为中性,Ba(OH)2和NaHSO4的物质的量之比为1:2:Ba2++2OH-+2H++SO=BaSO4↓+2H2O,故D正确;
故选D。
2.C
【详解】A.钠与冷水反应,生成NaOH和H2,离子方程式为:,A不正确;
B.Fe加到溶液中,生成FeSO4和Cu,离子方程式为:,B不正确;
C.氧化铜与盐酸混合,生成CuCl2和H2O,离子方程式为:,C正确;
D.氯气与水反应,生成盐酸和次氯酸,次氯酸为弱酸,离子方程式为:,D不正确;
故选C。
3.D
【详解】①碱性氧化物与水反应只生成碱,Na2O和水反应只生成碱,是碱性氧化物;Na2O2和水反应生成氢氧化钠和氧气,不是碱性氧化物,①错误;
②Na2CO3溶液和CaCl2溶液反应得到碳酸钙沉淀,NaHCO3溶液与CaCl2溶液不反应,无沉淀生成,②错误;
③钠的性质活泼,在常温下易被氧化生成氧化钠,③错误;
④Na2O2能与二氧化碳反应生成碳酸钠和氧气,Na2O2能与水反应生成氢氧化钠和氧气;而Na2O与二氧化碳和水反应不会产生氧气,因此Na2O2可作供氧剂,而Na2O不行,④正确;
⑤Na2O2粉末与水反应生成氢氧化钠和氧气,所得溶液呈碱性,使石蕊试液变蓝;过氧化钠具有强的氧化性,具有漂白性,可以使石蕊试液褪色,所以石蕊试液中加入Na2O2粉末,先变蓝后褪色,并有气泡生成,⑤正确;
⑥钠与浓的NaCl溶液反应,实质是钠和水反应生成氢氧化钠和氢气,⑥正确;
综上,④⑤⑥正确,答案选D。
4.D
【详解】A.L→N时失掉全部的结晶水,则分解反应为=+,根据图像可知,L→N剩余固体质量是15.5,失去结晶水的质量是26.3-15.5=10.8,则根据~建立等式,,解得n=6,A项正确;
B.L→M时失掉结晶水的质量是3.6g,则失去2个结晶水,则固体M的化学式为,B项正确;
C.失重率等于固体失去的质量与原固体质量的比值,则生成固体P时,样品的失重率=×100%≈71.5%,C项正确;
D.N→P失重后,根据质量比例,可知发生的反应是=NiO+SO3↑,的摩尔质量是155,NiO 的摩尔质量是75,所以P→Q固体质量上升,应该是NiO 被氧化得到NiO2,D项错误。
故答案选D。
5.D
【分析】氯气溶于水,与水发生反应:Cl2+H2OHCl+HClO,氯水中含有氯离子、氢离子、次氯酸根离子、次氯酸、少量氢氧根离子,只有氯气有颜色,为黄绿色,氯水中含有氯气而呈浅黄绿色,溶液中HCl与硝酸银反应产生AgCl白色沉淀,而溶液呈酸性,能与碳酸钠反应生成二氧化碳,溶液中HClO不稳定,光照容易分解。
【详解】A.氯气溶于水,与水发生反应:Cl2+H2OHCl+HClO,氯水中含有氯离子、氢离子、次氯酸根离子、次氯酸、少量氢氧根离子,只有氯气有颜色,为黄绿色,所以氯水的颜色呈浅黄绿色,说明氯水中含有Cl2,A正确;
B.氯水与硝酸银溶液反应产生白色沉淀,只能是Cl-与Ag+反应得到AgCl白色沉淀,说明氯水中含有Cl-,B正确;
C.溶液呈酸性,含有盐酸和次氯酸,次氯酸的酸性比碳酸弱,盐酸与与碳酸钠反应生成二氧化碳,C正确;
D.溶液中含有的HClO不稳定,光照分解产生HCl和O2,所以为防止氯水变质,要把氯水盛放在棕色试剂瓶中,D错误;
故合理选项是D。
【点睛】本题考查氯水的性质,掌握氯气与水的反应,判断氯水中含有的微粒及各种物质的性质是本题解答的关键,侧重考查元素化合物知识的综合理解和运用。
6.B
【详解】A. Na2SO3具有还原性,能被空气中的O2氧化生成Na2SO4而变质,A错误;
B. NaHSO4在空气中能稳定存在,B正确;
C.亚硫酸具有还原性,能被空气中的O2氧化生成H2SO4而变质,C错误;
D.次氯酸见光分解生成HCl和O2而变质,D错误;
故答案选B。
7.A
【详解】A.氯水中的Cl2与NaOH溶液反应生成NaCl、NaClO和水,不会生成气体,故A符合题意;
B.新制氯水中含有HCl,NaHCO3和HCl反应生成CO2气体,故B不符合题意;
C.新制氯水中含有HClO,光照条件下HClO分解生成O2,故C不符合题意;
D.Na2O2与水反应生成O2,故D不符合题意;
答案选A。
8.D
【详解】A.干燥的氯气没有漂白性,且干燥的HCl气体也不能电离出氢离子,无论HCl气体中是否含有氯气,都不会使干燥的蓝色石蕊试纸发生颜色变化,故A错误;
B.干燥的氯气不具有漂白性,无论是否含有氯气都不能使干燥的有色布条发生颜色变化,故B错误;
C.无论是否含有氯气,气体通入硝酸银溶液中均会产生沉淀,故C错误;
D.HCl气体不能使湿润的淀粉碘化钾试纸变色,当混有氯气时,氯气具有强氧化性,可以将碘离子氧化成碘单质,从而使试纸变蓝,故D正确;
故答案为D。
9.B
【详解】A.漂白粉中的主要成分是Ca(ClO)2和CaCl2,有效成分是Ca(ClO)2,A错误;
B.新制的氯水主要是氯气分子、水分子、HCl、HClO在光照条件下HClO会发生分解反应方程式如下:2HClO2HCl+O2↑,B正确;
C.溶液和胶体的本质区别是分散质粒子直径大小不同,C错误;
D.干燥氯气不能使干燥的有色物质褪色,但鲜花中含有水,因此干燥的氯气能使鲜花褪色,D错误;
故选B。
10.(1) Na Na2O
(2)2Na+O2Na2O2
(3)↑
(4) 2Na2O2+2CO2=2Na2CO3+O2 既是氧化剂又是还原剂
【分析】A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下:;若A是一种金属,C是淡黄色固体,可知C为过氧化钠,A为金属钠,B为氧化钠,据以上分析解答。
(1)
由分析可知,C为过氧化钠,A为金属钠,B为氧化钠,A的化学式为Na;B的化学式为Na2O;
(2)
A为金属钠,C为过氧化钠,A→C反应的化学方程式为:2Na+O2Na2O2;
(3)
A为金属钠,Na与水反应的化学方程式↑;
(4)
C是淡黄色固体,可用于呼吸面具或潜水艇中氧气的来源,反应原理是过氧化钠与二氧化碳生成氧气,反应方程式:2Na2O2+2CO2=2Na2CO3+O2;该反应中,Na2O2中-1价的氧部分升高到0价,部分降低到-1价,本身既是氧化剂又是还原剂。
11.(1)D
(2)D
(3) 淡黄色 2Na+O2Na2O2 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=Na2CO3+O2和2Na2O2+2H2O=4NaOH+O2↑
【解析】(1)
钠的化学性质活泼,易与O2、H2O等反应,应密封保存,钠的密度比煤油大,可保存在煤油中,D符合题意;
故选 D。
(2)
钠的性质活泼,易与空气中的氧气反应生成Na2O,反应方程式为:4Na+O2=2Na2O,Na2O可与水反应生成NaOH,反应方程式为:Na2O+ H2O= 2NaOH, NaOH与空气中的水和CO2反应生成Na2CO3·xH2O,Na2CO3·xH2O风化脱水生成Na2CO3,D符合题意;
故选 D。|
(3)
钠与氧气在加热条件下反应生成淡黄色过氧化钠,化学方程式为2Na+O2Na2O2;
将该试管冷却后直立,滴加几滴水,过氧化钠与水反应生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑;呼吸面具利用呼出的二氧化碳和水分别与过氧化钠反应,呼出的二氧化碳与过氧化钠反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=Na2CO3+O2,呼出的水蒸气与过氧化钠反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;
12. 除去氯气中的水蒸气(或干燥氯气) 装置中的有色布条不褪色,装置中的有色布条褪色 没有尾气吸收装置
【分析】气体a的主要成分是含有少量水蒸气的氯气,经过浓硫酸后,水蒸气被吸收,干燥的有色布条不褪色,氯气可以使湿润的有色布条褪色,最后补充装置,用碱液吸收尾气,由此分析。
【详解】(1)探究氯气能否与水发生反应,应先除去氯气中的水蒸气,浓硫酸起到干燥氯气的作用;
(2)装置B中的有色布条不褪色,说明干燥的氯气不能使有色布条褪色,装置中的有色布条褪色,说明氯气与水反应后的生成物使有色布条褪色;
(3)氯气有毒,为防止空气污染,应该有尾气吸收装置,可用碱溶液吸收氯气,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O。
13. D 吸收尾气,防止污染空气 Cl2 + SO2 + 2H2O =2HCl + H2SO4
【分析】装置A没有加热装置,则为制取SO2的装置,之后将SO2通入品红溶液,检验SO2的漂白性,然后用NaOH溶液吸收;装置B为制取氯气的装置,通入品红溶液检验氯气水溶液的漂白性,然后用NaOH溶液吸收。
【详解】(1)氯气溶于水后生成具有漂白性的HClO,HClO的漂白为永久性漂白,SO2的漂白可以恢复,所以D试管中无明显现象;
(2)氯气和SO2都会污染空气,都能和NaOH溶液反应,所以装置C的作用是吸收尾气,防止污染空气;
(3) Cl2 与 SO21:1混合后发生氧化还原反应,生成两种没有漂白作用的酸,应为HCl和H2SO4,化学方程式为 Cl2 + SO2 + 2H2O =2HCl + H2SO4。
14.(1) MnO2 + 4H+ +2Cl-Mn2+ + Cl2↑ + 2H2O Cl2 + 2H2O = Cl- +ClO-+ H2O
(2) 不能 Cl2中混有的HCl与NaOH反应降低NaClO的产率与纯度
(3)避免生成NaClO3
(4) 除去Cl2中的H2O 不能 b中干燥有色布条不褪色 c中红色鲜花褪色 Cl2 本身没有漂白性
【分析】根据装置图可知,装置A中二氧化锰和浓盐酸在加热条件下反应生成氯气,因浓盐酸具有挥发性,制得的氯气中混有HCl气体,则用B中的饱和食盐水除去氯气中混有的HCl,C中浓硫酸用于干燥氯气,氯气再与NaOH反应生成氯化钠、次氯酸钠和水
【详解】(1)A中二氧化锰和浓盐酸在加热条件下反应生成氯气,离子方程式为MnO2 + 4H+ +2Cl-Mn2+ + Cl2↑ + 2H2O,D中氯气与NaOH反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2H2O =Cl-+ClO-+H2O;
(2)装置B中的饱和食盐水除去氯气中混有的HCl,若省去则HCl会与NaOH反应降低NaClO的产率和纯度,故不能省去;
(3)由题干可知,氯气与水的反应是放热反应,而在加热条件下,氯气和NaOH反应生成氯化钠、氯酸钠和水,故采用冰水浴冷却的目的是避免生成KClO3;
(4)①装置a中浓硫酸具有吸水性,作用为除去氯气中的水。干燥的氯气没有漂白性,若省去a装置,则b中红色布条将褪色,无法检验氯气的性质;
②干燥的氯气没有漂白性,则b中干燥的红色布条不褪色,湿润的氯气有漂白性,则c中红色鲜花褪色,对比b、c中现象可以得到的结论是Cl2本身没有漂白性,是其与水反应生成的HClO有漂白性。
15. H2O CO2 O2 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【分析】根据关系,C和A反应生成D和F,C与B反应生成D和E,D为单质,在中学阶段应是过氧化钠与H2O、CO2的反应,推出C为Na2O2,D为O2,B为CO2,A为H2O,E为Na2CO3,F为NaOH,据此分析;
【详解】根据关系,C和A反应生成D和F,C与B反应生成D和E,D为单质,在中学阶段应是过氧化钠与H2O、CO2的反应,推出C为Na2O2,D为O2,B为CO2,A为H2O,E为Na2CO3,F为NaOH,
(1)根据上述分析,A为H2O,B为CO2,D为O2;
(2)过氧化钠的电子式为;
(3)Na2CO3→NaOH,发生的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
16. MgSO4 BaCl2 AgNO3 Ba2++=BaSO4↓ Mg(OH)2+2H+=Mg2++2H2O Ag+ + Cl- = AgCl↓
【分析】反应①为X+Ba(NO3)2→Mg(NO3)2,根据复分解反应发生的条件可知,X为镁盐,由反应②可知Y为Mg(OH)2,由反应③可知Z为MgCl2,根据反应⑤可知X为MgSO4,试剂甲为BaCl2,根据反应④可知,试剂乙为AgNO3。
【详解】(1)由分析可知,X为MgSO4,试剂甲为BaCl2,试剂乙为AgNO3;
(2)反应①是MgSO4和Ba(NO3)2的反应,离子方程式为Ba2++=BaSO4↓;
反应③是Mg(OH)2和HCl的反应,离子方程式为Mg(OH)2+2H+=Mg2++2H2O;
反应④是为MgCl2和AgNO3的反应,离子方程式为Ag+ + Cl- = AgCl↓。
17.(1) CuSO4 Na2CO3
(2)
(3)取少量A溶液于试管中,先加硝酸银溶液有白色沉淀生成再加稀硝酸,沉淀不溶解,则证明A中阴离子为Cl
【分析】8种离子形成四种可溶性物质,其中Ag+不能和、Cl 、三种离子结合,而只能和结合,Ba2+不能和、结合,而只能和、Cl ,则四种物质中一定有BaCl2、AgNO3;Cu2+不能和结合,只能形成CuSO4;Na+对应为Na2CO3,则四种可溶性物质分别为BaCl2、AgNO3、CuSO4、Na2CO3:①四种盐中只有C盐溶液是蓝色的,则C为CuSO4;②向四种物质的溶液中加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出,则B为AgNO3,D为Na2CO3;A为BaCl2,据此分析解。
(1)
由上述分析可知C为CuSO4,D为Na2CO3;
故答案为CuSO4,Na2CO3;
(2)
A为BaCl2,D为Na2CO3,A与C反应的离子方程式;
故答案为;
(3)
A溶液中阴离子为Cl ,检验Cl 的试剂是稀硝酸和硝酸银溶液,具体检验方法是:取少量A溶液于试管中,先加硝酸银溶液有白色沉淀生成再加稀硝酸,沉淀不溶解,则证明A中阴离子为Cl ;
故答案为取少量A溶液于试管中,先加硝酸银溶液有白色沉淀生成再加稀硝酸,沉淀不溶解,则证明A中阴离子为Cl 。
【点睛】本题考查常见离子的性质及检验、无机物的推断及方程式的书写、物质的分类等知识,侧重分析能力、推断能力和灵活运用能力的考查,把握常见离子的性质、离子之间的反应、离子的推断为解答的关键。
