2023年高一化学必修一第四章第三节1硫课件(共21张PPT)
文档属性
| 名称 | 2023年高一化学必修一第四章第三节1硫课件(共21张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-09 00:00:00 | ||
图片预览








文档简介
(共21张PPT)
3 硫和氮的氧化物
第四章 非金属及其化合物
2023年高一化学必修一
一、硫原子结构
最外层电子数是6
具有弱氧化性
结构
S
易得到2个电子,显-2价
决 定
S元素常见价态:
0
-2
+4
+6
2
8
6
+16
性质
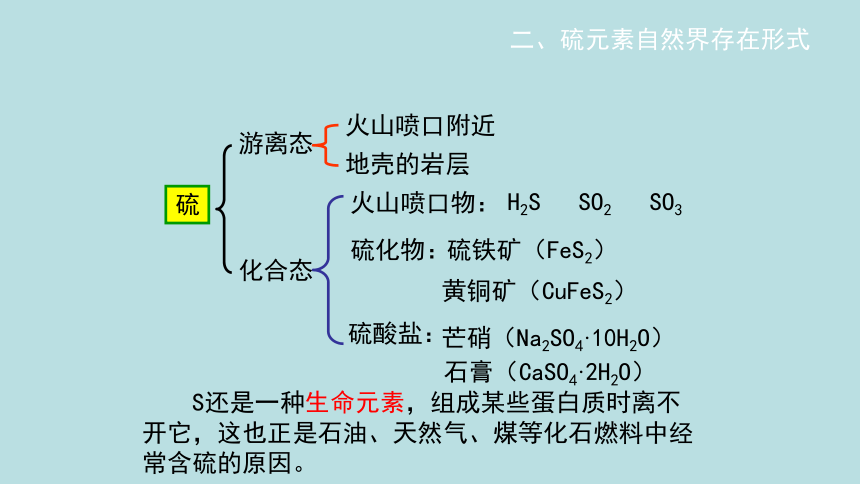
硫
游离态
化合态
火山喷口附近
地壳的岩层
硫化物:
硫酸盐:
石膏(CaSO4·2H2O)
黄铜矿(CuFeS2)
H2S SO2 SO3
二、硫元素自然界存在形式
芒硝(Na2SO4·10H2O)
硫铁矿(FeS2)
火山喷口物:
S还是一种生命元素,组成某些蛋白质时离不开它,这也正是石油、天然气、煤等化石燃料中经常含硫的原因。
1、物理性质
俗称:
色态:
质地:
溶解度:
密度:
熔沸点:
思考:试管壁上有硫附着应如何洗涤?
黄色晶体
脆,易研成粉末
不溶于水,微溶于酒精,易溶于二硫化碳(CS2)。
密度比水大
熔沸点低(112.8℃,444.6 ℃)
三、硫(S)
硫黄
可用CS2洗涤
2、化学性质
(1)与金属的反应
钠与硫
铁与硫
铜与硫
汞与硫
总结:硫单质的氧化性比较弱,只能把具有变价的金属单质氧化到低价态的硫化物。(与Cl2的比较)
三、硫(S)
Fe + S = FeS
Δ
2Cu + S = Cu2S
Δ
硫化亚铁,黑色
硫化亚铜,黑色
Hg + S = HgS
除去有毒Hg的办法
既有氧化性,又有还原性
2Na + S = Na2S
Δ
2、化学性质
(2)与非金属的反应
S + O2 = SO2
0
+4
①S作氧化剂
空气:发出淡蓝色火焰
点燃
三、硫(S)
纯氧:发出蓝紫色火焰
S + H2 = H2S
Δ
②S作还原剂
0
-2
四、二氧化硫(SO2)
1、物理性质
颜色:
气味:
毒性:
溶解性:
密度:
易液化
无色
实验室收集SO2只用向上排空气法
刺激性气味
有毒
大于空气
易溶于水(1:40)
水:气体 H2O :Cl2 H2O :SO2 H2O :HCl
体积比
溶解性
1:2
可溶
1:40
易溶
1:500
极易溶
四、二氧化硫(SO2)
实验4-7[P90:观察并思考]
①实验中原盛有SO2气体的试管水位有什么变化?说明了什么?
——试管内水位上升;说明SO2易溶水
②用pH值试纸检验试管内水溶液酸碱性。
——试纸变红色,溶液呈酸性
③向试管中水溶液滴加品红溶液,振荡,观察颜色变化?加热试管,再观察有什么变化?
——使品红溶液的红色褪去;加热后,溶液又恢复红色。
这是检验SO2的方法之一。
2、化学性质
(1)漂白性
①漂白原理:
②漂白特性
可逆性:
选择性:
③应用:
SO2与有色物质结合成不稳定的无色物质
工业上漂白纸浆、毛、丝、草帽辫
无色物质容易分解而使有色物质恢复原来的颜色。
不能结合个别有机物(例如石蕊)而使之褪色。
四、二氧化硫(SO2)
四、二氧化硫(SO2)
北京市场黄白两种银耳对比 中央电视台《生活》栏目
探讨:你学过的哪些物质具有漂白性?
活性炭
Na2O2
氯水
物理吸附
氧化漂白
漂白原理是否相同?
思考:久置的草帽、纸张为什么会泛黄?
四、二氧化硫(SO2)
化合漂白
SO2
永久漂白
暂时漂白
永久漂白
四、二氧化硫(SO2)
2、化学性质
(2)通性——具有酸性氧化物的性质
① 与水反应
SO2能溶于水,并能与水反应生成亚硫酸
H2SO3不稳定,容易分解
二氧化硫溶于水是一个可逆反应
可逆反应:在相同条件下,既能向正反应方向进行、又能向逆反应方向进行的反应。
SO2 + H2O H2SO3
(弱酸,但强于碳酸)
H2SO3 = SO2↑ + H2O
SO2 + H2O = H2SO3
H2SO3的酸酐
四、二氧化硫(SO2)
思考: 2H2O 通电 2H2↑ + O2↑与 2H2 + O2 点燃 2H2O
是可逆反应吗?
CO2溶于水也是一个可逆反应:
Cl2溶于水也是一个可逆反应:
CO2 + H2O H2CO3
Cl2 + H2O HCl + HClO
不是,两个反应条件不同
四、二氧化硫(SO2)
② 与碱反应
与氢氧化钠溶液反应:
SO2少量:
SO2过量:
与澄清石灰水反应:
SO2少量:
SO2过量:
使澄清石灰水先变浑浊后变澄清的气体,除CO2外,还可能是SO2 。
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Na2SO3 + H2O
SO2 + Ca(OH)2 = CaSO3↓ + H2O
2SO2 + Ca(OH)2 = Ca(HSO3)2
实验室吸收SO2尾气
( SO2 + Na2SO3 + H2O = 2NaHSO3 )
( SO2 + CaSO3 + H2O = Ca(HSO3)2 )
③ 与碱性氧化物反应
与Na2O反应:
与CaO反应:
SO2 + CaO = CaSO3
高温
——石灰法脱硫,可以在煤中加入生石灰,防治大气污染。
SO2 + Na2O = Na2SO3
四、二氧化硫(SO2)
四、二氧化硫(SO2)
(3)具有较强的还原性
①SO2的催化氧化
②被X2(卤素单质)氧化
③被KMnO4(H+)氧化
(4)具有氧化性
SO2 + CI2 + 2H2O = H2SO4 + 2HCl
2SO2 + O2 2SO3
催化剂
△
(X2还可以是Br2、I2)
(SO2与Cl2混合,因发生反应而失去漂白能力)
SO2能使氯水、溴水和酸性KMnO4溶液褪色,可用此法检验SO2
SO2 + 2H2S = 3S↓ + 2H2O
氧化剂
还原剂
五、硫化氢(H2S)
[资料卡片]p91
1、物理性质:
2、化学性质:
无色、有臭鸡蛋气味、有毒气体,是一种大气污染物。
①还原性:
2H2S + SO2 = 3S + 2H2O
2H2S + 3O2 = 2SO2 + 2H2O
点燃
②可燃性:
③不稳定性:
H2S = S + H2
Δ
六、三氧化硫(SO3)
1、物理性质
2、化学性质
SO3 + H2O = H2SO4
(工业制硫酸)
SO3 + CaO = CaSO4
SO3 + Ca(OH)2 = CaSO4 + H2O
——酸性氧化物
无色易挥发的晶体,熔沸点很低,熔点16.8°C,沸点44.8°C
H2SO4的酸酐
2.下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味 C、通入澄清石灰水 D、通入品红溶液中
B D
1.氯气和二氧化硫皆可做漂白剂,若用两者以1:1的物质的量一起漂白一种有色物质时,漂白效果会( )
A. 增强 B. 不变 C. 减弱 D. 难确定
C
SO2 + Cl2 + 2H2O = 2HCl + H2SO4
随堂练习
随堂练习
3、检验混合气体(SO2和CO2)中存在CO2的方法:
SO2和CO2
品红溶液
酸性KMnO4溶液
品红溶液
澄清石灰水
(混合气体)
(证明有SO2)
(除去SO2)
(验证是否除尽SO2)
(检验CO2)
3 硫和氮的氧化物
第四章 非金属及其化合物
2023年高一化学必修一
一、硫原子结构
最外层电子数是6
具有弱氧化性
结构
S
易得到2个电子,显-2价
决 定
S元素常见价态:
0
-2
+4
+6
2
8
6
+16
性质
硫
游离态
化合态
火山喷口附近
地壳的岩层
硫化物:
硫酸盐:
石膏(CaSO4·2H2O)
黄铜矿(CuFeS2)
H2S SO2 SO3
二、硫元素自然界存在形式
芒硝(Na2SO4·10H2O)
硫铁矿(FeS2)
火山喷口物:
S还是一种生命元素,组成某些蛋白质时离不开它,这也正是石油、天然气、煤等化石燃料中经常含硫的原因。
1、物理性质
俗称:
色态:
质地:
溶解度:
密度:
熔沸点:
思考:试管壁上有硫附着应如何洗涤?
黄色晶体
脆,易研成粉末
不溶于水,微溶于酒精,易溶于二硫化碳(CS2)。
密度比水大
熔沸点低(112.8℃,444.6 ℃)
三、硫(S)
硫黄
可用CS2洗涤
2、化学性质
(1)与金属的反应
钠与硫
铁与硫
铜与硫
汞与硫
总结:硫单质的氧化性比较弱,只能把具有变价的金属单质氧化到低价态的硫化物。(与Cl2的比较)
三、硫(S)
Fe + S = FeS
Δ
2Cu + S = Cu2S
Δ
硫化亚铁,黑色
硫化亚铜,黑色
Hg + S = HgS
除去有毒Hg的办法
既有氧化性,又有还原性
2Na + S = Na2S
Δ
2、化学性质
(2)与非金属的反应
S + O2 = SO2
0
+4
①S作氧化剂
空气:发出淡蓝色火焰
点燃
三、硫(S)
纯氧:发出蓝紫色火焰
S + H2 = H2S
Δ
②S作还原剂
0
-2
四、二氧化硫(SO2)
1、物理性质
颜色:
气味:
毒性:
溶解性:
密度:
易液化
无色
实验室收集SO2只用向上排空气法
刺激性气味
有毒
大于空气
易溶于水(1:40)
水:气体 H2O :Cl2 H2O :SO2 H2O :HCl
体积比
溶解性
1:2
可溶
1:40
易溶
1:500
极易溶
四、二氧化硫(SO2)
实验4-7[P90:观察并思考]
①实验中原盛有SO2气体的试管水位有什么变化?说明了什么?
——试管内水位上升;说明SO2易溶水
②用pH值试纸检验试管内水溶液酸碱性。
——试纸变红色,溶液呈酸性
③向试管中水溶液滴加品红溶液,振荡,观察颜色变化?加热试管,再观察有什么变化?
——使品红溶液的红色褪去;加热后,溶液又恢复红色。
这是检验SO2的方法之一。
2、化学性质
(1)漂白性
①漂白原理:
②漂白特性
可逆性:
选择性:
③应用:
SO2与有色物质结合成不稳定的无色物质
工业上漂白纸浆、毛、丝、草帽辫
无色物质容易分解而使有色物质恢复原来的颜色。
不能结合个别有机物(例如石蕊)而使之褪色。
四、二氧化硫(SO2)
四、二氧化硫(SO2)
北京市场黄白两种银耳对比 中央电视台《生活》栏目
探讨:你学过的哪些物质具有漂白性?
活性炭
Na2O2
氯水
物理吸附
氧化漂白
漂白原理是否相同?
思考:久置的草帽、纸张为什么会泛黄?
四、二氧化硫(SO2)
化合漂白
SO2
永久漂白
暂时漂白
永久漂白
四、二氧化硫(SO2)
2、化学性质
(2)通性——具有酸性氧化物的性质
① 与水反应
SO2能溶于水,并能与水反应生成亚硫酸
H2SO3不稳定,容易分解
二氧化硫溶于水是一个可逆反应
可逆反应:在相同条件下,既能向正反应方向进行、又能向逆反应方向进行的反应。
SO2 + H2O H2SO3
(弱酸,但强于碳酸)
H2SO3 = SO2↑ + H2O
SO2 + H2O = H2SO3
H2SO3的酸酐
四、二氧化硫(SO2)
思考: 2H2O 通电 2H2↑ + O2↑与 2H2 + O2 点燃 2H2O
是可逆反应吗?
CO2溶于水也是一个可逆反应:
Cl2溶于水也是一个可逆反应:
CO2 + H2O H2CO3
Cl2 + H2O HCl + HClO
不是,两个反应条件不同
四、二氧化硫(SO2)
② 与碱反应
与氢氧化钠溶液反应:
SO2少量:
SO2过量:
与澄清石灰水反应:
SO2少量:
SO2过量:
使澄清石灰水先变浑浊后变澄清的气体,除CO2外,还可能是SO2 。
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Na2SO3 + H2O
SO2 + Ca(OH)2 = CaSO3↓ + H2O
2SO2 + Ca(OH)2 = Ca(HSO3)2
实验室吸收SO2尾气
( SO2 + Na2SO3 + H2O = 2NaHSO3 )
( SO2 + CaSO3 + H2O = Ca(HSO3)2 )
③ 与碱性氧化物反应
与Na2O反应:
与CaO反应:
SO2 + CaO = CaSO3
高温
——石灰法脱硫,可以在煤中加入生石灰,防治大气污染。
SO2 + Na2O = Na2SO3
四、二氧化硫(SO2)
四、二氧化硫(SO2)
(3)具有较强的还原性
①SO2的催化氧化
②被X2(卤素单质)氧化
③被KMnO4(H+)氧化
(4)具有氧化性
SO2 + CI2 + 2H2O = H2SO4 + 2HCl
2SO2 + O2 2SO3
催化剂
△
(X2还可以是Br2、I2)
(SO2与Cl2混合,因发生反应而失去漂白能力)
SO2能使氯水、溴水和酸性KMnO4溶液褪色,可用此法检验SO2
SO2 + 2H2S = 3S↓ + 2H2O
氧化剂
还原剂
五、硫化氢(H2S)
[资料卡片]p91
1、物理性质:
2、化学性质:
无色、有臭鸡蛋气味、有毒气体,是一种大气污染物。
①还原性:
2H2S + SO2 = 3S + 2H2O
2H2S + 3O2 = 2SO2 + 2H2O
点燃
②可燃性:
③不稳定性:
H2S = S + H2
Δ
六、三氧化硫(SO3)
1、物理性质
2、化学性质
SO3 + H2O = H2SO4
(工业制硫酸)
SO3 + CaO = CaSO4
SO3 + Ca(OH)2 = CaSO4 + H2O
——酸性氧化物
无色易挥发的晶体,熔沸点很低,熔点16.8°C,沸点44.8°C
H2SO4的酸酐
2.下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味 C、通入澄清石灰水 D、通入品红溶液中
B D
1.氯气和二氧化硫皆可做漂白剂,若用两者以1:1的物质的量一起漂白一种有色物质时,漂白效果会( )
A. 增强 B. 不变 C. 减弱 D. 难确定
C
SO2 + Cl2 + 2H2O = 2HCl + H2SO4
随堂练习
随堂练习
3、检验混合气体(SO2和CO2)中存在CO2的方法:
SO2和CO2
品红溶液
酸性KMnO4溶液
品红溶液
澄清石灰水
(混合气体)
(证明有SO2)
(除去SO2)
(验证是否除尽SO2)
(检验CO2)
