2022-2023学年鲁科版高中化学选择性必修一 2.2化学反应的限度 课件(共22张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学选择性必修一 2.2化学反应的限度 课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-09 09:15:59 | ||
图片预览





文档简介
(共22张PPT)
化学反应的限度
-- 基于核心素养发展的大单元教学实践
农家有谚语:有收无收在于水,收多收少在于肥。
*甲骨文中有施肥的萌芽
*《诗经》中有“锄草沤肥,使黍稷生长茂盛”的记载
K
P
N是植物形成核酸和叶绿素的重要元素,氮肥的需求量和增产效果均居首位。
N
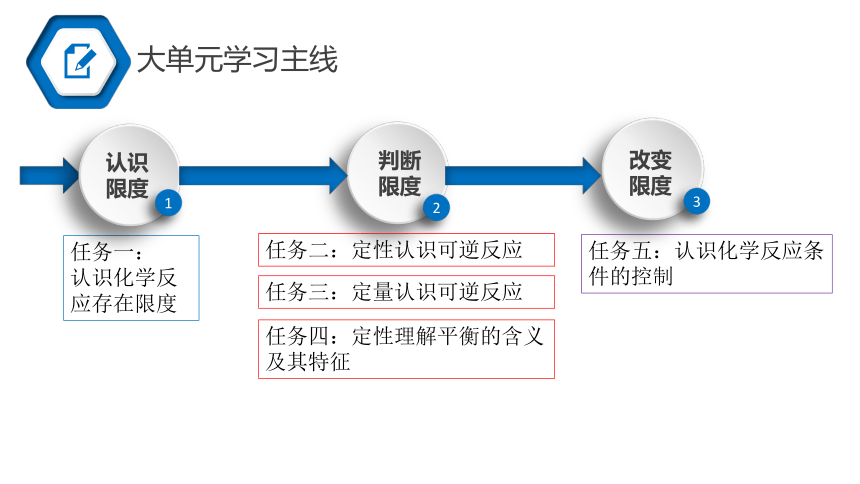
大单元学习主线
任务一:
认识化学反应存在限度
任务五:认识化学反应条件的控制
任务三:定量认识可逆反应
任务四:定性理解平衡的含义 及其特征
1
3
改变
限度
认识
限度
2
判断
限度
任务二:定性认识可逆反应
学习目标
01
通过工业合成氨工业流程及实验探究的方式认识化学反应有一定的限度,发展“科学探究与创新意识”的核心素养;
02
通过实验探究和体会科学家利用同位素示踪法定性认识可逆反应,发展“宏观辨识和微观探析”的核心素养;
03
通过对数据进行处理,作t-c、t-v图,发展“证据推理与模型认知”的核心素养,构建平衡思想;
04
通过宏观模拟化学平衡的建立,体会化学平衡的建立过程,理解化学平衡的特征,初步形成“条件改变,平衡将被破坏”的意识。
任务一:认识化学反应存在限度
1
3
改变
限度
认识
限度
2
判断
限度
限度:范围的极限;最高或最低的数量或程度。
1≤X≤3
任务一:认识化学反应存在限度
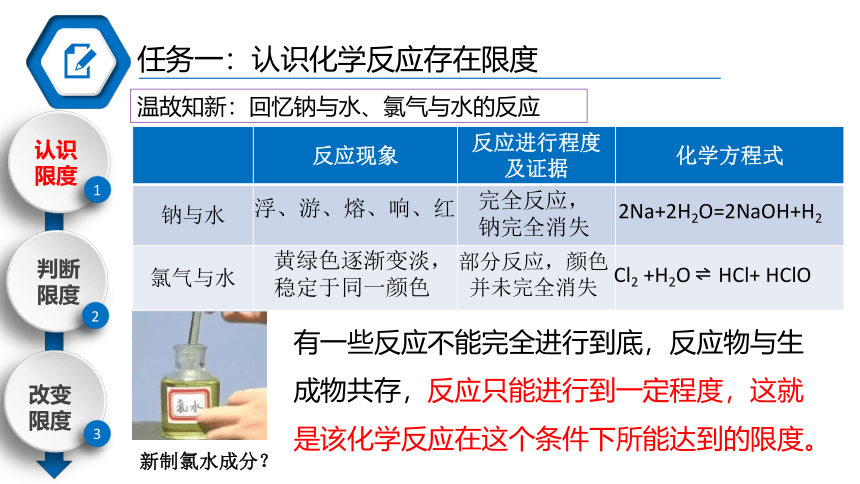
温故知新:回忆钠与水、氯气与水的反应
反应现象 反应进行程度及证据 化学方程式
钠与水
氯气与水
有一些反应不能完全进行到底,反应物与生成物共存,反应只能进行到一定程度,这就是该化学反应在这个条件下所能达到的限度。
Cl2 +H2O HCl+ HClO
浮、游、熔、响、红
黄绿色逐渐变淡,稳定于同一颜色
2Na+2H2O=2NaOH+H2
完全反应,
钠完全消失
部分反应,颜色并未完全消失
1
3
改变
限度
认识
限度
2
判断
限度
新制氯水成分?
任务一:认识化学反应存在限度
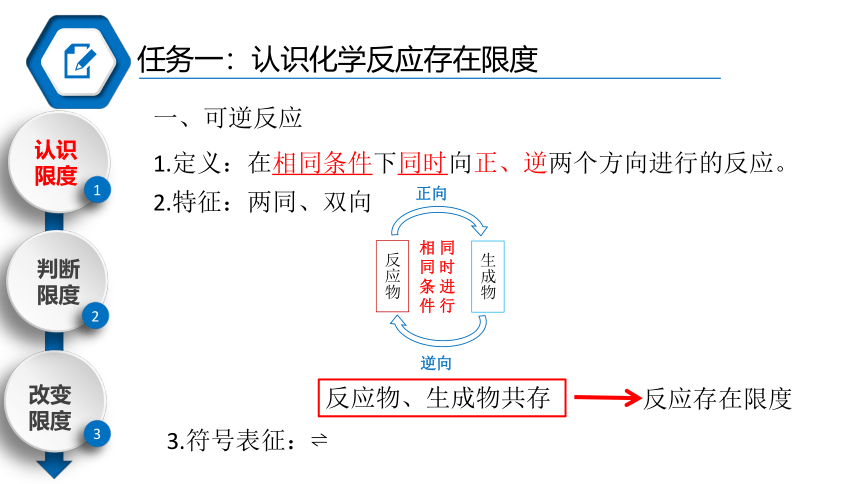
一、可逆反应
1.定义:在相同条件下同时向正、逆两个方向进行的反应。
2.特征:两同、双向
反应存在限度
3.符号表征:
反应物、生成物共存
正向
反应物
生成物
逆向
相同条件
1
3
改变
限度
认识
限度
2
判断
限度
同
时
进
行
任务一:认识化学反应存在限度
学以致用:
请判断以下化学反应是否是可逆反应?你的证据是怎样的?
1.水的生成和电解
2.CO2和H2O在植物体内通过光合作用合成糖类与糖类在人体内氧化生成CO2和H2O
3.NH3和HCl反应生成NH4Cl与NH4Cl受热分解为NH3和HCl
4.2Fe3+ + 2I- = 2Fe2+ + I2
1
3
改变
限度
认识
限度
2
判断
限度
任务二:定性认识可逆反应
1
3
改变
限度
认识
限度
2
判断
限度
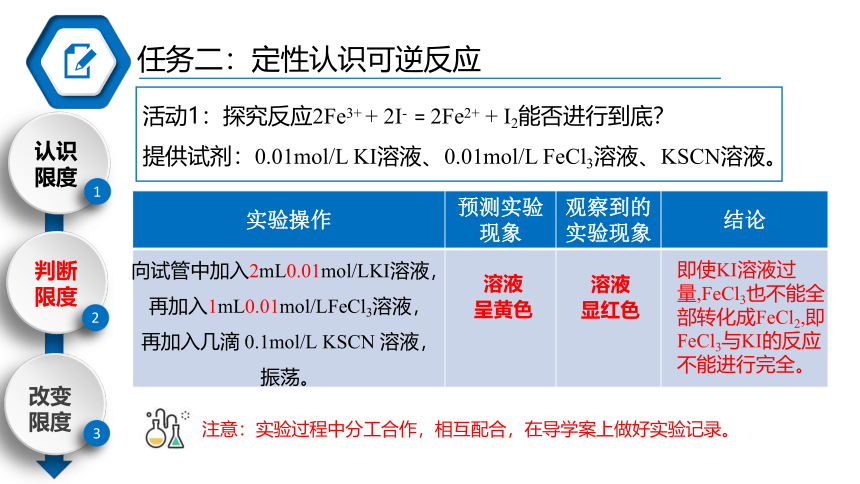
活动1:探究反应2Fe3+ + 2I- = 2Fe2+ + I2能否进行到底?
提供试剂:0.01mol/L KI溶液、0.01mol/L FeCl3溶液、KSCN溶液。
注意:实验过程中分工合作,相互配合,在导学案上做好实验记录。
实验操作 预测实验现象 观察到的实验现象 结论
向试管中加入2mL0.01mol/LKI溶液,再加入1mL0.01mol/LFeCl3溶液,再加入几滴 0.1mol/L KSCN 溶液,振荡。
溶液
呈黄色
溶液
显红色
即使KI溶液过量,FeCl3也不能全部转化成FeCl2,即FeCl3与KI的反应不能进行完全。
任务二:定性认识可逆反应
小组讨论:P64交流研讨
请回答3个观点是否正确?
观点1?
观点2?
信息1:实验发现,一定条件下向一密闭容器中充入SO2与18O2,反应一段时间后,核素18O存在于SO2、O2、SO3中。
信息2:密闭容器中SO2与O2在一定条件下发生反应,反应过程中SO3的物质的量的变化趋势如图所示。
同位素示踪法
问题导引:
反应是进行到某一阶段停止了还是正向、逆向同时进行?
1
3
改变
限度
认识
限度
2
判断
限度
观点3?
任务三:定量认识可逆反应
素材:在500℃、102KPa,将10molSO2和5molO2充入1L密闭容器中进行反应,利用传感器测得的不同反应时间各组分浓度如表所示:
时间(min) 浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 10 7 5 3.5 2 1 1 1
O2 5 3.5 2.5 1.75 1 0.5 0.5 0.5
SO3 0 3 5 6.5 8 9 9 9
活动2:根据数据分别绘制出SO2、O2、SO3的t-c图像,分析各组分浓度变化规律。
1
3
改变
限度
认识
限度
2
判断
限度
C(mol/L)
t(min)
0
10
20
30
40
50
60
70
8
2
4
6
10
任务三:定量认识可逆反应
结论:宏观角度看,随着时间推移,反应物浓度减小,生成物浓度增大,一段时间后,反应物和生成物浓度不再随时间变化,保持不变。
1
3
改变
限度
认识
限度
2
判断
限度
问题导引:
可逆反应正向、逆向同时进行,为什么反应物浓度一直减少直至不变,而没有出现增加的现象?
任务三:定量认识可逆反应
活动3:结合化学反应速率的影响因素和活动2,以SO2为例大致画出正、逆反应速率随时间变化的(t-v)图像,分析正、逆反应速率变化规律。
v(mol/L·min)
t(min)
0
10
20
30
40
50
60
70
反应物浓度 ?
生成物浓度 ?
v正 ?
v逆 ?
反应
开始
反应
过程中
达到
平衡
反应物浓度 ?
生成物浓度 ?
宏观:各物质的浓度不再改变
v正 ?
v逆 ?
微观:
v正 = v逆≠0
1
3
改变
限度
认识
限度
2
判断
限度
最大
为0
最大
为0
逐渐减小
逐渐增大
减小
增大
任务四:定性理解平衡的含义
平衡:矛盾的暂时的相对的统一
生成与消耗
反应是否停止?
正逆反应速率相等,各组分浓度不变
能否被打破?
1
3
改变
限度
认识
限度
2
判断
限度
任务四:定性理解平衡的含义
二、化学平衡状态
1.定义:在一定条件下可逆反应进行到一定程度时,反应物和生成物的浓度不再随时间的延长而发生变化,正逆反应速率相等,这种状态称为化学平衡状态,简称化学平衡。
2.特征:逆
等
动
定
变
1
3
改变
限度
认识
限度
2
判断
限度
条件改变,原平衡被破坏,在新的条件下建立新的化学平衡
研究对象为可逆反应
v(正)=v(逆)
动态平衡,v(正)=v(逆) ≠0
条件一定,平衡混合物中各物质的浓度一定(不是相等)
①同种物质:vA(正)=vA(逆)
②不同物质:v(正)与v(逆)之比等于它们系数比
各组分n、m、质量分数、体积分数均不变
3.化学平衡判断依据的核心:变量:变 不变
任务四:定性理解平衡的含义
1.观察到的现象是什么?
2.颜色是哪个物理量的体现?
4.颜色会一直加深或者变浅吗?为什么?
3.颜色的变化说明什么?
活动4:将封装有二氧化氮(NO2 )和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
问题导引:
1
3
改变
限度
认识
限度
2
判断
限度
平衡破坏
条件改变
新平衡
原平衡
任务五:化学反应条件的控制
1. 控制化学反应条件的目的
促进有利反应:
提高反应物的转化率即原料的利用率,加快反应速率等。
抑制有害反应:
减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生等。
2. 控制化学反应条件的方法
改变化学反应速率:
改变温度、溶液的浓度、气体压强(或浓度)、固体表面积及使用催化剂等。
改变可逆反应进行的程度:
改变温度、溶液浓度、气体压强(或浓度)等。
化工生产中调控反应条件时,需要考虑:
控制反应条件的成本和实际可能性。
趋利避害
1
3
改变
限度
认识
限度
2
判断
限度
任务五:化学反应条件的控制
1
3
改变
限度
认识
限度
2
判断
限度
课堂总结
认识到化学反应存在限度
化学反应条件的控制
趋利避害
理解化学平衡的定义及特征
1
3
改变
限度
可逆反应的定义、特征、符号表征
认识
限度
2
判断
限度
发展“科学探究与创新意识”核心素养
发展“宏观辨识和微观探析”、“证据推理与模型认知”核心素养
发展“科学探究与创新意识”核心素养
定性、定量认识可逆反应
随堂检测
下列关于化学反应限度的说法,正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,正逆反应速率相等且等于零
C.平衡状态时,各物质的浓度保持相等
D.化学反应的限度不可以通过改变条件而改变
A
作业
查阅资料了解“炼铁高炉尾气之迷”
并利用所学知识进行破解。
优化设计“学以致用”模块
必做作业
探究性作业
本节课结束. 敬请批评指正
感谢
化学反应的限度
-- 基于核心素养发展的大单元教学实践
农家有谚语:有收无收在于水,收多收少在于肥。
*甲骨文中有施肥的萌芽
*《诗经》中有“锄草沤肥,使黍稷生长茂盛”的记载
K
P
N是植物形成核酸和叶绿素的重要元素,氮肥的需求量和增产效果均居首位。
N
大单元学习主线
任务一:
认识化学反应存在限度
任务五:认识化学反应条件的控制
任务三:定量认识可逆反应
任务四:定性理解平衡的含义 及其特征
1
3
改变
限度
认识
限度
2
判断
限度
任务二:定性认识可逆反应
学习目标
01
通过工业合成氨工业流程及实验探究的方式认识化学反应有一定的限度,发展“科学探究与创新意识”的核心素养;
02
通过实验探究和体会科学家利用同位素示踪法定性认识可逆反应,发展“宏观辨识和微观探析”的核心素养;
03
通过对数据进行处理,作t-c、t-v图,发展“证据推理与模型认知”的核心素养,构建平衡思想;
04
通过宏观模拟化学平衡的建立,体会化学平衡的建立过程,理解化学平衡的特征,初步形成“条件改变,平衡将被破坏”的意识。
任务一:认识化学反应存在限度
1
3
改变
限度
认识
限度
2
判断
限度
限度:范围的极限;最高或最低的数量或程度。
1≤X≤3
任务一:认识化学反应存在限度
温故知新:回忆钠与水、氯气与水的反应
反应现象 反应进行程度及证据 化学方程式
钠与水
氯气与水
有一些反应不能完全进行到底,反应物与生成物共存,反应只能进行到一定程度,这就是该化学反应在这个条件下所能达到的限度。
Cl2 +H2O HCl+ HClO
浮、游、熔、响、红
黄绿色逐渐变淡,稳定于同一颜色
2Na+2H2O=2NaOH+H2
完全反应,
钠完全消失
部分反应,颜色并未完全消失
1
3
改变
限度
认识
限度
2
判断
限度
新制氯水成分?
任务一:认识化学反应存在限度
一、可逆反应
1.定义:在相同条件下同时向正、逆两个方向进行的反应。
2.特征:两同、双向
反应存在限度
3.符号表征:
反应物、生成物共存
正向
反应物
生成物
逆向
相同条件
1
3
改变
限度
认识
限度
2
判断
限度
同
时
进
行
任务一:认识化学反应存在限度
学以致用:
请判断以下化学反应是否是可逆反应?你的证据是怎样的?
1.水的生成和电解
2.CO2和H2O在植物体内通过光合作用合成糖类与糖类在人体内氧化生成CO2和H2O
3.NH3和HCl反应生成NH4Cl与NH4Cl受热分解为NH3和HCl
4.2Fe3+ + 2I- = 2Fe2+ + I2
1
3
改变
限度
认识
限度
2
判断
限度
任务二:定性认识可逆反应
1
3
改变
限度
认识
限度
2
判断
限度
活动1:探究反应2Fe3+ + 2I- = 2Fe2+ + I2能否进行到底?
提供试剂:0.01mol/L KI溶液、0.01mol/L FeCl3溶液、KSCN溶液。
注意:实验过程中分工合作,相互配合,在导学案上做好实验记录。
实验操作 预测实验现象 观察到的实验现象 结论
向试管中加入2mL0.01mol/LKI溶液,再加入1mL0.01mol/LFeCl3溶液,再加入几滴 0.1mol/L KSCN 溶液,振荡。
溶液
呈黄色
溶液
显红色
即使KI溶液过量,FeCl3也不能全部转化成FeCl2,即FeCl3与KI的反应不能进行完全。
任务二:定性认识可逆反应
小组讨论:P64交流研讨
请回答3个观点是否正确?
观点1?
观点2?
信息1:实验发现,一定条件下向一密闭容器中充入SO2与18O2,反应一段时间后,核素18O存在于SO2、O2、SO3中。
信息2:密闭容器中SO2与O2在一定条件下发生反应,反应过程中SO3的物质的量的变化趋势如图所示。
同位素示踪法
问题导引:
反应是进行到某一阶段停止了还是正向、逆向同时进行?
1
3
改变
限度
认识
限度
2
判断
限度
观点3?
任务三:定量认识可逆反应
素材:在500℃、102KPa,将10molSO2和5molO2充入1L密闭容器中进行反应,利用传感器测得的不同反应时间各组分浓度如表所示:
时间(min) 浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 10 7 5 3.5 2 1 1 1
O2 5 3.5 2.5 1.75 1 0.5 0.5 0.5
SO3 0 3 5 6.5 8 9 9 9
活动2:根据数据分别绘制出SO2、O2、SO3的t-c图像,分析各组分浓度变化规律。
1
3
改变
限度
认识
限度
2
判断
限度
C(mol/L)
t(min)
0
10
20
30
40
50
60
70
8
2
4
6
10
任务三:定量认识可逆反应
结论:宏观角度看,随着时间推移,反应物浓度减小,生成物浓度增大,一段时间后,反应物和生成物浓度不再随时间变化,保持不变。
1
3
改变
限度
认识
限度
2
判断
限度
问题导引:
可逆反应正向、逆向同时进行,为什么反应物浓度一直减少直至不变,而没有出现增加的现象?
任务三:定量认识可逆反应
活动3:结合化学反应速率的影响因素和活动2,以SO2为例大致画出正、逆反应速率随时间变化的(t-v)图像,分析正、逆反应速率变化规律。
v(mol/L·min)
t(min)
0
10
20
30
40
50
60
70
反应物浓度 ?
生成物浓度 ?
v正 ?
v逆 ?
反应
开始
反应
过程中
达到
平衡
反应物浓度 ?
生成物浓度 ?
宏观:各物质的浓度不再改变
v正 ?
v逆 ?
微观:
v正 = v逆≠0
1
3
改变
限度
认识
限度
2
判断
限度
最大
为0
最大
为0
逐渐减小
逐渐增大
减小
增大
任务四:定性理解平衡的含义
平衡:矛盾的暂时的相对的统一
生成与消耗
反应是否停止?
正逆反应速率相等,各组分浓度不变
能否被打破?
1
3
改变
限度
认识
限度
2
判断
限度
任务四:定性理解平衡的含义
二、化学平衡状态
1.定义:在一定条件下可逆反应进行到一定程度时,反应物和生成物的浓度不再随时间的延长而发生变化,正逆反应速率相等,这种状态称为化学平衡状态,简称化学平衡。
2.特征:逆
等
动
定
变
1
3
改变
限度
认识
限度
2
判断
限度
条件改变,原平衡被破坏,在新的条件下建立新的化学平衡
研究对象为可逆反应
v(正)=v(逆)
动态平衡,v(正)=v(逆) ≠0
条件一定,平衡混合物中各物质的浓度一定(不是相等)
①同种物质:vA(正)=vA(逆)
②不同物质:v(正)与v(逆)之比等于它们系数比
各组分n、m、质量分数、体积分数均不变
3.化学平衡判断依据的核心:变量:变 不变
任务四:定性理解平衡的含义
1.观察到的现象是什么?
2.颜色是哪个物理量的体现?
4.颜色会一直加深或者变浅吗?为什么?
3.颜色的变化说明什么?
活动4:将封装有二氧化氮(NO2 )和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
问题导引:
1
3
改变
限度
认识
限度
2
判断
限度
平衡破坏
条件改变
新平衡
原平衡
任务五:化学反应条件的控制
1. 控制化学反应条件的目的
促进有利反应:
提高反应物的转化率即原料的利用率,加快反应速率等。
抑制有害反应:
减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生等。
2. 控制化学反应条件的方法
改变化学反应速率:
改变温度、溶液的浓度、气体压强(或浓度)、固体表面积及使用催化剂等。
改变可逆反应进行的程度:
改变温度、溶液浓度、气体压强(或浓度)等。
化工生产中调控反应条件时,需要考虑:
控制反应条件的成本和实际可能性。
趋利避害
1
3
改变
限度
认识
限度
2
判断
限度
任务五:化学反应条件的控制
1
3
改变
限度
认识
限度
2
判断
限度
课堂总结
认识到化学反应存在限度
化学反应条件的控制
趋利避害
理解化学平衡的定义及特征
1
3
改变
限度
可逆反应的定义、特征、符号表征
认识
限度
2
判断
限度
发展“科学探究与创新意识”核心素养
发展“宏观辨识和微观探析”、“证据推理与模型认知”核心素养
发展“科学探究与创新意识”核心素养
定性、定量认识可逆反应
随堂检测
下列关于化学反应限度的说法,正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,正逆反应速率相等且等于零
C.平衡状态时,各物质的浓度保持相等
D.化学反应的限度不可以通过改变条件而改变
A
作业
查阅资料了解“炼铁高炉尾气之迷”
并利用所学知识进行破解。
优化设计“学以致用”模块
必做作业
探究性作业
本节课结束. 敬请批评指正
感谢
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
