第3章不同聚集状态的物质与性质测试题(含解析)高二下学期化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第3章不同聚集状态的物质与性质测试题(含解析)高二下学期化学鲁科版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-09 12:14:42 | ||
图片预览




文档简介
第3章 不同聚集状态的物质与性质 测试题
一、单选题(共15题)
1.已知某有机物A的分子式为C4H8O3,又知A既可以与NaHCO3溶液反应,也可与钠反应,且等量的A与足量的NaHCO3、Na充分反应时生成气体的物质的量相等,则A的结构最多有
A.4种 B.5种 C.6种 D.7种
2.照相底片的定影及银的回收过程如下:
步骤1:将曝光后的照相底片用定影液(Na2S2O3)浸泡,使未曝光的AgBr转化成配合物溶解,该反应AgBr和Na2S2O3的物质的量比为1:2。
步骤2:在步骤1的废定影液中加Na2S使配合物转化为黑色沉淀,并使定影液再生。
步骤3:过滤,将黑色沉淀灼烧回收银。
下列说法不正确的是
A.步骤1中配合物的内外界离子数比为1:2
B.步骤2中黑色沉淀为Ag2S
C.步骤3灼烧时要进行尾气吸收
D.如图所示NaBr晶胞中有4个Br-原子
3.已知冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6=3Na++AlF。现有冰晶石的结构单元如图所示,位于大立方体顶点和面心,位于大立方体的12条棱的中点和8个小立方体的体心,是图中、中的一种。下列说法正确的是
A.冰晶石是共价晶体
B.大立方体的体心处代表Al3+
C.与Na+距离相等且最近的Na+有6个
D.冰晶石晶体的密度约为g cm-3
4.下列说法中正确的是
A.冰融化时,分子中键发生断裂
B.共价晶体中,共价键越强,共价晶体的熔点越高
C.共价晶体中的相邻原子间只存在非极性共价键
D.稀有气体形成的晶体属于共价晶体
5.下列说法正确的是
A.HF、HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
B.Ba(OH)2晶体不导电,但熔化后可以导电
C.干冰属于原子晶体,熔化破坏共价键和分子间作用力
D.干冰升华时,分子内共价键会发生断裂
6.Cu、Au能形成多种组成固定的合金,其中一种晶体的晶胞结构(立方体)如图所示,下列说法正确的是
A.该晶体的化学组成可表示为CuAu
B.与1个Cu原子距离最近的Au原子是4个
C.Au填充了由与之距离最近的Cu原子构成的正四面体空隙
D.根据图中信息,铜原子a的分数坐标为(0.5,0.5,0.5)
7.在海洋深处的沉积物中含有大量可燃冰,其主要成分是甲烷水合物。甲烷水合物的结构可以看成是甲烷分子装在由水分子形成的“笼子”里。下列说法正确的是
A.甲烷分子和水分子的VSEPR模型都是正四面体形
B.甲烷分子通过氢键与构成“笼子”的水分子相结合
C.可燃冰属于分子晶体
D.水分子的键角大于甲烷分子的键角
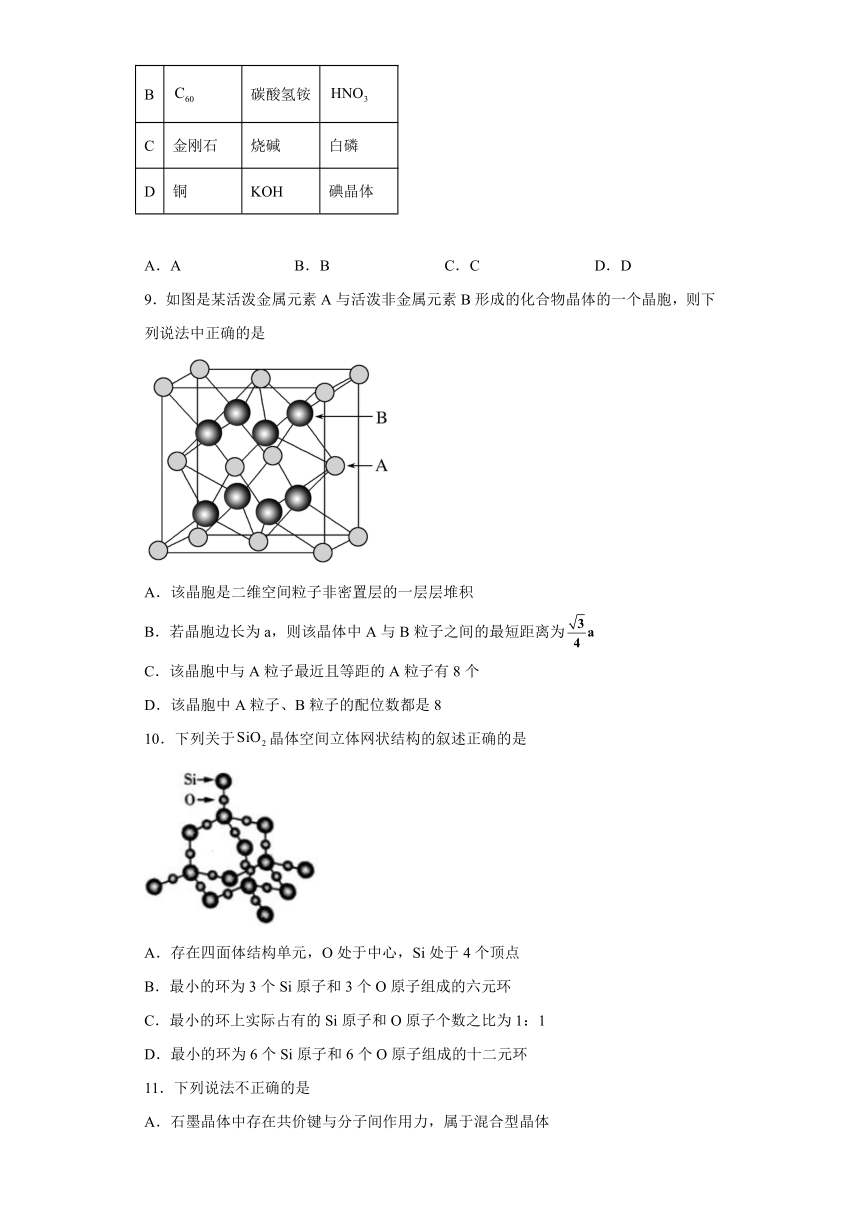
8.下表所列物质晶体的类型全部正确的一组是
原子晶体 离子晶体 分子晶体
A 二氧化硅 硫酸 He
B 碳酸氢铵
C 金刚石 烧碱 白磷
D 铜 KOH 碘晶体
A.A B.B C.C D.D
9.如图是某活泼金属元素A与活泼非金属元素B形成的化合物晶体的一个晶胞,则下列说法中正确的是
A.该晶胞是二维空间粒子非密置层的一层层堆积
B.若晶胞边长为a,则该晶体中A与B粒子之间的最短距离为
C.该晶胞中与A粒子最近且等距的A粒子有8个
D.该晶胞中A粒子、B粒子的配位数都是8
10.下列关于晶体空间立体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶点
B.最小的环为3个Si原子和3个O原子组成的六元环
C.最小的环上实际占有的Si原子和O原子个数之比为1:1
D.最小的环为6个Si原子和6个O原子组成的十二元环
11.下列说法不正确的是
A.石墨晶体中存在共价键与分子间作用力,属于混合型晶体
B.纯金属中加入其它元素会改变规则的层状排列,能增大金属硬度
C.液晶是液体和晶体聚集而成的一种特殊的混合物
D.NaCl和SiC晶体熔化时,克服粒子间作用力的类型不相同
12.GaAs是人工合成的新型半导体材料,其晶体结构与金刚石相似,晶胞边长为anm,下列说法正确的是
A.GaAs晶体中,As与Ga之间存在配位键
B.As原子在晶胞的内部,Ga原子在晶胞的顶角和面上
C.每一个As原子周围最近的As原子有8个
D.As原子与最近的Ga原子之间的距离为
13.下列说法不正确的是
A.晶体具有固定的熔、沸点,而非晶体没有固定的熔、沸点
B.晶体与非晶体具有相同的性质
C.部分电子表、电脑的显示器是由液晶材料制成的
D.等离子体是一种很好的导电体,在信息产业等领域有非常好的应用前景
14.镁单质及其化合物用途广泛,某镁硼化合物的晶胞结构如图所示。B原子独立为一层,具有类似石墨的结构。六棱柱底边边长为,高为,阿伏伽德罗常数的值为。下列说法错误的是
A.该化合物的化学式为
B.该晶胞中的配位数为12
C.每个B原子周围都有2个与之等距离且最近的B原子
D.该晶体的密度为
15.目前最热门的机器人材料液晶弹性体是一种最具代表性的智能材料,在外界刺激下,其相态或分子结构会产生变化,进而改变液晶基元的排列顺序,从而导致材料本身发生宏观形变,当撤去外界刺激后,液晶弹性体可以恢复到原来的形状。下列说法错误的是
A.该液晶同时具有各向异性和弹性
B.这种液晶弹性体机器人可以采用热、光、电、磁等进行驱动
C.该液晶弹性体具有形状记忆功能
D.液晶是介于液态和固态之间的物质状态,而固体是晶体
二、填空题(共8题)
16.X、Y、Z、W为元素周期表前四周期的元素,原子序数依次增大,X原子核外有6种不同运动状态的电子;Y原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
Fe、Co、Ni是三种重要的金属元素,三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为___。CoO的面心立方晶胞如图,设阿伏加德罗常数的值为NA,则CoO晶体的密度为__g·cm-3。
17.据报道,科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N结合3个氮原子而形成8电子稳定结构;
②N—N的键能为167 kJ mol-1。请回答下列问题:
N60分子组成的晶体为_____晶体,其熔、沸点比N2晶体的____(填“高”或“低”),原因是______。
18.灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用力很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图、晶胞俯视图如图所示。
螺旋链状中硒原子采用__杂化,1mol晶胞含___个硒原子(NA是阿伏加德罗常数的值)。
19.Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、4、6,且都含有18个电子,其中B、C是由两种元素的原子组成,且B分子中两种元素原子的个数比均为1 :2 ,C分子中两种元素原子的个数比均为1 :1,D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是___________;
(2)从B分子的立体结构判断,该分子属于________分子(填“极性”或“非极性”);分子空间结构为_______型。
(3)C在实验室可用来制取常见的一种气体单质,试写出该化学反应方程式__________________。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质): ________________。
Ⅱ. Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(5)基态Cu原子的核外电子排布式为_______________。
(6)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于_______________(填晶体类型)。
20.A、B、C、D是四种核电荷数依次增大的短周期元素,A与C的基态原子中L能层都有两个未成对电子,C、D同主族。E的基态原子中M能层有4个未成对电子,F原子N能层只有1个电子,其余各能层均为全充满。根据以上信息填空:
(1)E2+离子的外围电子轨道表示式是_______。
(2)化合物AC2和阴离子ABC-互为等电子体,它们结构相似,ABC-的电子式为_______,所含三种元素第一电离能由小到大的顺序是_______。
(3)B、C、D的最简单氢化物中,B原子的杂化轨道类型为_______,最稳定的是_______。
(4)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲中不存在的微粒间作用力_______ (填标号)。
A.离子键 B.配位键 C.氢键 D.σ键 E. π键
(5)由D,E,F三种元素组成的某种化合物,其晶胞如图所示,是上下底面为正方形的长方体,则其化学式为_______。
21.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有____个。
电池充电时,LiFeO4脱出部分Li+,形成Li1 xFePO4,结构示意图如(b)所示,则x=____,n(Fe2+)∶n(Fe3+)=____。
22.为便于研究只含C、H、O三种元素的有机物燃烧时生成物与所需氧气的量的关系,可用通式、或表示它们(m、n、x、y均为正整数)。例如、、等物质可用通式表示,它们的m分别为1、2、3,n均为1。它们完全燃烧时所需的氧气和生成的二氧化碳的体积比为3∶2。
(1)现有一类只含C、H、O三种元素的有机物,它们完全燃烧时消耗的氧气和生成的二氧化碳的体积比为5∶4,按照上述要求,该类有机物的通式可表示为__________,写出该类有机物相对分子质量最小的物质的结构简式__________。
(2)若某一类有机物可用通式表示,则在相同条件下,该类有机物完全燃烧时消耗氧气的体积和生成的体积必须满足的条件是__________。
23.某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱。供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
(1)仪器a的名称:___________。
(2)锥形瓶中装有某可溶性正盐,a中所盛试剂为___________。
(3)装置B所盛试剂是___________,其作用是___________。
(4)装置C所盛试剂是___________,C中反应的离子方程式是___________。
(5)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是___________。
(6)写出碳、氮、硅三元素的简单气态氢化物的稳定性由强到弱的顺序是(写化学式)___________。
(7)写出碳、氮、硅三元素的简单气态氢化物的沸点由高到低的顺序是(写化学式)___________。
参考答案:
1.B
【解析】有机物分子式为C4H8O3,不饱和度为1,可以与NaHCO3溶液反应,说明有机物分子中含有1个-COOH,等量的有机物与足量的NaHCO3溶液、Na反应时产生的气体在相同条件下的体积比为1:1,则分子内含1个-OH,从结构上看,该有机物可以看作C3H7-COOH中丙基中1个氢原子被一个羟基替代所得,丙基有2种,正丙基中有3种H原子,故对应有3种同分异构体,异丙基中有2种H原子,故对应有2种同分异构体,故该有机物的可能的结构有2+3=5种;
答案选B。
2.A
【解析】A.AgBr和Na2S2O3的物质的量比为1:2,反应的方程式为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr,Na3[Ag(S2O3)2]中内外界离子数比为1:3,A错误;
B.Na2S使配合物转化为黑色沉淀,方程式为Na2S+ 2Na3[Ag(S2O3)2]=Ag2S +4Na2S2O3,故黑色沉淀为Ag2S,B正确;
C.灼烧Ag2S时会生成SO2,SO2是污染气体,需要进行尾气吸收,C正确;
D.根据均摊法,晶胞中Br-的个数为8×+6×=4,D正确;
故选A。
3.D
【解析】A.冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6=3Na++AlF,熔融状态电离产生阳离子和阴离子,说明该物质属于离子晶体,A错误;
B.每个晶胞中含有的个数为,的个数为,冰晶石中与Na+的个数比为1:3,故与必然表示同一种微粒,表示Na+,B错误;
C.根据晶体结构可知:在该晶体中与Na+距离相等且最近的Na+有8个,C错误;
D.晶体的密度ρ=,D正确;
故合理选项是D。
4.B
【解析】A.冰属于分子晶体,构成冰晶体的微粒间存在分子间作用力,所以冰融化时克服的是分子间作用力,共价键不变,A错误;
B.共价晶体中共价键的强弱决定其熔点的高低,所以共价晶体中共价键越强,共价晶体的熔点越高,B正确;
C.晶体中、O原子间形成极性键,C错误;
D.稀有气体分子是单原子分子,形成的晶体为分子晶体,D错误;
故选B。
5.B
【解析】A.由于H-F、H-Cl、H-Br、H-I的键能依次减小,故HF、HCl、HBr、HI的稳定性逐渐减弱,但由于HF中存在分子间氢键,导致其熔沸点反常升高,则熔沸点为HF>HI>HBr>HCl,A错误;
B.Ba(OH)2晶体为离子晶体,由于晶体中的阴、阳离子不能自由移动而不导电,但熔化后中的阴、阳离子可以自由移动,则可以导电,B正确;
C.干冰即固体CO2,是CO2分子通过范德华力作用形成的分子晶体,熔化是只要克服分子间作用力,而不需要破坏共价键,C错误;
D.由C项分析可知,干冰为分子晶体,则干冰升华时,只要克服分子间作用力,而不需要破坏共价键,D错误;
故答案为:B。
6.B
【解析】A.由晶胞结构可知,晶胞中位于面心铜原子的个数为6×=3,位于顶点的金原子的个数为8×=1,则晶体的化学式为为Cu3Au,故A错误;
B.由晶胞结构可知,晶胞中金原子和距离最近的铜原子为顶点和面心的位置关系,则1个铜原子距离最近的金原子是4个,故B正确;
C.由晶胞结构可知,晶胞中金原子和距离最近的铜原子为顶点和面心的位置关系,则金原子没有填充铜原子构成的正八面体空隙,故C错误;
D.由晶胞结构可知,晶胞的边长为1,铜原子a位于晶胞右侧面的面心,分数坐标为(1,0.5,0.5),故D错误;
故选B。
7.C
【解析】A.甲烷分子中碳原子的价层电子对数为4,VSEPR模型为正四面体形,水分子中氧原子的价层电子对数为4,VSEPR模型是四面体形,故A错误;
B.甲烷分子不能与水分子形成分子间氢键,故B错误;
C.可燃冰是由分子形成的分子晶体,故C正确;
D.甲烷分子中碳原子和水分子中氧原子的价层电子对数都为4,但甲烷分子中碳原子的孤对电子对数为0,水分子中氧原子的孤对电子对数为2,孤对电子对成键电子对的斥力大于成键电子对对成键电子对的斥力,所以水分子的键角小于甲烷分子的键角,故D错误;
故选C。
8.C
【解析】A.硫酸的构成微粒是分子,故硫酸是分子晶体,A错误;
B.的构成微粒是分子,故是分子晶体,B错误;
C.金刚石的构成微粒是原子,故金刚石是原子晶体,烧碱的构成微粒是阴阳离子,属于离子晶体,白磷的构成微粒是分子,属于分子晶体,C正确;
D.铜的构成微粒是金属阳离子和自由电子,属于金属晶体,D错误;
故选C。
9.B
【解析】A.该图片是立体结构,A错误;
B.若晶胞边长为a,则该晶体中A与B粒子之间的最短距离为体对角线的四分之一,而体对角线为,故该距离为,B正确;
C.顶点上的每个A粒子,与A粒子最近且等距的A粒子数为,C错误;
D.根据图可知,A的配位数为8,B的配位数为4,D错误;
故选B。
10.D
【解析】A.晶体中存在四面体结构单元,每个原子能形成4个共价键,每个O原子能形成2个共价键,处于中心,O处于4个顶点,故A错误;
B.最小的环为6个原子和6个O原子组成的十二元环,故B错误;
C.每个环实际占有的原子数为,O原子数为,故最小的环上实际占有的原子和O原子个数之比为1:2,故C错误;
D.最小的环为6个原子和6个O原子组成的十二元环,故D正确;
故选D。
11.C
【解析】A.石墨晶体为层状结构,层与层之间的作用力为分子间作用力,层内碳与碳之间以共价键连接,同时层内还有类似于金属键的作用力,所以石墨晶体属于混合型晶体,A正确;
B.纯金属中原子排列规则有序,当加入其他元素后盖面规则的层状排列,使得原子不易发生相对滑动,从而增大金属的硬度,B正确;
C.液晶为由固态向液态转化过程中存在的取向有序的流体,既有液体的易流动性,还保留着部分晶态物质分子的各向异性有序排列,是一种兼有晶体和液体的部分性质的中间态,C错误;
D.NaCl为离子晶体,熔化时破坏离子键,SiC为共价晶体,熔化时破坏共价键,所以二者熔化时克服粒子间作用力的类型不同,D正确;
故选C。
12.A
【解析】A.砷原子还有1对孤对电子,而镓原子有容纳孤对电子的空轨道,所以可以构成配位键,A正确;
B.Ga的半径大于As,从图中可知,晶胞中Ga位于体内,数目为4,As原子位于顶点和面心,数目为8×+6×=4,B错误;
C.以顶点As原子为例,每个As原子周围最近等距离的As原子位于该顶点所在的三个面的面心上,数目为=12,C错误;
D.As原子与最近的Ga原子连线处于晶胞体对角线上,且Ga原子与As原子之间的距离为晶胞体对角线长度的倍,又晶胞的体对角线为晶胞棱长的倍,则Ga原子与As原子之间的距离为,D错误;
故选:A。
13.B
【解析】A.晶体有固定的熔点,自范性、各向异性,非晶体无固定的熔点,故A正确;
B.晶体与非晶体内部结构不同,故表现的性质不同,故B错误;
C.部分电子表、电脑的显示器是由液晶材料制成的,需要的驱动电压很低,故C正确;
D.等离子体是一种很好的导电体,在信息产业等领域有非常好的应用前景,等离子体技术在新能源行业、聚合物薄膜、材料防腐蚀等方面前景可观,故D正确;
故选B。
14.C
【解析】A.1个晶胞含有Mg原子数是、B原子数是6,该化合物的化学式为,故A正确;
B.依据晶胞面心的Mg原子分析,其上层、下层各有6个B原子,所以该晶胞中的配位数为12,故B正确;
C.根据图示,每个B原子周围都有3个与之等距离且最近的B原子,故C错误;
D.晶胞的体积为,该晶体的密度为 ,故D正确;
选C。
15.D
【解析】A.在外界刺激下,其相态或分子结构会产生变化,进而改变液晶基元的排列顺序,从而导致材料本身发生宏观形变,当撤去外界刺激后,液晶弹性体可以恢复到原来的形状,说明该液晶同时具有各向异性和弹性,A正确;
B.在外界刺激下,其相态或分子结构会产生变化,则这种液晶弹性体机器人可以采用热、光、电、磁等进行驱动,B正确;
C.撤去外界刺激后,液晶弹性体可以恢复到原来的形状,则该液晶弹性体具有形状记忆功能,C正确;
D.液晶是介于液态和晶态之间的物质状态,不是介于液态和固态之间的状态,D错误;
故选D。
16. NiO>CoO>FeO
根据三种物质所属的晶体类型判断熔化时克服离子键,利用离子半径的大小判断离子键的强弱,根据离子键的强弱判断熔点的高低;利用均摊法计算晶胞中实际含有的微粒数,根据密度计算公式进行计算晶胞密度;
【解析】三种元素二价氧化物均为离子化合物,其熔点和离子键的强弱有关,离子的半径越小,离子键越强,离子半径r(Fe2+)>r(Co2+)>r(Ni2+),形成的离子键依次增强,熔点依次升高,则熔点NiO>CoO>FeO;根据晶胞结构,O2-占据了面心和顶点,面心的O2-被2个晶胞所共有,顶点被8个晶胞所共有,则该晶体中有个O2-;Co2+占据了棱心和体心,棱心的Co2+被4个晶胞所共有,体心的Co2+被此晶胞所独有,则该晶胞中含有
个Co2+;根据公式可得。
17. 分子 高 N60、N2均形成分子晶体,且N60的相对分子质量较大,分子间作用力较强,故熔、沸点较高
【解析】N60、N2都是由分子形成的分子晶体。对于分子晶体来说,物质的相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高。由于Mr(N60)>Mr(N2),所以N60晶体中的分子间作用力比N2晶体中的大,N60晶体的熔、沸点比N60晶体的高。
18. sp3 9NA
【解析】观察晶胞图示,1个硒原子与2个硒原子形成σ键,硒原子价层电子对0.5×(6+2)=4,故采用sp3杂化;由晶胞图示和晶胞俯视图知,1个晶胞含硒原子数为6×+12×3×=9,所以1 mol晶胞含9NA个硒原子,故答案为:sp3;9NA。
19. Ar 极性 V形 2H2O22H2O+O2↑ D是CH3OH,分子之间能形成氢键 1s22s22p63s23p63d104s1 分子晶体
已知A、B、C、D四种分子所含原子的数目依次为1、3、4和6,且都含有18个电子,则A是Ar,又知B、C是由两种元素的原子组成,B分子中两种元素原子的个数比为1:2,C分子中两种元素原子的个数比为1:1,则B是H2S,C为H2O2,D是一种有毒的有机物,D为CH4O,据此解答。
【解析】已知A、B、C、D四种分子所含原子的数目依次为1、3、4和6,且都含有18个电子,则A是Ar,又知B、C是由两种元素的原子组成,B分子中两种元素原子的个数比为1:2,C分子中两种元素原子的个数比为1:1,则B是H2S,C为H2O2,D是一种有毒的有机物,D为CH4O;
(1)组成A分子的原子的元素符号是Ar;
(2)H2S分子中硫原子的价层电子对=2+=4,且含有两个孤电子对,所以其空间构型是V形,该分子不对称,为极性分子;
(3)H2O2在二氧化锰作用下会迅速产生氧气:2H2O22H2O+O2↑;
(4)D为CH3OH,甲醇与水分子之间形成氢键,导致沸点明显比甲烷高;
(5)Cu的核电荷数是29,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1;
(6)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于分子晶体。
20.(1)
(2) C(3) sp3 H2O
(4)C
(5)CuFeS2
A、B、C、D四种短周期元素,它们的核电荷数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;C、D同主族,则D为S元素;E、F都是第四周期元素,E原子核外有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素。
【解析】(1)Fe2+离子的价层电子排布3d6,其价层电子排布图是。
(2)化合物CO2和阴离子CNO-互为等电子体,它们结构相似,CNO-中C原子与O、N原子之间形成2对共用电子对,CNO-的电子式为 ;元素C、N、O属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是C(3)B、C、D的最简单氢化物分布为NH3、H2O、H2S,NH3中N原子的价层电子对数为3+0.5×(5-3)=4,杂化轨道类型为sp3;S、N、O三种元素中非金属性最大的是O,最稳定的是H2O。
(4)配合物甲的焰色反应呈紫色,含有K元素,其内界由中心离子Fe3+与配位体CN 构成,配位数为6,甲为K3[Fe(CN)6],甲中存在的微粒间作用力有:配位键、共价键、σ键、π键,由于K3[Fe(CN)6]中没有氢原子,不能形成氢键,故选C。
(5)晶胞中D(S)原子位于晶胞内部,原子数目为8个,E(Fe)原子6个位于面上、4个位于棱上,E(Fe)原子数目=6×+4×=4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×+1+8×=4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2。
21. 4 或0.1875 13:3
【解析】由题干可知,LiFePO4的晶胞中,Fe存在于由O构成的正八面体内部,P存在由O构成的正四面体内部;再分析题干中给出的(a),(b)和(c)三个不同物质的晶胞结构示意图,对比(a)和(c)的差异可知,(a)图所示的LiFePO4的晶胞中,小球表示为Li+,其位于晶胞的8个顶点,4个侧面面心以及上下底面各自的相对的两条棱心处,经计算一个晶胞中Li+的个数为=4个;进一步分析(a)图所示的LiFePO4的晶胞中,八面体结构和四面体结构的数目均为4,即晶胞中含Fe和P的数目均为4;考虑到化学式为LiFePO4,并且一个晶胞中含有的Li+,Fe和P的数目均为4,所以一个晶胞中含有4个LiFePO4单元。对比(a)和(b)两个晶胞结构示意图可知,Li1-xFePO4相比于LiFePO4缺失一个面心的Li+以及一个棱心的Li+;结合上一个空的分析可知,LiFePO4晶胞的化学式为Li4Fe4P4O16,那么Li1-xFePO4晶胞的化学式为Li3.25Fe4P4O16,所以有,即x=0.1875。结合上一个空计算的结果可知,Li1-xFePO4即Li0.8125FePO4;假设Fe2+和Fe3+数目分别为x和y,则列方程组:x+y=1,0.8125+2x+3y+5=4×2,解得x=0.8125,y=0.1875,则Li1-xFePO4中n(Fe2+)∶n(Fe3+)=0.8125∶0.1875=13∶3,故答案为4;或0.1875;13∶3。
22.
【解析】(1)有机物完全燃烧时消耗的氧气体积比生成的二氧化碳体积大,
该类有机物应满足通式,
由燃烧反应方程式,
结合题给条件得,解得,
所以该类有机物通式为。
分别对m、n取值,可得相对分子质量最小的物质的结构简式是。
(2)由燃烧反应方程式可知,
消耗氧气的体积与生成的体积比为,
故,即。
23.(1)分液漏斗
(2)稀硝酸
(3) 饱和碳酸氢钠溶液 吸收气体中硝酸
(4) 硅酸钠溶液 SiO+CO2+H2O=H2SiO3↓+CO
(5)N>C>Si
(6)NH3>CH4>SiH4
(7)NH3>SiH4>CH4
a中装有硝酸,装置A中装有碳酸钠溶液,硝酸与碳酸钠发生强酸制取弱酸的反应生成二氧化碳,装置B中为饱和碳酸氢钠溶液,可以除去挥发的硝酸,装置C中装有硅酸钠溶液,二氧化碳与硅酸钠发生强酸制取弱酸的反应生成硅酸沉淀,由此比较出酸性:HNO3>H2CO3>H2SiO3。
(1)
由图可知,仪器a为分液漏斗;
(2)
由分析可知,a中所盛试剂为稀硝酸;
(3)
由分析可知,装置B所盛试剂是饱和碳酸氢钠溶液,可以除去二氧化碳中的硝酸;
(4)
由分析可知,装置C中装有硅酸钠溶液,二氧化碳与硅酸钠溶液发生反应生成硅酸沉淀,离子方程式为SiO+CO2+H2O=H2SiO3↓+CO;
(5)
元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,酸性:HNO3>H2CO3>H2SiO3,则非金属性:N>C>Si;
(6)
元素的非金属性越强,对其氢化物的稳定性越强,则碳、氮、硅三元素的简单气态氢化物的稳定性由强到弱的顺序为NH3>CH4>SiH4;
(7)
NH3中含有氢键,其沸点较高,CH4和SiH4都是分子晶体,相对分子质量越大,沸点越高,则沸点:NH3>SiH4>CH4。
一、单选题(共15题)
1.已知某有机物A的分子式为C4H8O3,又知A既可以与NaHCO3溶液反应,也可与钠反应,且等量的A与足量的NaHCO3、Na充分反应时生成气体的物质的量相等,则A的结构最多有
A.4种 B.5种 C.6种 D.7种
2.照相底片的定影及银的回收过程如下:
步骤1:将曝光后的照相底片用定影液(Na2S2O3)浸泡,使未曝光的AgBr转化成配合物溶解,该反应AgBr和Na2S2O3的物质的量比为1:2。
步骤2:在步骤1的废定影液中加Na2S使配合物转化为黑色沉淀,并使定影液再生。
步骤3:过滤,将黑色沉淀灼烧回收银。
下列说法不正确的是
A.步骤1中配合物的内外界离子数比为1:2
B.步骤2中黑色沉淀为Ag2S
C.步骤3灼烧时要进行尾气吸收
D.如图所示NaBr晶胞中有4个Br-原子
3.已知冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6=3Na++AlF。现有冰晶石的结构单元如图所示,位于大立方体顶点和面心,位于大立方体的12条棱的中点和8个小立方体的体心,是图中、中的一种。下列说法正确的是
A.冰晶石是共价晶体
B.大立方体的体心处代表Al3+
C.与Na+距离相等且最近的Na+有6个
D.冰晶石晶体的密度约为g cm-3
4.下列说法中正确的是
A.冰融化时,分子中键发生断裂
B.共价晶体中,共价键越强,共价晶体的熔点越高
C.共价晶体中的相邻原子间只存在非极性共价键
D.稀有气体形成的晶体属于共价晶体
5.下列说法正确的是
A.HF、HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
B.Ba(OH)2晶体不导电,但熔化后可以导电
C.干冰属于原子晶体,熔化破坏共价键和分子间作用力
D.干冰升华时,分子内共价键会发生断裂
6.Cu、Au能形成多种组成固定的合金,其中一种晶体的晶胞结构(立方体)如图所示,下列说法正确的是
A.该晶体的化学组成可表示为CuAu
B.与1个Cu原子距离最近的Au原子是4个
C.Au填充了由与之距离最近的Cu原子构成的正四面体空隙
D.根据图中信息,铜原子a的分数坐标为(0.5,0.5,0.5)
7.在海洋深处的沉积物中含有大量可燃冰,其主要成分是甲烷水合物。甲烷水合物的结构可以看成是甲烷分子装在由水分子形成的“笼子”里。下列说法正确的是
A.甲烷分子和水分子的VSEPR模型都是正四面体形
B.甲烷分子通过氢键与构成“笼子”的水分子相结合
C.可燃冰属于分子晶体
D.水分子的键角大于甲烷分子的键角
8.下表所列物质晶体的类型全部正确的一组是
原子晶体 离子晶体 分子晶体
A 二氧化硅 硫酸 He
B 碳酸氢铵
C 金刚石 烧碱 白磷
D 铜 KOH 碘晶体
A.A B.B C.C D.D
9.如图是某活泼金属元素A与活泼非金属元素B形成的化合物晶体的一个晶胞,则下列说法中正确的是
A.该晶胞是二维空间粒子非密置层的一层层堆积
B.若晶胞边长为a,则该晶体中A与B粒子之间的最短距离为
C.该晶胞中与A粒子最近且等距的A粒子有8个
D.该晶胞中A粒子、B粒子的配位数都是8
10.下列关于晶体空间立体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶点
B.最小的环为3个Si原子和3个O原子组成的六元环
C.最小的环上实际占有的Si原子和O原子个数之比为1:1
D.最小的环为6个Si原子和6个O原子组成的十二元环
11.下列说法不正确的是
A.石墨晶体中存在共价键与分子间作用力,属于混合型晶体
B.纯金属中加入其它元素会改变规则的层状排列,能增大金属硬度
C.液晶是液体和晶体聚集而成的一种特殊的混合物
D.NaCl和SiC晶体熔化时,克服粒子间作用力的类型不相同
12.GaAs是人工合成的新型半导体材料,其晶体结构与金刚石相似,晶胞边长为anm,下列说法正确的是
A.GaAs晶体中,As与Ga之间存在配位键
B.As原子在晶胞的内部,Ga原子在晶胞的顶角和面上
C.每一个As原子周围最近的As原子有8个
D.As原子与最近的Ga原子之间的距离为
13.下列说法不正确的是
A.晶体具有固定的熔、沸点,而非晶体没有固定的熔、沸点
B.晶体与非晶体具有相同的性质
C.部分电子表、电脑的显示器是由液晶材料制成的
D.等离子体是一种很好的导电体,在信息产业等领域有非常好的应用前景
14.镁单质及其化合物用途广泛,某镁硼化合物的晶胞结构如图所示。B原子独立为一层,具有类似石墨的结构。六棱柱底边边长为,高为,阿伏伽德罗常数的值为。下列说法错误的是
A.该化合物的化学式为
B.该晶胞中的配位数为12
C.每个B原子周围都有2个与之等距离且最近的B原子
D.该晶体的密度为
15.目前最热门的机器人材料液晶弹性体是一种最具代表性的智能材料,在外界刺激下,其相态或分子结构会产生变化,进而改变液晶基元的排列顺序,从而导致材料本身发生宏观形变,当撤去外界刺激后,液晶弹性体可以恢复到原来的形状。下列说法错误的是
A.该液晶同时具有各向异性和弹性
B.这种液晶弹性体机器人可以采用热、光、电、磁等进行驱动
C.该液晶弹性体具有形状记忆功能
D.液晶是介于液态和固态之间的物质状态,而固体是晶体
二、填空题(共8题)
16.X、Y、Z、W为元素周期表前四周期的元素,原子序数依次增大,X原子核外有6种不同运动状态的电子;Y原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
Fe、Co、Ni是三种重要的金属元素,三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为___。CoO的面心立方晶胞如图,设阿伏加德罗常数的值为NA,则CoO晶体的密度为__g·cm-3。
17.据报道,科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N结合3个氮原子而形成8电子稳定结构;
②N—N的键能为167 kJ mol-1。请回答下列问题:
N60分子组成的晶体为_____晶体,其熔、沸点比N2晶体的____(填“高”或“低”),原因是______。
18.灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用力很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图、晶胞俯视图如图所示。
螺旋链状中硒原子采用__杂化,1mol晶胞含___个硒原子(NA是阿伏加德罗常数的值)。
19.Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、4、6,且都含有18个电子,其中B、C是由两种元素的原子组成,且B分子中两种元素原子的个数比均为1 :2 ,C分子中两种元素原子的个数比均为1 :1,D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是___________;
(2)从B分子的立体结构判断,该分子属于________分子(填“极性”或“非极性”);分子空间结构为_______型。
(3)C在实验室可用来制取常见的一种气体单质,试写出该化学反应方程式__________________。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质): ________________。
Ⅱ. Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(5)基态Cu原子的核外电子排布式为_______________。
(6)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于_______________(填晶体类型)。
20.A、B、C、D是四种核电荷数依次增大的短周期元素,A与C的基态原子中L能层都有两个未成对电子,C、D同主族。E的基态原子中M能层有4个未成对电子,F原子N能层只有1个电子,其余各能层均为全充满。根据以上信息填空:
(1)E2+离子的外围电子轨道表示式是_______。
(2)化合物AC2和阴离子ABC-互为等电子体,它们结构相似,ABC-的电子式为_______,所含三种元素第一电离能由小到大的顺序是_______。
(3)B、C、D的最简单氢化物中,B原子的杂化轨道类型为_______,最稳定的是_______。
(4)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲中不存在的微粒间作用力_______ (填标号)。
A.离子键 B.配位键 C.氢键 D.σ键 E. π键
(5)由D,E,F三种元素组成的某种化合物,其晶胞如图所示,是上下底面为正方形的长方体,则其化学式为_______。
21.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有____个。
电池充电时,LiFeO4脱出部分Li+,形成Li1 xFePO4,结构示意图如(b)所示,则x=____,n(Fe2+)∶n(Fe3+)=____。
22.为便于研究只含C、H、O三种元素的有机物燃烧时生成物与所需氧气的量的关系,可用通式、或表示它们(m、n、x、y均为正整数)。例如、、等物质可用通式表示,它们的m分别为1、2、3,n均为1。它们完全燃烧时所需的氧气和生成的二氧化碳的体积比为3∶2。
(1)现有一类只含C、H、O三种元素的有机物,它们完全燃烧时消耗的氧气和生成的二氧化碳的体积比为5∶4,按照上述要求,该类有机物的通式可表示为__________,写出该类有机物相对分子质量最小的物质的结构简式__________。
(2)若某一类有机物可用通式表示,则在相同条件下,该类有机物完全燃烧时消耗氧气的体积和生成的体积必须满足的条件是__________。
23.某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱。供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
(1)仪器a的名称:___________。
(2)锥形瓶中装有某可溶性正盐,a中所盛试剂为___________。
(3)装置B所盛试剂是___________,其作用是___________。
(4)装置C所盛试剂是___________,C中反应的离子方程式是___________。
(5)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是___________。
(6)写出碳、氮、硅三元素的简单气态氢化物的稳定性由强到弱的顺序是(写化学式)___________。
(7)写出碳、氮、硅三元素的简单气态氢化物的沸点由高到低的顺序是(写化学式)___________。
参考答案:
1.B
【解析】有机物分子式为C4H8O3,不饱和度为1,可以与NaHCO3溶液反应,说明有机物分子中含有1个-COOH,等量的有机物与足量的NaHCO3溶液、Na反应时产生的气体在相同条件下的体积比为1:1,则分子内含1个-OH,从结构上看,该有机物可以看作C3H7-COOH中丙基中1个氢原子被一个羟基替代所得,丙基有2种,正丙基中有3种H原子,故对应有3种同分异构体,异丙基中有2种H原子,故对应有2种同分异构体,故该有机物的可能的结构有2+3=5种;
答案选B。
2.A
【解析】A.AgBr和Na2S2O3的物质的量比为1:2,反应的方程式为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr,Na3[Ag(S2O3)2]中内外界离子数比为1:3,A错误;
B.Na2S使配合物转化为黑色沉淀,方程式为Na2S+ 2Na3[Ag(S2O3)2]=Ag2S +4Na2S2O3,故黑色沉淀为Ag2S,B正确;
C.灼烧Ag2S时会生成SO2,SO2是污染气体,需要进行尾气吸收,C正确;
D.根据均摊法,晶胞中Br-的个数为8×+6×=4,D正确;
故选A。
3.D
【解析】A.冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6=3Na++AlF,熔融状态电离产生阳离子和阴离子,说明该物质属于离子晶体,A错误;
B.每个晶胞中含有的个数为,的个数为,冰晶石中与Na+的个数比为1:3,故与必然表示同一种微粒,表示Na+,B错误;
C.根据晶体结构可知:在该晶体中与Na+距离相等且最近的Na+有8个,C错误;
D.晶体的密度ρ=,D正确;
故合理选项是D。
4.B
【解析】A.冰属于分子晶体,构成冰晶体的微粒间存在分子间作用力,所以冰融化时克服的是分子间作用力,共价键不变,A错误;
B.共价晶体中共价键的强弱决定其熔点的高低,所以共价晶体中共价键越强,共价晶体的熔点越高,B正确;
C.晶体中、O原子间形成极性键,C错误;
D.稀有气体分子是单原子分子,形成的晶体为分子晶体,D错误;
故选B。
5.B
【解析】A.由于H-F、H-Cl、H-Br、H-I的键能依次减小,故HF、HCl、HBr、HI的稳定性逐渐减弱,但由于HF中存在分子间氢键,导致其熔沸点反常升高,则熔沸点为HF>HI>HBr>HCl,A错误;
B.Ba(OH)2晶体为离子晶体,由于晶体中的阴、阳离子不能自由移动而不导电,但熔化后中的阴、阳离子可以自由移动,则可以导电,B正确;
C.干冰即固体CO2,是CO2分子通过范德华力作用形成的分子晶体,熔化是只要克服分子间作用力,而不需要破坏共价键,C错误;
D.由C项分析可知,干冰为分子晶体,则干冰升华时,只要克服分子间作用力,而不需要破坏共价键,D错误;
故答案为:B。
6.B
【解析】A.由晶胞结构可知,晶胞中位于面心铜原子的个数为6×=3,位于顶点的金原子的个数为8×=1,则晶体的化学式为为Cu3Au,故A错误;
B.由晶胞结构可知,晶胞中金原子和距离最近的铜原子为顶点和面心的位置关系,则1个铜原子距离最近的金原子是4个,故B正确;
C.由晶胞结构可知,晶胞中金原子和距离最近的铜原子为顶点和面心的位置关系,则金原子没有填充铜原子构成的正八面体空隙,故C错误;
D.由晶胞结构可知,晶胞的边长为1,铜原子a位于晶胞右侧面的面心,分数坐标为(1,0.5,0.5),故D错误;
故选B。
7.C
【解析】A.甲烷分子中碳原子的价层电子对数为4,VSEPR模型为正四面体形,水分子中氧原子的价层电子对数为4,VSEPR模型是四面体形,故A错误;
B.甲烷分子不能与水分子形成分子间氢键,故B错误;
C.可燃冰是由分子形成的分子晶体,故C正确;
D.甲烷分子中碳原子和水分子中氧原子的价层电子对数都为4,但甲烷分子中碳原子的孤对电子对数为0,水分子中氧原子的孤对电子对数为2,孤对电子对成键电子对的斥力大于成键电子对对成键电子对的斥力,所以水分子的键角小于甲烷分子的键角,故D错误;
故选C。
8.C
【解析】A.硫酸的构成微粒是分子,故硫酸是分子晶体,A错误;
B.的构成微粒是分子,故是分子晶体,B错误;
C.金刚石的构成微粒是原子,故金刚石是原子晶体,烧碱的构成微粒是阴阳离子,属于离子晶体,白磷的构成微粒是分子,属于分子晶体,C正确;
D.铜的构成微粒是金属阳离子和自由电子,属于金属晶体,D错误;
故选C。
9.B
【解析】A.该图片是立体结构,A错误;
B.若晶胞边长为a,则该晶体中A与B粒子之间的最短距离为体对角线的四分之一,而体对角线为,故该距离为,B正确;
C.顶点上的每个A粒子,与A粒子最近且等距的A粒子数为,C错误;
D.根据图可知,A的配位数为8,B的配位数为4,D错误;
故选B。
10.D
【解析】A.晶体中存在四面体结构单元,每个原子能形成4个共价键,每个O原子能形成2个共价键,处于中心,O处于4个顶点,故A错误;
B.最小的环为6个原子和6个O原子组成的十二元环,故B错误;
C.每个环实际占有的原子数为,O原子数为,故最小的环上实际占有的原子和O原子个数之比为1:2,故C错误;
D.最小的环为6个原子和6个O原子组成的十二元环,故D正确;
故选D。
11.C
【解析】A.石墨晶体为层状结构,层与层之间的作用力为分子间作用力,层内碳与碳之间以共价键连接,同时层内还有类似于金属键的作用力,所以石墨晶体属于混合型晶体,A正确;
B.纯金属中原子排列规则有序,当加入其他元素后盖面规则的层状排列,使得原子不易发生相对滑动,从而增大金属的硬度,B正确;
C.液晶为由固态向液态转化过程中存在的取向有序的流体,既有液体的易流动性,还保留着部分晶态物质分子的各向异性有序排列,是一种兼有晶体和液体的部分性质的中间态,C错误;
D.NaCl为离子晶体,熔化时破坏离子键,SiC为共价晶体,熔化时破坏共价键,所以二者熔化时克服粒子间作用力的类型不同,D正确;
故选C。
12.A
【解析】A.砷原子还有1对孤对电子,而镓原子有容纳孤对电子的空轨道,所以可以构成配位键,A正确;
B.Ga的半径大于As,从图中可知,晶胞中Ga位于体内,数目为4,As原子位于顶点和面心,数目为8×+6×=4,B错误;
C.以顶点As原子为例,每个As原子周围最近等距离的As原子位于该顶点所在的三个面的面心上,数目为=12,C错误;
D.As原子与最近的Ga原子连线处于晶胞体对角线上,且Ga原子与As原子之间的距离为晶胞体对角线长度的倍,又晶胞的体对角线为晶胞棱长的倍,则Ga原子与As原子之间的距离为,D错误;
故选:A。
13.B
【解析】A.晶体有固定的熔点,自范性、各向异性,非晶体无固定的熔点,故A正确;
B.晶体与非晶体内部结构不同,故表现的性质不同,故B错误;
C.部分电子表、电脑的显示器是由液晶材料制成的,需要的驱动电压很低,故C正确;
D.等离子体是一种很好的导电体,在信息产业等领域有非常好的应用前景,等离子体技术在新能源行业、聚合物薄膜、材料防腐蚀等方面前景可观,故D正确;
故选B。
14.C
【解析】A.1个晶胞含有Mg原子数是、B原子数是6,该化合物的化学式为,故A正确;
B.依据晶胞面心的Mg原子分析,其上层、下层各有6个B原子,所以该晶胞中的配位数为12,故B正确;
C.根据图示,每个B原子周围都有3个与之等距离且最近的B原子,故C错误;
D.晶胞的体积为,该晶体的密度为 ,故D正确;
选C。
15.D
【解析】A.在外界刺激下,其相态或分子结构会产生变化,进而改变液晶基元的排列顺序,从而导致材料本身发生宏观形变,当撤去外界刺激后,液晶弹性体可以恢复到原来的形状,说明该液晶同时具有各向异性和弹性,A正确;
B.在外界刺激下,其相态或分子结构会产生变化,则这种液晶弹性体机器人可以采用热、光、电、磁等进行驱动,B正确;
C.撤去外界刺激后,液晶弹性体可以恢复到原来的形状,则该液晶弹性体具有形状记忆功能,C正确;
D.液晶是介于液态和晶态之间的物质状态,不是介于液态和固态之间的状态,D错误;
故选D。
16. NiO>CoO>FeO
根据三种物质所属的晶体类型判断熔化时克服离子键,利用离子半径的大小判断离子键的强弱,根据离子键的强弱判断熔点的高低;利用均摊法计算晶胞中实际含有的微粒数,根据密度计算公式进行计算晶胞密度;
【解析】三种元素二价氧化物均为离子化合物,其熔点和离子键的强弱有关,离子的半径越小,离子键越强,离子半径r(Fe2+)>r(Co2+)>r(Ni2+),形成的离子键依次增强,熔点依次升高,则熔点NiO>CoO>FeO;根据晶胞结构,O2-占据了面心和顶点,面心的O2-被2个晶胞所共有,顶点被8个晶胞所共有,则该晶体中有个O2-;Co2+占据了棱心和体心,棱心的Co2+被4个晶胞所共有,体心的Co2+被此晶胞所独有,则该晶胞中含有
个Co2+;根据公式可得。
17. 分子 高 N60、N2均形成分子晶体,且N60的相对分子质量较大,分子间作用力较强,故熔、沸点较高
【解析】N60、N2都是由分子形成的分子晶体。对于分子晶体来说,物质的相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高。由于Mr(N60)>Mr(N2),所以N60晶体中的分子间作用力比N2晶体中的大,N60晶体的熔、沸点比N60晶体的高。
18. sp3 9NA
【解析】观察晶胞图示,1个硒原子与2个硒原子形成σ键,硒原子价层电子对0.5×(6+2)=4,故采用sp3杂化;由晶胞图示和晶胞俯视图知,1个晶胞含硒原子数为6×+12×3×=9,所以1 mol晶胞含9NA个硒原子,故答案为:sp3;9NA。
19. Ar 极性 V形 2H2O22H2O+O2↑ D是CH3OH,分子之间能形成氢键 1s22s22p63s23p63d104s1 分子晶体
已知A、B、C、D四种分子所含原子的数目依次为1、3、4和6,且都含有18个电子,则A是Ar,又知B、C是由两种元素的原子组成,B分子中两种元素原子的个数比为1:2,C分子中两种元素原子的个数比为1:1,则B是H2S,C为H2O2,D是一种有毒的有机物,D为CH4O,据此解答。
【解析】已知A、B、C、D四种分子所含原子的数目依次为1、3、4和6,且都含有18个电子,则A是Ar,又知B、C是由两种元素的原子组成,B分子中两种元素原子的个数比为1:2,C分子中两种元素原子的个数比为1:1,则B是H2S,C为H2O2,D是一种有毒的有机物,D为CH4O;
(1)组成A分子的原子的元素符号是Ar;
(2)H2S分子中硫原子的价层电子对=2+=4,且含有两个孤电子对,所以其空间构型是V形,该分子不对称,为极性分子;
(3)H2O2在二氧化锰作用下会迅速产生氧气:2H2O22H2O+O2↑;
(4)D为CH3OH,甲醇与水分子之间形成氢键,导致沸点明显比甲烷高;
(5)Cu的核电荷数是29,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1;
(6)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于分子晶体。
20.(1)
(2) C
(4)C
(5)CuFeS2
A、B、C、D四种短周期元素,它们的核电荷数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;C、D同主族,则D为S元素;E、F都是第四周期元素,E原子核外有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素。
【解析】(1)Fe2+离子的价层电子排布3d6,其价层电子排布图是。
(2)化合物CO2和阴离子CNO-互为等电子体,它们结构相似,CNO-中C原子与O、N原子之间形成2对共用电子对,CNO-的电子式为 ;元素C、N、O属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是C
(4)配合物甲的焰色反应呈紫色,含有K元素,其内界由中心离子Fe3+与配位体CN 构成,配位数为6,甲为K3[Fe(CN)6],甲中存在的微粒间作用力有:配位键、共价键、σ键、π键,由于K3[Fe(CN)6]中没有氢原子,不能形成氢键,故选C。
(5)晶胞中D(S)原子位于晶胞内部,原子数目为8个,E(Fe)原子6个位于面上、4个位于棱上,E(Fe)原子数目=6×+4×=4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×+1+8×=4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2。
21. 4 或0.1875 13:3
【解析】由题干可知,LiFePO4的晶胞中,Fe存在于由O构成的正八面体内部,P存在由O构成的正四面体内部;再分析题干中给出的(a),(b)和(c)三个不同物质的晶胞结构示意图,对比(a)和(c)的差异可知,(a)图所示的LiFePO4的晶胞中,小球表示为Li+,其位于晶胞的8个顶点,4个侧面面心以及上下底面各自的相对的两条棱心处,经计算一个晶胞中Li+的个数为=4个;进一步分析(a)图所示的LiFePO4的晶胞中,八面体结构和四面体结构的数目均为4,即晶胞中含Fe和P的数目均为4;考虑到化学式为LiFePO4,并且一个晶胞中含有的Li+,Fe和P的数目均为4,所以一个晶胞中含有4个LiFePO4单元。对比(a)和(b)两个晶胞结构示意图可知,Li1-xFePO4相比于LiFePO4缺失一个面心的Li+以及一个棱心的Li+;结合上一个空的分析可知,LiFePO4晶胞的化学式为Li4Fe4P4O16,那么Li1-xFePO4晶胞的化学式为Li3.25Fe4P4O16,所以有,即x=0.1875。结合上一个空计算的结果可知,Li1-xFePO4即Li0.8125FePO4;假设Fe2+和Fe3+数目分别为x和y,则列方程组:x+y=1,0.8125+2x+3y+5=4×2,解得x=0.8125,y=0.1875,则Li1-xFePO4中n(Fe2+)∶n(Fe3+)=0.8125∶0.1875=13∶3,故答案为4;或0.1875;13∶3。
22.
【解析】(1)有机物完全燃烧时消耗的氧气体积比生成的二氧化碳体积大,
该类有机物应满足通式,
由燃烧反应方程式,
结合题给条件得,解得,
所以该类有机物通式为。
分别对m、n取值,可得相对分子质量最小的物质的结构简式是。
(2)由燃烧反应方程式可知,
消耗氧气的体积与生成的体积比为,
故,即。
23.(1)分液漏斗
(2)稀硝酸
(3) 饱和碳酸氢钠溶液 吸收气体中硝酸
(4) 硅酸钠溶液 SiO+CO2+H2O=H2SiO3↓+CO
(5)N>C>Si
(6)NH3>CH4>SiH4
(7)NH3>SiH4>CH4
a中装有硝酸,装置A中装有碳酸钠溶液,硝酸与碳酸钠发生强酸制取弱酸的反应生成二氧化碳,装置B中为饱和碳酸氢钠溶液,可以除去挥发的硝酸,装置C中装有硅酸钠溶液,二氧化碳与硅酸钠发生强酸制取弱酸的反应生成硅酸沉淀,由此比较出酸性:HNO3>H2CO3>H2SiO3。
(1)
由图可知,仪器a为分液漏斗;
(2)
由分析可知,a中所盛试剂为稀硝酸;
(3)
由分析可知,装置B所盛试剂是饱和碳酸氢钠溶液,可以除去二氧化碳中的硝酸;
(4)
由分析可知,装置C中装有硅酸钠溶液,二氧化碳与硅酸钠溶液发生反应生成硅酸沉淀,离子方程式为SiO+CO2+H2O=H2SiO3↓+CO;
(5)
元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,酸性:HNO3>H2CO3>H2SiO3,则非金属性:N>C>Si;
(6)
元素的非金属性越强,对其氢化物的稳定性越强,则碳、氮、硅三元素的简单气态氢化物的稳定性由强到弱的顺序为NH3>CH4>SiH4;
(7)
NH3中含有氢键,其沸点较高,CH4和SiH4都是分子晶体,相对分子质量越大,沸点越高,则沸点:NH3>SiH4>CH4。
