第2章元素与物质世界测试卷(含解析)高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第2章元素与物质世界测试卷(含解析)高一上学期化学鲁科版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 860.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-09 00:00:00 | ||
图片预览




文档简介
第2章《元素与物质世界》测试卷
一、单选题
1.已知某一反应体系反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2,则关于该反应体系说法错误的是
A.该反应的化学方程式为2H2CrO4+3H2O2═2Cr(OH)3↓+3O2↑+2H2O
B.该反应中的氧化剂是H2O2,还原产物是O2
C.氧化性:H2CrO4 > O2
D.如反应转移了0.3mol电子,则产生的气体在标准状况下体积为3.36L
2.下列离子方程式不正确的是
A.氯气和氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B.双氧水和酸化后的碘化钾溶液反应2H++H2O2+2I-=2H2O+I2
C.向FeBr2中通入过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.硫酸氢钠溶液与过量氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
3.下列物质按照混合物、非电解质、碱、酸式盐的顺序排列正确的是
A.漂白粉、Cl2、氨水、NaHCO3 B.福尔马林、苯、Cu2(OH)2CO3、明矾
C.盐酸、SO2、纯碱、NH4Cl D.食醋、C2H5OH、苛性钾、NaHSO4
4.下列分散系能产生“丁达尔效应”的是
A.氢氧化铁胶体 B.稀硫酸 C.饱和食盐水 D.硫酸铜溶液
5.某固体可能含有Na+、Ba2+、NH、Mg2+、OH-、Cl-、CO、SO中的几种离子,取等质量的两份该固体,进行如下实验(不考虑水的电离):
(1)一份固体溶于水,加入足量BaCl2溶液,得沉淀2.33g;过滤后加盐酸沉淀不溶解。
(2)另一份固体溶于水,与过量NaOH溶液混合后充分加热,只产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。下列说法正确的是
A.该固体中一定含有NH、Cl-、SO、Na+
B.根据以上实验,无法确定该固体中是否含有Cl-
C.一定存在且n(Cl-)大于等于0.01mol
D.该固体中一定没有Na+、Ba2+、Mg2+、OH-、CO
6.双氧水()是一种重要的绿色氧化剂,在双氧水中滴加少量酸性溶液,紫色溶液迅速褪为无色,同时产生气泡,其反应离子方程式为:,下列说法正确的是
A.在该反应中是还原产物
B.在任何化学反应中都只作氧化剂
C.该反应中氧化剂和还原剂的物质的量之比为2∶5
D.当有完全反应生成时,转移电子数为
7.下列离子反应方程式正确的是
A.氢氧化钡和稀硫酸反应:Ba2++OH-+H++-=BaSO4↓+H2O
B.盐酸溶解碳酸钙:2H++=CO2↑+H2O
C.氨水中加盐酸:NH3·H2O+H+=+H2O
D.铁和稀盐酸:2Fe+6H+=2Fe3++3H2↑
8.已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3+6HCl=3Cl2↑+KCl+3H2O,③2KBrO3+Cl2=Br2+2KClO3。下列说法错误的是
A.反应②中氧化产物与还原产物的物质的量之比为1∶5
B.①中KCl是还原产物,KBr发生氧化反应
C.③中1mol氧化剂参加反应得到电子的物质的量为5mol
D.氧化性由弱到强的顺序为:Br2<Cl2<KClO3<KBrO3
9.下列物质在水溶液中的电离方程式书写正确的是
A.Ba(OH)2=Ba2++(OH)2-
B.K2CO3=K+2+
C.KAl(SO4)2=K++Al3++2
D.Fe2(SO4)3=2Fe2++3
10.下列有关物质用途的说法中,正确的是( )
①Ca(ClO)2可用于杀菌、消毒 ②液氨可用作制冷剂
③Fe2O3常用作红色油漆和涂料 ④SO2可用来漂白馒头、银耳等食品
A.①②③ B.①② C.①③ D.都正确
11.下列关于胶体的说法中,不正确的是
A.与其他分散系的本质区别是能否发生丁达尔效应
B.分散质粒子直径在10-9~l0-7 m之间
C.分散质粒子能穿过滤纸
D.属于介稳体系
12.化学是一门以实验为基础的学科,下列有关实验的说法正确的是
A.取原溶液少许,加入稀盐酸,产生使澄清石灰水变浑浊的无色气体,则溶液中含
B.从煤油中取出钠切一小块,银白色迅速变暗,钠和氧气反应生成了黑色的
C.用洁净铂丝蘸取某溶液进行焰色试验,火焰呈黄色,该溶液是钠盐
D.取原溶液少许,先加适量硝酸酸化,再加入溶液,若产生白色沉淀,则溶液含
13.下列离子方程式的书写正确的是( )
A.Cl2与H2O反应:Cl2+H2O2H++Cl-+ClO-
B.Cu与浓硫酸反应:Cu+2H+=Cu2++H2↑
C.Fe与FeCl3溶液反应:Fe+Fe3+=2Fe2+
D.Mg(OH)2与盐酸反应:Mg(OH)2+2H+=Mg2++2H2O
14.实验室制取少量氯气,为了防止污染空气,吸收多余氯气的最佳试剂是( )
A.自来水 B.NaOH溶液 C.饱和食盐水 D.饱和石灰水
15.下列各组离子能够大量共存且溶液呈无色的是
A.H+、Ag+、Cl-、SO42- B.Mg2+、Al3+、OH-、SO42-
C.K+、Na+、Cl-、CO32- D.NH4+、MnO4-、Na+、NO3-
二、填空题
16.现有下列10种物质:①铁 ②蔗糖固体 ③盐酸 ④熔融CaO ⑤溶液 ⑥ ⑦熔融NaOH ⑧氢氧化铁胶体 ⑨无水酒精 ⑩固体
(1)上述物质属于电解质的有_______(填序号,下同),属于非电解质的有_______。
(2)在水溶液中的电离方程式:_______。
(3)少量通入澄清石灰水反应的离子方程式:_______。
(4)与溶液反应的离子方程式:_______。
(5)实验室制备氢氧化铁胶体的化学方程式:_______。
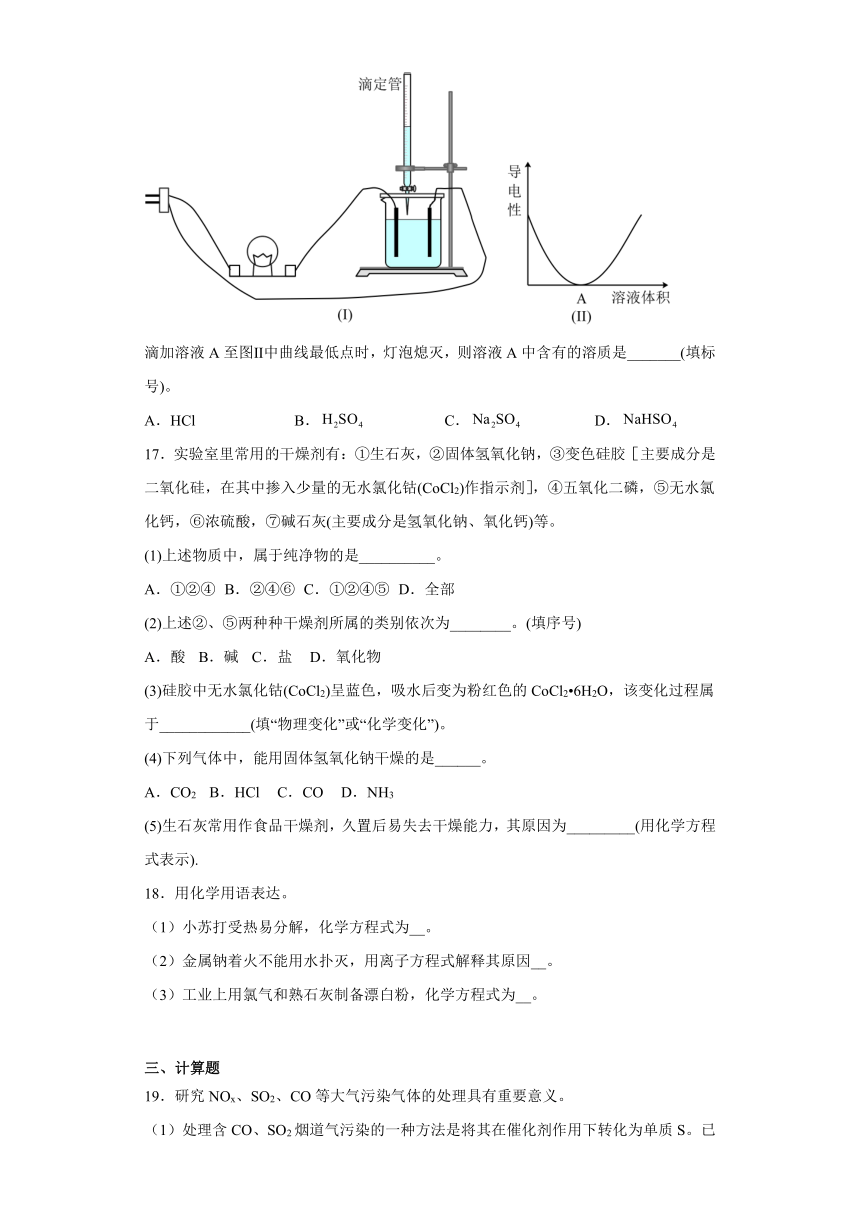
(6)图Ⅰ所示的装置中,烧杯中盛放的是溶液,当从滴定管中逐渐加入A溶液时,溶液导电性的变化趋势如图Ⅱ所示:
滴加溶液A至图Ⅱ中曲线最低点时,灯泡熄灭,则溶液A中含有的溶质是_______(填标号)。
A.HCl B. C. D.
17.实验室里常用的干燥剂有:①生石灰,②固体氢氧化钠,③变色硅胶[主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂],④五氧化二磷,⑤无水氯化钙,⑥浓硫酸,⑦碱石灰(主要成分是氢氧化钠、氧化钙)等。
(1)上述物质中,属于纯净物的是__________。
A.①②④ B.②④⑥ C.①②④⑤ D.全部
(2)上述②、⑤两种种干燥剂所属的类别依次为________。(填序号)
A.酸 B.碱 C.盐 D.氧化物
(3)硅胶中无水氯化钴(CoCl2)呈蓝色,吸水后变为粉红色的CoCl2 6H2O,该变化过程属于____________(填“物理变化”或“化学变化”)。
(4)下列气体中,能用固体氢氧化钠干燥的是______。
A.CO2 B.HCl C.CO D.NH3
(5)生石灰常用作食品干燥剂,久置后易失去干燥能力,其原因为_________(用化学方程式表示).
18.用化学用语表达。
(1)小苏打受热易分解,化学方程式为__。
(2)金属钠着火不能用水扑灭,用离子方程式解释其原因__。
(3)工业上用氯气和熟石灰制备漂白粉,化学方程式为__。
三、计算题
19.研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
此反应的热化学方程式是_______。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下22.4L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_mol,放出的热量为___kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,则ΔH2=__。
20.我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸。检验实验中是否加碘,可利用如下反应:
(1)该反应中氧化剂和还原剂的物质的量之比为___________;
(2)如果反应中转移0.5mol电子,则生成的物质的量为_____________;
(3)若要提取生成的碘,所用的萃取剂可以是_________(填序号)
①水 ②酒精 ③淀粉溶液 ④四氯化碳
四、实验题
21.检测血液中Ca2+的浓度可用于判断多种疾病。某研究性学习小组设计如下实验测定血液中Ca2+的浓度。
(1)配制酸性KMnO4溶液。如图是配制100 mL0.010 mol·L-1酸性KMnO4溶液的过程示意图。
① 配制100 mL0.010 mol·L-1酸性KMnO4溶液时所需称量(分析天平,精确度0.0001g)KMnO4固体的质量为_______g。
②观察图示并判断其中不正确的操作有_______ (填序号)。
③其中使用的玻璃仪器除量筒、烧杯外还有_______(填名称)。
④如果按照图示的操作配制溶液,在其他操作均正确的情况下,配制溶液的浓度将_______ (填“偏大”或“偏小”)。
(2)测定血液样品中Ca2+的浓度。取血液样品40.00 mL,加适量的草酸铵[(NH4)2C2O4]溶液可析出草酸钙(CaC2O4)沉淀,将洗涤后的草酸钙沉淀溶于强酸可得草酸(H2C2O4),再用0.010 mol·L-1酸性KMnO4溶液反应,反应完全时,共消耗48.00 mL酸性KMnO4溶液。涉及的反应为:5H2C2O4+2MnO+6H+=2Mn2++10CO2↑+8H2O。计算血液样品中Ca2+的浓度为_______mg·mL-1。(写出计算过程)
参考答案:
1.B
【详解】A.根据题意可知该过程中H2O2被氧化,根据所给物质中各元素的价态变化规律可知H2CrO4应为氧化剂,将H2O2氧化成O2,自身被还原成Cr(OH)3,结合电子守恒和元素守恒可得化学方程式为2H2CrO4+3H2O2═2Cr(OH)3↓+3O2↑+2H2O,故A正确;
B.根据元素的价态变化可知H2O2是还原剂,O2为氧化产物,故B错误;
C.反应中氧化剂的氧化性大于氧化产物的氧化性,所以氧化性:H2CrO4>O2,故C正确;
D.该反应中O2为唯一氧化产物,H2O2→O2过程中O元素化合价升高1价,所以每生成一个O2转移2个电子,则转移0.3mol电子时生成0.15molO2,标况下体积为0.15mol22.4L/mol=3.36L,故D正确;
综上所述答案为B。
2.C
【详解】A.氯气和氢氧化钠溶液反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故A正确;
B.双氧水和酸化后的碘化钾溶液发生氧化还原反应,反应的离子方程式为:2H++H2O2+2I-═2H2O+I2,故B正确;
C.FeBr2 中通入过量的Cl2,FeBr2 完全被氧化,正确的离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C错误;
D.硫酸氢钠溶液与过量氢氧化钡溶液混合,反应生成硫酸钡沉淀、水和氢氧化钠,H++SO42-+Ba2++OH-═BaSO4↓+H2O,故D正确;
故选C。
【点睛】本题的易错点为D,要注意硫酸氢钠溶液与氢氧化钡反应的离子方程式与反应后溶液的性质有关,与过量氢氧化钡溶液,反应后溶液显碱性;若溶液显中性,则为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O。
3.D
【详解】A.氯气是单质,不是非电解质,故错误;
B.碱式碳酸铜属于盐,故错误;
C.氯化铵是盐,不是酸式盐,故错误;
D.食醋是醋酸的水溶液,是混合物,乙醇是非电解质,苛性钾是氢氧化钾,是碱,硫酸氢钠属于酸式盐,故正确。
故选D。
【点睛】掌握电解质和非电解质的定义和物质类别。在水溶液中或熔融状态下能导电的化合物为电解质,都不导电的化合物为非电解质。注意单质和混合物不是电解质也不是非电解质。
4.A
【详解】分散系分为溶液、胶体、浊液,胶体粒子的直径在1~100nm之间,分散质微粒直径小于1nm的是溶液,大于100nm的是浊液,丁达尔效应是指当一束光线透过胶体时,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路”,丁达尔现象是胶体特有的性质,故B、C、D错误,A正确;
故选A。
5.C
【分析】一份固体溶于水的溶液,加入足量BaCl2溶液,得沉淀2.33g,在沉淀中加入过量稀盐酸,仍有2.33g沉淀,是硫酸钡沉淀,物质的量为0.01mol,而碳酸钡沉淀溶于稀盐酸,所以说明原溶液中一定含有,一定不含Ba2+、CO,;另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体,即氨气0.672L即0.03mol(标准状况),所以含有铵根离子0.03mol,则一定含有NH,一定不含OH-,根据电荷守恒,所以一定含有氯离子,其物质的量至少是:0.03mol×1 0.01mol×2=0.01mol,钠离子无法确定是否存在;
【详解】A.根据上述分析,该固体中一定含有NH、Cl-、,Na+不确定是否存在,A错误;
B.该固体一定含有Cl-,B错误;
C.该固体中一定含有氯离子,其物质的量至少是:0.03mol×1 0.01mol×2=0.01mol,C正确;
D.Na+不确定是否存在,D错误;
故选C。
6.C
【详解】A.该反应中中-1价的O被氧化生成氧气,氧气为氧化产物,故A错误;
B.该反应中中-1价的O被氧化生成氧气,氧气为氧化产物,在此反应为还原剂,故B错误;
C.该反应中为氧化剂,为还原剂,根据方程式得氧化剂和还原剂的物质的量之比为2∶5,故C正确;
D.+7价的被还原成,转移5mol电子,当有完全反应生成时,转移电子数为,故D错误;
故答案为C。
7.C
【详解】A.氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,反应的离子方程式为:Ba2++2OH-+2H++-=BaSO4↓+2H2O,选项A错误;
B.盐酸溶解碳酸钙,生成氯化钙、二氧化碳和水,反应的离子方程式为:2H++CaCO3=Ca2++CO2↑+H2O,选项B错误;
C.氨水中加盐酸反应生成氯化铵和水,反应的离子方程式为:NH3·H2O+H+=+H2O,选项C正确;
D.铁和稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,选项D错误;
答案选C。
8.A
【详解】A. ②KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂是氯酸钾,参加反应的的氯化氢作还原剂,所以氧化剂与还原剂的物质的量之比为1:5,氧化产物与还原产物的物质的量之比为5∶1,选项A错误;
B.反应①Cl2+2KBr-=2KCl+Br2中氯元素化合价由0价变为-1价被还原,KCl是还原产物,溴元素化合价由-1价变为0价被氧化,KBr发生氧化反应,选项B正确;
C.③2KBrO3+Cl2=Br2+2KClO3中氧化剂是KBrO3,溴元素由+5价变为0价,1mol氧化剂参加反应得到的电子是1×(5-0)mol=5mol,选项C正确;
D.①Cl2+2KBr=2KCl+Br2中氧化剂是氯气,氧化产物是溴,所以氯气的氧化性大于溴,②KClO3+6HCl=3Cl2+KCl+3H2O中氧化剂是氯酸钾,氧化产物是氯气,氯酸钾的氧化性大于氯气,③2KBrO3+Cl2=Br2+2KClO3中氧化剂是溴酸钾,氧化产物是氯酸钾,所以溴酸钾的氧化性大于氯酸钾,总之,氧化性强弱顺序是 KBrO3>KClO3>Cl2>Br2,选项D正确;
答案选A。
9.C
【详解】A.Ba(OH)2是强电解质,在水溶液中电离出Ba2+和OH-,电离方程式为:Ba(OH)2=Ba2++2OH-,故A错误;
B.K2CO3是强电解质,在水溶液中电离出K+和,电离方程式为:K2CO3=2K++,故B错误;
C.KAl(SO4)2是强电解质,在水溶液中电离出K+、Al3+和,电离方程式为:KAl(SO4)2=K++Al3++2,故C正确;
D.Fe2(SO4)3是强电解质,在水溶液中电离出Fe3+和,电离方程式为:Fe2(SO4)3=2Fe3++3,故D错误;
故选C。
10.A
【详解】①Ca(ClO)2中含ClO-,具有强氧化性,可用于杀菌、消毒,故①正确;
②液氨易挥发,吸收热量,可使温度降低,则可用作制冷剂,故②正确;
③Fe2O3为红棕色物质,则可用作红色油漆和涂料,故③正确;
④SO2虽然具有漂白性,但二氧化硫有毒,不能用来漂白馒头、银耳等食品,故④错误;
综上所述,①②③正确,答案为A。
11.A
【详解】A. 胶体与其他分散系的本质区别是分散质微粒直径的大小,A错误;
B. 胶体分散质粒子直径在10-9~l0-7 m之间,溶液的分散质微粒直径小于10-9 m,浊液的分散质微粒的直径大于10-7m,B正确;
C. 胶体分散质粒子直径小于滤纸缝隙的直径,能够穿过滤纸,C正确;
D. 胶体的稳定性介于导体和绝缘体之间,属于介稳体系,D正确;
故合理选项是A。
12.D
【详解】A.加入稀盐酸后产生能使澄清石灰水变浑浊的无色气体,该气体是CO2、SO2中的一种或两种,则原溶液中可能含有、、、中的至少一种,A错误;
B.钠和氧气反应生成的Na2O为白色固体,B错误;
C.进行焰色试验时,火焰呈黄色,说明溶液中含有Na+,该溶液可以是钠盐溶液,也可以是氢氧化钠溶液,C错误;
D.先加适量的稀硝酸将溶液酸化,排除碳酸根等离子的干扰,再加入AgNO3溶液,产生白色沉淀为氯化银,则溶液含Cl-,D正确;
故选D。
13.D
【详解】A.HClO为弱电解质,离子方程式中不可拆,故A错误;
B. Cu与浓硫酸反应的方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,故B错误;
C.电荷不守恒,应为Fe+2Fe3+=3Fe2+,故C错误;
D. Mg(OH)2为沉淀,写成化学式形式,其与盐酸反应离子方程式:Mg(OH)2+2H+=Mg2++2H2O,故D正确;
故答案为D。
14.B
【详解】A.氯气可溶于水,但与水发生可逆反应,自来水不能将氯气完全吸收;
B.氯气可与NaOH溶液完全反应生成氯化钠、次氯酸钠和水,氯气可被完全吸收;
C.饱和食盐水不能溶解氯气,无法吸收氯气;
D.氯气可与饱和石灰水反应生成氯化钙、次氯酸钙和水,由于氢氧化钙在水中的溶解度较小,饱和石灰水中氢氧化钙的含量较低,对氯气的吸收效果不好;
综上分析,吸收多余氯气的最佳试剂是NaOH溶液,答案选B。
15.C
【详解】A.Ag+与Cl-、SO42-反应生成沉淀,不能大量共存,A错误;
B.Mg2+、Al3+与OH-反应生成沉淀,不能大量共存,B错误;
C.K+、Na+、Cl-、CO32-的溶液无色,能够大量共存,C正确;
D.MnO4-是紫红色的,D错误;
故选C。
16.(1) ④⑦⑩ ②⑥⑨
(2)
(3)
(4)
(5)
(6)B
【详解】(1)电解质、非电解质均为化合物(前提是纯净物),属于电解质的有酸、碱、盐、金属氧化物、H2O,本题中④⑦⑩是电解质;属于非电解质的有非金属氧化物(除H2O)、部分有机物(如蔗糖、乙醇)、NH3,本题中②⑥⑨是非电解质;故答案为:④⑦⑩;②⑥⑨;
(2)NaHSO4在水溶液中完全电离为Na+、H+、,故答案为:;
(3)少量CO2通入澄清石灰水,生成CaCO3沉淀和H2O,根据电荷守恒、原子守恒可写出离子方程式,故答案为:;
(4)NaHCO3在水溶液中完全电离为Na+、,NaHSO4在水溶液中完全电离为Na+、H+、,二者在水溶液中发生的反应,本质上是与H+反应生成CO2和H2O,故答案为:;
(5)实验室制备氢氧化铁胶体,是将饱和FeCl3溶液滴入沸水中,故答案为:;
(6)根据图Ⅱ,溶液A与Ba(OH)2溶液反应时,可以使溶液中的离子浓度接近零。
A.HCl与Ba(OH)2反应生成BaCl2和H2O,不会使溶液中离子浓度接近零,不符合题意;
B.H2SO4与Ba(OH)2反应生成BaSO4沉淀和H2O,能够使溶液中离子浓度接近零,符合题意;
C.Na2SO4与Ba(OH)2反应生成BaSO4沉淀和NaOH,不会使溶液中离子浓度接近零,不符合题意;
D.少量NaHSO4与Ba(OH)2反应生成BaSO4沉淀、NaOH和H2O,过量NaHSO4与Ba(OH)2反应生成BaSO4沉淀、Na2SO4和H2O,不会使溶液中离子浓度接近零,不符合题意;故答案为:B。
【点睛】单质、混合物(如盐酸、氨水、某某胶体),既不是电解质也不是非电解质,在分类时一定要注意。
17. C B、C 化学变化 CD CaO+H2O=Ca(OH)2
【详解】(1)①生石灰为CaO,属于纯净物;②固体NaOH属于纯净物;③变色硅胶含SiO2和CoCl2,属于混合物;④五氧化二磷属于纯净物;⑤无水氯化钙属于纯净物;⑥浓硫酸属于混合物;⑦碱石灰的主要成分为NaOH和CaO,属于混合物;属于纯净物的是①②④⑤,答案选C;
(2)②固体NaOH属于碱,⑤无水CaCl2属于盐,故选B、C;
(3)该过程可表示为CoCl2+6H2O=CoCl2·6H2O,有新物质生成,属于化学变化;
(4)CO2、HCl都能被NaOH吸收(相应的反应为CO2+2NaOH=Na2CO3+H2O、HCl+NaOH=NaCl+H2O),所以不能用固体NaOH干燥;CO、NH3不能被固体NaOH吸收,能用固体NaOH干燥;答案选CD;
(5)生石灰久置后易失去干燥能力,由于生石灰吸水生成了Ca(OH)2,反应的化学方程式为CaO+H2O= Ca(OH)2。
18. 2NaHCO3Na2CO3+CO2↑+H2O 2Na+2H2O=2Na++2OH-+H2↑ 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【详解】(1)小苏打是碳酸氢钠,受热易分解生成碳酸钠、二氧化碳和水,其化学方程式为
2NaHCO3Na2CO3+CO2↑+H2O,故答案为:2NaHCO3Na2CO3+CO2↑+H2O;
(2)金属钠易与水发生反应生成氢氧化钠和氢气,所以金属钠着火不能用水扑灭,其离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)熟石灰主要成分是氢氧化钙,氯气与氢氧化钙反应生成次氯酸钙、氯化钙和水,其化学反应方程式为:2Cl2+2Ca(OH)2=CaCl2+
Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
【点睛】84消毒液的制备:Cl2+2NaOH=NaCl+NaClO+H2O;
19. 2CO(g)+SO2(g)= S(s)+2CO2(g) ΔH=-270.0 kJ·mol-1 2 -1180 kJ·mol-1
【分析】根据盖斯定律计算反应热时,通过适当的数学运算得到目标反应,并求出反应热。
【详解】(1)①CO(g)+O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
根据盖斯定律,由①2-②可得到2CO(g)+SO2(g)= S(s)+2CO2(g),则ΔH=(-280.0 kJ·mol-1)2-(-290.0 kJ·mol-1)= -270.0 kJ·mol-1,因此,CO、SO2烟道气在催化剂作用下转化为单质S的热化学方程式是2CO(g)+SO2(g)= S(s)+2CO2(g) ΔH=-270.0 kJ·mol-1。
(2)①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
根据盖斯定律,由①2+②可得到4CO(g)+2NO2(g)= N2(g)+4CO2(g) ΔH=-(2a+b) kJ·mol-1。若用标准状况下22.4L CO(物质的量为1mol)还原NO2至N2(CO完全反应),根据碳元素的化合价变化(由+2到+4)可以知道,整个过程中转移电子的物质的量为2mol;由4CO(g)+2NO2(g)= N2(g)+4CO2(g) ΔH=-(2a+b) kJ·mol-1可以计算,放出的热量为kJ。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
根据盖斯定律,由①+②可得到2CH4(g)+4NO2(g)==2N2(g)+2CO2(g)+4H2O(g) ΔH=ΔH1+ΔH2。若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,ΔH=-860 kJ·mol-12=-1720 kJ·mol-1,则ΔH2=ΔH -ΔH1=-1720 kJ·mol-1-(-540 kJ·mol-1)= -1180 kJ·mol-1。
20. 1:5 0.3mol ④
【分析】反应中,KIO3中碘元素化合价由+5价降为0价,KI中碘元素化合价从-1价升高到0价,据此判断氧化剂和还原剂,进一步进行计算;
【详解】(1)反应中,KIO3中碘元素化合价由+5价降为0价,得到电子,作氧化剂,KI中碘元素化合价从-1价升高到0价,失去电子,作还原剂, 氧化剂和还原剂的物质的量之比为1:5
(2)发生反应生成3molCl2电子转移5mol,那么0.5mol电子转移,生成的I2的物质的量为=0.3mol;
(3)要提取生成的碘常用萃取的方法,碘单质在萃取剂中溶解度大且不与萃取剂反应,综合后选择④CCl4。
【点睛】注意事项:萃取剂选择时,①溶质在萃取剂中的溶解度比在原溶剂中大②萃取剂与原溶剂不反应、不相溶③萃取剂与溶质不反应④常用的萃取剂是苯或CCl4,一般不用酒精作萃取剂。
21.(1) 0.1580 ①③⑤ 玻璃棒、胶头滴管、100 mL容量瓶 偏小
(2)1.2 mg·mL-1
【分析】配制100 mL0.010 mol·L-1酸性KMnO4溶液,需要经过计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等步骤,据此分析回答问题。
【详解】(1)①根据信息可知,KMnO4固体的质量为 ;
②由图示可知,①高锰酸钾具有强氧化性,应放入烧杯中称量,③移液的过程中应该使用玻璃棒引流,⑤定容时,视线,刻线,凹液面应该先切,故为①③⑤;
③其中使用的玻璃仪器除量筒、烧杯外还有玻璃棒、胶头滴管、100 mL容量瓶;
④定容时仰视,水加入的过多,导致配制溶液的浓度将减小;
(2)根据转化关系可知,n(Ca2+)=n(H2C2O4) = n(MnO)= 0.010mol·L-10.048L=1.210-3 mol,m(Ca2+)=40 g·mol-11.210-3 mol=0.048 g,故血液样品中Ca2+的浓度为0.048103 mg/40.00 mL=1.2 mg·mL-1。
一、单选题
1.已知某一反应体系反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2,则关于该反应体系说法错误的是
A.该反应的化学方程式为2H2CrO4+3H2O2═2Cr(OH)3↓+3O2↑+2H2O
B.该反应中的氧化剂是H2O2,还原产物是O2
C.氧化性:H2CrO4 > O2
D.如反应转移了0.3mol电子,则产生的气体在标准状况下体积为3.36L
2.下列离子方程式不正确的是
A.氯气和氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B.双氧水和酸化后的碘化钾溶液反应2H++H2O2+2I-=2H2O+I2
C.向FeBr2中通入过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.硫酸氢钠溶液与过量氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
3.下列物质按照混合物、非电解质、碱、酸式盐的顺序排列正确的是
A.漂白粉、Cl2、氨水、NaHCO3 B.福尔马林、苯、Cu2(OH)2CO3、明矾
C.盐酸、SO2、纯碱、NH4Cl D.食醋、C2H5OH、苛性钾、NaHSO4
4.下列分散系能产生“丁达尔效应”的是
A.氢氧化铁胶体 B.稀硫酸 C.饱和食盐水 D.硫酸铜溶液
5.某固体可能含有Na+、Ba2+、NH、Mg2+、OH-、Cl-、CO、SO中的几种离子,取等质量的两份该固体,进行如下实验(不考虑水的电离):
(1)一份固体溶于水,加入足量BaCl2溶液,得沉淀2.33g;过滤后加盐酸沉淀不溶解。
(2)另一份固体溶于水,与过量NaOH溶液混合后充分加热,只产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。下列说法正确的是
A.该固体中一定含有NH、Cl-、SO、Na+
B.根据以上实验,无法确定该固体中是否含有Cl-
C.一定存在且n(Cl-)大于等于0.01mol
D.该固体中一定没有Na+、Ba2+、Mg2+、OH-、CO
6.双氧水()是一种重要的绿色氧化剂,在双氧水中滴加少量酸性溶液,紫色溶液迅速褪为无色,同时产生气泡,其反应离子方程式为:,下列说法正确的是
A.在该反应中是还原产物
B.在任何化学反应中都只作氧化剂
C.该反应中氧化剂和还原剂的物质的量之比为2∶5
D.当有完全反应生成时,转移电子数为
7.下列离子反应方程式正确的是
A.氢氧化钡和稀硫酸反应:Ba2++OH-+H++-=BaSO4↓+H2O
B.盐酸溶解碳酸钙:2H++=CO2↑+H2O
C.氨水中加盐酸:NH3·H2O+H+=+H2O
D.铁和稀盐酸:2Fe+6H+=2Fe3++3H2↑
8.已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3+6HCl=3Cl2↑+KCl+3H2O,③2KBrO3+Cl2=Br2+2KClO3。下列说法错误的是
A.反应②中氧化产物与还原产物的物质的量之比为1∶5
B.①中KCl是还原产物,KBr发生氧化反应
C.③中1mol氧化剂参加反应得到电子的物质的量为5mol
D.氧化性由弱到强的顺序为:Br2<Cl2<KClO3<KBrO3
9.下列物质在水溶液中的电离方程式书写正确的是
A.Ba(OH)2=Ba2++(OH)2-
B.K2CO3=K+2+
C.KAl(SO4)2=K++Al3++2
D.Fe2(SO4)3=2Fe2++3
10.下列有关物质用途的说法中,正确的是( )
①Ca(ClO)2可用于杀菌、消毒 ②液氨可用作制冷剂
③Fe2O3常用作红色油漆和涂料 ④SO2可用来漂白馒头、银耳等食品
A.①②③ B.①② C.①③ D.都正确
11.下列关于胶体的说法中,不正确的是
A.与其他分散系的本质区别是能否发生丁达尔效应
B.分散质粒子直径在10-9~l0-7 m之间
C.分散质粒子能穿过滤纸
D.属于介稳体系
12.化学是一门以实验为基础的学科,下列有关实验的说法正确的是
A.取原溶液少许,加入稀盐酸,产生使澄清石灰水变浑浊的无色气体,则溶液中含
B.从煤油中取出钠切一小块,银白色迅速变暗,钠和氧气反应生成了黑色的
C.用洁净铂丝蘸取某溶液进行焰色试验,火焰呈黄色,该溶液是钠盐
D.取原溶液少许,先加适量硝酸酸化,再加入溶液,若产生白色沉淀,则溶液含
13.下列离子方程式的书写正确的是( )
A.Cl2与H2O反应:Cl2+H2O2H++Cl-+ClO-
B.Cu与浓硫酸反应:Cu+2H+=Cu2++H2↑
C.Fe与FeCl3溶液反应:Fe+Fe3+=2Fe2+
D.Mg(OH)2与盐酸反应:Mg(OH)2+2H+=Mg2++2H2O
14.实验室制取少量氯气,为了防止污染空气,吸收多余氯气的最佳试剂是( )
A.自来水 B.NaOH溶液 C.饱和食盐水 D.饱和石灰水
15.下列各组离子能够大量共存且溶液呈无色的是
A.H+、Ag+、Cl-、SO42- B.Mg2+、Al3+、OH-、SO42-
C.K+、Na+、Cl-、CO32- D.NH4+、MnO4-、Na+、NO3-
二、填空题
16.现有下列10种物质:①铁 ②蔗糖固体 ③盐酸 ④熔融CaO ⑤溶液 ⑥ ⑦熔融NaOH ⑧氢氧化铁胶体 ⑨无水酒精 ⑩固体
(1)上述物质属于电解质的有_______(填序号,下同),属于非电解质的有_______。
(2)在水溶液中的电离方程式:_______。
(3)少量通入澄清石灰水反应的离子方程式:_______。
(4)与溶液反应的离子方程式:_______。
(5)实验室制备氢氧化铁胶体的化学方程式:_______。
(6)图Ⅰ所示的装置中,烧杯中盛放的是溶液,当从滴定管中逐渐加入A溶液时,溶液导电性的变化趋势如图Ⅱ所示:
滴加溶液A至图Ⅱ中曲线最低点时,灯泡熄灭,则溶液A中含有的溶质是_______(填标号)。
A.HCl B. C. D.
17.实验室里常用的干燥剂有:①生石灰,②固体氢氧化钠,③变色硅胶[主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂],④五氧化二磷,⑤无水氯化钙,⑥浓硫酸,⑦碱石灰(主要成分是氢氧化钠、氧化钙)等。
(1)上述物质中,属于纯净物的是__________。
A.①②④ B.②④⑥ C.①②④⑤ D.全部
(2)上述②、⑤两种种干燥剂所属的类别依次为________。(填序号)
A.酸 B.碱 C.盐 D.氧化物
(3)硅胶中无水氯化钴(CoCl2)呈蓝色,吸水后变为粉红色的CoCl2 6H2O,该变化过程属于____________(填“物理变化”或“化学变化”)。
(4)下列气体中,能用固体氢氧化钠干燥的是______。
A.CO2 B.HCl C.CO D.NH3
(5)生石灰常用作食品干燥剂,久置后易失去干燥能力,其原因为_________(用化学方程式表示).
18.用化学用语表达。
(1)小苏打受热易分解,化学方程式为__。
(2)金属钠着火不能用水扑灭,用离子方程式解释其原因__。
(3)工业上用氯气和熟石灰制备漂白粉,化学方程式为__。
三、计算题
19.研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
此反应的热化学方程式是_______。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下22.4L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_mol,放出的热量为___kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,则ΔH2=__。
20.我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸。检验实验中是否加碘,可利用如下反应:
(1)该反应中氧化剂和还原剂的物质的量之比为___________;
(2)如果反应中转移0.5mol电子,则生成的物质的量为_____________;
(3)若要提取生成的碘,所用的萃取剂可以是_________(填序号)
①水 ②酒精 ③淀粉溶液 ④四氯化碳
四、实验题
21.检测血液中Ca2+的浓度可用于判断多种疾病。某研究性学习小组设计如下实验测定血液中Ca2+的浓度。
(1)配制酸性KMnO4溶液。如图是配制100 mL0.010 mol·L-1酸性KMnO4溶液的过程示意图。
① 配制100 mL0.010 mol·L-1酸性KMnO4溶液时所需称量(分析天平,精确度0.0001g)KMnO4固体的质量为_______g。
②观察图示并判断其中不正确的操作有_______ (填序号)。
③其中使用的玻璃仪器除量筒、烧杯外还有_______(填名称)。
④如果按照图示的操作配制溶液,在其他操作均正确的情况下,配制溶液的浓度将_______ (填“偏大”或“偏小”)。
(2)测定血液样品中Ca2+的浓度。取血液样品40.00 mL,加适量的草酸铵[(NH4)2C2O4]溶液可析出草酸钙(CaC2O4)沉淀,将洗涤后的草酸钙沉淀溶于强酸可得草酸(H2C2O4),再用0.010 mol·L-1酸性KMnO4溶液反应,反应完全时,共消耗48.00 mL酸性KMnO4溶液。涉及的反应为:5H2C2O4+2MnO+6H+=2Mn2++10CO2↑+8H2O。计算血液样品中Ca2+的浓度为_______mg·mL-1。(写出计算过程)
参考答案:
1.B
【详解】A.根据题意可知该过程中H2O2被氧化,根据所给物质中各元素的价态变化规律可知H2CrO4应为氧化剂,将H2O2氧化成O2,自身被还原成Cr(OH)3,结合电子守恒和元素守恒可得化学方程式为2H2CrO4+3H2O2═2Cr(OH)3↓+3O2↑+2H2O,故A正确;
B.根据元素的价态变化可知H2O2是还原剂,O2为氧化产物,故B错误;
C.反应中氧化剂的氧化性大于氧化产物的氧化性,所以氧化性:H2CrO4>O2,故C正确;
D.该反应中O2为唯一氧化产物,H2O2→O2过程中O元素化合价升高1价,所以每生成一个O2转移2个电子,则转移0.3mol电子时生成0.15molO2,标况下体积为0.15mol22.4L/mol=3.36L,故D正确;
综上所述答案为B。
2.C
【详解】A.氯气和氢氧化钠溶液反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故A正确;
B.双氧水和酸化后的碘化钾溶液发生氧化还原反应,反应的离子方程式为:2H++H2O2+2I-═2H2O+I2,故B正确;
C.FeBr2 中通入过量的Cl2,FeBr2 完全被氧化,正确的离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C错误;
D.硫酸氢钠溶液与过量氢氧化钡溶液混合,反应生成硫酸钡沉淀、水和氢氧化钠,H++SO42-+Ba2++OH-═BaSO4↓+H2O,故D正确;
故选C。
【点睛】本题的易错点为D,要注意硫酸氢钠溶液与氢氧化钡反应的离子方程式与反应后溶液的性质有关,与过量氢氧化钡溶液,反应后溶液显碱性;若溶液显中性,则为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O。
3.D
【详解】A.氯气是单质,不是非电解质,故错误;
B.碱式碳酸铜属于盐,故错误;
C.氯化铵是盐,不是酸式盐,故错误;
D.食醋是醋酸的水溶液,是混合物,乙醇是非电解质,苛性钾是氢氧化钾,是碱,硫酸氢钠属于酸式盐,故正确。
故选D。
【点睛】掌握电解质和非电解质的定义和物质类别。在水溶液中或熔融状态下能导电的化合物为电解质,都不导电的化合物为非电解质。注意单质和混合物不是电解质也不是非电解质。
4.A
【详解】分散系分为溶液、胶体、浊液,胶体粒子的直径在1~100nm之间,分散质微粒直径小于1nm的是溶液,大于100nm的是浊液,丁达尔效应是指当一束光线透过胶体时,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路”,丁达尔现象是胶体特有的性质,故B、C、D错误,A正确;
故选A。
5.C
【分析】一份固体溶于水的溶液,加入足量BaCl2溶液,得沉淀2.33g,在沉淀中加入过量稀盐酸,仍有2.33g沉淀,是硫酸钡沉淀,物质的量为0.01mol,而碳酸钡沉淀溶于稀盐酸,所以说明原溶液中一定含有,一定不含Ba2+、CO,;另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体,即氨气0.672L即0.03mol(标准状况),所以含有铵根离子0.03mol,则一定含有NH,一定不含OH-,根据电荷守恒,所以一定含有氯离子,其物质的量至少是:0.03mol×1 0.01mol×2=0.01mol,钠离子无法确定是否存在;
【详解】A.根据上述分析,该固体中一定含有NH、Cl-、,Na+不确定是否存在,A错误;
B.该固体一定含有Cl-,B错误;
C.该固体中一定含有氯离子,其物质的量至少是:0.03mol×1 0.01mol×2=0.01mol,C正确;
D.Na+不确定是否存在,D错误;
故选C。
6.C
【详解】A.该反应中中-1价的O被氧化生成氧气,氧气为氧化产物,故A错误;
B.该反应中中-1价的O被氧化生成氧气,氧气为氧化产物,在此反应为还原剂,故B错误;
C.该反应中为氧化剂,为还原剂,根据方程式得氧化剂和还原剂的物质的量之比为2∶5,故C正确;
D.+7价的被还原成,转移5mol电子,当有完全反应生成时,转移电子数为,故D错误;
故答案为C。
7.C
【详解】A.氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,反应的离子方程式为:Ba2++2OH-+2H++-=BaSO4↓+2H2O,选项A错误;
B.盐酸溶解碳酸钙,生成氯化钙、二氧化碳和水,反应的离子方程式为:2H++CaCO3=Ca2++CO2↑+H2O,选项B错误;
C.氨水中加盐酸反应生成氯化铵和水,反应的离子方程式为:NH3·H2O+H+=+H2O,选项C正确;
D.铁和稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,选项D错误;
答案选C。
8.A
【详解】A. ②KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂是氯酸钾,参加反应的的氯化氢作还原剂,所以氧化剂与还原剂的物质的量之比为1:5,氧化产物与还原产物的物质的量之比为5∶1,选项A错误;
B.反应①Cl2+2KBr-=2KCl+Br2中氯元素化合价由0价变为-1价被还原,KCl是还原产物,溴元素化合价由-1价变为0价被氧化,KBr发生氧化反应,选项B正确;
C.③2KBrO3+Cl2=Br2+2KClO3中氧化剂是KBrO3,溴元素由+5价变为0价,1mol氧化剂参加反应得到的电子是1×(5-0)mol=5mol,选项C正确;
D.①Cl2+2KBr=2KCl+Br2中氧化剂是氯气,氧化产物是溴,所以氯气的氧化性大于溴,②KClO3+6HCl=3Cl2+KCl+3H2O中氧化剂是氯酸钾,氧化产物是氯气,氯酸钾的氧化性大于氯气,③2KBrO3+Cl2=Br2+2KClO3中氧化剂是溴酸钾,氧化产物是氯酸钾,所以溴酸钾的氧化性大于氯酸钾,总之,氧化性强弱顺序是 KBrO3>KClO3>Cl2>Br2,选项D正确;
答案选A。
9.C
【详解】A.Ba(OH)2是强电解质,在水溶液中电离出Ba2+和OH-,电离方程式为:Ba(OH)2=Ba2++2OH-,故A错误;
B.K2CO3是强电解质,在水溶液中电离出K+和,电离方程式为:K2CO3=2K++,故B错误;
C.KAl(SO4)2是强电解质,在水溶液中电离出K+、Al3+和,电离方程式为:KAl(SO4)2=K++Al3++2,故C正确;
D.Fe2(SO4)3是强电解质,在水溶液中电离出Fe3+和,电离方程式为:Fe2(SO4)3=2Fe3++3,故D错误;
故选C。
10.A
【详解】①Ca(ClO)2中含ClO-,具有强氧化性,可用于杀菌、消毒,故①正确;
②液氨易挥发,吸收热量,可使温度降低,则可用作制冷剂,故②正确;
③Fe2O3为红棕色物质,则可用作红色油漆和涂料,故③正确;
④SO2虽然具有漂白性,但二氧化硫有毒,不能用来漂白馒头、银耳等食品,故④错误;
综上所述,①②③正确,答案为A。
11.A
【详解】A. 胶体与其他分散系的本质区别是分散质微粒直径的大小,A错误;
B. 胶体分散质粒子直径在10-9~l0-7 m之间,溶液的分散质微粒直径小于10-9 m,浊液的分散质微粒的直径大于10-7m,B正确;
C. 胶体分散质粒子直径小于滤纸缝隙的直径,能够穿过滤纸,C正确;
D. 胶体的稳定性介于导体和绝缘体之间,属于介稳体系,D正确;
故合理选项是A。
12.D
【详解】A.加入稀盐酸后产生能使澄清石灰水变浑浊的无色气体,该气体是CO2、SO2中的一种或两种,则原溶液中可能含有、、、中的至少一种,A错误;
B.钠和氧气反应生成的Na2O为白色固体,B错误;
C.进行焰色试验时,火焰呈黄色,说明溶液中含有Na+,该溶液可以是钠盐溶液,也可以是氢氧化钠溶液,C错误;
D.先加适量的稀硝酸将溶液酸化,排除碳酸根等离子的干扰,再加入AgNO3溶液,产生白色沉淀为氯化银,则溶液含Cl-,D正确;
故选D。
13.D
【详解】A.HClO为弱电解质,离子方程式中不可拆,故A错误;
B. Cu与浓硫酸反应的方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,故B错误;
C.电荷不守恒,应为Fe+2Fe3+=3Fe2+,故C错误;
D. Mg(OH)2为沉淀,写成化学式形式,其与盐酸反应离子方程式:Mg(OH)2+2H+=Mg2++2H2O,故D正确;
故答案为D。
14.B
【详解】A.氯气可溶于水,但与水发生可逆反应,自来水不能将氯气完全吸收;
B.氯气可与NaOH溶液完全反应生成氯化钠、次氯酸钠和水,氯气可被完全吸收;
C.饱和食盐水不能溶解氯气,无法吸收氯气;
D.氯气可与饱和石灰水反应生成氯化钙、次氯酸钙和水,由于氢氧化钙在水中的溶解度较小,饱和石灰水中氢氧化钙的含量较低,对氯气的吸收效果不好;
综上分析,吸收多余氯气的最佳试剂是NaOH溶液,答案选B。
15.C
【详解】A.Ag+与Cl-、SO42-反应生成沉淀,不能大量共存,A错误;
B.Mg2+、Al3+与OH-反应生成沉淀,不能大量共存,B错误;
C.K+、Na+、Cl-、CO32-的溶液无色,能够大量共存,C正确;
D.MnO4-是紫红色的,D错误;
故选C。
16.(1) ④⑦⑩ ②⑥⑨
(2)
(3)
(4)
(5)
(6)B
【详解】(1)电解质、非电解质均为化合物(前提是纯净物),属于电解质的有酸、碱、盐、金属氧化物、H2O,本题中④⑦⑩是电解质;属于非电解质的有非金属氧化物(除H2O)、部分有机物(如蔗糖、乙醇)、NH3,本题中②⑥⑨是非电解质;故答案为:④⑦⑩;②⑥⑨;
(2)NaHSO4在水溶液中完全电离为Na+、H+、,故答案为:;
(3)少量CO2通入澄清石灰水,生成CaCO3沉淀和H2O,根据电荷守恒、原子守恒可写出离子方程式,故答案为:;
(4)NaHCO3在水溶液中完全电离为Na+、,NaHSO4在水溶液中完全电离为Na+、H+、,二者在水溶液中发生的反应,本质上是与H+反应生成CO2和H2O,故答案为:;
(5)实验室制备氢氧化铁胶体,是将饱和FeCl3溶液滴入沸水中,故答案为:;
(6)根据图Ⅱ,溶液A与Ba(OH)2溶液反应时,可以使溶液中的离子浓度接近零。
A.HCl与Ba(OH)2反应生成BaCl2和H2O,不会使溶液中离子浓度接近零,不符合题意;
B.H2SO4与Ba(OH)2反应生成BaSO4沉淀和H2O,能够使溶液中离子浓度接近零,符合题意;
C.Na2SO4与Ba(OH)2反应生成BaSO4沉淀和NaOH,不会使溶液中离子浓度接近零,不符合题意;
D.少量NaHSO4与Ba(OH)2反应生成BaSO4沉淀、NaOH和H2O,过量NaHSO4与Ba(OH)2反应生成BaSO4沉淀、Na2SO4和H2O,不会使溶液中离子浓度接近零,不符合题意;故答案为:B。
【点睛】单质、混合物(如盐酸、氨水、某某胶体),既不是电解质也不是非电解质,在分类时一定要注意。
17. C B、C 化学变化 CD CaO+H2O=Ca(OH)2
【详解】(1)①生石灰为CaO,属于纯净物;②固体NaOH属于纯净物;③变色硅胶含SiO2和CoCl2,属于混合物;④五氧化二磷属于纯净物;⑤无水氯化钙属于纯净物;⑥浓硫酸属于混合物;⑦碱石灰的主要成分为NaOH和CaO,属于混合物;属于纯净物的是①②④⑤,答案选C;
(2)②固体NaOH属于碱,⑤无水CaCl2属于盐,故选B、C;
(3)该过程可表示为CoCl2+6H2O=CoCl2·6H2O,有新物质生成,属于化学变化;
(4)CO2、HCl都能被NaOH吸收(相应的反应为CO2+2NaOH=Na2CO3+H2O、HCl+NaOH=NaCl+H2O),所以不能用固体NaOH干燥;CO、NH3不能被固体NaOH吸收,能用固体NaOH干燥;答案选CD;
(5)生石灰久置后易失去干燥能力,由于生石灰吸水生成了Ca(OH)2,反应的化学方程式为CaO+H2O= Ca(OH)2。
18. 2NaHCO3Na2CO3+CO2↑+H2O 2Na+2H2O=2Na++2OH-+H2↑ 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【详解】(1)小苏打是碳酸氢钠,受热易分解生成碳酸钠、二氧化碳和水,其化学方程式为
2NaHCO3Na2CO3+CO2↑+H2O,故答案为:2NaHCO3Na2CO3+CO2↑+H2O;
(2)金属钠易与水发生反应生成氢氧化钠和氢气,所以金属钠着火不能用水扑灭,其离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)熟石灰主要成分是氢氧化钙,氯气与氢氧化钙反应生成次氯酸钙、氯化钙和水,其化学反应方程式为:2Cl2+2Ca(OH)2=CaCl2+
Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
【点睛】84消毒液的制备:Cl2+2NaOH=NaCl+NaClO+H2O;
19. 2CO(g)+SO2(g)= S(s)+2CO2(g) ΔH=-270.0 kJ·mol-1 2 -1180 kJ·mol-1
【分析】根据盖斯定律计算反应热时,通过适当的数学运算得到目标反应,并求出反应热。
【详解】(1)①CO(g)+O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
根据盖斯定律,由①2-②可得到2CO(g)+SO2(g)= S(s)+2CO2(g),则ΔH=(-280.0 kJ·mol-1)2-(-290.0 kJ·mol-1)= -270.0 kJ·mol-1,因此,CO、SO2烟道气在催化剂作用下转化为单质S的热化学方程式是2CO(g)+SO2(g)= S(s)+2CO2(g) ΔH=-270.0 kJ·mol-1。
(2)①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
根据盖斯定律,由①2+②可得到4CO(g)+2NO2(g)= N2(g)+4CO2(g) ΔH=-(2a+b) kJ·mol-1。若用标准状况下22.4L CO(物质的量为1mol)还原NO2至N2(CO完全反应),根据碳元素的化合价变化(由+2到+4)可以知道,整个过程中转移电子的物质的量为2mol;由4CO(g)+2NO2(g)= N2(g)+4CO2(g) ΔH=-(2a+b) kJ·mol-1可以计算,放出的热量为kJ。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
根据盖斯定律,由①+②可得到2CH4(g)+4NO2(g)==2N2(g)+2CO2(g)+4H2O(g) ΔH=ΔH1+ΔH2。若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,ΔH=-860 kJ·mol-12=-1720 kJ·mol-1,则ΔH2=ΔH -ΔH1=-1720 kJ·mol-1-(-540 kJ·mol-1)= -1180 kJ·mol-1。
20. 1:5 0.3mol ④
【分析】反应中,KIO3中碘元素化合价由+5价降为0价,KI中碘元素化合价从-1价升高到0价,据此判断氧化剂和还原剂,进一步进行计算;
【详解】(1)反应中,KIO3中碘元素化合价由+5价降为0价,得到电子,作氧化剂,KI中碘元素化合价从-1价升高到0价,失去电子,作还原剂, 氧化剂和还原剂的物质的量之比为1:5
(2)发生反应生成3molCl2电子转移5mol,那么0.5mol电子转移,生成的I2的物质的量为=0.3mol;
(3)要提取生成的碘常用萃取的方法,碘单质在萃取剂中溶解度大且不与萃取剂反应,综合后选择④CCl4。
【点睛】注意事项:萃取剂选择时,①溶质在萃取剂中的溶解度比在原溶剂中大②萃取剂与原溶剂不反应、不相溶③萃取剂与溶质不反应④常用的萃取剂是苯或CCl4,一般不用酒精作萃取剂。
21.(1) 0.1580 ①③⑤ 玻璃棒、胶头滴管、100 mL容量瓶 偏小
(2)1.2 mg·mL-1
【分析】配制100 mL0.010 mol·L-1酸性KMnO4溶液,需要经过计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等步骤,据此分析回答问题。
【详解】(1)①根据信息可知,KMnO4固体的质量为 ;
②由图示可知,①高锰酸钾具有强氧化性,应放入烧杯中称量,③移液的过程中应该使用玻璃棒引流,⑤定容时,视线,刻线,凹液面应该先切,故为①③⑤;
③其中使用的玻璃仪器除量筒、烧杯外还有玻璃棒、胶头滴管、100 mL容量瓶;
④定容时仰视,水加入的过多,导致配制溶液的浓度将减小;
(2)根据转化关系可知,n(Ca2+)=n(H2C2O4) = n(MnO)= 0.010mol·L-10.048L=1.210-3 mol,m(Ca2+)=40 g·mol-11.210-3 mol=0.048 g,故血液样品中Ca2+的浓度为0.048103 mg/40.00 mL=1.2 mg·mL-1。
