人教版(2019)选择性必修二 2.2.2 杂化轨道理论 课件(共16张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修二 2.2.2 杂化轨道理论 课件(共16张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-09 00:00:00 | ||
图片预览


文档简介
(共16张PPT)
《物质结构与性质》专题复习(第六课时)
分子的空间结构(二)
册 别:选择性必修2
学 科:高中化学(人教版)
杂化轨道理论
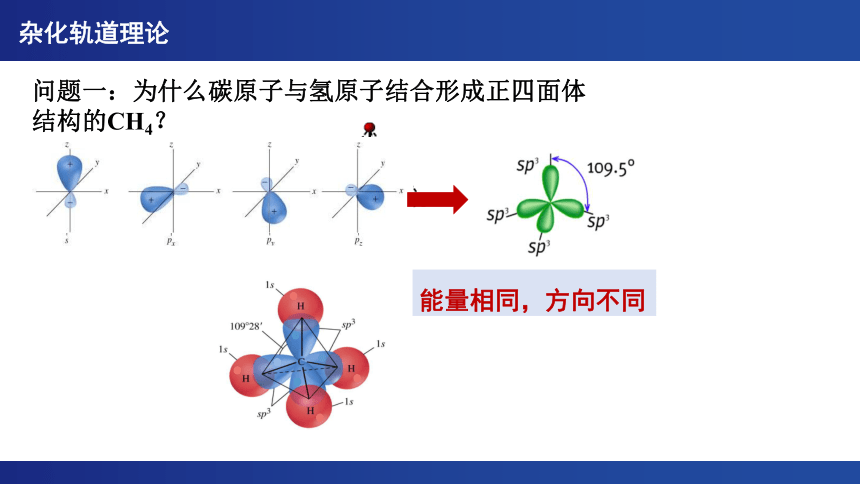
问题一:为什么碳原子与氢原子结合形成正四面体结构的CH4?
CH4
能量相同,方向不同
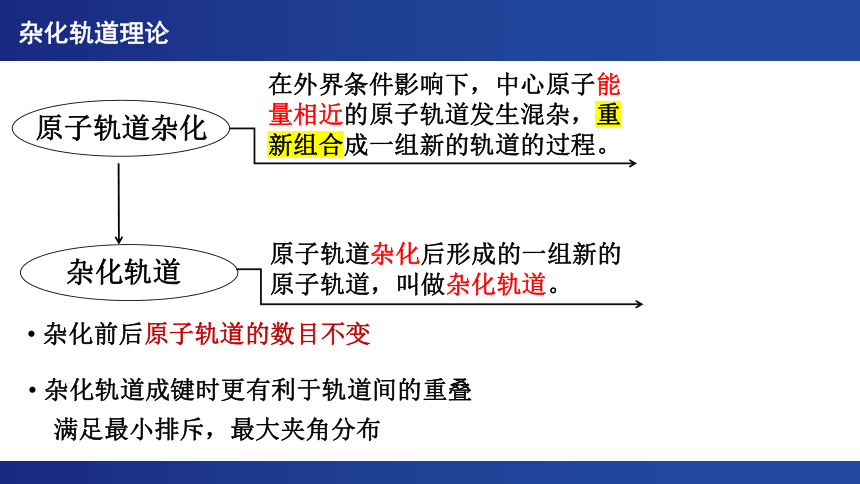
原子轨道杂化
杂化轨道
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
原子轨道杂化后形成的一组新的原子轨道,叫做杂化轨道。
杂化轨道理论
杂化前后原子轨道的数目不变
杂化轨道成键时更有利于轨道间的重叠
满足最小排斥,最大夹角分布
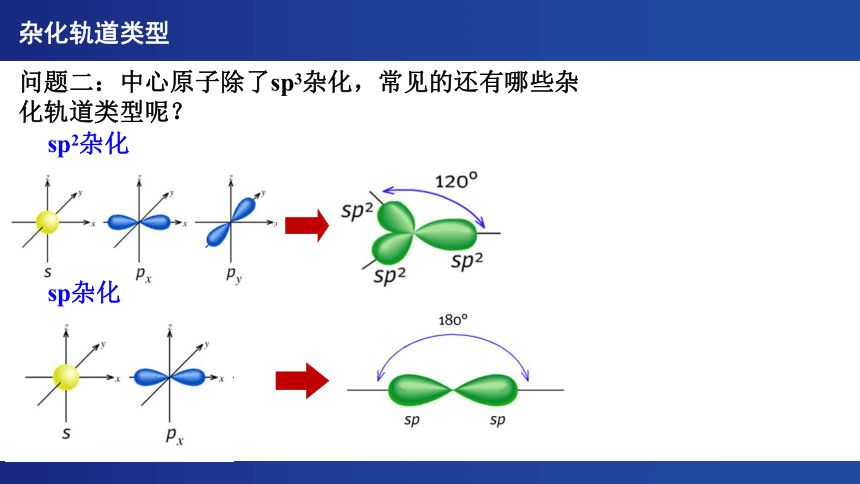
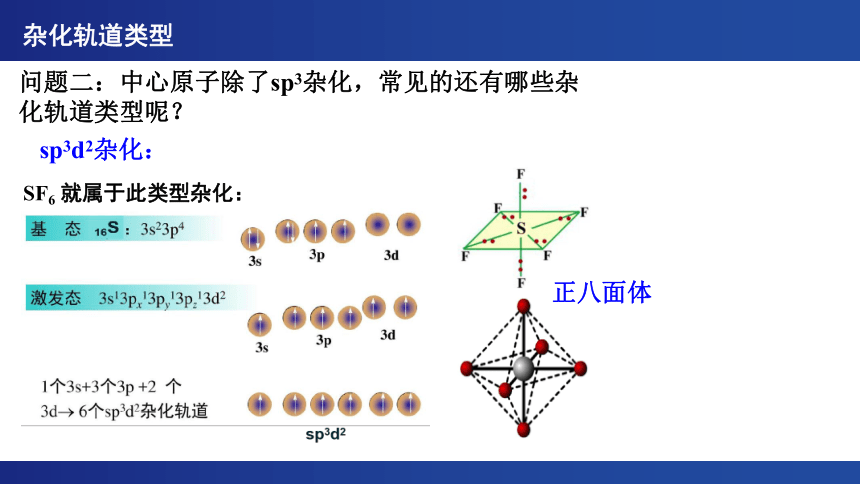
问题二:中心原子除了sp3杂化,常见的还有哪些杂化轨道类型呢?
sp2杂化
杂化轨道类型
sp杂化
杂化轨道类型
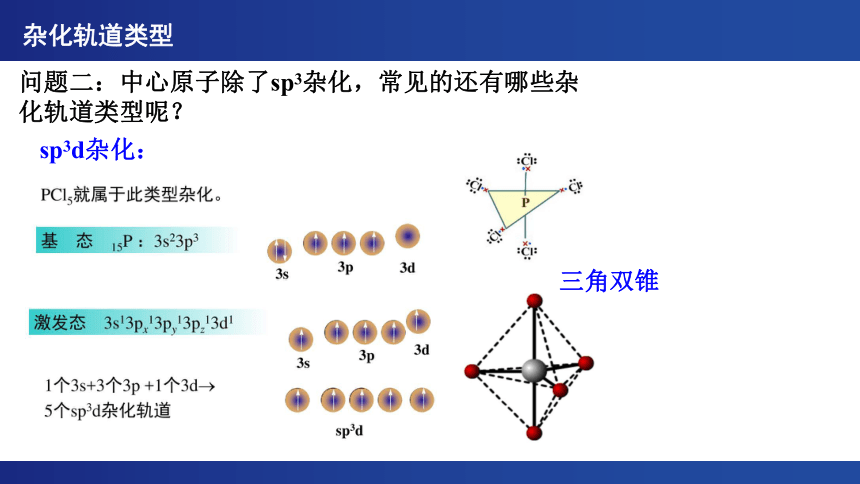
sp3d杂化:
问题二:中心原子除了sp3杂化,常见的还有哪些杂化轨道类型呢?
三角双锥
杂化轨道类型
sp3d2杂化:
问题二:中心原子除了sp3杂化,常见的还有哪些杂化轨道类型呢?
SF6 就属于此类型杂化:
正八面体
判断杂化轨道类型
问题三:如何判断中心原子的杂化轨道类型呢?
中心原子的杂化类型与VSEPR模型的关系:
杂化轨道用于形成σ键或用来容纳未参与成键的孤电子对。
杂化轨道数 = 价层电子对数
= 中心原子孤电子对数+中心原子σ键电子对数
中心原子价层电子对数为4
中心原子价层电子对数为3
中心原子价层电子对数为2
sp3杂化
sp2杂化
sp杂化
VSEPR模型、杂化轨道类型与空间结构
粒子 中心原子 分子空间结构
价层电子对数 VSEPR模型 杂化轨道类型 杂化轨道数 SO2
H2O
HCN
BF3
NH3
H3O+
CH2O
SO42-
3
3
平面三角形
sp2
V形
4
4
四面体形
sp3
V形
2
2
直线形
sp
直线形
3
3
平面三角形
sp2
平面三角形
4
4
四面体形
sp3
三角锥形
4
4
四面体形
sp3
三角锥形
3
3
平面三角形
sp2
平面三角形
4
4
四面体形
sp3
正四面体形
杂化轨道理论的应用
问题四:试用杂化轨道理论分析乙烯、乙炔和苯分子的成键情况?
未参与杂化的p轨道可用于形成π键
CH2=CH2
杂化轨道理论的应用
CH2=CH2
问题四:试用杂化轨道理论分析乙烯、乙炔和苯分子的成键情况?
π键
杂化轨道理论的应用
问题四:试用杂化轨道理论分析乙烯、乙炔和苯分子的成键情况?
未参与杂化的p轨道可用于形成π键
CH CH
杂化轨道理论的应用
问题四:试用杂化轨道理论分析乙烯、乙炔和苯分子的成键情况?
C6H6
sp2杂化
大π 键
杂化轨道理论的应用
问题五:为什么石墨能导电?
石墨中的碳原子采取sp2杂化,每个碳原子剩余一个未参与杂化的p轨道,分别垂直于层平面而相互平行。这些p轨道中的电子参与形成了大π 键 ,且能相对自由移动。
当堂练习
1.在 中,中间的碳原子和两边的碳原子分别采用的杂化方式是( )
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp3
解析
中间的碳原子上的孤电子对数为0,σ键个数为3;
两边的碳原子上的孤电子对数为0,σ键个数为4。
C
当堂练习
解析:分子中的两个碳原子都是采取sp2杂化,溴原子的价电子排布式为4s24p5,4p轨道上的一个未成对电子与碳原子的一个sp2杂化轨道成键。
2.在BrCH=CHBr分子中,C—Br键采用的成键轨道是( )
A.sp-p B.sp2-s
C.sp2-p D.sp3-p
C
课堂小结
《物质结构与性质》专题复习(第六课时)
分子的空间结构(二)
册 别:选择性必修2
学 科:高中化学(人教版)
杂化轨道理论
问题一:为什么碳原子与氢原子结合形成正四面体结构的CH4?
CH4
能量相同,方向不同
原子轨道杂化
杂化轨道
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
原子轨道杂化后形成的一组新的原子轨道,叫做杂化轨道。
杂化轨道理论
杂化前后原子轨道的数目不变
杂化轨道成键时更有利于轨道间的重叠
满足最小排斥,最大夹角分布
问题二:中心原子除了sp3杂化,常见的还有哪些杂化轨道类型呢?
sp2杂化
杂化轨道类型
sp杂化
杂化轨道类型
sp3d杂化:
问题二:中心原子除了sp3杂化,常见的还有哪些杂化轨道类型呢?
三角双锥
杂化轨道类型
sp3d2杂化:
问题二:中心原子除了sp3杂化,常见的还有哪些杂化轨道类型呢?
SF6 就属于此类型杂化:
正八面体
判断杂化轨道类型
问题三:如何判断中心原子的杂化轨道类型呢?
中心原子的杂化类型与VSEPR模型的关系:
杂化轨道用于形成σ键或用来容纳未参与成键的孤电子对。
杂化轨道数 = 价层电子对数
= 中心原子孤电子对数+中心原子σ键电子对数
中心原子价层电子对数为4
中心原子价层电子对数为3
中心原子价层电子对数为2
sp3杂化
sp2杂化
sp杂化
VSEPR模型、杂化轨道类型与空间结构
粒子 中心原子 分子空间结构
价层电子对数 VSEPR模型 杂化轨道类型 杂化轨道数 SO2
H2O
HCN
BF3
NH3
H3O+
CH2O
SO42-
3
3
平面三角形
sp2
V形
4
4
四面体形
sp3
V形
2
2
直线形
sp
直线形
3
3
平面三角形
sp2
平面三角形
4
4
四面体形
sp3
三角锥形
4
4
四面体形
sp3
三角锥形
3
3
平面三角形
sp2
平面三角形
4
4
四面体形
sp3
正四面体形
杂化轨道理论的应用
问题四:试用杂化轨道理论分析乙烯、乙炔和苯分子的成键情况?
未参与杂化的p轨道可用于形成π键
CH2=CH2
杂化轨道理论的应用
CH2=CH2
问题四:试用杂化轨道理论分析乙烯、乙炔和苯分子的成键情况?
π键
杂化轨道理论的应用
问题四:试用杂化轨道理论分析乙烯、乙炔和苯分子的成键情况?
未参与杂化的p轨道可用于形成π键
CH CH
杂化轨道理论的应用
问题四:试用杂化轨道理论分析乙烯、乙炔和苯分子的成键情况?
C6H6
sp2杂化
大π 键
杂化轨道理论的应用
问题五:为什么石墨能导电?
石墨中的碳原子采取sp2杂化,每个碳原子剩余一个未参与杂化的p轨道,分别垂直于层平面而相互平行。这些p轨道中的电子参与形成了大π 键 ,且能相对自由移动。
当堂练习
1.在 中,中间的碳原子和两边的碳原子分别采用的杂化方式是( )
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp3
解析
中间的碳原子上的孤电子对数为0,σ键个数为3;
两边的碳原子上的孤电子对数为0,σ键个数为4。
C
当堂练习
解析:分子中的两个碳原子都是采取sp2杂化,溴原子的价电子排布式为4s24p5,4p轨道上的一个未成对电子与碳原子的一个sp2杂化轨道成键。
2.在BrCH=CHBr分子中,C—Br键采用的成键轨道是( )
A.sp-p B.sp2-s
C.sp2-p D.sp3-p
C
课堂小结
