人教版(2019)选择性必修一 3.2.3 酸碱中和滴定 课件(共17张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修一 3.2.3 酸碱中和滴定 课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 484.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-09 14:47:01 | ||
图片预览






文档简介
(共17张PPT)
酸碱中和滴定
册 别:选择性必修1
学 科:高中化学(人教版)
通过酸碱指示剂、pH试纸、pH计等
2.现有一瓶未知浓度的盐酸, 如何准确测出其真实浓度?
酸碱中和滴定
【思考与讨论】
1.如何判断一个失去标签的溶液是酸还是碱?
0.1000mol/L
【小试牛刀】
用0.1000mol/L的NaOH溶液测定20.00mL未知
浓度HCl的溶液,测定完成时,用去NaOH溶液
20.00mL。通过计算测得HCl溶液的浓度是多少?
【学习任务一】认识酸碱中和滴定
标准液
待测液
2.原理:
中和反应:H++OH-=H2O
c(H+)·V酸=c(OH-)·V碱
c标V标
V测
=
c测
思考1:如何保证测定c(测)的准确性?
1.概念:依据中和反应,用已知浓度的碱(或酸)来测定未知浓度的酸(或碱) 的方法,叫做酸碱中和滴定。
酸碱恰好完全反应: n(H+) = n(OH-)
3.实验的关键:
(1)V(测)要准,不多不少
(2)V(标)要准,准确判断中和反应是否恰好完全反应
c标V标
V测
=
c测
已知
滴定管
思考2:溶液体积V如何准确量取?
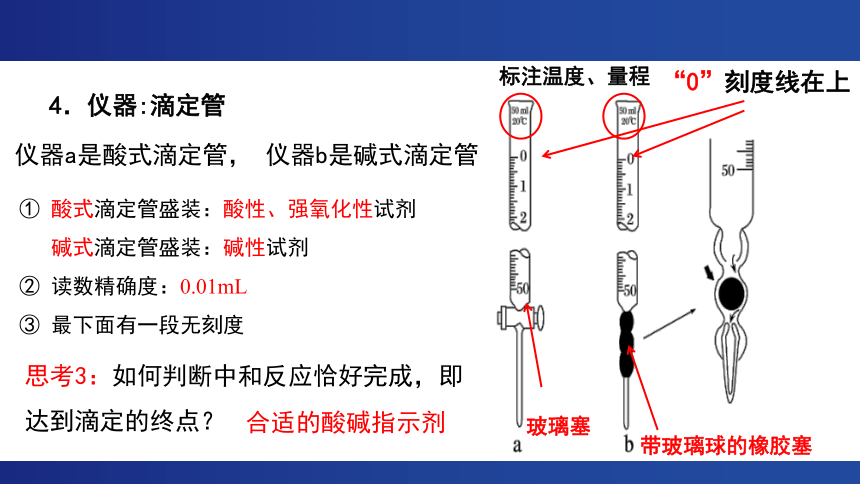
4.仪器:滴定管
玻璃塞
带玻璃球的橡胶塞
标注温度、量程
“0”刻度线在上
仪器a是酸式滴定管, 仪器b是碱式滴定管
① 酸式滴定管盛装:酸性、强氧化性试剂
碱式滴定管盛装:碱性试剂
② 读数精确度:0.01mL
③ 最下面有一段无刻度
思考3:如何判断中和反应恰好完成,即达到滴定的终点?
合适的酸碱指示剂
5.指示剂的选择
原则:
①滴定终点时颜色变化要明显,指示剂变色范围要窄(一般不用石蕊)
②指示剂变色范围尽量接近终点时溶液的pH。
红 橙 黄
红 紫 蓝
无色 粉红 红
用0.10 mol/L 的NaOH溶液滴定20 mL 0.10 mol/L 的HCl 溶液,
计算反应过程中溶液的pH值。
填写下表,并绘制pH-V(NaOH)/mL图像。
【学生活动】
V (NaOH)/mL 0.00 10.00 19.00 19.96 20.00 20.04 21.00 30.00
pH
1
7
19.96
20.04
V (NaOH)/mL 0.00 10.00 19.00 19.96 20.00 20.04 21.00 30.00
pH 1 1.5 2.6 4 7 10 11.4 12.4
等当点
突跃范围
绘制pH随NaOH溶液体积变化的曲线图
突跃范围
酚 酞
20.04
甲基橙
19.96
NaOH溶液的体积/mL
溶液的pH
滴定突跃:接近反应终点时,很少量(0.04 mL,约1滴)的酸或碱会引起pH的突跃。
结论:甲基橙和酚酞都可以作为强碱滴强酸的指示剂。
【学习任务二】中和滴定的实验操作
1.滴定前的准备工作
①查漏:使用前先检查滴定管活塞是否漏水。
②润洗:滴定管在加入反应液之前,先用蒸馏水洗涤干净,然后分别用所要盛装的溶液润洗2~3遍。
③装液:分别将反应液加入相应滴定管中,使液面位于滴定管“0”刻度线以上2~3mL处。
⑤调液面,记数据:在滴定管下放一烧杯,然后调节滴定管液面使其处于某一刻度,准确读取数值并记录V1。
④排气泡:调节活塞,使滴定管尖嘴部分充满反应液
酸式滴定管→快速放液;碱式滴定管→橡皮管向上翘起
滴定管
1.滴定前的准备工作
锥形瓶
①洗涤:使用前先用蒸馏水洗涤干净
②装液:装入一定量的待测液
③指示剂:加入2-3滴指示剂
2.滴定
锥形瓶内溶液颜色变化
摇动锥形瓶
旋转酸定管活塞或挤压碱式滴定管玻璃珠
3.终点判断(以盐酸滴定氢氧化钠溶液为例,酚酞作为指示剂)
当滴入最后半滴盐酸时,刚好使锥形瓶中的溶液从粉红色变为无色,且在半分钟内不变色,即到滴定终点。读数并记录V2
为减少实验误差,滴定时,要求重复2-3次,求出所用标准溶液体积的 平均值 ,然后再计算待测液的物质的量浓度。
4.数据处理
C(待)=
C(标)×V(标)
V(待)
已知
已知
读数
c待测的大小取决于V标准的大小。
【学习任务三】误差分析
当用标准酸溶液滴定待测碱溶液时,c标准、V待测均为定值代入公式
三、误差分析(标准酸溶液滴定待测碱溶液)
实验操作情况 c(碱)
①开始滴定时滴定管尖嘴处留有气泡
②读数开始时仰视,终止时俯视
③到滴定终点时尚有一滴酸挂在滴定管尖嘴外而未滴入锥瓶
④洗净的酸式滴定管未用标准液润洗
⑤洗净的锥瓶用待测碱液润洗
⑥不小心将标准液滴至锥形瓶外
⑦不小心将待测液溅至锥形瓶外
⑧滴定前向锥形瓶中加入10 mL蒸馏水,其余操作正常
V标偏大 c待偏高
V标偏大 c待偏高
V标偏大 c待偏高
V标偏大 c待偏高
V标偏大 c待偏高
V标偏小 c待偏低
V标正常 c待正常
V标偏小 c待偏低
酸
碱
中
和
滴
定
定义
已知物质的量的浓度的酸(或碱)来测定未知浓度的碱(或酸)
原理
c酸v酸=c碱v碱 (一元酸和一元碱)
仪器及试剂
酸、碱式滴定管等
标准液、待测液、 酸碱指示剂
步骤
滴定操作
记录(记下读数)并计算
误差分析
c酸v酸=c碱v碱 (一元酸和一元碱)
查漏、洗涤、润洗、装液、调液和取液(记下读数)
【小结】
酸碱中和滴定
册 别:选择性必修1
学 科:高中化学(人教版)
通过酸碱指示剂、pH试纸、pH计等
2.现有一瓶未知浓度的盐酸, 如何准确测出其真实浓度?
酸碱中和滴定
【思考与讨论】
1.如何判断一个失去标签的溶液是酸还是碱?
0.1000mol/L
【小试牛刀】
用0.1000mol/L的NaOH溶液测定20.00mL未知
浓度HCl的溶液,测定完成时,用去NaOH溶液
20.00mL。通过计算测得HCl溶液的浓度是多少?
【学习任务一】认识酸碱中和滴定
标准液
待测液
2.原理:
中和反应:H++OH-=H2O
c(H+)·V酸=c(OH-)·V碱
c标V标
V测
=
c测
思考1:如何保证测定c(测)的准确性?
1.概念:依据中和反应,用已知浓度的碱(或酸)来测定未知浓度的酸(或碱) 的方法,叫做酸碱中和滴定。
酸碱恰好完全反应: n(H+) = n(OH-)
3.实验的关键:
(1)V(测)要准,不多不少
(2)V(标)要准,准确判断中和反应是否恰好完全反应
c标V标
V测
=
c测
已知
滴定管
思考2:溶液体积V如何准确量取?
4.仪器:滴定管
玻璃塞
带玻璃球的橡胶塞
标注温度、量程
“0”刻度线在上
仪器a是酸式滴定管, 仪器b是碱式滴定管
① 酸式滴定管盛装:酸性、强氧化性试剂
碱式滴定管盛装:碱性试剂
② 读数精确度:0.01mL
③ 最下面有一段无刻度
思考3:如何判断中和反应恰好完成,即达到滴定的终点?
合适的酸碱指示剂
5.指示剂的选择
原则:
①滴定终点时颜色变化要明显,指示剂变色范围要窄(一般不用石蕊)
②指示剂变色范围尽量接近终点时溶液的pH。
红 橙 黄
红 紫 蓝
无色 粉红 红
用0.10 mol/L 的NaOH溶液滴定20 mL 0.10 mol/L 的HCl 溶液,
计算反应过程中溶液的pH值。
填写下表,并绘制pH-V(NaOH)/mL图像。
【学生活动】
V (NaOH)/mL 0.00 10.00 19.00 19.96 20.00 20.04 21.00 30.00
pH
1
7
19.96
20.04
V (NaOH)/mL 0.00 10.00 19.00 19.96 20.00 20.04 21.00 30.00
pH 1 1.5 2.6 4 7 10 11.4 12.4
等当点
突跃范围
绘制pH随NaOH溶液体积变化的曲线图
突跃范围
酚 酞
20.04
甲基橙
19.96
NaOH溶液的体积/mL
溶液的pH
滴定突跃:接近反应终点时,很少量(0.04 mL,约1滴)的酸或碱会引起pH的突跃。
结论:甲基橙和酚酞都可以作为强碱滴强酸的指示剂。
【学习任务二】中和滴定的实验操作
1.滴定前的准备工作
①查漏:使用前先检查滴定管活塞是否漏水。
②润洗:滴定管在加入反应液之前,先用蒸馏水洗涤干净,然后分别用所要盛装的溶液润洗2~3遍。
③装液:分别将反应液加入相应滴定管中,使液面位于滴定管“0”刻度线以上2~3mL处。
⑤调液面,记数据:在滴定管下放一烧杯,然后调节滴定管液面使其处于某一刻度,准确读取数值并记录V1。
④排气泡:调节活塞,使滴定管尖嘴部分充满反应液
酸式滴定管→快速放液;碱式滴定管→橡皮管向上翘起
滴定管
1.滴定前的准备工作
锥形瓶
①洗涤:使用前先用蒸馏水洗涤干净
②装液:装入一定量的待测液
③指示剂:加入2-3滴指示剂
2.滴定
锥形瓶内溶液颜色变化
摇动锥形瓶
旋转酸定管活塞或挤压碱式滴定管玻璃珠
3.终点判断(以盐酸滴定氢氧化钠溶液为例,酚酞作为指示剂)
当滴入最后半滴盐酸时,刚好使锥形瓶中的溶液从粉红色变为无色,且在半分钟内不变色,即到滴定终点。读数并记录V2
为减少实验误差,滴定时,要求重复2-3次,求出所用标准溶液体积的 平均值 ,然后再计算待测液的物质的量浓度。
4.数据处理
C(待)=
C(标)×V(标)
V(待)
已知
已知
读数
c待测的大小取决于V标准的大小。
【学习任务三】误差分析
当用标准酸溶液滴定待测碱溶液时,c标准、V待测均为定值代入公式
三、误差分析(标准酸溶液滴定待测碱溶液)
实验操作情况 c(碱)
①开始滴定时滴定管尖嘴处留有气泡
②读数开始时仰视,终止时俯视
③到滴定终点时尚有一滴酸挂在滴定管尖嘴外而未滴入锥瓶
④洗净的酸式滴定管未用标准液润洗
⑤洗净的锥瓶用待测碱液润洗
⑥不小心将标准液滴至锥形瓶外
⑦不小心将待测液溅至锥形瓶外
⑧滴定前向锥形瓶中加入10 mL蒸馏水,其余操作正常
V标偏大 c待偏高
V标偏大 c待偏高
V标偏大 c待偏高
V标偏大 c待偏高
V标偏大 c待偏高
V标偏小 c待偏低
V标正常 c待正常
V标偏小 c待偏低
酸
碱
中
和
滴
定
定义
已知物质的量的浓度的酸(或碱)来测定未知浓度的碱(或酸)
原理
c酸v酸=c碱v碱 (一元酸和一元碱)
仪器及试剂
酸、碱式滴定管等
标准液、待测液、 酸碱指示剂
步骤
滴定操作
记录(记下读数)并计算
误差分析
c酸v酸=c碱v碱 (一元酸和一元碱)
查漏、洗涤、润洗、装液、调液和取液(记下读数)
【小结】
