人教版(2019)选择性必修二 实验活动:简单配合物的形成 课件(共18张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修二 实验活动:简单配合物的形成 课件(共18张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-09 00:00:00 | ||
图片预览




文档简介
(共18张PPT)
实验活动:简单配合物的形成
册 别:选择性必修2
学 科:高中化学(人教版)
【实验原理】
配合物是由中心原子或离子与一定数目的中性分子或阴离子以配位键结合而形成的一类化合物。中心离子形成配合物后性质不同于原来的金属离子,具有新的化学特性。
【实验目的】
1.加深对配合物的认识。
2.了解配合物的形成。
3.探究简单离子与配离子的区别。
【实验用品】
仪器:
试管、胶头滴管。
试剂:
硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯化铁溶液、硫氰化钾溶液、K3[Fe(CN)6]溶液、蒸馏水、乙醇。
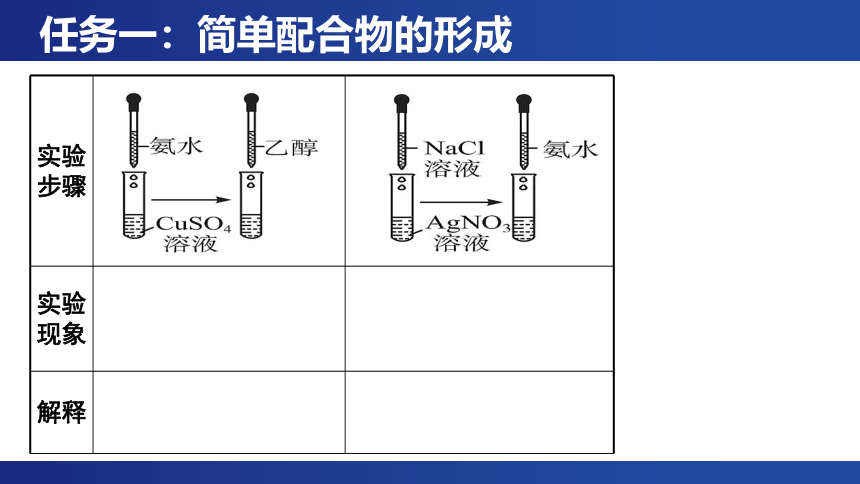
任务一:简单配合物的形成
实验 步骤
实验 现象
解释
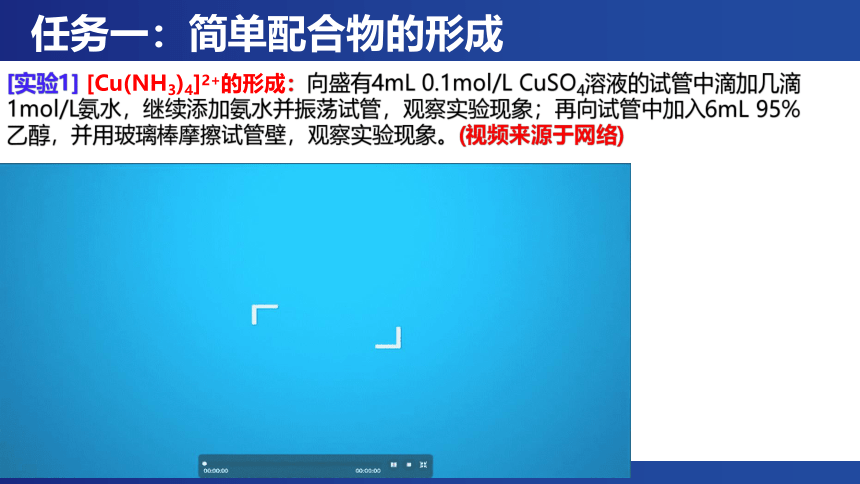
任务一:简单配合物的形成
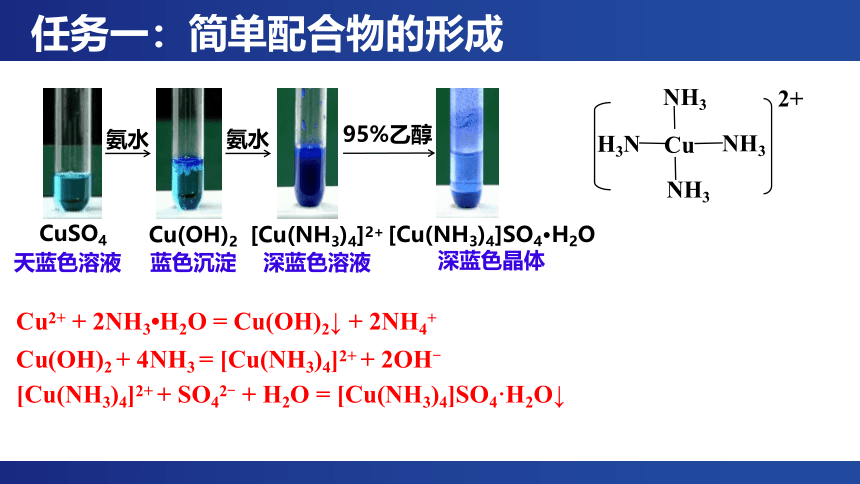
[实验1] [Cu(NH3)4]2+的形成:向盛有4mL 0.1mol/L CuSO4溶液的试管中滴加几滴1mol/L氨水,继续添加氨水并振荡试管,观察实验现象;再向试管中加入6mL 95%乙醇,并用玻璃棒摩擦试管壁,观察实验现象。(视频来源于网络)
Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH-
Cu2+ + 2NH3 H2O = Cu(OH)2↓ + 2NH4+
[Cu(NH3)4]2+
深蓝色溶液
氨水
蓝色沉淀
Cu(OH)2
CuSO4
氨水
95%乙醇
[Cu(NH3)4]SO4·H2O
深蓝色晶体
[Cu(NH3)4]2+ + SO42- + H2O = [Cu(NH3)4]SO4·H2O↓
天蓝色溶液
NH3
Cu
NH3
H3N
NH3
2+
任务一:简单配合物的形成
[实验2][Ag(NH3)2]+的形成:向盛有少量0.1mol/L NaCl溶液的试管中滴加几滴0.1mol/L AgNO3溶液,再滴入1 mol/L氨水,振荡,观察实验现象。(视频来源于网络)
任务一:简单配合物的形成
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl-
NaCl 溶液
少量
AgNO3 溶液
白色沉淀
氨水
澄清
Ag+ + Cl- = AgCl↓
温馨提醒:
①配制银氨溶液时,应防止加入过量的氨水。否则可能会生成雷酸银(AgONC),雷酸银在受热或撞击时有爆炸的危险。
②银氨溶液必须随配随用,不可久置。因为银氨溶液久置后,将变成叠氮化银(AgN3)沉淀,它受振动时很容易分解而发生猛烈爆炸。
实验完毕,试管内的银氨溶液要及时处理,不能直接当废液倾倒。
任务一:简单配合物的形成
实验 步骤
实验 现象 滴加氨水后,试管中先出现蓝色沉淀, 氨水过量后沉淀逐渐溶解, 滴加乙醇后析出深蓝色晶体。 先产生白色沉淀,
滴加氨水后白色沉淀溶解。
解释
AgCl(s) Ag+(aq) + Cl-(aq)
+
2NH3·H2O
[Ag(NH3)2]+
=
Cu(OH)2(s) Cu2+(aq) + 2OH-(aq)
+
4NH3·H2O
[Cu(NH3)4]2+
=
任务一:简单配合物的形成
任务二:配合物的结构特点
[Cu(NH3)4]SO4
内界
外界
中心离子
配体
配位数
配离子
离子
[Ag(NH3)2]Cl
内界
外界
中心离子
配体
配位数
配离子
离子
简单离子与配离子有什么区别呢?
任务三:简单离子与配离子的区别
实验 步骤 【实验3】向盛有0.1mol/L FeCl3溶液的试管中滴加2滴硫氰化钾溶液。 【实验4】向盛有0.1mol/L K3[Fe(CN)6]溶液的试管中滴加2滴硫氰化钾溶液。
实验 现象
解释
【实验3】向盛有少量0.1mol/L FeCl3溶液的试管中滴加2滴硫氰化钾溶液。(视频来源于网络)
任务三:简单离子与配离子的区别
【实验4】向盛有少量0.1mol/L K3[Fe(CN)6]溶液的试管中滴加2滴硫氰化钾溶液。(视频来源于网络)
任务三:简单离子与配离子的区别
实验 步骤 【实验3】向盛有0.1mol/L FeCl3溶液的试管中滴加2滴硫氰化钾溶液。 【实验4】向盛有0.1mol/L K3[Fe(CN)6]溶液的试管中滴加2滴硫氰化钾溶液。
实验 现象
解释
如:Fe3++3SCN- Fe(SCN)3
Fe3+ + n SCN- [Fe(SCN)n]3-n
(n=1~6,随 SCN-的浓度而异)
因为CN-的配位能力强于SCN-,[Fe(CN)6]3-很稳定,转化为硫氰化铁的平衡正向移动的趋势很小
无明显变化
KSCN溶液
红色溶液
KSCN溶液
任务三:简单离子与配离子的区别
【定量分析】向盛有少量0.1mol/L K3[Fe(CN)6]溶液的试管中滴加2滴硫氰化钾溶液,为何不能转变为红色的Fe(SCN)3溶液?
Fe3++6CN- Fe(CN)63- K稳 [Fe(CN)63-]=1.0×1042
已知:Fe3++3SCN- Fe(SCN)3 K稳 [Fe(SCN)3]=1.0×105
解析:Fe(CN)63- + 3SCN- Fe(SCN)3 + 6CN-
K = K稳 [Fe(CN)63-]/K稳 [Fe(SCN)3]
= (1.0×105)/(1.0×1042)
= 1.0×10-37
平衡常数 K=1.0×10-37,说明此配位反应正向进行的趋势很小。
任务三:简单离子与配离子的区别
【问题和讨论】
K3[Fe(CN)6]在水中可以电离出配离子[Fe(CN)6]3-,该配离子的中心离子、配体是什么?配位数是多少?[Fe(CN)6]3-和Fe3+的性质一样吗?
[Fe(CN)6]3-的中心离子是Fe3+,配体是CN-,配位数是6。[Fe(CN)6]3-和Fe3+的性质不一样。
任务三:简单离子与配离子的区别
任务四:总结与归纳
(1)溶解性的影响
如:AgCl→[Ag(NH3)2]Cl,由难溶于水的沉淀,转变为易溶于水的物质。
(2)颜色的改变
当简单离子形成配离子时其性质往往有很大变化。颜色变化就是一种常见的现象,我们根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-在溶液中可生成配位数为1~6的配离子,这些配离子的颜色是红色的。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。
配合物的形成对性质的影响
【练习1】向盛有硫酸铜蓝色溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色溶液,再加无水乙醇得到深蓝色晶体。下列说法正确的是( )
A.深蓝色溶液中含有的主要有色离子为[Cu(H2O)4]2+
B.NH3与Cu2+间的配位键比H2O与Cu2+间的配位键弱
C.加乙醇的目的是降低生成的配合物的溶解度
D.1mol [Cu(H2O)4]2+中含有σ键的数目为16NA
C
实验时,天蓝色的[Cu(H2O)4]2+最终转化成了深蓝色的[Cu(NH3)4]2+,说明氨分子与铜离子形成的配位键强于水分子与铜离子形成的配位键
练习巩固
实验活动:简单配合物的形成
册 别:选择性必修2
学 科:高中化学(人教版)
【实验原理】
配合物是由中心原子或离子与一定数目的中性分子或阴离子以配位键结合而形成的一类化合物。中心离子形成配合物后性质不同于原来的金属离子,具有新的化学特性。
【实验目的】
1.加深对配合物的认识。
2.了解配合物的形成。
3.探究简单离子与配离子的区别。
【实验用品】
仪器:
试管、胶头滴管。
试剂:
硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯化铁溶液、硫氰化钾溶液、K3[Fe(CN)6]溶液、蒸馏水、乙醇。
任务一:简单配合物的形成
实验 步骤
实验 现象
解释
任务一:简单配合物的形成
[实验1] [Cu(NH3)4]2+的形成:向盛有4mL 0.1mol/L CuSO4溶液的试管中滴加几滴1mol/L氨水,继续添加氨水并振荡试管,观察实验现象;再向试管中加入6mL 95%乙醇,并用玻璃棒摩擦试管壁,观察实验现象。(视频来源于网络)
Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH-
Cu2+ + 2NH3 H2O = Cu(OH)2↓ + 2NH4+
[Cu(NH3)4]2+
深蓝色溶液
氨水
蓝色沉淀
Cu(OH)2
CuSO4
氨水
95%乙醇
[Cu(NH3)4]SO4·H2O
深蓝色晶体
[Cu(NH3)4]2+ + SO42- + H2O = [Cu(NH3)4]SO4·H2O↓
天蓝色溶液
NH3
Cu
NH3
H3N
NH3
2+
任务一:简单配合物的形成
[实验2][Ag(NH3)2]+的形成:向盛有少量0.1mol/L NaCl溶液的试管中滴加几滴0.1mol/L AgNO3溶液,再滴入1 mol/L氨水,振荡,观察实验现象。(视频来源于网络)
任务一:简单配合物的形成
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl-
NaCl 溶液
少量
AgNO3 溶液
白色沉淀
氨水
澄清
Ag+ + Cl- = AgCl↓
温馨提醒:
①配制银氨溶液时,应防止加入过量的氨水。否则可能会生成雷酸银(AgONC),雷酸银在受热或撞击时有爆炸的危险。
②银氨溶液必须随配随用,不可久置。因为银氨溶液久置后,将变成叠氮化银(AgN3)沉淀,它受振动时很容易分解而发生猛烈爆炸。
实验完毕,试管内的银氨溶液要及时处理,不能直接当废液倾倒。
任务一:简单配合物的形成
实验 步骤
实验 现象 滴加氨水后,试管中先出现蓝色沉淀, 氨水过量后沉淀逐渐溶解, 滴加乙醇后析出深蓝色晶体。 先产生白色沉淀,
滴加氨水后白色沉淀溶解。
解释
AgCl(s) Ag+(aq) + Cl-(aq)
+
2NH3·H2O
[Ag(NH3)2]+
=
Cu(OH)2(s) Cu2+(aq) + 2OH-(aq)
+
4NH3·H2O
[Cu(NH3)4]2+
=
任务一:简单配合物的形成
任务二:配合物的结构特点
[Cu(NH3)4]SO4
内界
外界
中心离子
配体
配位数
配离子
离子
[Ag(NH3)2]Cl
内界
外界
中心离子
配体
配位数
配离子
离子
简单离子与配离子有什么区别呢?
任务三:简单离子与配离子的区别
实验 步骤 【实验3】向盛有0.1mol/L FeCl3溶液的试管中滴加2滴硫氰化钾溶液。 【实验4】向盛有0.1mol/L K3[Fe(CN)6]溶液的试管中滴加2滴硫氰化钾溶液。
实验 现象
解释
【实验3】向盛有少量0.1mol/L FeCl3溶液的试管中滴加2滴硫氰化钾溶液。(视频来源于网络)
任务三:简单离子与配离子的区别
【实验4】向盛有少量0.1mol/L K3[Fe(CN)6]溶液的试管中滴加2滴硫氰化钾溶液。(视频来源于网络)
任务三:简单离子与配离子的区别
实验 步骤 【实验3】向盛有0.1mol/L FeCl3溶液的试管中滴加2滴硫氰化钾溶液。 【实验4】向盛有0.1mol/L K3[Fe(CN)6]溶液的试管中滴加2滴硫氰化钾溶液。
实验 现象
解释
如:Fe3++3SCN- Fe(SCN)3
Fe3+ + n SCN- [Fe(SCN)n]3-n
(n=1~6,随 SCN-的浓度而异)
因为CN-的配位能力强于SCN-,[Fe(CN)6]3-很稳定,转化为硫氰化铁的平衡正向移动的趋势很小
无明显变化
KSCN溶液
红色溶液
KSCN溶液
任务三:简单离子与配离子的区别
【定量分析】向盛有少量0.1mol/L K3[Fe(CN)6]溶液的试管中滴加2滴硫氰化钾溶液,为何不能转变为红色的Fe(SCN)3溶液?
Fe3++6CN- Fe(CN)63- K稳 [Fe(CN)63-]=1.0×1042
已知:Fe3++3SCN- Fe(SCN)3 K稳 [Fe(SCN)3]=1.0×105
解析:Fe(CN)63- + 3SCN- Fe(SCN)3 + 6CN-
K = K稳 [Fe(CN)63-]/K稳 [Fe(SCN)3]
= (1.0×105)/(1.0×1042)
= 1.0×10-37
平衡常数 K=1.0×10-37,说明此配位反应正向进行的趋势很小。
任务三:简单离子与配离子的区别
【问题和讨论】
K3[Fe(CN)6]在水中可以电离出配离子[Fe(CN)6]3-,该配离子的中心离子、配体是什么?配位数是多少?[Fe(CN)6]3-和Fe3+的性质一样吗?
[Fe(CN)6]3-的中心离子是Fe3+,配体是CN-,配位数是6。[Fe(CN)6]3-和Fe3+的性质不一样。
任务三:简单离子与配离子的区别
任务四:总结与归纳
(1)溶解性的影响
如:AgCl→[Ag(NH3)2]Cl,由难溶于水的沉淀,转变为易溶于水的物质。
(2)颜色的改变
当简单离子形成配离子时其性质往往有很大变化。颜色变化就是一种常见的现象,我们根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-在溶液中可生成配位数为1~6的配离子,这些配离子的颜色是红色的。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。
配合物的形成对性质的影响
【练习1】向盛有硫酸铜蓝色溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色溶液,再加无水乙醇得到深蓝色晶体。下列说法正确的是( )
A.深蓝色溶液中含有的主要有色离子为[Cu(H2O)4]2+
B.NH3与Cu2+间的配位键比H2O与Cu2+间的配位键弱
C.加乙醇的目的是降低生成的配合物的溶解度
D.1mol [Cu(H2O)4]2+中含有σ键的数目为16NA
C
实验时,天蓝色的[Cu(H2O)4]2+最终转化成了深蓝色的[Cu(NH3)4]2+,说明氨分子与铜离子形成的配位键强于水分子与铜离子形成的配位键
练习巩固
