江西省九江市彭泽县2022-2023学年高二下学期5月期中考试化学试题(含答案)
文档属性
| 名称 | 江西省九江市彭泽县2022-2023学年高二下学期5月期中考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-09 17:36:49 | ||
图片预览



文档简介
彭泽县2022-2023学年高二下学期5月期中考试
化学
一.单选题(每小题3分,共30分)
1.中华优秀传统文化涉及到很多的化学知识。下列有关说法不正确的是
A.宋代梅尧臣的《陶者》“陶尽门前土,屋上无片瓦。十指不沾泥,鳞鳞居大厦。”黏土烧制陶瓷的过程中没有发生化学变化
B.古代炼丹著作《黄白第十六》中“曾青涂铁,铁赤如铜”,该反应类型为置换反应
C.东汉魏伯阳在《周易参同契》中对汞的描述.“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的“黄芽”指的是硫黄
D.明代李时珍《本草纲目》中“自元时始创其法,用浓酒和糟入甑,蒸令气上,用器承滴露”,其“法”是指蒸馏
2.下列化学用语中正确的是
A.与互为同分异构体
B.乙烯分子的电子式:
C.正丁烷的球棍模型:
D.二氧化碳的空间填充模型:
3.下列说法不正确的是
A.某有机物完全燃烧只生成CO2和H2O,两者物质的量之比为1∶2,则该有机物为甲烷
B.甲苯分子的核磁共振氢谱中有4个不同的吸收峰
C.红外光谱可以帮助确定许多有机物的结构
D.通过质谱法可以确认有机化合物的相对分子质量
4.中国国家航天局公布了由“祝融号”火星车拍摄的科学影像图,发现火星岩石中富含X、Y、Z、W四种元素。已知:X、Y、Z、W为原子序数依次增大的四种短周期元素,Z的原子半径是所有短周期主族元素中最大的,X、W为同一主族元素,Y是地球地壳中含量最高的元素,经测定火星岩石中含有物质。下列说法错误的是
A.原子半径:W>Y>X
B.W位于元素周期表第三周期IVA族
C.Y和W形成的化合物能与X的单质在一定条件下反应
D.化合物Z2Y、Z2Y2中阴阳离子个数比均为
5.草酸为二元弱酸,常用作除锈剂、还原剂。设NA为阿伏加德罗常数的值,关于常温下pH=2的H2C2O4溶液,下列说法正确的是
A.1L该溶液所含H+数目为0.02NA
B.加入Na2C2O4固体,溶液酸性减弱
C.加水稀释使电离度增大,溶液pH减小
D.存在c(H+)= c(H2C2O4)+c(HC2O)+2c(C2O)+c(OH-)
6.某研究性学习小组对手性分子提出了以下四个观点:
①互为手性异构体的分子互为镜像
②利用手性催化剂合成可得到一种或主要得到一种手性分子
③手性异构体分子组成相同
④手性异构体性质相同
你认为正确的是
A.①②③ B.①②④ C.②③④ D.全部
7.溴苯是一种化工原料,实验室合成溴苯的装置如图(夹持装置已略去),下列关于溴苯的性质及制备的说法不正确的是
A.实验开始后,a中上部有白雾生成 B.b为恒压滴液漏斗,便于其中液体顺利滴下
C.c为球形冷凝管,冷凝水应从上口进入 D.烧杯中溶液的作用是吸收及
8.四种短周期元素W、X、Y、Z的原子序数依次增大,其中X是地壳含量最高的元素,W、Z同主族,X、Y、Z能形成一种层状晶体,其结构如下所示,下列说法正确的是。
A.原子半径:Z>Y>X>W
B.X与Y形成的化合物一定含有共价键
C.W、Z分别与X形成的化合物熔点:高于
D.W的最高价氧化物对应水化物的酸性强于Z
9.用如图所示装置进行实验,仪器a、b、c中分别盛有试剂1、2、3,其中能达到实验目的的是
选项 试剂1 试剂2 试剂3 实验目的
A 浓盐酸 MnO2 饱和食盐水 制备氯气
B 盐酸 Na2CO3 Na2SiO3溶液 验证碳的非金属性比硅强
C 盐酸 Na2SO3 品红试液 验证SO2具有漂白性
D 稀硫酸 溶液X 澄清石灰水 验证X溶液中是否有
A.A B.B C.C D.D
10.工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置如图所示。下列说法正确的是
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-=Fe3+
C.当乙装置中有1.6gCH4参加反应,则C电极理论上生成气体体积为4.48L
D.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
二、不定项选择题(每题有一个或多个选项,每题4分,共20分)
11.某元素的最外层电子数为2,价电子数为3,并且是同族中原子序数最小的元素,关于该元素的判断错误的是
A.电子排布式为: B.该元素为Sc
C.该元素为IIIA族元素 D.该元素位于d区
12.短周期主族元素W、Q、X、Y、Z的原子序数依次增大;灰黑色晶体Y的导电性介于导体和绝缘体之间,一种制备晶体Y的路线如图所示,通常状态下YW4呈气态且W的单质是最清洁能源。
YQ2X2YYW4Y的单质
下列说法正确的是
A.常温下,W与Q形成的化合物为液态 B.X的最高价氧化对应的水化物是强酸
C.ZQ2可用于自来水消毒 D.YW4中仅含离子键
13.有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成:
下列说法正确的是
A.能用FeCl3溶液鉴别X与Y
B.X分子中所有原子一定在同一平面上
C.1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为2mol
D.1molX与溴水充分反应,最多消耗Br2的物质的量为3mol
14.下列除杂(括号内为杂质)的试剂和方法均正确的是
物质 除杂试剂 操作方法
A 苯酚(乙酸) 溶液 分液
B 饱和溶液 洗气
C 苯甲酸(NaCl) 蒸馏水 重结晶
D 浓NaOH溶液 过滤
A.A B.B C.C D.D
15.钛酸钙矿物的晶胞结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导体材料的结构如图(b)所示,晶胞边长为a cm,其中A为,另两种离子为和。下列说法错误的是
A.钛酸钙晶体中距离最近的有8个
B.图(b)中,X为
C.图(b)该晶体密度为
D.钛酸钙晶胞中距离最近的形成了正八面体,位于其中心
三、填空题(共50分)
16.(10分)醇和酚在人类生产和生活中扮演着重要的角色。
(1)白藜芦醇( )广泛存在于食物中。
①白藜芦醇的分子式为___________。
②白藜芦醇所含官能团的名称为___________。
③1mol白藜芦醇最多消耗___________mol NaOH。
(2)如图所示的操作和实验现象,能验证苯酚的性质。
①若验证苯酚在水中的溶解性与温度的关系,则操作1是___________,操作2是___________。
②若验证苯酚的酸性弱于碳酸,操作1是加NaOH溶液,则操作2是___________;操作2发生反应的化学方程式为___________。
17.(10分)乙酰苯胺()作为一种常用药,具有解热镇痛的效果。乙酰苯胺可通过苯胺()和冰醋酸反应制得,该反应是放热的可逆反应。
已知:I.苯胺在空气中易被氧化。
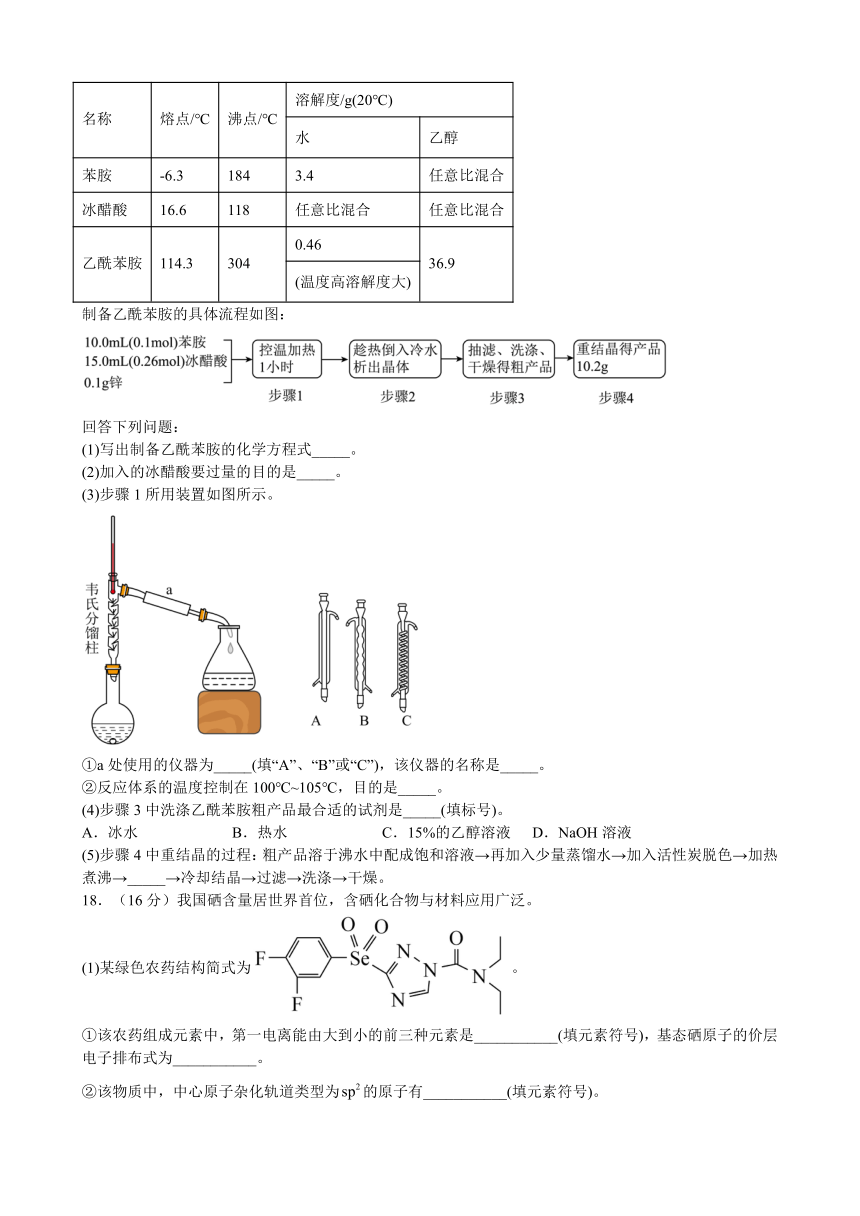
Ⅱ.可能用到的有关性质如表:
名称 熔点/℃ 沸点/℃ 溶解度/g(20℃)
水 乙醇
苯胺 -6.3 184 3.4 任意比混合
冰醋酸 16.6 118 任意比混合 任意比混合
乙酰苯胺 114.3 304 0.46 36.9
(温度高溶解度大)
制备乙酰苯胺的具体流程如图:
回答下列问题:
(1)写出制备乙酰苯胺的化学方程式_____。
(2)加入的冰醋酸要过量的目的是_____。
(3)步骤1所用装置如图所示。
①a处使用的仪器为_____(填“A”、“B”或“C”),该仪器的名称是_____。
②反应体系的温度控制在100℃~105℃,目的是_____。
(4)步骤3中洗涤乙酰苯胺粗产品最合适的试剂是_____(填标号)。
A.冰水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(5)步骤4中重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→_____→冷却结晶→过滤→洗涤→干燥。
18.(16分)我国硒含量居世界首位,含硒化合物与材料应用广泛。
(1)某绿色农药结构简式为。
①该农药组成元素中,第一电离能由大到小的前三种元素是___________(填元素符号),基态硒原子的价层电子排布式为___________。
②该物质中,中心原子杂化轨道类型为的原子有___________(填元素符号)。
(2)碱金属的硒化物溶液能够溶解硒生成多硒化合物()。如多硒化钠,该物质中,化学键类型是___________,Se原子之间形成的空间构型为___________。
(3)下表中有机物沸点不同的原因是___________。
有机物 甲醇 甲硫醇 甲硒醇
沸点/℃ 64.7 5.95 25.05
(4)β-MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。
①β-MnSe中Mn的配位数为___________。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为,则距离最近的两个锰原子之间的距离为___________pm,β-MnSe的密度___________(列出表达式即可)。
19.(14分)诺氟沙星为第三代喹诺酮类抗菌药,会阻碍消化道内致病细菌的DNA旋转酶的作用,阻碍细菌DNA复制,对细菌有抑制作用,是治疗肠炎痢疾的常用药。但此药对未成年人骨骼形成有延缓作用,会影响发育,故禁止未成年人服用。一种合成诺氟沙星的路线如图所示。回答下列问题:
(1)诺氟沙星中含氧官能团的名称是_________。
(2)A→C的反应类型是___________。C→D中,另一产物是________(填结构简式)。
(3)E→F的反应条件是___________。
(4)D→E的化学方程式为___________。
(5)在G的链状同分异构体中,同时具备下列条件的结构有________种(不包括立体异构)。
①含2个氨基。
②同一个碳原子上不连接2个氨基。
(6)已知:硝基苯在铁粉和盐酸作用下被还原成苯胺。以苯、为原料合成某药物中间体( ),设计合成路线___________(无机试剂任选)。
1.A
A. 黏土烧制陶器的过程中生成了新的物质,发生了化学变化,故A错误;
B. 曾青涂铁是一种可溶性铜盐的溶液放入金属铁得到金属铜的过程,故B正确;
C. 液态的金属汞,受热易变成汞蒸气,汞属于重金属,能使蛋白质变性,属于有毒物质,但常温下能和硫反应生成硫化汞,从而防止其变成汞气体,黄芽指呈淡黄色的硫磺,故C正确;
D. 蒸令气上,则利用互溶混合物的沸点差异分离,则该法为蒸馏,故D正确;
故选:A。
2.A
A.前者为正丁烷,后者为异丁烷,分子式均为C4H10,两者互为同分异构体,A正确;
B.乙烯分子中,C与C之间形成碳碳双键,应该有两列并排的电子,B错误;
C.正丁烷为一条碳链,没有支链,图示为异丁烷的模型,C错误;
D.二氧化碳中碳原子位于中间且碳原子的半径大于氧原子半径,D错误;
故答案选A。
3.A
A.生成CO2和H2O,两者的物质的量之比为1∶2,说明C、H原子比值为1∶4,该有机物可能为甲烷或甲醇,故A错误;
B.甲苯分子中含有4种H,核磁共振氢谱中有4个不同的吸收峰,故B正确;
C.红外光谱可测定有机物的共价键和官能团,可用于测定有机物的结构,故C正确;
D.质谱法用于测定有机物的质荷比,可以确认化合物的相对分子质量,故D正确;
故选A。
4.A
A.同周期主族元素自左而右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径:Si>C>O,A错误;
B.Si的原子序数为14,在元素周期表中位于元素周期表第三周期ⅣA族,B正确;
C.Y、W形成的化合物为二氧化硅,二氧化硅与碳在高温下反应生成硅和一氧化碳,C正确;
D.Na2O、Na2O2中阴阳离子个数比都为1:2,D正确;
故答案选A。
5.B
A.1L该溶液所含H+数目为 即0.01NA,故A错误;
B.溶液中存在,,加入Na2C2O4固体平衡逆向移动,氢离子浓度下降,溶液酸性减弱,故B正确;
C.加水稀释平衡正向移动使电离度增大,但氢离子浓度下降,溶液pH增大,故C错误;
D.溶液中存在电荷守恒c(H+)=c(HC2O)+2c(C2O)+c(OH-),故D错误;
故答案为B。
6.A
根据手性分子的定义及性质判断:①互为手性异构体的分子互为镜像,正确;②利用手性催化剂合成可得到一种或主要得到一种手性分子,正确;③手性异构体分子组成相同,正确,④手性异构体性质不相同,错误,答案选A。
7.C
A.苯与液溴在催化剂作用下发生取代反应生成溴苯和HBr,HBr遇水蒸气形成白雾,A正确;
B.根据b的结构特点可知其为恒压滴液漏斗,其侧面导管使漏斗和三颈烧瓶内压强相等,便于其中液体顺利滴下,B正确;
C.根据c的结构特点可知其为球形冷凝管,为增强冷凝效果,冷凝水应从下口进入,C错误;
D.溶液可以吸收及挥发出的,D正确;
故选C。
8.D
A.由分析可知,W、X、Y、Z分别为:C、O、Na、Si四种元素,故原子半径: Y>Z>W>X,A错误;
B.由分析可知,X为O与Y为Na形成的化合物有Na2O只含离子键,Na2O2中既有离子键又有共价键,B错误;
C.由分析可知,W、Z分别与X形成的化合物即CO2、SiO2,CO2常温是气体,是分子晶体,SiO2常温下是固体,是原子晶体(或共价晶体),故熔点:低于,C错误;
D.由分析可知,W为C,Z为Si,则C的非金属性强于Si,则W的最高价氧化物对应水化物即H2CO3的酸性强于Z的即H2SiO3,D正确;
故答案为:D。
9.C
A.用MnO2与浓盐酸反应制备氯气需要加热,故A错误;
B.盐酸易挥发,会使硅酸钠溶液变浑浊,干扰实验,故B错误;
C.盐酸与Na2SO3反应生成SO2,SO2使品红试液褪色,证明其具有漂白性,故C正确;
D.使澄清石灰水变浑浊的气体可能是CO2或SO2,则X溶液中可能含,,,等,故D错误。
综上所述,答案为C。
10.D
A.保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入能使导电能力增强的电解质必须是可溶于水的、显中性的盐,加入硫酸不能生成Fe(OH)3沉淀,故A错误;
B.电解池中Fe为阳极,发生Fe-2e-=Fe2+,故B错误;
C.阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,当乙装置中有1.6 gCH4参加反应,即0.1mol甲烷参加反应时,有0.8mol电子转移,则C电极理论上生成气体在标准状况下为8.96L,故C错误;
D.电池是以熔融碳酸盐为电解质,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,正极反应为O2+2CO2+4e-=2CO32-,可以循环利用的物质只有二氧化碳,故D正确;
故答案为D。
11.AC
A.由分析知,该元素为第四周期元素,价电子排布式为3d14s2,电子排布式为1s22s22p63s23p63d14s2,A错误;
B.该元素的核电荷数为21,元素符号为Sc,B正确;
C.该元素的价电子数为3,为ⅢB族元素,C错误;
D.该元素为ⅢB族元素,位于元素周期表中d区,D正确;
故选AC。
12.AC
A.W为H元素,Q是O元素,W与Q形成的化合物H2O或H2O2常温下为液态,A正确;
B.X是Mg元素,其最高价氧化对应的水化物Mg(OH)2是中强碱,B错误;
C.Z是Cl元素,Q是O元素,ClO2可用于自来水消毒,C正确;
D.YW4是SiH4,仅含Si-H共价键,D错误;
故选AC。
13.AD
A.X含有酚羟基,能与FeCl3溶液发生显色反应,Y不含酚羟基,不能与FeCl3溶液发生显色反应,能用FeCl3溶液鉴别X与Y,故A正确;
B.苯环与烃基之间的C-C键可自由旋转,则X分子中所有原子不一定在同一个平面上,故B错误;
C.Y中有2个酯基,其中苯环左侧的酯基水解后生成的羟基为酚羟基,仍能与NaOH反应,1 mol Y最多消耗3molNaOH,故C错误;
D.X中碳碳双键能与Br2加成,酚羟基邻位上的两个氢也能被溴取代,1 mol X最多消耗3 mol Br2,故D正确;
答案选AD。
14.CD
A.苯酚和乙酸都能与碳酸钠溶液反应,所以不能用碳酸钠溶液除去苯酚中混有的乙酸杂质,故A错误;
B.二氧化碳和二氧化硫但不能与饱和亚硫酸氢钠溶液反应,所以不能用饱和亚硫酸氢钠溶液除去二氧化碳中混有的二氧化硫杂质,故B错误;
C.苯甲酸的溶解度随温度变化大,而氯化钠的溶解度随温度变化小,所以能用重结晶的方法除去苯甲酸中混有的氯化钠杂质,故C正确;
D.氢氧化铜能与浓氢氧化钠溶液反应生成四羟基合铜离子,铜与浓氢氧化钠溶液不反应,所以可用浓氢氧化钠溶液除去铜中混有的氢氧化铜,故D正确;
故选CD。
15.BC
A.以顶点的Ca2+为研究对象,离Ca2+最近的钛离子位于晶胞的体心,所以晶体中离Ca2+最近的Ti4+有8个,A项正确;
B.晶胞图b中含有1个A,3个X,1个B,且A为,根据电中性原理可推知,X为I ,B项错误;
C. b晶胞中A个数为8×=1个,B的个数为1,X的个数为6×=3,A为,则B为Pb2+,X为I 和,化学式为PbCH3NH3I3,摩尔质量为620g/mol,该晶胞的密度为,C错误;
D.由晶胞图a可知,钛酸钙晶体中离Ti4+最近的氧离子形成了正八面体,钛离子位于其中心,D项正确;
故答案为:BC。
16.(1) (酚)羟基和碳碳双键 3
(2)加热 冷却 通入
17.(1) +CH3COOH +H2O
(2)提高苯胺的利用率
(3)A 直形冷凝管 有利于水蒸气馏出,减少乙酸等馏出
(4)A
(5)趁热过滤
18.(1) F、N、O N、C
(2)离子键、共价键(或“非极性共价键”) 折线形或锯齿形或V形
(3)三种物质都是分子晶体,结构相似,相对分子质量越大,沸点越高,甲醇分子间存在氢键所以沸点最高
(4)4
19.(1)羧基、酮(羰)基
(2)取代反应
(3)水溶液、加热,稀硫酸酸化
(4)+CH3CH2Br+HBr
(5)12
(6)
化学
一.单选题(每小题3分,共30分)
1.中华优秀传统文化涉及到很多的化学知识。下列有关说法不正确的是
A.宋代梅尧臣的《陶者》“陶尽门前土,屋上无片瓦。十指不沾泥,鳞鳞居大厦。”黏土烧制陶瓷的过程中没有发生化学变化
B.古代炼丹著作《黄白第十六》中“曾青涂铁,铁赤如铜”,该反应类型为置换反应
C.东汉魏伯阳在《周易参同契》中对汞的描述.“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的“黄芽”指的是硫黄
D.明代李时珍《本草纲目》中“自元时始创其法,用浓酒和糟入甑,蒸令气上,用器承滴露”,其“法”是指蒸馏
2.下列化学用语中正确的是
A.与互为同分异构体
B.乙烯分子的电子式:
C.正丁烷的球棍模型:
D.二氧化碳的空间填充模型:
3.下列说法不正确的是
A.某有机物完全燃烧只生成CO2和H2O,两者物质的量之比为1∶2,则该有机物为甲烷
B.甲苯分子的核磁共振氢谱中有4个不同的吸收峰
C.红外光谱可以帮助确定许多有机物的结构
D.通过质谱法可以确认有机化合物的相对分子质量
4.中国国家航天局公布了由“祝融号”火星车拍摄的科学影像图,发现火星岩石中富含X、Y、Z、W四种元素。已知:X、Y、Z、W为原子序数依次增大的四种短周期元素,Z的原子半径是所有短周期主族元素中最大的,X、W为同一主族元素,Y是地球地壳中含量最高的元素,经测定火星岩石中含有物质。下列说法错误的是
A.原子半径:W>Y>X
B.W位于元素周期表第三周期IVA族
C.Y和W形成的化合物能与X的单质在一定条件下反应
D.化合物Z2Y、Z2Y2中阴阳离子个数比均为
5.草酸为二元弱酸,常用作除锈剂、还原剂。设NA为阿伏加德罗常数的值,关于常温下pH=2的H2C2O4溶液,下列说法正确的是
A.1L该溶液所含H+数目为0.02NA
B.加入Na2C2O4固体,溶液酸性减弱
C.加水稀释使电离度增大,溶液pH减小
D.存在c(H+)= c(H2C2O4)+c(HC2O)+2c(C2O)+c(OH-)
6.某研究性学习小组对手性分子提出了以下四个观点:
①互为手性异构体的分子互为镜像
②利用手性催化剂合成可得到一种或主要得到一种手性分子
③手性异构体分子组成相同
④手性异构体性质相同
你认为正确的是
A.①②③ B.①②④ C.②③④ D.全部
7.溴苯是一种化工原料,实验室合成溴苯的装置如图(夹持装置已略去),下列关于溴苯的性质及制备的说法不正确的是
A.实验开始后,a中上部有白雾生成 B.b为恒压滴液漏斗,便于其中液体顺利滴下
C.c为球形冷凝管,冷凝水应从上口进入 D.烧杯中溶液的作用是吸收及
8.四种短周期元素W、X、Y、Z的原子序数依次增大,其中X是地壳含量最高的元素,W、Z同主族,X、Y、Z能形成一种层状晶体,其结构如下所示,下列说法正确的是。
A.原子半径:Z>Y>X>W
B.X与Y形成的化合物一定含有共价键
C.W、Z分别与X形成的化合物熔点:高于
D.W的最高价氧化物对应水化物的酸性强于Z
9.用如图所示装置进行实验,仪器a、b、c中分别盛有试剂1、2、3,其中能达到实验目的的是
选项 试剂1 试剂2 试剂3 实验目的
A 浓盐酸 MnO2 饱和食盐水 制备氯气
B 盐酸 Na2CO3 Na2SiO3溶液 验证碳的非金属性比硅强
C 盐酸 Na2SO3 品红试液 验证SO2具有漂白性
D 稀硫酸 溶液X 澄清石灰水 验证X溶液中是否有
A.A B.B C.C D.D
10.工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置如图所示。下列说法正确的是
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-=Fe3+
C.当乙装置中有1.6gCH4参加反应,则C电极理论上生成气体体积为4.48L
D.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
二、不定项选择题(每题有一个或多个选项,每题4分,共20分)
11.某元素的最外层电子数为2,价电子数为3,并且是同族中原子序数最小的元素,关于该元素的判断错误的是
A.电子排布式为: B.该元素为Sc
C.该元素为IIIA族元素 D.该元素位于d区
12.短周期主族元素W、Q、X、Y、Z的原子序数依次增大;灰黑色晶体Y的导电性介于导体和绝缘体之间,一种制备晶体Y的路线如图所示,通常状态下YW4呈气态且W的单质是最清洁能源。
YQ2X2YYW4Y的单质
下列说法正确的是
A.常温下,W与Q形成的化合物为液态 B.X的最高价氧化对应的水化物是强酸
C.ZQ2可用于自来水消毒 D.YW4中仅含离子键
13.有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成:
下列说法正确的是
A.能用FeCl3溶液鉴别X与Y
B.X分子中所有原子一定在同一平面上
C.1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为2mol
D.1molX与溴水充分反应,最多消耗Br2的物质的量为3mol
14.下列除杂(括号内为杂质)的试剂和方法均正确的是
物质 除杂试剂 操作方法
A 苯酚(乙酸) 溶液 分液
B 饱和溶液 洗气
C 苯甲酸(NaCl) 蒸馏水 重结晶
D 浓NaOH溶液 过滤
A.A B.B C.C D.D
15.钛酸钙矿物的晶胞结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导体材料的结构如图(b)所示,晶胞边长为a cm,其中A为,另两种离子为和。下列说法错误的是
A.钛酸钙晶体中距离最近的有8个
B.图(b)中,X为
C.图(b)该晶体密度为
D.钛酸钙晶胞中距离最近的形成了正八面体,位于其中心
三、填空题(共50分)
16.(10分)醇和酚在人类生产和生活中扮演着重要的角色。
(1)白藜芦醇( )广泛存在于食物中。
①白藜芦醇的分子式为___________。
②白藜芦醇所含官能团的名称为___________。
③1mol白藜芦醇最多消耗___________mol NaOH。
(2)如图所示的操作和实验现象,能验证苯酚的性质。
①若验证苯酚在水中的溶解性与温度的关系,则操作1是___________,操作2是___________。
②若验证苯酚的酸性弱于碳酸,操作1是加NaOH溶液,则操作2是___________;操作2发生反应的化学方程式为___________。
17.(10分)乙酰苯胺()作为一种常用药,具有解热镇痛的效果。乙酰苯胺可通过苯胺()和冰醋酸反应制得,该反应是放热的可逆反应。
已知:I.苯胺在空气中易被氧化。
Ⅱ.可能用到的有关性质如表:
名称 熔点/℃ 沸点/℃ 溶解度/g(20℃)
水 乙醇
苯胺 -6.3 184 3.4 任意比混合
冰醋酸 16.6 118 任意比混合 任意比混合
乙酰苯胺 114.3 304 0.46 36.9
(温度高溶解度大)
制备乙酰苯胺的具体流程如图:
回答下列问题:
(1)写出制备乙酰苯胺的化学方程式_____。
(2)加入的冰醋酸要过量的目的是_____。
(3)步骤1所用装置如图所示。
①a处使用的仪器为_____(填“A”、“B”或“C”),该仪器的名称是_____。
②反应体系的温度控制在100℃~105℃,目的是_____。
(4)步骤3中洗涤乙酰苯胺粗产品最合适的试剂是_____(填标号)。
A.冰水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(5)步骤4中重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→_____→冷却结晶→过滤→洗涤→干燥。
18.(16分)我国硒含量居世界首位,含硒化合物与材料应用广泛。
(1)某绿色农药结构简式为。
①该农药组成元素中,第一电离能由大到小的前三种元素是___________(填元素符号),基态硒原子的价层电子排布式为___________。
②该物质中,中心原子杂化轨道类型为的原子有___________(填元素符号)。
(2)碱金属的硒化物溶液能够溶解硒生成多硒化合物()。如多硒化钠,该物质中,化学键类型是___________,Se原子之间形成的空间构型为___________。
(3)下表中有机物沸点不同的原因是___________。
有机物 甲醇 甲硫醇 甲硒醇
沸点/℃ 64.7 5.95 25.05
(4)β-MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。
①β-MnSe中Mn的配位数为___________。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为,则距离最近的两个锰原子之间的距离为___________pm,β-MnSe的密度___________(列出表达式即可)。
19.(14分)诺氟沙星为第三代喹诺酮类抗菌药,会阻碍消化道内致病细菌的DNA旋转酶的作用,阻碍细菌DNA复制,对细菌有抑制作用,是治疗肠炎痢疾的常用药。但此药对未成年人骨骼形成有延缓作用,会影响发育,故禁止未成年人服用。一种合成诺氟沙星的路线如图所示。回答下列问题:
(1)诺氟沙星中含氧官能团的名称是_________。
(2)A→C的反应类型是___________。C→D中,另一产物是________(填结构简式)。
(3)E→F的反应条件是___________。
(4)D→E的化学方程式为___________。
(5)在G的链状同分异构体中,同时具备下列条件的结构有________种(不包括立体异构)。
①含2个氨基。
②同一个碳原子上不连接2个氨基。
(6)已知:硝基苯在铁粉和盐酸作用下被还原成苯胺。以苯、为原料合成某药物中间体( ),设计合成路线___________(无机试剂任选)。
1.A
A. 黏土烧制陶器的过程中生成了新的物质,发生了化学变化,故A错误;
B. 曾青涂铁是一种可溶性铜盐的溶液放入金属铁得到金属铜的过程,故B正确;
C. 液态的金属汞,受热易变成汞蒸气,汞属于重金属,能使蛋白质变性,属于有毒物质,但常温下能和硫反应生成硫化汞,从而防止其变成汞气体,黄芽指呈淡黄色的硫磺,故C正确;
D. 蒸令气上,则利用互溶混合物的沸点差异分离,则该法为蒸馏,故D正确;
故选:A。
2.A
A.前者为正丁烷,后者为异丁烷,分子式均为C4H10,两者互为同分异构体,A正确;
B.乙烯分子中,C与C之间形成碳碳双键,应该有两列并排的电子,B错误;
C.正丁烷为一条碳链,没有支链,图示为异丁烷的模型,C错误;
D.二氧化碳中碳原子位于中间且碳原子的半径大于氧原子半径,D错误;
故答案选A。
3.A
A.生成CO2和H2O,两者的物质的量之比为1∶2,说明C、H原子比值为1∶4,该有机物可能为甲烷或甲醇,故A错误;
B.甲苯分子中含有4种H,核磁共振氢谱中有4个不同的吸收峰,故B正确;
C.红外光谱可测定有机物的共价键和官能团,可用于测定有机物的结构,故C正确;
D.质谱法用于测定有机物的质荷比,可以确认化合物的相对分子质量,故D正确;
故选A。
4.A
A.同周期主族元素自左而右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径:Si>C>O,A错误;
B.Si的原子序数为14,在元素周期表中位于元素周期表第三周期ⅣA族,B正确;
C.Y、W形成的化合物为二氧化硅,二氧化硅与碳在高温下反应生成硅和一氧化碳,C正确;
D.Na2O、Na2O2中阴阳离子个数比都为1:2,D正确;
故答案选A。
5.B
A.1L该溶液所含H+数目为 即0.01NA,故A错误;
B.溶液中存在,,加入Na2C2O4固体平衡逆向移动,氢离子浓度下降,溶液酸性减弱,故B正确;
C.加水稀释平衡正向移动使电离度增大,但氢离子浓度下降,溶液pH增大,故C错误;
D.溶液中存在电荷守恒c(H+)=c(HC2O)+2c(C2O)+c(OH-),故D错误;
故答案为B。
6.A
根据手性分子的定义及性质判断:①互为手性异构体的分子互为镜像,正确;②利用手性催化剂合成可得到一种或主要得到一种手性分子,正确;③手性异构体分子组成相同,正确,④手性异构体性质不相同,错误,答案选A。
7.C
A.苯与液溴在催化剂作用下发生取代反应生成溴苯和HBr,HBr遇水蒸气形成白雾,A正确;
B.根据b的结构特点可知其为恒压滴液漏斗,其侧面导管使漏斗和三颈烧瓶内压强相等,便于其中液体顺利滴下,B正确;
C.根据c的结构特点可知其为球形冷凝管,为增强冷凝效果,冷凝水应从下口进入,C错误;
D.溶液可以吸收及挥发出的,D正确;
故选C。
8.D
A.由分析可知,W、X、Y、Z分别为:C、O、Na、Si四种元素,故原子半径: Y>Z>W>X,A错误;
B.由分析可知,X为O与Y为Na形成的化合物有Na2O只含离子键,Na2O2中既有离子键又有共价键,B错误;
C.由分析可知,W、Z分别与X形成的化合物即CO2、SiO2,CO2常温是气体,是分子晶体,SiO2常温下是固体,是原子晶体(或共价晶体),故熔点:低于,C错误;
D.由分析可知,W为C,Z为Si,则C的非金属性强于Si,则W的最高价氧化物对应水化物即H2CO3的酸性强于Z的即H2SiO3,D正确;
故答案为:D。
9.C
A.用MnO2与浓盐酸反应制备氯气需要加热,故A错误;
B.盐酸易挥发,会使硅酸钠溶液变浑浊,干扰实验,故B错误;
C.盐酸与Na2SO3反应生成SO2,SO2使品红试液褪色,证明其具有漂白性,故C正确;
D.使澄清石灰水变浑浊的气体可能是CO2或SO2,则X溶液中可能含,,,等,故D错误。
综上所述,答案为C。
10.D
A.保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入能使导电能力增强的电解质必须是可溶于水的、显中性的盐,加入硫酸不能生成Fe(OH)3沉淀,故A错误;
B.电解池中Fe为阳极,发生Fe-2e-=Fe2+,故B错误;
C.阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,当乙装置中有1.6 gCH4参加反应,即0.1mol甲烷参加反应时,有0.8mol电子转移,则C电极理论上生成气体在标准状况下为8.96L,故C错误;
D.电池是以熔融碳酸盐为电解质,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,正极反应为O2+2CO2+4e-=2CO32-,可以循环利用的物质只有二氧化碳,故D正确;
故答案为D。
11.AC
A.由分析知,该元素为第四周期元素,价电子排布式为3d14s2,电子排布式为1s22s22p63s23p63d14s2,A错误;
B.该元素的核电荷数为21,元素符号为Sc,B正确;
C.该元素的价电子数为3,为ⅢB族元素,C错误;
D.该元素为ⅢB族元素,位于元素周期表中d区,D正确;
故选AC。
12.AC
A.W为H元素,Q是O元素,W与Q形成的化合物H2O或H2O2常温下为液态,A正确;
B.X是Mg元素,其最高价氧化对应的水化物Mg(OH)2是中强碱,B错误;
C.Z是Cl元素,Q是O元素,ClO2可用于自来水消毒,C正确;
D.YW4是SiH4,仅含Si-H共价键,D错误;
故选AC。
13.AD
A.X含有酚羟基,能与FeCl3溶液发生显色反应,Y不含酚羟基,不能与FeCl3溶液发生显色反应,能用FeCl3溶液鉴别X与Y,故A正确;
B.苯环与烃基之间的C-C键可自由旋转,则X分子中所有原子不一定在同一个平面上,故B错误;
C.Y中有2个酯基,其中苯环左侧的酯基水解后生成的羟基为酚羟基,仍能与NaOH反应,1 mol Y最多消耗3molNaOH,故C错误;
D.X中碳碳双键能与Br2加成,酚羟基邻位上的两个氢也能被溴取代,1 mol X最多消耗3 mol Br2,故D正确;
答案选AD。
14.CD
A.苯酚和乙酸都能与碳酸钠溶液反应,所以不能用碳酸钠溶液除去苯酚中混有的乙酸杂质,故A错误;
B.二氧化碳和二氧化硫但不能与饱和亚硫酸氢钠溶液反应,所以不能用饱和亚硫酸氢钠溶液除去二氧化碳中混有的二氧化硫杂质,故B错误;
C.苯甲酸的溶解度随温度变化大,而氯化钠的溶解度随温度变化小,所以能用重结晶的方法除去苯甲酸中混有的氯化钠杂质,故C正确;
D.氢氧化铜能与浓氢氧化钠溶液反应生成四羟基合铜离子,铜与浓氢氧化钠溶液不反应,所以可用浓氢氧化钠溶液除去铜中混有的氢氧化铜,故D正确;
故选CD。
15.BC
A.以顶点的Ca2+为研究对象,离Ca2+最近的钛离子位于晶胞的体心,所以晶体中离Ca2+最近的Ti4+有8个,A项正确;
B.晶胞图b中含有1个A,3个X,1个B,且A为,根据电中性原理可推知,X为I ,B项错误;
C. b晶胞中A个数为8×=1个,B的个数为1,X的个数为6×=3,A为,则B为Pb2+,X为I 和,化学式为PbCH3NH3I3,摩尔质量为620g/mol,该晶胞的密度为,C错误;
D.由晶胞图a可知,钛酸钙晶体中离Ti4+最近的氧离子形成了正八面体,钛离子位于其中心,D项正确;
故答案为:BC。
16.(1) (酚)羟基和碳碳双键 3
(2)加热 冷却 通入
17.(1) +CH3COOH +H2O
(2)提高苯胺的利用率
(3)A 直形冷凝管 有利于水蒸气馏出,减少乙酸等馏出
(4)A
(5)趁热过滤
18.(1) F、N、O N、C
(2)离子键、共价键(或“非极性共价键”) 折线形或锯齿形或V形
(3)三种物质都是分子晶体,结构相似,相对分子质量越大,沸点越高,甲醇分子间存在氢键所以沸点最高
(4)4
19.(1)羧基、酮(羰)基
(2)取代反应
(3)水溶液、加热,稀硫酸酸化
(4)+CH3CH2Br+HBr
(5)12
(6)
同课章节目录
