第一章第二节原子结构与元素的性质课时作业二(含解析)高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第一章第二节原子结构与元素的性质课时作业二(含解析)高二化学人教版(2019)选择性必修2 | 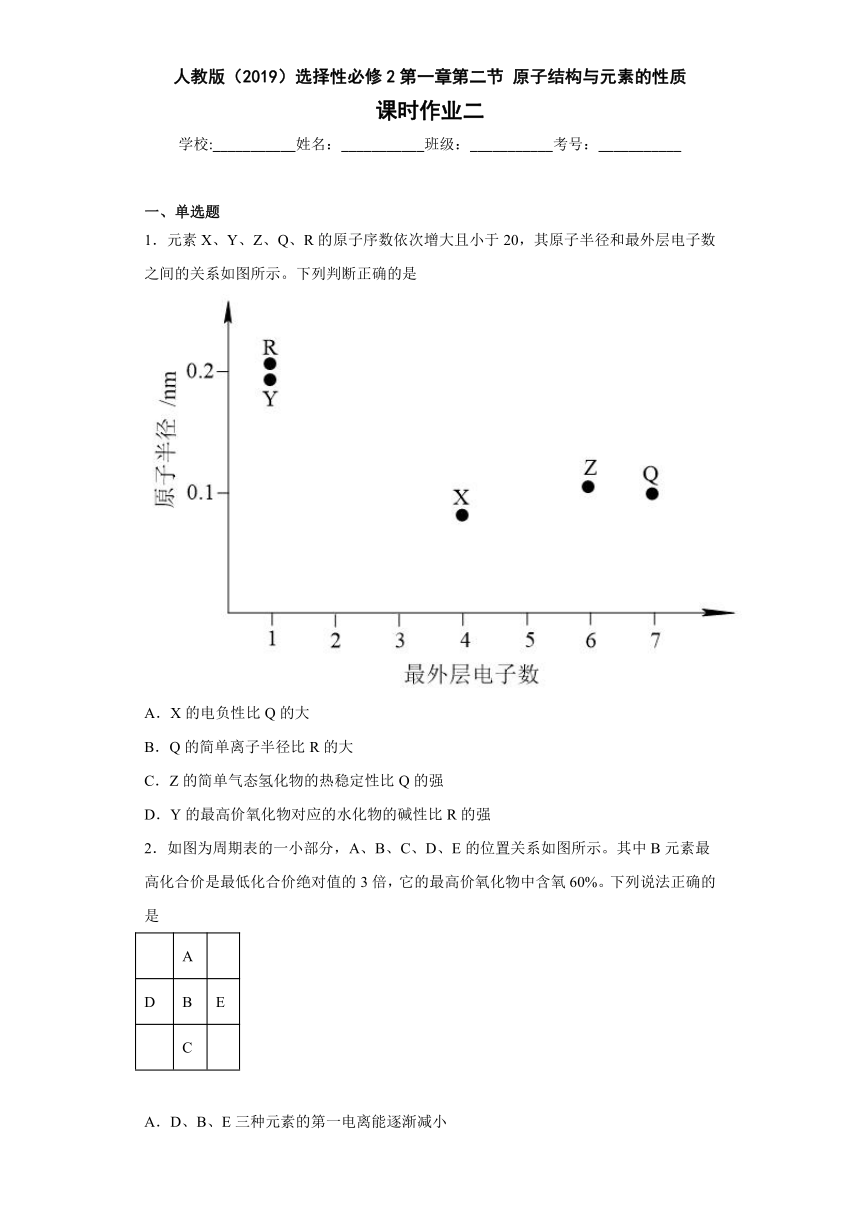 | |
| 格式 | docx | ||
| 文件大小 | 876.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-10 06:30:20 | ||
图片预览





文档简介
人教版(2019)选择性必修2第一章第二节 原子结构与元素的性质
课时作业二
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是
A.X的电负性比Q的大
B.Q的简单离子半径比R的大
C.Z的简单气态氢化物的热稳定性比Q的强
D.Y的最高价氧化物对应的水化物的碱性比R的强
2.如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示。其中B元素最高化合价是最低化合价绝对值的3倍,它的最高价氧化物中含氧60%。下列说法正确的是
A
D B E
C
A.D、B、E三种元素的第一电离能逐渐减小
B.电负性:C>E
C.D、B、E三种元素形成的简单离子的半径逐渐增大
D.气态氢化物的稳定性顺序:D<B<E
3.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是
A.离子半径的大小顺序:e>f>g>h B.与x形成简单化合物的沸点:y>z>d
C.y、z、d三种元素第一电离能和电负性的大小顺序不一致 D.e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应
4.金属Na溶解于液氨中形成氨合钠离子和氨合电子,向该溶液中加入穴醚类配体L,得到首个含碱金属阴离子的金黄色化合物[NaL]+Na-。下列说法错误的是
A.Na-的半径比F-的大 B.Na-的还原性比Na的强
C.Na-的第一电离能比H-的大 D.该事实说明Na也可表现出非金属性
5.钠和钾是两种常见金属,下列说法正确的是
A.钠元素的第一电离能大于钾 B.基态钾原子价层电子轨道表示式为
C.钾能置换出NaCl溶液中的钠 D.钠元素与钾元素的原子序数相差18
6.下表列出了某短周期元素的各级电离能数据(用、表示,单位为)。
……
R 740 1500 7700 10500 ……
下列关于元素的判断中一定正确的是A.R的最高正价为+3
B.R元素位于元素周期表中第IIA族
C.R元素的原子最外层共有4个电子
D.R元素基态原子的电子排布式为
7.用中子轰击X原子产生α粒子(即氦核He)的核反应为:X+n→Y+He。已知元素Y在化合物中呈+1价。下列说法正确的是
A.H3XO3可用于中和溅在皮肤上的NaOH溶液
B.Y单质在空气中燃烧的产物是Y2O2
C.X和氢元素形成离子化合物
D.6Y和7Y互为同素异形体
8.下列化学用语使用正确的是
A.基态C原子价电子排布图: B.结构示意图:
C.形成过程: D.质量数为2的氢核素:
9.、的半衰期很短,自然界中不能稳定存在。人工合成反应如下:;。下列说法正确的是
A.X的中子数为2
B.X、Y互为同位素
C.、可用作示踪原子研究化学反应历程
D.自然界不存在、分子是因其化学键不稳定
10.2021年4月13日,日本政府决定以海洋排放方式处置福岛核电站事故核废水,核废水中含有氚(3H)和14C等放射性同位素。下列有关说法正确的是
A.氚的核内中子数是2H的2倍 B.氚气的还原性比氢气强
C.5Li+n→3He+3H属于化学变化 D.含碳的材料都属于非金属材料
11.下列有关原子核外电子的说法错误的是
A.每个电子层作为最外层时,最多可容纳8个电子
B.电子在核外是分层排布的
C.电子不停地做高速运动
D.离原子核近的电子能量低,离原子核远的电子能量高
12.下列说法正确的是
A.18O2和16O3互为同位素
B.质子数为6,中子数为8的微粒:C
C.NaClO的电子式
D.CO2结构式:O-C-O
13.北京冬奥会中许多核心技术将为比赛保驾护航,其中碲化镉(CdTe)发电玻璃用于一体化项目,其发电原理为在玻璃表面涂抹一层碲化镉,使其具有光电转换功能。以下说法正确的是
A.碲元素属于过渡元素
B.的中子数为128
C.112Cd与114Cd互为同素异形体
D.碲化镉玻璃发电过程是将光能转化为电能
14.的衰变反应为,其半衰期(反应物的量被消耗到其初始量的一半需要的时间)为5730年。下列说法正确的是
A.与互为同位素
B.与的中子数相同
C.和的价层轨道电子数相差2
D.某考古样品中的量应为其11460年前的
15.Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍。下列说法正确的是
A.非金属性: B.单质的熔点:
C.简单氢化物的沸点: D.最高价含氧酸的酸性:
二、填空题
16.X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:
元素代号 X Y Z M Q R
原子半径/nm 0.160 0.143 0.102 0.089 0.074 0.037
主要化合价 +2 +3 +6,-2 +2 -2 +1
(1)X、Y、Q各自形成简单离子,其中离子半径最大的是__(填离子符号)。
(2)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式___。
17.合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为___________,占据最高能级电子的电子云轮廓图为___________形。
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为___________。
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是___________。
②比较Mg、Ca第一电离能的大小:___________。O的第一电离能小于N,原因是___________。
③下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
元素 Na Mg Al
电离能(kJ/mol) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10540 11575
结合数据说明Mg的常见化合价为+2价的原因:___________。
(3)我国科研人员研制出了“Fe—LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为___________,铁在元素周期表中的位置___________。
②比较Li+与H-的半径大小关系:r(Li+)___________r(H-)(填“>”或“<”)。
18.下表为元素周期表的一部分,请回答下列有关问题:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 ①
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧
4 ⑨ ⑩
(1)元素②的一种核素可测定文物年代,这种核素的符号为___________,已知元素⑩的一种核素,其中子数为45,这种核素的符号为___________。
(2)由元素①和④可形成18电子的化合物,该化合物的化学式为___________。
(3)图中标出的元素的最高价氧化物对应的水化物中,酸性最强的是___________(用化学式回答),写出该水化物与⑥的最高价氧化物的水化物反应的离子方程式___________。
(4)将⑤、⑥、⑨单质各1mol分别投入到足量的同浓度的盐酸中,预测实验结果:___________与盐酸反应最剧烈,___________与盐酸反应的速度最慢;___________与盐酸反应产生的气体最多。(用元素符号回答)
(5)元素的非金属性⑧___________⑩(填“>”或“<”);下列事实不能证明上述结论的是___________。
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
E.元素⑧的氢化物的还原性比元素⑩的弱
19.《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也”。青金石的化学组成可表示为。回答下列问题:
(1)钠在元素周期表中的位置是___________;钙离子的结构示意图为___________。
(2)的电子式为___________,的结构式为___________。
(3)Be与Al的化学性质相似,则Be与NaOH溶液反应的化学方程式是___________。
(4)宏观辨识与微观探析是化学学科的核心素养之一,下列能说明Cl的非金属性比S强的事实是___________(填字母)。
A.氯、硫的最低负价分别为、
B.中氯显价,硫显价
C.的酸性比的强
D.向水溶液中通入有淡黄色沉淀生成
E.硫化氢在300℃时开始分解,HCl在1500℃时开始缓慢分解
20.如表所示为元素周期表的一部分,参照元素①~⑩在表中的位置,请回答下列问题:
已知周期表中存在对角相似规则,如②与⑦在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑥的氢氧化物反应的化学方程式___。
三、实验题
21.镓是一种低熔点、高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业。回答下列问题:
(1)镓的原子结构示意图为,镓元素在元素周期表中的位置是_______。
(2)的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是_______(填“共价化合物”或“离子化合物”)。
(3)已知与同周期,与N同主族。
①用原子结构理论推测,中元素的化合价为_______;
②下列事实不能用元素周期律解释的是_______(填标序号);
a.原子半径: b.热稳定性:
c.碱性: d.酸性:
(4)是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产的工艺如图。
①“热转化”时转化为的化学方程式是_______。
②某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
仪器X中的试剂是_______;加热前需先通入一段时间的,原因是_______;装置G的作用是_______。
22.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
Ⅰ.探究同周期元素性质的递变规律
(1)相同条件下,将钠、镁、铝各1 mol分别投入到足量的同浓度的稀盐酸中,试预测实验结果:___________与稀盐酸反应最剧烈;___________与稀盐酸反应产生的气体最多。
(2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀,可证明S的非金属性比Si强,反应的离子方程式为___________。
Ⅱ.探究同主族元素非金属性的递变规律
某研究性学习小组设计了一组实验来探究ⅦA族元素原子的得电子能力强弱规律。图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①、②处依次放置蘸有NaBr溶液、NaOH浓溶液的棉球。
(3)写出装置B中仪器a的名称___________。
(4)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,依据该反应原理选择___________(填“A”或“B”或“C”)装置制取氯气。
(5)反应装置的导气管连接装置D的X导管,①处发生反应的离子方程式为:___________。②处发生反应的离子方程式为:___________。
参考答案:
1.B
【分析】X、Y、Z、Q、R的原子序数依次增大且小于20,由图象中最外层电子数和原子半径的关系可知,X为C、Y为Na、Z为S、Q为Cl、R为K。
【详解】A.C的电负性比Cl的小,故A错误;
B.核外电子数相同时质子数越大半径越小,故Q的简单离子半径比R的大,故B正确;
C.同周期元素,原子序数越大非金属性越强,则简单氢化物更稳定,则Z的简单气态氢化物的热稳定性比Q的弱,故C错误;
D.同主族元素,原子序数越大金属性越强,则最高价氧化物对应水化物的碱性越强,则Y的最高价氧化物对应的水化物的碱性比R的弱,故D错误;
故选B。
2.D
【解析】B元素最高价是最低负价绝对值的3倍,则B元素最高正价为+6价,其最高价氧化物化学式表示为BO3,又最高氧化物中含氧60%,令B元素相对原子质量为b,则,解得b=32,故B为S元素,由元素在周期表中相对位置可知,A为O元素、C为Se、D为P元素、E为Cl,
【详解】由上述分析可知,A为O,B为S,C为Se,D为P,E为Cl,
A.非金属性越强,第一电离能越大,但P的3p电子半满为稳定结构,则D、E、B三种元素的第一电离能逐渐减小,故A错误;
B.同主族元素从上到下,元素的电负性减弱,同周期从左到右,电负性增大,则电负性E>C,故B错误;
C.D、B、E三种元素形成的简单离子具有相同的核外电子排布,核电荷数越大离子半径越小,故C错误;
D.非金属性:D(P)<B(S)<E(Cl),故氢化物稳定性:D<B<E,故D正确;
故选:D。
3.C
【分析】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,a位于第一周期,为H元素; b、c、d位于第二周期,b为C ,c为N, d为O元素;e、f、g、h位于第三周期,则e为Na,f为Al ,g为s , h为Cl元素,据此结合元素周期律、元素化合物知识解答。
【详解】A.根据电子层越多半径越大,电子层数相同时,核电荷数越大半径越小分析,离子半径关系为S2->Cl->Na+>Al3+,A错误;
B.三种物质分别为甲烷,氨气和水,因为氨气和水分子间存在氢键,所以沸点高,沸点顺序为H2O>NH3>CH4,B错误;
C.碳氮氧的电负性依次增加,但是氮元素为半满结构,第一电离能大于碳,故第一电离能顺序为氮>碳>氧,二者大小顺序不一致,C正确;
D.e、f、g、h四种元素对应最高价氧化物的水化物分别为氢氧化钠、氢氧化铝、硫酸、高氯酸,氢氧化铝和其他三种都能反应,但硫酸和高氯酸不能相互反应,D错误;
故选C。
4.C
【详解】A.核外有3个电子层、核外有2个电子层,故的半径比的大,A项正确;
B.的半径比Na的大,中原子核对最外层电子的引力小,易失电子,故的还原性比Na的强,B项正确;
C.的1s上有2个电子,为全充满稳定结构,不易失去电子,故的第一电离能比的小,C项错误;
D.该事实说明Na可以形成,得电子表现出非金属性,D项正确。
故选C。
5.A
【详解】A.同一主族元素的第一电离能从上到下依次减小,金属性越强的元素,其第一电离能越小,因此,钠元素的第一电离能大于钾,A说法正确;
B.基态钾原子价层电子为4s1,其轨道表示式为,B说法不正确;
C.钾和钠均能与水发生置换反应,因此,钾不能置换出 NaC1溶液中的钠,C说法不正确;
D.钠元素与钾元素的原子序数分别为11和19,两者相差8,D说法不正确;
综上所述,本题选A。
6.B
【分析】从表中原子的第一至第四电离能可以看出,元素的第一、第二电离能都较小,可失去2个电子,最高化合价为+2价,即最外层应有2个电子,应为第IIA族元素。
【详解】A.根据分析可知,R的最高正价为+2,故A错误;
B.根据分析可知,R元素位于元素周期表中第IIA族,故B正确;
C.根据分析可知,R元素的原子最外层共有2个电子,故C错误;
D.根据分析可知,短周期元素为第IIA族元素,可能是Mg或Be,即R元素基态原子的电子排布式可能为1s22s22p63s2,故D错误;
答案选B。
7.A
【分析】根据核反应为:可知,X的质量数N为4+7-1=10,又因为Y在化合物中呈价,则推知Y位于IA族,质量数=质子数+中子数,Y的质量数为7,所以得出Y为Li,其质子数p=3,所以X的质子数Z=3+2-0=5,核电荷数=原子序数=核内质子数=5,则推知X属于B元素,据此分析解答。
【详解】A.为硼酸,氢氧化钠溶液具有腐蚀性,若不慎将溶液溅到皮肤上,则需用大量水冲洗,同时涂抹,以中和碱液,A正确;
B.Y为Li,在空气中燃烧的产物只有Li2O,B错误;
C.X为B,与氢元素会形成BH3或B2H4等硼氢化合物,B元素与H元素以共价键结合,属于共价化合物,C错误;
D.和两者的质子数均为3,中子数不同,所以两者互为同位素,D错误;
故选A。
8.D
【详解】A.基态C原子价电子排布图为: ,A错误;
B.结构示意图为:,B错误;
C.形成过程为:,C错误;
D.质量数为2的氢核素为:,D正确;
故答案为:D。
9.B
【详解】根据质量守恒可知,X微粒为,Y微粒为,据此分析解题。
A. 由分析可知,X微粒为,根据质量数等于质子数加中子数可知,该微粒的中子数为4,A错误;
B. 由分析可知,X微粒为,Y微粒为,二者具有相同的质子数而不同的中子数的原子,故互为同位素,B正确;
C.由题干信息可知,与的半衰期很短,故不适宜用作示踪原子研究化学反应历程,C错误;
D.自然界中不存在与并不是其化学键不稳定,而是由于与的半衰期很短,很容易发生核变化,转化为气体其他原子,O=O的键能与形成该键的核素无关,D错误;
故答案为:B。
10.A
【详解】A.3H核内2个中子,2H核内1个中子,故A正确;
B.氚和氢核外电子排布相同,所以氚气和氢气的化学性质相同,故B错误;
C.5Li+n→3He+3H原子核发生变化,核反应不属于化学变化,故C错误;
D.生铁是金属材料,生铁含碳,属于合金,故D错误;
选A。
11.A
【详解】A.第一个电子层作为最外层时,最多可容纳2个电子,如氦原子,故A错误;
B.电子在原子中处于不同的能量状态,按照能量不同分层排布,故B正确;
C.原子核外的电子,在核外不停的作无规则高速移动,故C正确;
D.原子核外区域能量可能不同,距核由近到远,能量由低到高,即离原子核近的电子能量低,离核远的电子能量高,故D正确;
故选A。
12.C
【详解】A.同位素的研究对象为原子,18O2和16O3是单质,A错误;
B.质子数为6,中子数为8的微粒应是C,B错误;
C.NaClO的电子式,符合离子化合物电子式的书写,C正确;
D.CO2结构式应是O=C=O,D错误;
故选C。
13.D
【详解】A.过渡元素全部是金属元素,A项错误;
B.的中子数为76,B项错误;
C.112Cd与114Cd互为同位素,C项错误;
D.由信息可知发电过程是将光能转化为电能,D项正确。
故选D。
14.D
【解析】由,可知z=7,X为N,因此。
【详解】A.z=7,与质子数不相同,不互为同位素,A错误;
B.与的中子数分别为14-6=8、14-7=7,中子数不同,B错误;
C.和的核外电子数均为6,核外电子排布相同,价层轨道电子数相同,C错误;
D.根据半衰期的定义,某考古样品中的量应为其5730年前的,为5730×2=11460年前的,D正确;
答案选D。
15.D
【分析】Q、X、Y、Z为原子序数依次增大的短周期主族元素,Q与X、Y、Z不在同一周期,Y原子最外层电子数为Q原子内层电子数的2倍,则Q应为第二周期元素,X、Y、Z位于第三周期,Y的最外层电子数为4,则Y为Si元素,X、Y相邻,且X的原子序数小于Y,则X为Al元素,Q、X、Y、Z的最外层电子数之和为19,则Q、Z的最外层电子数之和为19-3-4=12,主族元素的最外层电子数最多为7,若Q的最外层电子数为7,为F元素,Z的最外层电子数为5,为P元素,若Q的最外层电子数为6,为O元素,则Z的最外层电子数为6,为S元素,若Q的最外层电子数为5,为N元素,Z的最外层电子数为7,为Cl元素;综上所述,Q为N或O或F,X为Al,Y为Si,Z为Cl或S或P,据此分析解题。
【详解】A.X为Al,Q为N或O或F,同一周期从左往右元素非金属性依次增强,同一主族从上往下依次减弱,故非金属性:Q>X,A错误;
B.由分析可知,X为Al属于金属晶体,Y为Si属于原子晶体或共价晶体,故单质熔点Si>Al,即Y>X,B错误;
C.含有氢键的物质沸点升高,由分析可知Q为N或O或F,其简单氢化物为H2O或NH3或HF,Z为Cl或S或P,其简单氢化物为HCl或H2S或PH3,由于前者物质中存在分子间氢键,而后者物质中不存在,故沸点Q>Z,C错误;
D.元素的非金属性越强,其最高价含氧酸的酸性越强,P、S、Cl的非金属性均强于Si,因此最高价含氧酸酸性:Z>Y,D正确;
故答案为:D。
16.(1)O2-
(2)BeO+2OH-=BeO+H2O
【分析】同一周期,左到右,原子半径减小,同一主族,从上到下,原子半径增大;五种元素为1-18号元素,上述分析可以知道,X为Mg,Y为Al,Z为S,M为Be,Q为O,R为H。
(1)
Mg2+、Al3+和O2-的核外电子数相同,核电荷数越小半径越大,故离子半径最大的为O2-。
(2)
Be的氧化物具有两性,能与氢氧化钠反应生成铍酸钠和氢气,反应式为BeO+2OH-=BeO+H2O。
17.(1) 哑铃 N>H
(2) Al、O Mg>Ca O的价电子层2s22p4,失去一个电子后,2p能级达到半满的结构,相对稳定;N的价电子层2s22p3,半满的结构,相对稳定,不易失去电子 镁的第三电离能比第一、二电离能大很多,镁很难失去第三个电子,而易失去两个电子形成+2价镁离子
(3) 1s22s22p63s23p63d64s2 第四周期第Ⅷ族 <
【详解】(1)①基态氮原子的电子排布式为1s22s22p3,其轨道表示式为;占据最高能级为2p,其电子云轮廓图为哑铃形;
②NH3分子中,与N原子相连的H显正电性,则N、H电负性大小顺序为N>H;
(2)①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是Al、O;
②同一主族从上到下,第一电离能逐渐减小,则Mg、Ca第一电离能的大小为Mg>Ca;O的价电子层2s22p4,失去一个电子后,2p能级达到半满的结构,相对稳定;N的价电子层2s22p3,半满的结构,相对稳定,不易失去电子,故第一电离能:O<N;
③镁的第三电离能比第一、二电离能大很多,镁很难失去第三个电子,而易失去两个电子形成+2价镁离子,故Mg的常见化合价为+2价;
(3)①基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,铁在元素周期表中位于第四周期第Ⅷ族;
②Li+与H-具有相同的电子层数,原子序数越小,离子半径越大,则离子半径:r(Li+)<r(H-)。
18.(1)
(2)H2O2
(3) HClO4
(4) K Al Al
(5) > D
【分析】由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为K、⑩为Br。
(1)
元素②为C,C的一种核素可测定文物年代,则这种核素的符号为,⑩为Br,处于第四周期第ⅦA族,是35号元素,它的一种核素中子数为45,则质量数为35+45=80,该核素的符号为;
(2)
由元素①(H)和④(O)形成的18电子化合物为过氧化氢,该化合物的化学式为H2O2;
(3)
元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,以上元素中,非金属性最强的是Cl元素,则酸性最强的是高氯酸,其化学式为HClO4,⑥的最高价氧化物的水化物为氢氧化铝,氢氧化铝与高氯酸反应生成Al(ClO4)3和水,反应离子方程式为为;
(4)
⑤、⑥、⑨分别为Na、Al、K,将Na、Al、K各1mol分别投入到足量的同浓度的盐酸中,由于金属性K>Na>Al,故K与盐酸反应最剧烈,Al与盐酸反应的速度最慢,金属完全反应,Al表现+3价,Na、K均表现+1价,根据电子转移守恒,可知Al与盐酸反应产生的氢气最多;
(5)
同主族自上而下元素非金属性减弱,故非金属性⑧>⑩;
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为黄色,说明有Br2生成,证明Cl元素非金属性比Br强,故A不符合题意;
B.元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强,非金属性⑧>⑩,故B不符合题意;
C.元素非金属性与氢化物稳定性一致,元素⑧和⑩的氢化物受热分解,前者的分解温度高,说明⑧的非金属性更强,故C不符合题意;
D.氢化物酸性强弱不能说明元素非金属性强弱,如酸性HF<HCl、H2S<HCl,但非金属性F>Cl,Cl>S,故D符合题意;
E.元素⑧的氢化物的还原性比元素⑩的弱,说明⑧的非金属性更强,故E不符合题意;
答案选D。
19.(1) 第三周期ⅠA族
(2)
(3)
(4)BDE
【解析】(1)
钠为11号元素,在元素周期表中的位置是第三周期ⅠA族,钙离子最外层失去两个电子,结构示意图为,故答案为:第三周期ⅠA族;:
(2)
过氧化钠为离子化合物,含有2个钠离子和一个过氧根,电子式为,共价化合物,原子均要达到8电子的稳定结构,结构式为,故答案为:;;
(3)
Be与Al的化学性质相似,则Be与NaOH溶液反应生成和氢气,化学方程式是,故答案为:;
(4)
A.氯、硫的最低负价分别为、,能表示他们得到的电子数目,但非金属性与电子得失数目无关,故A不选;
B.中氯显价,硫显价,说明氯更容易得电子,说明其非金属性强,故B选;
C.,都不是最高价氧化物对应的水化物,故不能比较非金属性,故C不选;
D.向水溶液中通入有淡黄色沉淀生成,说明氯气把硫置换出来,则氯的非金属性强于硫,故D选;
E.硫化氢在300℃时开始分解,HCl在1500℃时开始缓慢分解,说明氯化氢的稳定性较好,则说明其非金属性强,故E选;
故答案为:BDE。
20.Be(OH)2+2NaOH=Na2BeO2+2H2O
【分析】由元素在周期表中位置,可知①是H,②是Be,③是N,④是O,⑤是F,⑥是Na,⑦是Al,⑧是P,⑨是S,⑩是Cl。
【详解】②的氢氧化物Be(OH)2是两性氢氧化物,可以与⑥的氢氧化物NaOH反应,生成偏铝酸钠和水,反应方程式为Be(OH)2+2NaOH=Na2BeO2+2H2O。
21.(1)第四周期第ⅢA族
(2)共价化合物
(3) -3 d
(4) 浓氨水(或浓溶液) 排尽装置中的空气,避免空气与镓反应,使产物不纯 吸收过量的氨气,防止污染环境
【解析】(1)
镓的原子结构示意图为,含有四个电子层,所以镓在第四周期,第三周期含有18个电子全充满,最外层有三个电子,所以镓在第ⅢA族,故答案为:第四周期第ⅢA族;
(2)
离子化合物在熔融状态下均导电,的熔点为1238℃,且熔融状态不导电,可知为共价化合物,故答案为:共价化合物;
(3)
①位于第四周期第VA族,位于第四周期第ⅢA族,同周期主族元素从左向右电负性递增,得电子能力递增,所以中元素显负价,最外层有三个电子,最外层有五个电子,所以中元素的化合价为:-3,故答案为:-3;
②a.位于第四周期第VA族,位于第四周期第ⅢA族,同周期主族元素从左向右原子半径递减,所以原子半径:;
b.同主族元素非金属性从上到下递减,简单气态氢化物稳定性递减,与N同主族,所以热稳定性:;
c.同主族元素金属性从上到下递增,最高价氧化物对应水化物碱性增强,和同主族,所以碱性:;
d.利用元素周期律可以解释不同元素的最高价氧化物对应水化物的酸性强弱,同种元素不同价态的含氧酸酸性不可以解释;
故答案为:d;
(4)
①热转化”时和发生反应生成和,化学方程式为:,故答案为:;
②装置A用锌与稀硫酸反应制备氢气,将该体系内空气排尽,防止氧气与反应,使产物不纯,干扰实验;装置C利用氧化钙的吸水性,吸收浓氨水中的水分,同时放出热量,促使一水合氨分解产生氨气,干燥后的氨气与反应制备;F装置作为防倒吸装置,G为尾气处理装置,稀硫酸吸收过量的氨气,防止空气污染,答案为:浓氨水(或浓溶液);排尽装置中的空气,避免空气与镓反应,使产物不纯;吸收过量的氨气,防止污染环境。
22. 钠 铝 +2H+=H2SiO3↓ 分液漏斗 A C12+2Br﹣=2Cl﹣+Br2 Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
【分析】I.(1)金属性Na>Mg>Al,金属越活泼,与酸反应越剧烈,均1mol时Al失去电子最多; (2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀生成硅酸,利用强酸制弱酸;
Ⅱ.实验室制备氯气可用二氧化锰和浓盐酸在加热条件下反应,也可用高锰酸钾与浓盐酸反应制备,反应较为剧烈,无需加热即可进行,氯气具有强氧化性,能与NaBr溶液发生置换反应生成单质Br2,氯气有毒,用碱吸收,在碱性溶液中自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
【详解】I.(1)金属活泼性顺序为:钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钠;生成1mol氢气需要得到2mol电子,1mol钠失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝,故答案为:钠;铝;
(2) 利用强酸制弱酸,向Na2SiO3溶液中加入稀H2SO4出现白色沉淀生成硅酸,离子方程式为:+2H+=H2SiO3↓;故答案为:+2H+=H2SiO3↓;
Ⅱ.(3)装置B中仪器a的名称为分液漏斗,故答案为:分液漏斗;
(4)高锰酸钾与浓盐酸反应较为剧烈,无需加热即可进行,是固体和液体不加热制备气体装置,选择A,故答案为:A;
(5)①氯气与NaBr溶液反应生成Br2,反应的离子方程式为Cl2+2Br-=2Cl-+Br2,故答案为:C12+2Br-=2Cl-+Br2;
②氯气在碱性溶液中自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O。
课时作业二
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是
A.X的电负性比Q的大
B.Q的简单离子半径比R的大
C.Z的简单气态氢化物的热稳定性比Q的强
D.Y的最高价氧化物对应的水化物的碱性比R的强
2.如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示。其中B元素最高化合价是最低化合价绝对值的3倍,它的最高价氧化物中含氧60%。下列说法正确的是
A
D B E
C
A.D、B、E三种元素的第一电离能逐渐减小
B.电负性:C>E
C.D、B、E三种元素形成的简单离子的半径逐渐增大
D.气态氢化物的稳定性顺序:D<B<E
3.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是
A.离子半径的大小顺序:e>f>g>h B.与x形成简单化合物的沸点:y>z>d
C.y、z、d三种元素第一电离能和电负性的大小顺序不一致 D.e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应
4.金属Na溶解于液氨中形成氨合钠离子和氨合电子,向该溶液中加入穴醚类配体L,得到首个含碱金属阴离子的金黄色化合物[NaL]+Na-。下列说法错误的是
A.Na-的半径比F-的大 B.Na-的还原性比Na的强
C.Na-的第一电离能比H-的大 D.该事实说明Na也可表现出非金属性
5.钠和钾是两种常见金属,下列说法正确的是
A.钠元素的第一电离能大于钾 B.基态钾原子价层电子轨道表示式为
C.钾能置换出NaCl溶液中的钠 D.钠元素与钾元素的原子序数相差18
6.下表列出了某短周期元素的各级电离能数据(用、表示,单位为)。
……
R 740 1500 7700 10500 ……
下列关于元素的判断中一定正确的是A.R的最高正价为+3
B.R元素位于元素周期表中第IIA族
C.R元素的原子最外层共有4个电子
D.R元素基态原子的电子排布式为
7.用中子轰击X原子产生α粒子(即氦核He)的核反应为:X+n→Y+He。已知元素Y在化合物中呈+1价。下列说法正确的是
A.H3XO3可用于中和溅在皮肤上的NaOH溶液
B.Y单质在空气中燃烧的产物是Y2O2
C.X和氢元素形成离子化合物
D.6Y和7Y互为同素异形体
8.下列化学用语使用正确的是
A.基态C原子价电子排布图: B.结构示意图:
C.形成过程: D.质量数为2的氢核素:
9.、的半衰期很短,自然界中不能稳定存在。人工合成反应如下:;。下列说法正确的是
A.X的中子数为2
B.X、Y互为同位素
C.、可用作示踪原子研究化学反应历程
D.自然界不存在、分子是因其化学键不稳定
10.2021年4月13日,日本政府决定以海洋排放方式处置福岛核电站事故核废水,核废水中含有氚(3H)和14C等放射性同位素。下列有关说法正确的是
A.氚的核内中子数是2H的2倍 B.氚气的还原性比氢气强
C.5Li+n→3He+3H属于化学变化 D.含碳的材料都属于非金属材料
11.下列有关原子核外电子的说法错误的是
A.每个电子层作为最外层时,最多可容纳8个电子
B.电子在核外是分层排布的
C.电子不停地做高速运动
D.离原子核近的电子能量低,离原子核远的电子能量高
12.下列说法正确的是
A.18O2和16O3互为同位素
B.质子数为6,中子数为8的微粒:C
C.NaClO的电子式
D.CO2结构式:O-C-O
13.北京冬奥会中许多核心技术将为比赛保驾护航,其中碲化镉(CdTe)发电玻璃用于一体化项目,其发电原理为在玻璃表面涂抹一层碲化镉,使其具有光电转换功能。以下说法正确的是
A.碲元素属于过渡元素
B.的中子数为128
C.112Cd与114Cd互为同素异形体
D.碲化镉玻璃发电过程是将光能转化为电能
14.的衰变反应为,其半衰期(反应物的量被消耗到其初始量的一半需要的时间)为5730年。下列说法正确的是
A.与互为同位素
B.与的中子数相同
C.和的价层轨道电子数相差2
D.某考古样品中的量应为其11460年前的
15.Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍。下列说法正确的是
A.非金属性: B.单质的熔点:
C.简单氢化物的沸点: D.最高价含氧酸的酸性:
二、填空题
16.X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:
元素代号 X Y Z M Q R
原子半径/nm 0.160 0.143 0.102 0.089 0.074 0.037
主要化合价 +2 +3 +6,-2 +2 -2 +1
(1)X、Y、Q各自形成简单离子,其中离子半径最大的是__(填离子符号)。
(2)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式___。
17.合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为___________,占据最高能级电子的电子云轮廓图为___________形。
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为___________。
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是___________。
②比较Mg、Ca第一电离能的大小:___________。O的第一电离能小于N,原因是___________。
③下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
元素 Na Mg Al
电离能(kJ/mol) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10540 11575
结合数据说明Mg的常见化合价为+2价的原因:___________。
(3)我国科研人员研制出了“Fe—LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为___________,铁在元素周期表中的位置___________。
②比较Li+与H-的半径大小关系:r(Li+)___________r(H-)(填“>”或“<”)。
18.下表为元素周期表的一部分,请回答下列有关问题:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 ①
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧
4 ⑨ ⑩
(1)元素②的一种核素可测定文物年代,这种核素的符号为___________,已知元素⑩的一种核素,其中子数为45,这种核素的符号为___________。
(2)由元素①和④可形成18电子的化合物,该化合物的化学式为___________。
(3)图中标出的元素的最高价氧化物对应的水化物中,酸性最强的是___________(用化学式回答),写出该水化物与⑥的最高价氧化物的水化物反应的离子方程式___________。
(4)将⑤、⑥、⑨单质各1mol分别投入到足量的同浓度的盐酸中,预测实验结果:___________与盐酸反应最剧烈,___________与盐酸反应的速度最慢;___________与盐酸反应产生的气体最多。(用元素符号回答)
(5)元素的非金属性⑧___________⑩(填“>”或“<”);下列事实不能证明上述结论的是___________。
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
E.元素⑧的氢化物的还原性比元素⑩的弱
19.《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也”。青金石的化学组成可表示为。回答下列问题:
(1)钠在元素周期表中的位置是___________;钙离子的结构示意图为___________。
(2)的电子式为___________,的结构式为___________。
(3)Be与Al的化学性质相似,则Be与NaOH溶液反应的化学方程式是___________。
(4)宏观辨识与微观探析是化学学科的核心素养之一,下列能说明Cl的非金属性比S强的事实是___________(填字母)。
A.氯、硫的最低负价分别为、
B.中氯显价,硫显价
C.的酸性比的强
D.向水溶液中通入有淡黄色沉淀生成
E.硫化氢在300℃时开始分解,HCl在1500℃时开始缓慢分解
20.如表所示为元素周期表的一部分,参照元素①~⑩在表中的位置,请回答下列问题:
已知周期表中存在对角相似规则,如②与⑦在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑥的氢氧化物反应的化学方程式___。
三、实验题
21.镓是一种低熔点、高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业。回答下列问题:
(1)镓的原子结构示意图为,镓元素在元素周期表中的位置是_______。
(2)的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是_______(填“共价化合物”或“离子化合物”)。
(3)已知与同周期,与N同主族。
①用原子结构理论推测,中元素的化合价为_______;
②下列事实不能用元素周期律解释的是_______(填标序号);
a.原子半径: b.热稳定性:
c.碱性: d.酸性:
(4)是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。一种镍催化法生产的工艺如图。
①“热转化”时转化为的化学方程式是_______。
②某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
仪器X中的试剂是_______;加热前需先通入一段时间的,原因是_______;装置G的作用是_______。
22.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
Ⅰ.探究同周期元素性质的递变规律
(1)相同条件下,将钠、镁、铝各1 mol分别投入到足量的同浓度的稀盐酸中,试预测实验结果:___________与稀盐酸反应最剧烈;___________与稀盐酸反应产生的气体最多。
(2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀,可证明S的非金属性比Si强,反应的离子方程式为___________。
Ⅱ.探究同主族元素非金属性的递变规律
某研究性学习小组设计了一组实验来探究ⅦA族元素原子的得电子能力强弱规律。图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①、②处依次放置蘸有NaBr溶液、NaOH浓溶液的棉球。
(3)写出装置B中仪器a的名称___________。
(4)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,依据该反应原理选择___________(填“A”或“B”或“C”)装置制取氯气。
(5)反应装置的导气管连接装置D的X导管,①处发生反应的离子方程式为:___________。②处发生反应的离子方程式为:___________。
参考答案:
1.B
【分析】X、Y、Z、Q、R的原子序数依次增大且小于20,由图象中最外层电子数和原子半径的关系可知,X为C、Y为Na、Z为S、Q为Cl、R为K。
【详解】A.C的电负性比Cl的小,故A错误;
B.核外电子数相同时质子数越大半径越小,故Q的简单离子半径比R的大,故B正确;
C.同周期元素,原子序数越大非金属性越强,则简单氢化物更稳定,则Z的简单气态氢化物的热稳定性比Q的弱,故C错误;
D.同主族元素,原子序数越大金属性越强,则最高价氧化物对应水化物的碱性越强,则Y的最高价氧化物对应的水化物的碱性比R的弱,故D错误;
故选B。
2.D
【解析】B元素最高价是最低负价绝对值的3倍,则B元素最高正价为+6价,其最高价氧化物化学式表示为BO3,又最高氧化物中含氧60%,令B元素相对原子质量为b,则,解得b=32,故B为S元素,由元素在周期表中相对位置可知,A为O元素、C为Se、D为P元素、E为Cl,
【详解】由上述分析可知,A为O,B为S,C为Se,D为P,E为Cl,
A.非金属性越强,第一电离能越大,但P的3p电子半满为稳定结构,则D、E、B三种元素的第一电离能逐渐减小,故A错误;
B.同主族元素从上到下,元素的电负性减弱,同周期从左到右,电负性增大,则电负性E>C,故B错误;
C.D、B、E三种元素形成的简单离子具有相同的核外电子排布,核电荷数越大离子半径越小,故C错误;
D.非金属性:D(P)<B(S)<E(Cl),故氢化物稳定性:D<B<E,故D正确;
故选:D。
3.C
【分析】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,a位于第一周期,为H元素; b、c、d位于第二周期,b为C ,c为N, d为O元素;e、f、g、h位于第三周期,则e为Na,f为Al ,g为s , h为Cl元素,据此结合元素周期律、元素化合物知识解答。
【详解】A.根据电子层越多半径越大,电子层数相同时,核电荷数越大半径越小分析,离子半径关系为S2->Cl->Na+>Al3+,A错误;
B.三种物质分别为甲烷,氨气和水,因为氨气和水分子间存在氢键,所以沸点高,沸点顺序为H2O>NH3>CH4,B错误;
C.碳氮氧的电负性依次增加,但是氮元素为半满结构,第一电离能大于碳,故第一电离能顺序为氮>碳>氧,二者大小顺序不一致,C正确;
D.e、f、g、h四种元素对应最高价氧化物的水化物分别为氢氧化钠、氢氧化铝、硫酸、高氯酸,氢氧化铝和其他三种都能反应,但硫酸和高氯酸不能相互反应,D错误;
故选C。
4.C
【详解】A.核外有3个电子层、核外有2个电子层,故的半径比的大,A项正确;
B.的半径比Na的大,中原子核对最外层电子的引力小,易失电子,故的还原性比Na的强,B项正确;
C.的1s上有2个电子,为全充满稳定结构,不易失去电子,故的第一电离能比的小,C项错误;
D.该事实说明Na可以形成,得电子表现出非金属性,D项正确。
故选C。
5.A
【详解】A.同一主族元素的第一电离能从上到下依次减小,金属性越强的元素,其第一电离能越小,因此,钠元素的第一电离能大于钾,A说法正确;
B.基态钾原子价层电子为4s1,其轨道表示式为,B说法不正确;
C.钾和钠均能与水发生置换反应,因此,钾不能置换出 NaC1溶液中的钠,C说法不正确;
D.钠元素与钾元素的原子序数分别为11和19,两者相差8,D说法不正确;
综上所述,本题选A。
6.B
【分析】从表中原子的第一至第四电离能可以看出,元素的第一、第二电离能都较小,可失去2个电子,最高化合价为+2价,即最外层应有2个电子,应为第IIA族元素。
【详解】A.根据分析可知,R的最高正价为+2,故A错误;
B.根据分析可知,R元素位于元素周期表中第IIA族,故B正确;
C.根据分析可知,R元素的原子最外层共有2个电子,故C错误;
D.根据分析可知,短周期元素为第IIA族元素,可能是Mg或Be,即R元素基态原子的电子排布式可能为1s22s22p63s2,故D错误;
答案选B。
7.A
【分析】根据核反应为:可知,X的质量数N为4+7-1=10,又因为Y在化合物中呈价,则推知Y位于IA族,质量数=质子数+中子数,Y的质量数为7,所以得出Y为Li,其质子数p=3,所以X的质子数Z=3+2-0=5,核电荷数=原子序数=核内质子数=5,则推知X属于B元素,据此分析解答。
【详解】A.为硼酸,氢氧化钠溶液具有腐蚀性,若不慎将溶液溅到皮肤上,则需用大量水冲洗,同时涂抹,以中和碱液,A正确;
B.Y为Li,在空气中燃烧的产物只有Li2O,B错误;
C.X为B,与氢元素会形成BH3或B2H4等硼氢化合物,B元素与H元素以共价键结合,属于共价化合物,C错误;
D.和两者的质子数均为3,中子数不同,所以两者互为同位素,D错误;
故选A。
8.D
【详解】A.基态C原子价电子排布图为: ,A错误;
B.结构示意图为:,B错误;
C.形成过程为:,C错误;
D.质量数为2的氢核素为:,D正确;
故答案为:D。
9.B
【详解】根据质量守恒可知,X微粒为,Y微粒为,据此分析解题。
A. 由分析可知,X微粒为,根据质量数等于质子数加中子数可知,该微粒的中子数为4,A错误;
B. 由分析可知,X微粒为,Y微粒为,二者具有相同的质子数而不同的中子数的原子,故互为同位素,B正确;
C.由题干信息可知,与的半衰期很短,故不适宜用作示踪原子研究化学反应历程,C错误;
D.自然界中不存在与并不是其化学键不稳定,而是由于与的半衰期很短,很容易发生核变化,转化为气体其他原子,O=O的键能与形成该键的核素无关,D错误;
故答案为:B。
10.A
【详解】A.3H核内2个中子,2H核内1个中子,故A正确;
B.氚和氢核外电子排布相同,所以氚气和氢气的化学性质相同,故B错误;
C.5Li+n→3He+3H原子核发生变化,核反应不属于化学变化,故C错误;
D.生铁是金属材料,生铁含碳,属于合金,故D错误;
选A。
11.A
【详解】A.第一个电子层作为最外层时,最多可容纳2个电子,如氦原子,故A错误;
B.电子在原子中处于不同的能量状态,按照能量不同分层排布,故B正确;
C.原子核外的电子,在核外不停的作无规则高速移动,故C正确;
D.原子核外区域能量可能不同,距核由近到远,能量由低到高,即离原子核近的电子能量低,离核远的电子能量高,故D正确;
故选A。
12.C
【详解】A.同位素的研究对象为原子,18O2和16O3是单质,A错误;
B.质子数为6,中子数为8的微粒应是C,B错误;
C.NaClO的电子式,符合离子化合物电子式的书写,C正确;
D.CO2结构式应是O=C=O,D错误;
故选C。
13.D
【详解】A.过渡元素全部是金属元素,A项错误;
B.的中子数为76,B项错误;
C.112Cd与114Cd互为同位素,C项错误;
D.由信息可知发电过程是将光能转化为电能,D项正确。
故选D。
14.D
【解析】由,可知z=7,X为N,因此。
【详解】A.z=7,与质子数不相同,不互为同位素,A错误;
B.与的中子数分别为14-6=8、14-7=7,中子数不同,B错误;
C.和的核外电子数均为6,核外电子排布相同,价层轨道电子数相同,C错误;
D.根据半衰期的定义,某考古样品中的量应为其5730年前的,为5730×2=11460年前的,D正确;
答案选D。
15.D
【分析】Q、X、Y、Z为原子序数依次增大的短周期主族元素,Q与X、Y、Z不在同一周期,Y原子最外层电子数为Q原子内层电子数的2倍,则Q应为第二周期元素,X、Y、Z位于第三周期,Y的最外层电子数为4,则Y为Si元素,X、Y相邻,且X的原子序数小于Y,则X为Al元素,Q、X、Y、Z的最外层电子数之和为19,则Q、Z的最外层电子数之和为19-3-4=12,主族元素的最外层电子数最多为7,若Q的最外层电子数为7,为F元素,Z的最外层电子数为5,为P元素,若Q的最外层电子数为6,为O元素,则Z的最外层电子数为6,为S元素,若Q的最外层电子数为5,为N元素,Z的最外层电子数为7,为Cl元素;综上所述,Q为N或O或F,X为Al,Y为Si,Z为Cl或S或P,据此分析解题。
【详解】A.X为Al,Q为N或O或F,同一周期从左往右元素非金属性依次增强,同一主族从上往下依次减弱,故非金属性:Q>X,A错误;
B.由分析可知,X为Al属于金属晶体,Y为Si属于原子晶体或共价晶体,故单质熔点Si>Al,即Y>X,B错误;
C.含有氢键的物质沸点升高,由分析可知Q为N或O或F,其简单氢化物为H2O或NH3或HF,Z为Cl或S或P,其简单氢化物为HCl或H2S或PH3,由于前者物质中存在分子间氢键,而后者物质中不存在,故沸点Q>Z,C错误;
D.元素的非金属性越强,其最高价含氧酸的酸性越强,P、S、Cl的非金属性均强于Si,因此最高价含氧酸酸性:Z>Y,D正确;
故答案为:D。
16.(1)O2-
(2)BeO+2OH-=BeO+H2O
【分析】同一周期,左到右,原子半径减小,同一主族,从上到下,原子半径增大;五种元素为1-18号元素,上述分析可以知道,X为Mg,Y为Al,Z为S,M为Be,Q为O,R为H。
(1)
Mg2+、Al3+和O2-的核外电子数相同,核电荷数越小半径越大,故离子半径最大的为O2-。
(2)
Be的氧化物具有两性,能与氢氧化钠反应生成铍酸钠和氢气,反应式为BeO+2OH-=BeO+H2O。
17.(1) 哑铃 N>H
(2) Al、O Mg>Ca O的价电子层2s22p4,失去一个电子后,2p能级达到半满的结构,相对稳定;N的价电子层2s22p3,半满的结构,相对稳定,不易失去电子 镁的第三电离能比第一、二电离能大很多,镁很难失去第三个电子,而易失去两个电子形成+2价镁离子
(3) 1s22s22p63s23p63d64s2 第四周期第Ⅷ族 <
【详解】(1)①基态氮原子的电子排布式为1s22s22p3,其轨道表示式为;占据最高能级为2p,其电子云轮廓图为哑铃形;
②NH3分子中,与N原子相连的H显正电性,则N、H电负性大小顺序为N>H;
(2)①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是Al、O;
②同一主族从上到下,第一电离能逐渐减小,则Mg、Ca第一电离能的大小为Mg>Ca;O的价电子层2s22p4,失去一个电子后,2p能级达到半满的结构,相对稳定;N的价电子层2s22p3,半满的结构,相对稳定,不易失去电子,故第一电离能:O<N;
③镁的第三电离能比第一、二电离能大很多,镁很难失去第三个电子,而易失去两个电子形成+2价镁离子,故Mg的常见化合价为+2价;
(3)①基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,铁在元素周期表中位于第四周期第Ⅷ族;
②Li+与H-具有相同的电子层数,原子序数越小,离子半径越大,则离子半径:r(Li+)<r(H-)。
18.(1)
(2)H2O2
(3) HClO4
(4) K Al Al
(5) > D
【分析】由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为K、⑩为Br。
(1)
元素②为C,C的一种核素可测定文物年代,则这种核素的符号为,⑩为Br,处于第四周期第ⅦA族,是35号元素,它的一种核素中子数为45,则质量数为35+45=80,该核素的符号为;
(2)
由元素①(H)和④(O)形成的18电子化合物为过氧化氢,该化合物的化学式为H2O2;
(3)
元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,以上元素中,非金属性最强的是Cl元素,则酸性最强的是高氯酸,其化学式为HClO4,⑥的最高价氧化物的水化物为氢氧化铝,氢氧化铝与高氯酸反应生成Al(ClO4)3和水,反应离子方程式为为;
(4)
⑤、⑥、⑨分别为Na、Al、K,将Na、Al、K各1mol分别投入到足量的同浓度的盐酸中,由于金属性K>Na>Al,故K与盐酸反应最剧烈,Al与盐酸反应的速度最慢,金属完全反应,Al表现+3价,Na、K均表现+1价,根据电子转移守恒,可知Al与盐酸反应产生的氢气最多;
(5)
同主族自上而下元素非金属性减弱,故非金属性⑧>⑩;
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为黄色,说明有Br2生成,证明Cl元素非金属性比Br强,故A不符合题意;
B.元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强,非金属性⑧>⑩,故B不符合题意;
C.元素非金属性与氢化物稳定性一致,元素⑧和⑩的氢化物受热分解,前者的分解温度高,说明⑧的非金属性更强,故C不符合题意;
D.氢化物酸性强弱不能说明元素非金属性强弱,如酸性HF<HCl、H2S<HCl,但非金属性F>Cl,Cl>S,故D符合题意;
E.元素⑧的氢化物的还原性比元素⑩的弱,说明⑧的非金属性更强,故E不符合题意;
答案选D。
19.(1) 第三周期ⅠA族
(2)
(3)
(4)BDE
【解析】(1)
钠为11号元素,在元素周期表中的位置是第三周期ⅠA族,钙离子最外层失去两个电子,结构示意图为,故答案为:第三周期ⅠA族;:
(2)
过氧化钠为离子化合物,含有2个钠离子和一个过氧根,电子式为,共价化合物,原子均要达到8电子的稳定结构,结构式为,故答案为:;;
(3)
Be与Al的化学性质相似,则Be与NaOH溶液反应生成和氢气,化学方程式是,故答案为:;
(4)
A.氯、硫的最低负价分别为、,能表示他们得到的电子数目,但非金属性与电子得失数目无关,故A不选;
B.中氯显价,硫显价,说明氯更容易得电子,说明其非金属性强,故B选;
C.,都不是最高价氧化物对应的水化物,故不能比较非金属性,故C不选;
D.向水溶液中通入有淡黄色沉淀生成,说明氯气把硫置换出来,则氯的非金属性强于硫,故D选;
E.硫化氢在300℃时开始分解,HCl在1500℃时开始缓慢分解,说明氯化氢的稳定性较好,则说明其非金属性强,故E选;
故答案为:BDE。
20.Be(OH)2+2NaOH=Na2BeO2+2H2O
【分析】由元素在周期表中位置,可知①是H,②是Be,③是N,④是O,⑤是F,⑥是Na,⑦是Al,⑧是P,⑨是S,⑩是Cl。
【详解】②的氢氧化物Be(OH)2是两性氢氧化物,可以与⑥的氢氧化物NaOH反应,生成偏铝酸钠和水,反应方程式为Be(OH)2+2NaOH=Na2BeO2+2H2O。
21.(1)第四周期第ⅢA族
(2)共价化合物
(3) -3 d
(4) 浓氨水(或浓溶液) 排尽装置中的空气,避免空气与镓反应,使产物不纯 吸收过量的氨气,防止污染环境
【解析】(1)
镓的原子结构示意图为,含有四个电子层,所以镓在第四周期,第三周期含有18个电子全充满,最外层有三个电子,所以镓在第ⅢA族,故答案为:第四周期第ⅢA族;
(2)
离子化合物在熔融状态下均导电,的熔点为1238℃,且熔融状态不导电,可知为共价化合物,故答案为:共价化合物;
(3)
①位于第四周期第VA族,位于第四周期第ⅢA族,同周期主族元素从左向右电负性递增,得电子能力递增,所以中元素显负价,最外层有三个电子,最外层有五个电子,所以中元素的化合价为:-3,故答案为:-3;
②a.位于第四周期第VA族,位于第四周期第ⅢA族,同周期主族元素从左向右原子半径递减,所以原子半径:;
b.同主族元素非金属性从上到下递减,简单气态氢化物稳定性递减,与N同主族,所以热稳定性:;
c.同主族元素金属性从上到下递增,最高价氧化物对应水化物碱性增强,和同主族,所以碱性:;
d.利用元素周期律可以解释不同元素的最高价氧化物对应水化物的酸性强弱,同种元素不同价态的含氧酸酸性不可以解释;
故答案为:d;
(4)
①热转化”时和发生反应生成和,化学方程式为:,故答案为:;
②装置A用锌与稀硫酸反应制备氢气,将该体系内空气排尽,防止氧气与反应,使产物不纯,干扰实验;装置C利用氧化钙的吸水性,吸收浓氨水中的水分,同时放出热量,促使一水合氨分解产生氨气,干燥后的氨气与反应制备;F装置作为防倒吸装置,G为尾气处理装置,稀硫酸吸收过量的氨气,防止空气污染,答案为:浓氨水(或浓溶液);排尽装置中的空气,避免空气与镓反应,使产物不纯;吸收过量的氨气,防止污染环境。
22. 钠 铝 +2H+=H2SiO3↓ 分液漏斗 A C12+2Br﹣=2Cl﹣+Br2 Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
【分析】I.(1)金属性Na>Mg>Al,金属越活泼,与酸反应越剧烈,均1mol时Al失去电子最多; (2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀生成硅酸,利用强酸制弱酸;
Ⅱ.实验室制备氯气可用二氧化锰和浓盐酸在加热条件下反应,也可用高锰酸钾与浓盐酸反应制备,反应较为剧烈,无需加热即可进行,氯气具有强氧化性,能与NaBr溶液发生置换反应生成单质Br2,氯气有毒,用碱吸收,在碱性溶液中自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
【详解】I.(1)金属活泼性顺序为:钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钠;生成1mol氢气需要得到2mol电子,1mol钠失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝,故答案为:钠;铝;
(2) 利用强酸制弱酸,向Na2SiO3溶液中加入稀H2SO4出现白色沉淀生成硅酸,离子方程式为:+2H+=H2SiO3↓;故答案为:+2H+=H2SiO3↓;
Ⅱ.(3)装置B中仪器a的名称为分液漏斗,故答案为:分液漏斗;
(4)高锰酸钾与浓盐酸反应较为剧烈,无需加热即可进行,是固体和液体不加热制备气体装置,选择A,故答案为:A;
(5)①氯气与NaBr溶液反应生成Br2,反应的离子方程式为Cl2+2Br-=2Cl-+Br2,故答案为:C12+2Br-=2Cl-+Br2;
②氯气在碱性溶液中自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O。
