第三章第四节沉淀溶解平衡课时训练五(含解析)高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 第三章第四节沉淀溶解平衡课时训练五(含解析)高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-10 06:38:12 | ||
图片预览



文档简介
人教版(2019)选择性必修1第三章 第四节 沉淀溶解平衡课时训练五
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.当Mg(OH)2固体在水中溶解达到平衡时:Mg(OH)2 (s) Mg2++2OH- ,为使Mg(OH)2固体的量减少,可加入的物质是
A.MgSO4 B.NaOH C.HCl D.NaCl
2.室温下,用饱和溶液浸泡粉末,一段时间后过滤,向滤渣中加入足量稀盐酸、产生气泡,固体未完全溶解。已知,。下列说法正确的是
A.滤渣中加入醋酸发生反应的离子方程式:
B.饱和溶液中存在:
C.反应正向进行,需满足
D.过滤后所得溶液中一定存在且
3.二氧化碳的过量排放可对海洋环境造成影响,原理如图所示。下列叙述错误的是
A.海水酸化引起浓度增大
B.海水酸化促进CaCO3的溶解、珊瑚礁减少
C.CO2引起海水酸化主要因为H++
D.使用太阳能等新能源有利于改善海洋环境
4.下列有关电解质溶液的说法正确的是
A.的盐酸中
B.常温下,溶液加水稀释时,逐渐增大
C.25℃时,在的悬浊液中加入少量固体,减小
D.室温下的醋酸溶液和的溶液等体积混合后溶液呈酸性
5.T℃时,。当时,溶液的pH等于(已知:该温度下,水的离子积常数)
A. B. C. D.
6.宏观辨识与微观探析是化学学科核心素养之一、下列相关方程式正确的是
A.石灰乳中存在的溶解平衡:Ca(OH)2 Ca2++2OH-
B.向明矾溶液中加入Ba(OH)2溶液至沉淀质量最大时的离子方程式:A13++2+2Ba2++4OH-=2BaSO4↓++2H2O
C.Na2S溶液呈碱性:S2-+2H2O=H2S+2OH-
D.NaHCO3在水溶液中的电离方程式:NaHCO3 Na++
7.25 ℃时,在含有大量PbI2的饱和溶液中存在着平衡PbI2(s)Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是
A.溶液中Pb2+和I-浓度都增大 B.溶液中Pb2+和I-浓度都减小
C.沉淀溶解平衡向右移动 D.溶液中Pb2+浓度减小
8.AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.图中各点对应的c(H )相同
B.图中各点对应的Ksp的关系为:Ksp(a)=Ksp(b)>Ksp(c)
C.升高温度,b点饱和溶液的组成由b点向c点方向移动
D.a点已达平衡状态,向a点溶液加入NaCl固体,饱和溶液的各微粒浓度不变
9.表示下列反应的方程式正确的是
A.铁粉与水蒸气共热,生成可燃性气体:
B.向溶液中加入铜片,溶液由黄色变成蓝色:
C.向浊液中加入溶液,生成红褐色沉淀:
D.向溶液中滴加溶液,溶液由浅绿色变成黄色:
10.下列对有关实验现象的解释或所得结论不正确的是
实验操作 现象 解释或结论
A 向2mL 0.1mol/L Na2S溶液中滴加0.1mol/LZnSO4溶液至不再有沉淀产生,再滴加几滴0.1mol/L CuSO4 溶液 先产生白色沉淀,又出现黑色沉淀 Ksp(ZnS)>Ksp(CuS)
B 用蒸馏水溶解CuCl2固体,并继续加水稀释 溶液由绿色逐渐变为蓝色 [CuCl4]2-+4H2O4Cl-+[Cu(H2O)4]2+正向移动
C 将25℃ 0.1mol/L 的 Na2SO3溶液加热到40℃,用传感器监测溶液pH变化 溶液的pH逐渐减小 温度升高,SO的水解增大程度小于水的电离增大程度,导致最终c(H+)升高
D 向某补血口服液中滴加酸性KMnO4溶液 酸性KMnO4溶液紫色褪去 该补血口服液中一定含有Fe2+
A.A B.B C.C D.D
11.下列反应的离子方程式正确的是
A.用饱和碳酸钠溶液处理水垢中的硫酸钙:
B.通入水中制硝酸:
C.硫酸铜溶液中加少量的铁粉:
D.室温下用稀溶解铜:
12.下列过程中的化学反应,相应的离子方程式错误的是
A.将稀H2SO4加入NaIO3和NaI的混合溶液中:5I-++6H+=3I2+3H2O
B.向稀HNO3中滴加Na2SO3溶液:3+2H++2=3+2NO↑+H2O
C.用饱和Na2CO3溶液浸泡CaSO4:CaSO4(s)+(aq)=CaCO3(s)+(aq)
D.向NaHCO3溶液中加入足量Ba(OH)2溶液:2+Ba2++2OH-=BaCO3↓+2H2O+
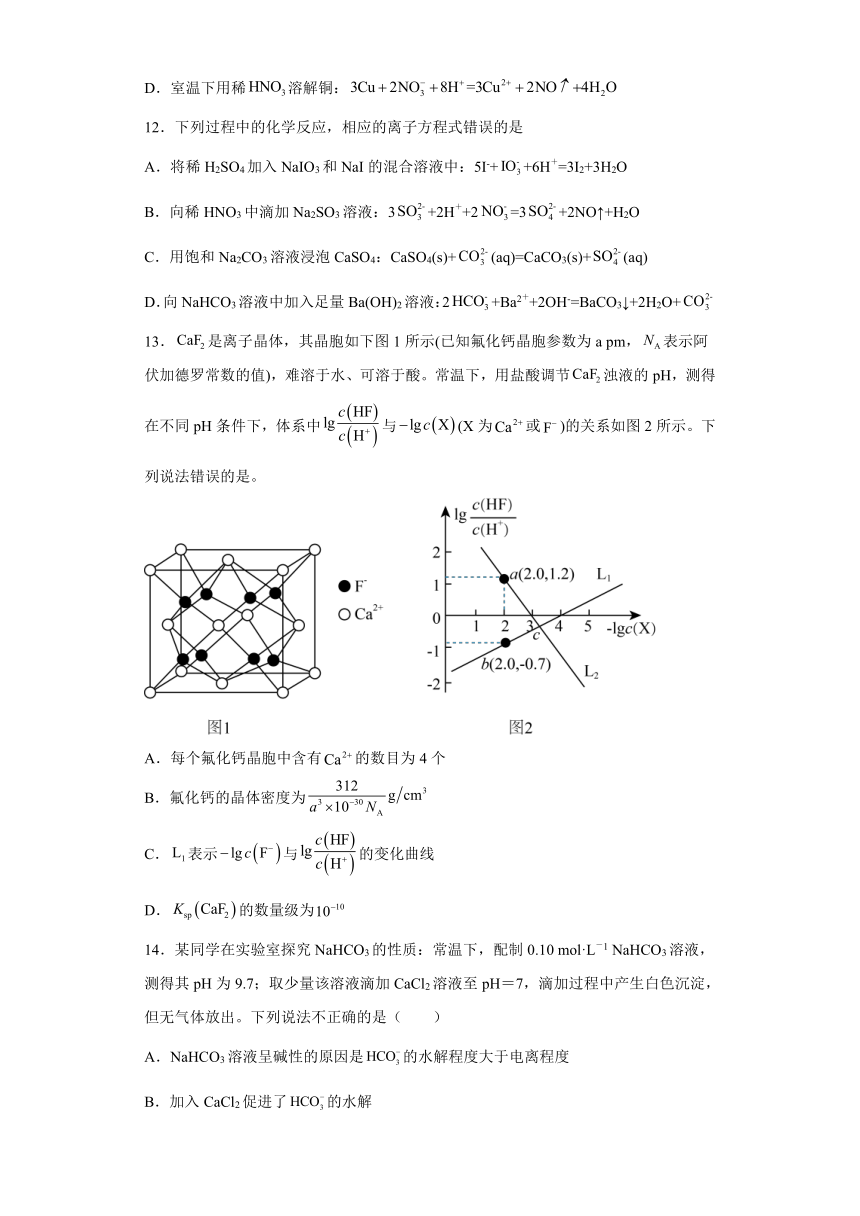
13.是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm,表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节浊液的pH,测得在不同pH条件下,体系中与(X为或)的关系如图2所示。下列说法错误的是。
A.每个氟化钙晶胞中含有的数目为4个
B.氟化钙的晶体密度为
C.表示与的变化曲线
D.的数量级为
14.某同学在实验室探究NaHCO3的性质:常温下,配制0.10 mol·L-1 NaHCO3溶液,测得其pH为9.7;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是( )
A.NaHCO3溶液呈碱性的原因是的水解程度大于电离程度
B.加入CaCl2促进了的水解
C.反应的离子方程式是2+Ca2+=CaCO3↓+H2CO3
D.反应后的溶液中存在:c(Na+)+2c(Ca2+)=c()+2c()+c(Cl-)
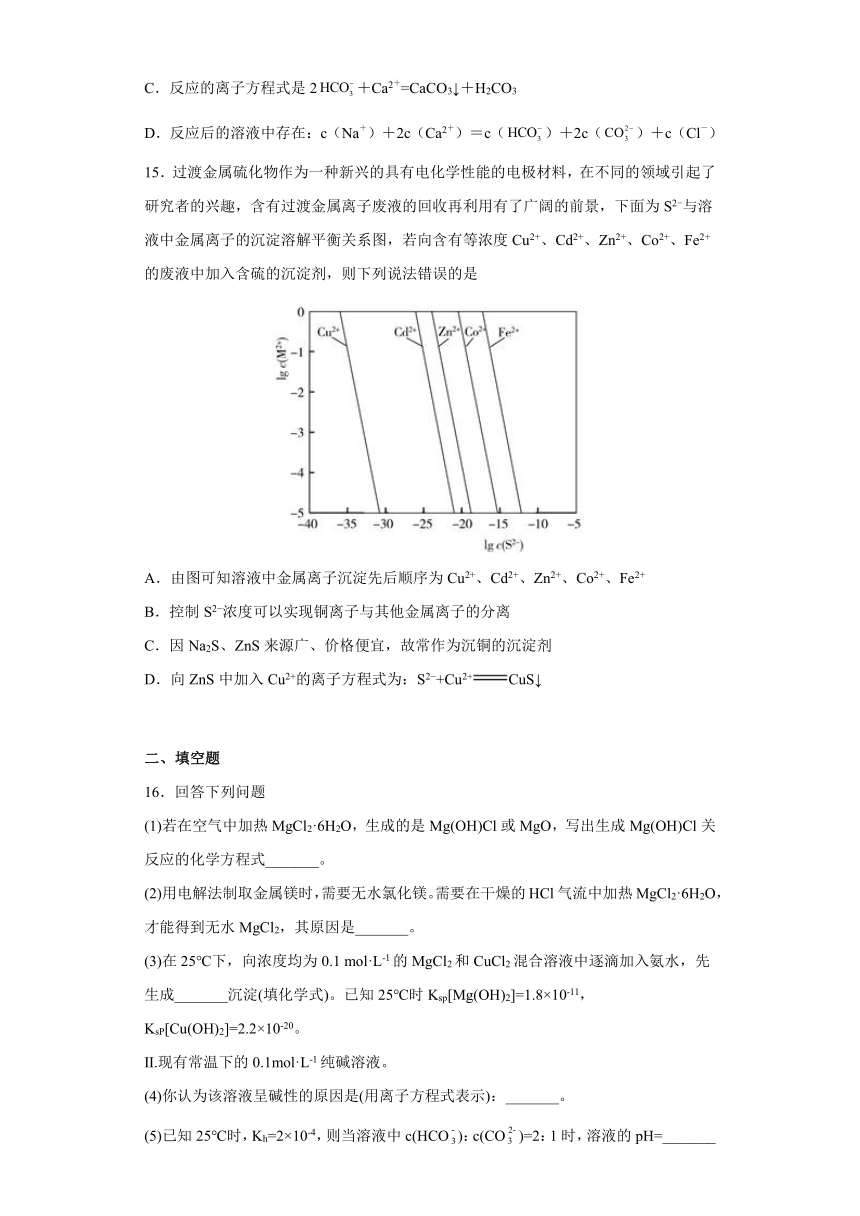
15.过渡金属硫化物作为一种新兴的具有电化学性能的电极材料,在不同的领域引起了研究者的兴趣,含有过渡金属离子废液的回收再利用有了广阔的前景,下面为S2 与溶液中金属离子的沉淀溶解平衡关系图,若向含有等浓度Cu2+、Cd2+、Zn2+、Co2+、Fe2+的废液中加入含硫的沉淀剂,则下列说法错误的是
A.由图可知溶液中金属离子沉淀先后顺序为Cu2+、Cd2+、Zn2+、Co2+、Fe2+
B.控制S2 浓度可以实现铜离子与其他金属离子的分离
C.因Na2S、ZnS来源广、价格便宜,故常作为沉铜的沉淀剂
D.向ZnS中加入Cu2+的离子方程式为:S2 +Cu2+CuS↓
二、填空题
16.回答下列问题
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出生成Mg(OH)Cl关反应的化学方程式_______。
(2)用电解法制取金属镁时,需要无水氯化镁。需要在干燥的HCl气流中加热MgCl2·6H2O,才能得到无水MgCl2,其原因是_______。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式)。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
Ⅱ.现有常温下的0.1mol·L-1纯碱溶液。
(4)你认为该溶液呈碱性的原因是(用离子方程式表示):_______。
(5)已知25℃时,Kh=2×10-4,则当溶液中c(HCO):c(CO)=2:1时,溶液的pH=_______
(6)0.1mol·L-1 Na2CO3溶液中c(OH-)-c(H+)=_______[用含c(HCO)、c(H2CO3)的关系式表示]
(7)向Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:_______
17.向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
(1)完全沉淀后,溶液中=_______。
(2)完全沉淀后,溶液的pH=_______。
(3)如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?_______(填“是”或“否”)。
(4)该温度下,AgCl饱和溶液的密度为1 g/cm3,则该温度下,AgCl在水中的溶解度约为_______ g。
18.人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风和关节炎,有关平衡有:①HUr(尿酸,aq)(尿酸根,aq)、②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时,,,。
②37℃时,模拟关节滑液pH=7.4,。
(1)37℃时,HUr溶液的pH约为_______(已知)。
(2)下列事实可以证明尿酸是弱电解质的是_______(填字母)。
A.NaUr溶液显碱性
B.HUr溶液可使石蕊溶液变红
C.常温下,等浓度的尿酸溶液导电性比盐酸弱
D.10mL溶液与10mLNaOH溶液完全反应
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中_______(填“>”“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至时,通过计算判断是否有NaUr晶体析出,请写出判断过程:_______。
(5)关节炎发作大都在脚趾和手指的关节处,反应②是_______(填“放热”或“吸热”)反应。
(6)对于尿酸偏高的人群,下列建议正确的是_______(填字母)。
A.多喝水,食用新鲜蔬果
B.饮食宜多盐、多脂
C.适度运动,注意关节保暖
D.减少摄入易代谢出尿酸的食物
19.C元素是组成化合物种类最多的元素,含C元素的酸有也多种,其中氢氰酸(HCN)和草酸()是两种比较特殊的酸。
(1)氢氰酸有剧毒,25℃时,该酸的电离常数为。
①HCN在水溶液中的电离方程式为_______。
②25℃时KCN溶液中的水解常数_______(保留一位小数)。
③0.2 mol/L的KOH溶液与0.4 mol/L的HCN溶液等体积混合后,恢复到25℃,混合溶液中和浓度大小关系是_______(填“>”、“<”或“=”)。
④已知T℃时,,,则T℃下,,该反应的平衡常数K=_______。
(2)为测定某草酸晶体产品中()的质量分数,称取14.0 g产品溶于水,配制成500 mL溶液,用浓度为0.10 mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00 mL,实验结果记录如表:(杂质不与高锰酸钾反应,相对分子质量为126)
实验次数 第一次 第二次 第三次
消耗溶液体积/mL 20.05 19.95 24.36
已知反应:
①滴定终点的现象是_______。
②通过实验数据,计算该产品中()的质量分数为_______。
③下列操作会导致测定结果偏低的是_______。
A.锥形瓶用待测液润洗
B.装酸性高锰酸钾溶液的滴定管没有润洗
C.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
D.滴定前平视,滴定结束时俯视
20.碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(,含有和少量等杂质)为原料制备碱式碳酸铜的流程如图所示:
已知:①有关金属离子形成氢氧化物沉淀的范围如下:
②常温稳定,在热水中会分解生成;
③。
金属离子
开始沉淀的 7.2 2.7 5.6 8.3
完全沉淀的 9.0 3.7 6.7 9.8
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有_______、_______(任写两种)。
(2)滤渣Ⅰ经提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分除外还有_______(填化学式)。
(3)常温下“除铁”时加入的试剂A可用,调节的范围为_______,若加A后将溶液的调为5,则溶液中的浓度为_______。
(4)写出“沉锰”(除)过程中反应的离子方程式:_______。
(5)“赶氨”时,最适宜的操作方法是_______。
三、实验题
21.氯化钡晶体()是广泛用于中学化学实验的一种试剂。某小组用纯制备并测定其纯度的实验方案如下:
实验一:制备。
取一定量纯于烧杯中,加入过量盐酸,充分反应,得到溶液M。
(1)常温下,溶液M的pH_______(填“>”、“<”或“=”)7。
(2)取少量溶液M,经蒸干得到固体,该固体的主要成分是_______(填化学式)。
(3)溶液M经蒸发浓缩、_______、过滤、洗涤、干燥得到产品。
实验二:测定产品纯度。
方案1:重量法。
取ng样品溶于蒸馏水,滴加足量的溶液和盐酸,过滤、洗涤、干燥,得到的固体质量为mg。
方案2:滴定法。
实验步骤如下:
步骤1:取xg样品配成250mL溶液,准确量取25.00mL溶液于锥形瓶中;
步骤2:向锥形瓶中加入溶液(过量);
步骤3:向其中加入硝基苯,用力振荡,使沉淀表面被有机物覆盖;
步骤4:加入指示剂溶液,用溶液滴定过量的至终点,消耗溶液的体积为mL。
已知:常温下,,
(4)方案1中,产品纯度为_______。如果用滤纸包裹在电炉中烘干,会因温度过高,导致炭黑还原部分,则测得结果_______(填“偏高”、“偏低”或“无影响”)。
(5)方案2中,滴定终点的现象是_______。硝基苯的作用是_______。
(6)方案2中,测得样品中氯元素质量分数为_______。若取消步骤3,则测定结果_______(填“偏大”、“偏小”或“无影响”)。
22.平衡常数的测定对化学学习和化学研究都有重要意义。已知“”为可逆反应,某小组将0.0100mol/L溶液与0.0400mo/L溶液等体积混合,测定平衡时各物质浓度、计算平衡常数。
(1)配制溶液所需的玻璃仪器有烧杯、量筒和_______。(从下图中选择仪器编号)
A. B. C. D. E.
(2)反应达到平衡后,过滤除去Ag单质,用0.01moL/LKSCN溶液滴定所取的15.00mL滤液中的,滴定原理为:(白色固体)、;滴定终点的现象为_______。除去Ag单质的目的是_______。
(3)若要测定平衡体系中浓度,可以利用pH为9~11.5条件下和磺基水杨酸()生成稳定的黄色络合物,可以通过测定吸光度得知其浓度。请据此将测定实验方案补充完整:取平衡后的浊液,_______,取5.00mL滤液,加入2mL2%磺基水杨酸溶液,加入pH为9~11.5的缓冲溶液,测定吸光度。
(4)若(3)中得出待测平衡体系中浓度为cmol/L,则测得的平衡常数K=_______。(用含c的计算式表示)
(5)该小组进一步研究常温下稀释对该平衡移动方向的影响。
设计方案并完成实验:用一定浓度的溶液和溶液,按下表配制总体积相同的系列溶液,测定平衡时浓度,记录数据。
序号
I 10 10 \
II 5 a b
……
_______,_______。用和的关系来表示平衡移动方向的判据是_______。
参考答案:
1.C
【详解】A.加入MgSO4,溶液中镁离子浓度增大,平衡逆向移动,Mg(OH)2固体的量增大,A不符合题意;
B.加入NaOH,溶液中氢氧根浓度增大,平衡逆向移动,Mg(OH)2固体的量增大,B不符合题意;
C.加入HCl,氢离子中和氢氧根,平衡正向移动,Mg(OH)2固体的量减少,C符合题意;
D.加入NaCl对平衡无影响,D不符合题意;
综上所述答案为C。
2.C
【详解】A.向滤渣中加入过量盐酸产生气泡,是BaCO3和盐酸反应,反应的离子方程式为:2H++ BaCO3=H2O+CO2↑+Ba2+,A错误;
B.饱和Na2CO3溶液中存在电荷守恒为:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO),B错误;
C.反应BaSO4+CO=BaCO3+SO达到平衡时,其平衡常数K====,要使BaSO4+CO=BaCO3+S0正向进行,则要满足QcD.过滤后得滤渣和滤液,则过滤前BaSO4+CO=BaCO3+SO达到平衡状态, BaSO4和BaCO3均达到溶解平衡状态,即c(CO)=,c(SO)=,D错误;
故选C。
3.C
【分析】二氧化碳的过量排放,能导致海水中,,平衡右移,H+又能与珊瑚礁溶解生成的结合生成,促使,平衡右移,从而使珊瑚礁减少。
【详解】A.海水酸化,海水中H+和的浓度增大,浓度减小,故A正确;
B.H+结合珊瑚礁溶解生成的,促进CaCO3的溶解、珊瑚礁减少,故B正确;
C.CO2引起海水酸化主要因为,,故C错误;
D.使用太阳能等新能源,能有效减少二氧化碳的排放,有利于改善海洋环境,故D正确;
故选:C。
4.D
【详解】A.盐酸溶液中还存在水的电离平衡,水电离可产生氢离子,故,A错误;
B.==,温度不变则该比值不变,B错误;
C.在的悬浊液中存在溶解平衡:,加入少量固体,能降低OH-浓度,促使溶解平衡正向移动,增大,C错误;
D.室温下pH=3的醋酸溶液H+浓度是10-3mol/L,醋酸是弱酸只发生部分电离,醋酸浓度远大于10-3mol/L;室温下pH=11的溶液OH-浓度是10-3mol/L,是强碱完全电离,故浓度远小于醋酸浓度,两者体积混合后溶液呈酸性,D正确;
故选D。
5.B
【详解】该温度下,,根据,结合,可求得,即可得到,从而可求得,故选B。
6.B
【详解】A.石灰乳中存在的溶解平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq),故A错误;
B.向明矾溶液中滴加Ba(OH)2溶液至沉淀质量最大时,硫酸根离子恰好完全沉淀,此时铝离子与氢氧根离子的物质的量之比为1∶4,铝离子转化成偏铝酸根离子,发生反应的离子方程式为:A13++2+2Ba2++4OH-=2BaSO4↓++2H2O,故B正确;
C.Na2S溶液因S2-发生水解呈碱性,分两步进行,以第一步水解为主,则水解方程式为S2-+H2OOH-+HS-,故C错误;
D.NaHCO3在水溶液中完全电离出Na+和,电离方程式为NaHCO3═Na++,故D错误;
故选:B。
7.D
【详解】A.加入KI溶液,I-浓度增大,PbI2(s)Pb2+(aq)+2I-(aq)平衡逆向移动,溶液中Pb2+浓度减小,故A错误;
B.加入KI溶液,I-浓度增大,PbI2(s)Pb2+(aq)+2I-(aq)平衡逆向移动,溶液中Pb2+浓度减小,故B错误;
C.加入KI溶液,I-浓度增大,PbI2(s)Pb2+(aq)+2I-(aq)平衡逆向移动,故C错误;
D.加入KI溶液,I-浓度增大,PbI2(s)Pb2+(aq)+2I-(aq)平衡逆向移动,溶液中Pb2+浓度减小,故D正确;
选D。
8.C
【详解】A.温度升高,水的电离平衡程度增大,c(H )增大,故图中各点对应的c(H )不相同,故A错误;
B.Ksp(AgCl)=c(Ag+)c(Cl-),温度相同,Ksp相同,a、b在同一曲线上,所处温度相同,c点c(Ag+)、c(Cl-)均较大,则图中各点对应的Ksp的关系为:Ksp(c)>Ksp(a)=Ksp(b),故B错误;
C.升高温度,AgCl的溶解平衡向溶解的方向移动,则b点饱和溶液的组成由b点向c点方向移动,故C正确;
D.a点已达平衡状态,向a点溶液加入NaCl固体,c(Cl-)增大,AgCl的溶解平衡向生成沉淀的方向移动,故c(Ag+)减小,故D错误;
故选C。
9.B
【详解】A.铁粉与水蒸气共热生成Fe3O4和H2,A错误;
B.向溶液中加入铜片,Fe3+与Cu反应生成Fe2+和Cu2+,溶液由黄色变成蓝色,离子方程式为,B正确;
C.在离子方程式中不能拆开,应该保留化学式,C错误;
D.向溶液中滴加溶液的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,D错误 ;
故答案为:B。
【点睛】判断离子方程式是否正确,一般先看产物是否符合客观事实,二看化学式拆分是否正确,三看是否漏离子反应,四看反应物的配比是否正确,五看各种符号是否齐全。
10.D
【详解】A.Na2S溶液滴加ZnSO4溶液至不再有沉淀产生,可知硫化钠完全反应,再滴加的CuSO4 溶液生成CuS,能说明是ZnS转化成CuS,能证明Ksp(ZnS)>Ksp(CuS),故A正确;
B.[CuCl4]2-呈绿色,[Cu(H2O)4]2+呈蓝色,用蒸馏水溶解CuCl2固体,并继续加水稀释根据颜色变化可知[CuCl4]2-转化为[Cu(H2O)4]2+,即[CuCl4]2-+4H2O4Cl-+[Cu(H2O)4]2+正向移动,故B正确;
C.25℃ 0.1mol/L 的 Na2SO3溶液加热到40℃,亚硫酸钠水解程度增大,溶液中氢氧根离子浓度应增大,但实际溶液的pH逐渐减小,可知温度升高过程中水的离子积常数增大,由可知,的增大程度大于了增大程度,即SO的水解增大程度小于水的电离增大程度,导致最终c(H+)升高,故C正确;
D.酸性KMnO4溶液紫色褪去只能说明溶液中存在还原性离子,但不一定是Fe2+,故D错误;
故选:D。
11.D
【详解】A.水垢中的硫酸钙是沉淀,故用饱和碳酸钠溶液处理水垢中的硫酸钙的离子方程式为:,A错误;
B.原离子方程式H原子不守恒,则通入水中制硝酸的离子方程式为:,B错误;
C.铁与盐溶液发生置换反应生成Fe2+,故硫酸铜溶液中加少量的铁粉的离子方程式为:,C错误;
D.室温下用稀溶解铜的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故其离子方程式为:,D正确;
故答案为:D。
12.D
【详解】A.H2SO4、NaIO3和NaI反应生成碘单质,I的化合价由+5价降低为0价,I的化合价由-1价升高为0价,根据化合价升降守恒、原子守恒和电荷守恒,可得:5I-+IO+6H+=3I2+3H2O,A正确;
B.HNO3和Na2SO3反应生成一氧化氮和硫酸钠,N的化合价由+5价降低为+2价,S的化合价由+4价升高为+6价,根据化合价升降守恒、原子守恒和电荷守恒,可得:3SO+2H++2NO=3SO+2NO↑+H2O,B正确;
C.CaSO4与浓度较大的可溶性碳酸盐反应可以得到碳酸钙,再用酸可以将其除去,离子方程式为CaSO4(s)+CO(aq)=CaCO3(s)+SO(aq),C正确;
D.假设量少的物质为1mol,过量的物质用多少写多少,NaHCO3为1mol,所以需要1molBa(OH)2,NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,所以反应的离子方程式为:HCO+Ba2++OH-=BaCO3↓+H2O,故D错误;
故选D。
13.C
【分析】已知HF的,则有,即有 越大,c(F-)越大,lgc(F-)越大,-lgc(F-)越小,c(F-)越大,c(Ca2+)越小,则-lgc(Ca2+)越大,故可知L1代表-lgc(Ca2+)的变化曲线,L2代表-lgc(F-)的变化曲线,据此分析解题。
【详解】A.每个氟化钙晶胞中含有Ca2+的数目为8×+6×=4,故A正确;
B.晶胞体积V=(a×10-10cm)3,该晶胞中相当于含有4个“CaF2”,晶胞质量为m=g,则氟化钙的密度=,故B正确;
C.由分析可知,L1表示-lgc(Ca2+)与的变化曲线,故C错误;
D.由a点坐标可知,═10-1.2,c(F-)=10-2,则Ka=10-1.2×10-2=10-3.2,由b点坐标可知,c(Ca2+)=10-2mol/L,此时=10-0.7,故可求出此时溶液中c(F-)=10-0.7×10-3.2=10-3.9,故Ksp(CaF2 )=c(Ca2+)c2(F-)=10-2×(10-3.9)2=10-9.8,故其数量级为10-10,故D正确;
故选:C。
14.B
【详解】A.NaHCO3既能电离又能水解,水解显碱性,电离显酸性,NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度,故A正确;
B.溶液中存在HCO3- CO32-+H+,加入CaCl2消耗CO32-,促进HCO3-的电离,故B错误;
C.HCO3-与Ca2+生成CaCO3和氢离子,氢离子结合HCO3-生成H2CO3,则反应的离子方程式,2HCO3-+Ca2+═CaCO3↓+H2CO3,故C正确;
D.溶液中存在电荷守恒,c(Na+)+c(H+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(OH-),溶液至pH=7,c(H+)=c(OH-),c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-),故D正确;
故选B。
15.D
【详解】由图可知溶液中金属硫化物沉淀的Ksp大小顺序为CuS16.(1)MgCl2·6H2O=Mg(OH)Cl+HCl↑+5H2O↑
(2)在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2·6H2O受热产生的水气,故能得到无水MgCl2
(3)Cu(OH)2
(4)
(5)10
(6)c(HCO)+2c(H2CO3)
(7)3CO+2Al3++3H2O=2Al(OH)3↓+3CO2↑
【详解】(1)在空气中加热MgCl2·6H2O,若生成的是Mg(OH)Cl,则还会同时生成HCl和水,根据反应物和生成物可得化学方程式为MgCl2·6H2O=Mg(OH)Cl+HCl↑+5H2O↑;
(2)氯化镁水解显酸性,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2·6H2O受热产生的水气,故能得到无水MgCl2;
(3)相同温度下,溶度积阐述表达式相同时,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,溶度积常数小的先生成沉淀,根据溶度积常数知,先生成Cu(OH)2沉淀;
(4)碳酸钠是强碱弱酸盐,碳酸根离子水解生成OH-导致溶液呈碱性,水解离子方程式为 ;
(5)已知25℃时,,,溶液中,溶液的pH=10;
(6)根据碳原子守恒
根据溶液中的电荷守恒得:
根据原子守恒、电荷守恒得c(OH-)-c(H+)=c(HCO)+2c(H2CO3);
(7)向Na2CO3溶液中加入明矾会产生沉淀和气体,铝离子和碳酸根离子发生双水解反应生成氢氧化铝和二氧化碳,离子方程式为3CO+2Al3++3H2O=2Al(OH)3↓+3CO2↑。
17.(1)1.0×10-7 mol/L
(2)2
(3)否
(4)1.435×10-4
【详解】(1)反应前,,
;反应后剩余的Cl-为0.1×10-3 mol,则混合溶液中, 。
(2)H+没有参与反应,沉淀完全后,,pH=2。
(3)因为加入的盐酸中和反应后所得溶液中的相同,没有改变,变小,所以,没有沉淀产生。
(4)
18.(1)3.7
(2)AC
(3)>
(4),故有尿酸钠晶体析出
(5)吸热
(6)ACD
【详解】(1)由尿酸的电离平衡:HUr(尿酸,aq)(尿酸根,aq),,解得,pH约为3.7,答案:3.7;
(2)A.NaUr溶液显碱性,说明是强碱弱酸盐,A正确;
B.HUr溶液可使石蕊溶液变红说明具有酸性,B错误;
C.常温下,等浓度的尿酸溶液导电性比盐酸弱,说明是弱酸,C正确;
D.10mL溶液与10mLNaOH溶液完全反应只能说明具有酸性,D错误;
故选AC。
(3)37℃时,模拟关节滑液pH=7.4,,遵循电荷守恒,所以:>,答案:>;
(4)37℃时,模拟关节滑液,当时故有尿酸钠晶体析出,答案:,故有尿酸钠晶体析出;
(5)关节炎的原因归结于在关节滑液中形成了尿酸钠晶体,夏天症状减轻,冬天症状加重,依据平衡温度降低平衡逆向移动,逆向是放热反应,正反应方向为吸热反应,答案:吸热;
(6)A.多喝水,食用新鲜蔬果,A正确;
B.饮食宜多盐、多脂,B错误;
C.适度运动,注意关节保暖,C正确;
D.减少摄入易代谢出尿酸的食物,D正确;
故选ACD。
19.(1) <
(2) 当最后半滴高猛酸钾溶液滴入时,溶液变为浅红色,且半分钟内不褪去 90% D
【详解】(1)①氰氢酸是弱酸,发生部分电离,答案:;
②=,答案:;
③0.2 的KOH溶液与0.4 的HCN溶液等体积混合后,可认为是和等浓度混合溶液,由题干信息和②答案可知在此溶液中,的电离小于的水解,混合溶液中和浓度大小关系是<,答案:<;
④=,答案:;
(2)①高锰酸钾和草酸发生氧化还原反应,之后褪色,故滴定终点的现象是:当最后半滴高锰酸钾溶液滴入时,溶液变为浅红色,且半分钟内不退去;
②因第三次与第一次、第二次测得体积相差较大,则平均消耗体积,故消耗;由,得n(=,则,则草酸晶体的质量分数= ;
③A.锥形瓶用待测液润洗,使待测液的量增加,则消耗标准液体积增大,最终导致测定结果偏高,A错误;
B.没用高锰酸钾标准液润洗酸式滴定管,使标准液浓度偏小,消耗标准液体积偏大,则导致测定结果偏高,B错误;
C.测得标准液体积比实际体积大,则导致计算得出的测定结果偏高,C错误;
D.俯视读取体积比实际体积小,则导致计算得出测定结果偏低,D正确;
故选D。
20.(1) 搅拌 适当增加硫酸浓度、适当加热等(任选二)
(2)
(3) 3.7~5.6(或3.7≤pH<5.6)
(4)
(5)将溶液加热
【分析】根据题意,用含有、、的辉铜矿石,制备碱式碳酸铜,开始加入稀硫酸酸浸并且用将氧化为而沉淀而除去。溶液中加入,促进水解生成而除去,溶液中剩余的阳离子为、,用将沉淀,加热除去溶液中的,最后将溶液处理,得到碱式碳酸铜。
【详解】(1)影响反应速率的方法有:适当升高温度、适当增大浓度、增大接触面、搅拌等。
(2)辉铜矿中含有、和,加入和后,,,和硫酸不发生反应,滤渣Ⅰ中的主要成分除外还有。
(3)加入调节,可以使完全沉淀,根据表中的数据,完全沉淀,≤3.7,开始沉淀<5.6,调节的范围为:3.7~5.6(或3.7≤pH<5.6)。加入调节=5,, ,溶液中的浓度为。
(4)向溶液中加入除去,生成沉淀,发生反应的方程式:。
(5)气体在溶液中的溶解度随着温度的升高而降低,故可以将溶液加热。
21.(1)<
(2)
(3)降温(冷却) 结晶
(4) 偏低
(5) 滴入最后半(或一)滴溶液时,溶液刚好变为血红色且半分钟内不变色 防止AgCl转化成AgSCN或其他合理答案
(6) 偏小
【详解】(1)和过量盐酸反应生成氯化钡、二氧化碳和水,,得到溶液M成分为氯化钡和盐酸,常温下,溶液M的pH<7,答案:<。
(2)少量氯化钡和盐酸溶液蒸干,盐酸挥发,得到固体,答案:。
(3)氯化钡和盐酸溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到产品,答案:降温(冷却) 结晶;
(4)ng样品加足量的溶液和盐酸,反生反应,过滤、洗涤、干燥,最后得到mg,物质的量为mol,产品纯度为=,若用滤纸包裹在电炉中烘干,会因温度过高,导致炭黑还原部分,则测得m偏小,所求样品纯度偏低,答案:,偏低;
(5)指示剂为溶液,用溶液滴定过量的至终点,先和生成沉淀,当达到滴定终点,和指示剂溶液反应,使溶液呈红色。所以滴定终点的现象是滴入最后半(或一)滴溶液时,溶液刚好变为血红色且半分钟内不变色。加硝基苯使沉淀表面被有机物覆盖,所以硝基苯的作用是防止AgCl转化成AgSCN。答案:滴入最后半(或一)滴溶液时,溶液刚好变为血红色且半分钟内不变色;防止AgCl转化成AgSCN或其他合理答案;
(6)物质的量为V110-4mol,剩余硝酸银物质的量为,和氯化钡反应硝酸银物质的量为V110-4mol-=(0.1V1-cV2) mol,样品中氯元素质量分数=,若取消步骤3,AgCl转化成AgSCN,会使V2偏大,则测定结果偏小。答案:;偏小。
22.(1)BCE
(2) 当滴入最后半滴标准KSCN溶液,锥形瓶内的溶液由无色变为红色且半分钟内不褪色 防止影响溶液颜色的观察
(3)过滤
(4)
(5) 5mL 10mL
【详解】(1)配制溶液的一般步骤需要计算、称量、溶解、冷却、转移定容,配制溶液所需的玻璃仪器有烧杯、量筒和玻璃棒、容量瓶、和滴管,故答案为BCE;
(2)用0.01moL/LKSCN溶液滴定所取的15.00mL滤液中的,滴定原理为:(白色固体),滤液中有Fe3+,滴定终点是当滴入最后半滴标准KSCN溶液,锥形瓶内的溶液由无色变为红色且半分钟内不褪色;滴定时过滤除去Ag单质的目的是防止影响溶液颜色的观察;
(3)测定平衡体系中浓度,可以利用pH为9~11.5条件下和磺基水杨酸()生成稳定的黄色络合物,取平衡后的浊液,过滤,取5.00mL滤液,2mL2%磺基水杨酸溶液,加入pH为9~11.5的缓冲溶液,测定吸光度;
(4)将0.0100mol/L溶液与0.0400mo/L溶液等体积混合,,,发生,测得平衡体系中浓度为cmol/L,故平衡时、,;
(5)研究常温下稀释对该平衡移动方向的影响。用一定浓度的溶液和溶液,按下表配制总体积相同的系列溶液,I的总体积为20mL,II的总体积也为20mL,a=5mL,b=10mL,加水稀释平衡向着微粒数增多的方向移动,平衡逆向移动,和的体积都稀释了2倍,平衡逆向移动的浓度。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.当Mg(OH)2固体在水中溶解达到平衡时:Mg(OH)2 (s) Mg2++2OH- ,为使Mg(OH)2固体的量减少,可加入的物质是
A.MgSO4 B.NaOH C.HCl D.NaCl
2.室温下,用饱和溶液浸泡粉末,一段时间后过滤,向滤渣中加入足量稀盐酸、产生气泡,固体未完全溶解。已知,。下列说法正确的是
A.滤渣中加入醋酸发生反应的离子方程式:
B.饱和溶液中存在:
C.反应正向进行,需满足
D.过滤后所得溶液中一定存在且
3.二氧化碳的过量排放可对海洋环境造成影响,原理如图所示。下列叙述错误的是
A.海水酸化引起浓度增大
B.海水酸化促进CaCO3的溶解、珊瑚礁减少
C.CO2引起海水酸化主要因为H++
D.使用太阳能等新能源有利于改善海洋环境
4.下列有关电解质溶液的说法正确的是
A.的盐酸中
B.常温下,溶液加水稀释时,逐渐增大
C.25℃时,在的悬浊液中加入少量固体,减小
D.室温下的醋酸溶液和的溶液等体积混合后溶液呈酸性
5.T℃时,。当时,溶液的pH等于(已知:该温度下,水的离子积常数)
A. B. C. D.
6.宏观辨识与微观探析是化学学科核心素养之一、下列相关方程式正确的是
A.石灰乳中存在的溶解平衡:Ca(OH)2 Ca2++2OH-
B.向明矾溶液中加入Ba(OH)2溶液至沉淀质量最大时的离子方程式:A13++2+2Ba2++4OH-=2BaSO4↓++2H2O
C.Na2S溶液呈碱性:S2-+2H2O=H2S+2OH-
D.NaHCO3在水溶液中的电离方程式:NaHCO3 Na++
7.25 ℃时,在含有大量PbI2的饱和溶液中存在着平衡PbI2(s)Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是
A.溶液中Pb2+和I-浓度都增大 B.溶液中Pb2+和I-浓度都减小
C.沉淀溶解平衡向右移动 D.溶液中Pb2+浓度减小
8.AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.图中各点对应的c(H )相同
B.图中各点对应的Ksp的关系为:Ksp(a)=Ksp(b)>Ksp(c)
C.升高温度,b点饱和溶液的组成由b点向c点方向移动
D.a点已达平衡状态,向a点溶液加入NaCl固体,饱和溶液的各微粒浓度不变
9.表示下列反应的方程式正确的是
A.铁粉与水蒸气共热,生成可燃性气体:
B.向溶液中加入铜片,溶液由黄色变成蓝色:
C.向浊液中加入溶液,生成红褐色沉淀:
D.向溶液中滴加溶液,溶液由浅绿色变成黄色:
10.下列对有关实验现象的解释或所得结论不正确的是
实验操作 现象 解释或结论
A 向2mL 0.1mol/L Na2S溶液中滴加0.1mol/LZnSO4溶液至不再有沉淀产生,再滴加几滴0.1mol/L CuSO4 溶液 先产生白色沉淀,又出现黑色沉淀 Ksp(ZnS)>Ksp(CuS)
B 用蒸馏水溶解CuCl2固体,并继续加水稀释 溶液由绿色逐渐变为蓝色 [CuCl4]2-+4H2O4Cl-+[Cu(H2O)4]2+正向移动
C 将25℃ 0.1mol/L 的 Na2SO3溶液加热到40℃,用传感器监测溶液pH变化 溶液的pH逐渐减小 温度升高,SO的水解增大程度小于水的电离增大程度,导致最终c(H+)升高
D 向某补血口服液中滴加酸性KMnO4溶液 酸性KMnO4溶液紫色褪去 该补血口服液中一定含有Fe2+
A.A B.B C.C D.D
11.下列反应的离子方程式正确的是
A.用饱和碳酸钠溶液处理水垢中的硫酸钙:
B.通入水中制硝酸:
C.硫酸铜溶液中加少量的铁粉:
D.室温下用稀溶解铜:
12.下列过程中的化学反应,相应的离子方程式错误的是
A.将稀H2SO4加入NaIO3和NaI的混合溶液中:5I-++6H+=3I2+3H2O
B.向稀HNO3中滴加Na2SO3溶液:3+2H++2=3+2NO↑+H2O
C.用饱和Na2CO3溶液浸泡CaSO4:CaSO4(s)+(aq)=CaCO3(s)+(aq)
D.向NaHCO3溶液中加入足量Ba(OH)2溶液:2+Ba2++2OH-=BaCO3↓+2H2O+
13.是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm,表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节浊液的pH,测得在不同pH条件下,体系中与(X为或)的关系如图2所示。下列说法错误的是。
A.每个氟化钙晶胞中含有的数目为4个
B.氟化钙的晶体密度为
C.表示与的变化曲线
D.的数量级为
14.某同学在实验室探究NaHCO3的性质:常温下,配制0.10 mol·L-1 NaHCO3溶液,测得其pH为9.7;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是( )
A.NaHCO3溶液呈碱性的原因是的水解程度大于电离程度
B.加入CaCl2促进了的水解
C.反应的离子方程式是2+Ca2+=CaCO3↓+H2CO3
D.反应后的溶液中存在:c(Na+)+2c(Ca2+)=c()+2c()+c(Cl-)
15.过渡金属硫化物作为一种新兴的具有电化学性能的电极材料,在不同的领域引起了研究者的兴趣,含有过渡金属离子废液的回收再利用有了广阔的前景,下面为S2 与溶液中金属离子的沉淀溶解平衡关系图,若向含有等浓度Cu2+、Cd2+、Zn2+、Co2+、Fe2+的废液中加入含硫的沉淀剂,则下列说法错误的是
A.由图可知溶液中金属离子沉淀先后顺序为Cu2+、Cd2+、Zn2+、Co2+、Fe2+
B.控制S2 浓度可以实现铜离子与其他金属离子的分离
C.因Na2S、ZnS来源广、价格便宜,故常作为沉铜的沉淀剂
D.向ZnS中加入Cu2+的离子方程式为:S2 +Cu2+CuS↓
二、填空题
16.回答下列问题
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出生成Mg(OH)Cl关反应的化学方程式_______。
(2)用电解法制取金属镁时,需要无水氯化镁。需要在干燥的HCl气流中加热MgCl2·6H2O,才能得到无水MgCl2,其原因是_______。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式)。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
Ⅱ.现有常温下的0.1mol·L-1纯碱溶液。
(4)你认为该溶液呈碱性的原因是(用离子方程式表示):_______。
(5)已知25℃时,Kh=2×10-4,则当溶液中c(HCO):c(CO)=2:1时,溶液的pH=_______
(6)0.1mol·L-1 Na2CO3溶液中c(OH-)-c(H+)=_______[用含c(HCO)、c(H2CO3)的关系式表示]
(7)向Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:_______
17.向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
(1)完全沉淀后,溶液中=_______。
(2)完全沉淀后,溶液的pH=_______。
(3)如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?_______(填“是”或“否”)。
(4)该温度下,AgCl饱和溶液的密度为1 g/cm3,则该温度下,AgCl在水中的溶解度约为_______ g。
18.人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风和关节炎,有关平衡有:①HUr(尿酸,aq)(尿酸根,aq)、②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时,,,。
②37℃时,模拟关节滑液pH=7.4,。
(1)37℃时,HUr溶液的pH约为_______(已知)。
(2)下列事实可以证明尿酸是弱电解质的是_______(填字母)。
A.NaUr溶液显碱性
B.HUr溶液可使石蕊溶液变红
C.常温下,等浓度的尿酸溶液导电性比盐酸弱
D.10mL溶液与10mLNaOH溶液完全反应
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中_______(填“>”“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至时,通过计算判断是否有NaUr晶体析出,请写出判断过程:_______。
(5)关节炎发作大都在脚趾和手指的关节处,反应②是_______(填“放热”或“吸热”)反应。
(6)对于尿酸偏高的人群,下列建议正确的是_______(填字母)。
A.多喝水,食用新鲜蔬果
B.饮食宜多盐、多脂
C.适度运动,注意关节保暖
D.减少摄入易代谢出尿酸的食物
19.C元素是组成化合物种类最多的元素,含C元素的酸有也多种,其中氢氰酸(HCN)和草酸()是两种比较特殊的酸。
(1)氢氰酸有剧毒,25℃时,该酸的电离常数为。
①HCN在水溶液中的电离方程式为_______。
②25℃时KCN溶液中的水解常数_______(保留一位小数)。
③0.2 mol/L的KOH溶液与0.4 mol/L的HCN溶液等体积混合后,恢复到25℃,混合溶液中和浓度大小关系是_______(填“>”、“<”或“=”)。
④已知T℃时,,,则T℃下,,该反应的平衡常数K=_______。
(2)为测定某草酸晶体产品中()的质量分数,称取14.0 g产品溶于水,配制成500 mL溶液,用浓度为0.10 mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00 mL,实验结果记录如表:(杂质不与高锰酸钾反应,相对分子质量为126)
实验次数 第一次 第二次 第三次
消耗溶液体积/mL 20.05 19.95 24.36
已知反应:
①滴定终点的现象是_______。
②通过实验数据,计算该产品中()的质量分数为_______。
③下列操作会导致测定结果偏低的是_______。
A.锥形瓶用待测液润洗
B.装酸性高锰酸钾溶液的滴定管没有润洗
C.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
D.滴定前平视,滴定结束时俯视
20.碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(,含有和少量等杂质)为原料制备碱式碳酸铜的流程如图所示:
已知:①有关金属离子形成氢氧化物沉淀的范围如下:
②常温稳定,在热水中会分解生成;
③。
金属离子
开始沉淀的 7.2 2.7 5.6 8.3
完全沉淀的 9.0 3.7 6.7 9.8
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有_______、_______(任写两种)。
(2)滤渣Ⅰ经提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分除外还有_______(填化学式)。
(3)常温下“除铁”时加入的试剂A可用,调节的范围为_______,若加A后将溶液的调为5,则溶液中的浓度为_______。
(4)写出“沉锰”(除)过程中反应的离子方程式:_______。
(5)“赶氨”时,最适宜的操作方法是_______。
三、实验题
21.氯化钡晶体()是广泛用于中学化学实验的一种试剂。某小组用纯制备并测定其纯度的实验方案如下:
实验一:制备。
取一定量纯于烧杯中,加入过量盐酸,充分反应,得到溶液M。
(1)常温下,溶液M的pH_______(填“>”、“<”或“=”)7。
(2)取少量溶液M,经蒸干得到固体,该固体的主要成分是_______(填化学式)。
(3)溶液M经蒸发浓缩、_______、过滤、洗涤、干燥得到产品。
实验二:测定产品纯度。
方案1:重量法。
取ng样品溶于蒸馏水,滴加足量的溶液和盐酸,过滤、洗涤、干燥,得到的固体质量为mg。
方案2:滴定法。
实验步骤如下:
步骤1:取xg样品配成250mL溶液,准确量取25.00mL溶液于锥形瓶中;
步骤2:向锥形瓶中加入溶液(过量);
步骤3:向其中加入硝基苯,用力振荡,使沉淀表面被有机物覆盖;
步骤4:加入指示剂溶液,用溶液滴定过量的至终点,消耗溶液的体积为mL。
已知:常温下,,
(4)方案1中,产品纯度为_______。如果用滤纸包裹在电炉中烘干,会因温度过高,导致炭黑还原部分,则测得结果_______(填“偏高”、“偏低”或“无影响”)。
(5)方案2中,滴定终点的现象是_______。硝基苯的作用是_______。
(6)方案2中,测得样品中氯元素质量分数为_______。若取消步骤3,则测定结果_______(填“偏大”、“偏小”或“无影响”)。
22.平衡常数的测定对化学学习和化学研究都有重要意义。已知“”为可逆反应,某小组将0.0100mol/L溶液与0.0400mo/L溶液等体积混合,测定平衡时各物质浓度、计算平衡常数。
(1)配制溶液所需的玻璃仪器有烧杯、量筒和_______。(从下图中选择仪器编号)
A. B. C. D. E.
(2)反应达到平衡后,过滤除去Ag单质,用0.01moL/LKSCN溶液滴定所取的15.00mL滤液中的,滴定原理为:(白色固体)、;滴定终点的现象为_______。除去Ag单质的目的是_______。
(3)若要测定平衡体系中浓度,可以利用pH为9~11.5条件下和磺基水杨酸()生成稳定的黄色络合物,可以通过测定吸光度得知其浓度。请据此将测定实验方案补充完整:取平衡后的浊液,_______,取5.00mL滤液,加入2mL2%磺基水杨酸溶液,加入pH为9~11.5的缓冲溶液,测定吸光度。
(4)若(3)中得出待测平衡体系中浓度为cmol/L,则测得的平衡常数K=_______。(用含c的计算式表示)
(5)该小组进一步研究常温下稀释对该平衡移动方向的影响。
设计方案并完成实验:用一定浓度的溶液和溶液,按下表配制总体积相同的系列溶液,测定平衡时浓度,记录数据。
序号
I 10 10 \
II 5 a b
……
_______,_______。用和的关系来表示平衡移动方向的判据是_______。
参考答案:
1.C
【详解】A.加入MgSO4,溶液中镁离子浓度增大,平衡逆向移动,Mg(OH)2固体的量增大,A不符合题意;
B.加入NaOH,溶液中氢氧根浓度增大,平衡逆向移动,Mg(OH)2固体的量增大,B不符合题意;
C.加入HCl,氢离子中和氢氧根,平衡正向移动,Mg(OH)2固体的量减少,C符合题意;
D.加入NaCl对平衡无影响,D不符合题意;
综上所述答案为C。
2.C
【详解】A.向滤渣中加入过量盐酸产生气泡,是BaCO3和盐酸反应,反应的离子方程式为:2H++ BaCO3=H2O+CO2↑+Ba2+,A错误;
B.饱和Na2CO3溶液中存在电荷守恒为:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO),B错误;
C.反应BaSO4+CO=BaCO3+SO达到平衡时,其平衡常数K====,要使BaSO4+CO=BaCO3+S0正向进行,则要满足Qc
故选C。
3.C
【分析】二氧化碳的过量排放,能导致海水中,,平衡右移,H+又能与珊瑚礁溶解生成的结合生成,促使,平衡右移,从而使珊瑚礁减少。
【详解】A.海水酸化,海水中H+和的浓度增大,浓度减小,故A正确;
B.H+结合珊瑚礁溶解生成的,促进CaCO3的溶解、珊瑚礁减少,故B正确;
C.CO2引起海水酸化主要因为,,故C错误;
D.使用太阳能等新能源,能有效减少二氧化碳的排放,有利于改善海洋环境,故D正确;
故选:C。
4.D
【详解】A.盐酸溶液中还存在水的电离平衡,水电离可产生氢离子,故,A错误;
B.==,温度不变则该比值不变,B错误;
C.在的悬浊液中存在溶解平衡:,加入少量固体,能降低OH-浓度,促使溶解平衡正向移动,增大,C错误;
D.室温下pH=3的醋酸溶液H+浓度是10-3mol/L,醋酸是弱酸只发生部分电离,醋酸浓度远大于10-3mol/L;室温下pH=11的溶液OH-浓度是10-3mol/L,是强碱完全电离,故浓度远小于醋酸浓度,两者体积混合后溶液呈酸性,D正确;
故选D。
5.B
【详解】该温度下,,根据,结合,可求得,即可得到,从而可求得,故选B。
6.B
【详解】A.石灰乳中存在的溶解平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq),故A错误;
B.向明矾溶液中滴加Ba(OH)2溶液至沉淀质量最大时,硫酸根离子恰好完全沉淀,此时铝离子与氢氧根离子的物质的量之比为1∶4,铝离子转化成偏铝酸根离子,发生反应的离子方程式为:A13++2+2Ba2++4OH-=2BaSO4↓++2H2O,故B正确;
C.Na2S溶液因S2-发生水解呈碱性,分两步进行,以第一步水解为主,则水解方程式为S2-+H2OOH-+HS-,故C错误;
D.NaHCO3在水溶液中完全电离出Na+和,电离方程式为NaHCO3═Na++,故D错误;
故选:B。
7.D
【详解】A.加入KI溶液,I-浓度增大,PbI2(s)Pb2+(aq)+2I-(aq)平衡逆向移动,溶液中Pb2+浓度减小,故A错误;
B.加入KI溶液,I-浓度增大,PbI2(s)Pb2+(aq)+2I-(aq)平衡逆向移动,溶液中Pb2+浓度减小,故B错误;
C.加入KI溶液,I-浓度增大,PbI2(s)Pb2+(aq)+2I-(aq)平衡逆向移动,故C错误;
D.加入KI溶液,I-浓度增大,PbI2(s)Pb2+(aq)+2I-(aq)平衡逆向移动,溶液中Pb2+浓度减小,故D正确;
选D。
8.C
【详解】A.温度升高,水的电离平衡程度增大,c(H )增大,故图中各点对应的c(H )不相同,故A错误;
B.Ksp(AgCl)=c(Ag+)c(Cl-),温度相同,Ksp相同,a、b在同一曲线上,所处温度相同,c点c(Ag+)、c(Cl-)均较大,则图中各点对应的Ksp的关系为:Ksp(c)>Ksp(a)=Ksp(b),故B错误;
C.升高温度,AgCl的溶解平衡向溶解的方向移动,则b点饱和溶液的组成由b点向c点方向移动,故C正确;
D.a点已达平衡状态,向a点溶液加入NaCl固体,c(Cl-)增大,AgCl的溶解平衡向生成沉淀的方向移动,故c(Ag+)减小,故D错误;
故选C。
9.B
【详解】A.铁粉与水蒸气共热生成Fe3O4和H2,A错误;
B.向溶液中加入铜片,Fe3+与Cu反应生成Fe2+和Cu2+,溶液由黄色变成蓝色,离子方程式为,B正确;
C.在离子方程式中不能拆开,应该保留化学式,C错误;
D.向溶液中滴加溶液的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,D错误 ;
故答案为:B。
【点睛】判断离子方程式是否正确,一般先看产物是否符合客观事实,二看化学式拆分是否正确,三看是否漏离子反应,四看反应物的配比是否正确,五看各种符号是否齐全。
10.D
【详解】A.Na2S溶液滴加ZnSO4溶液至不再有沉淀产生,可知硫化钠完全反应,再滴加的CuSO4 溶液生成CuS,能说明是ZnS转化成CuS,能证明Ksp(ZnS)>Ksp(CuS),故A正确;
B.[CuCl4]2-呈绿色,[Cu(H2O)4]2+呈蓝色,用蒸馏水溶解CuCl2固体,并继续加水稀释根据颜色变化可知[CuCl4]2-转化为[Cu(H2O)4]2+,即[CuCl4]2-+4H2O4Cl-+[Cu(H2O)4]2+正向移动,故B正确;
C.25℃ 0.1mol/L 的 Na2SO3溶液加热到40℃,亚硫酸钠水解程度增大,溶液中氢氧根离子浓度应增大,但实际溶液的pH逐渐减小,可知温度升高过程中水的离子积常数增大,由可知,的增大程度大于了增大程度,即SO的水解增大程度小于水的电离增大程度,导致最终c(H+)升高,故C正确;
D.酸性KMnO4溶液紫色褪去只能说明溶液中存在还原性离子,但不一定是Fe2+,故D错误;
故选:D。
11.D
【详解】A.水垢中的硫酸钙是沉淀,故用饱和碳酸钠溶液处理水垢中的硫酸钙的离子方程式为:,A错误;
B.原离子方程式H原子不守恒,则通入水中制硝酸的离子方程式为:,B错误;
C.铁与盐溶液发生置换反应生成Fe2+,故硫酸铜溶液中加少量的铁粉的离子方程式为:,C错误;
D.室温下用稀溶解铜的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故其离子方程式为:,D正确;
故答案为:D。
12.D
【详解】A.H2SO4、NaIO3和NaI反应生成碘单质,I的化合价由+5价降低为0价,I的化合价由-1价升高为0价,根据化合价升降守恒、原子守恒和电荷守恒,可得:5I-+IO+6H+=3I2+3H2O,A正确;
B.HNO3和Na2SO3反应生成一氧化氮和硫酸钠,N的化合价由+5价降低为+2价,S的化合价由+4价升高为+6价,根据化合价升降守恒、原子守恒和电荷守恒,可得:3SO+2H++2NO=3SO+2NO↑+H2O,B正确;
C.CaSO4与浓度较大的可溶性碳酸盐反应可以得到碳酸钙,再用酸可以将其除去,离子方程式为CaSO4(s)+CO(aq)=CaCO3(s)+SO(aq),C正确;
D.假设量少的物质为1mol,过量的物质用多少写多少,NaHCO3为1mol,所以需要1molBa(OH)2,NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O,所以反应的离子方程式为:HCO+Ba2++OH-=BaCO3↓+H2O,故D错误;
故选D。
13.C
【分析】已知HF的,则有,即有 越大,c(F-)越大,lgc(F-)越大,-lgc(F-)越小,c(F-)越大,c(Ca2+)越小,则-lgc(Ca2+)越大,故可知L1代表-lgc(Ca2+)的变化曲线,L2代表-lgc(F-)的变化曲线,据此分析解题。
【详解】A.每个氟化钙晶胞中含有Ca2+的数目为8×+6×=4,故A正确;
B.晶胞体积V=(a×10-10cm)3,该晶胞中相当于含有4个“CaF2”,晶胞质量为m=g,则氟化钙的密度=,故B正确;
C.由分析可知,L1表示-lgc(Ca2+)与的变化曲线,故C错误;
D.由a点坐标可知,═10-1.2,c(F-)=10-2,则Ka=10-1.2×10-2=10-3.2,由b点坐标可知,c(Ca2+)=10-2mol/L,此时=10-0.7,故可求出此时溶液中c(F-)=10-0.7×10-3.2=10-3.9,故Ksp(CaF2 )=c(Ca2+)c2(F-)=10-2×(10-3.9)2=10-9.8,故其数量级为10-10,故D正确;
故选:C。
14.B
【详解】A.NaHCO3既能电离又能水解,水解显碱性,电离显酸性,NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度,故A正确;
B.溶液中存在HCO3- CO32-+H+,加入CaCl2消耗CO32-,促进HCO3-的电离,故B错误;
C.HCO3-与Ca2+生成CaCO3和氢离子,氢离子结合HCO3-生成H2CO3,则反应的离子方程式,2HCO3-+Ca2+═CaCO3↓+H2CO3,故C正确;
D.溶液中存在电荷守恒,c(Na+)+c(H+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(OH-),溶液至pH=7,c(H+)=c(OH-),c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-),故D正确;
故选B。
15.D
【详解】由图可知溶液中金属硫化物沉淀的Ksp大小顺序为CuS
(2)在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2·6H2O受热产生的水气,故能得到无水MgCl2
(3)Cu(OH)2
(4)
(5)10
(6)c(HCO)+2c(H2CO3)
(7)3CO+2Al3++3H2O=2Al(OH)3↓+3CO2↑
【详解】(1)在空气中加热MgCl2·6H2O,若生成的是Mg(OH)Cl,则还会同时生成HCl和水,根据反应物和生成物可得化学方程式为MgCl2·6H2O=Mg(OH)Cl+HCl↑+5H2O↑;
(2)氯化镁水解显酸性,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2·6H2O受热产生的水气,故能得到无水MgCl2;
(3)相同温度下,溶度积阐述表达式相同时,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,溶度积常数小的先生成沉淀,根据溶度积常数知,先生成Cu(OH)2沉淀;
(4)碳酸钠是强碱弱酸盐,碳酸根离子水解生成OH-导致溶液呈碱性,水解离子方程式为 ;
(5)已知25℃时,,,溶液中,溶液的pH=10;
(6)根据碳原子守恒
根据溶液中的电荷守恒得:
根据原子守恒、电荷守恒得c(OH-)-c(H+)=c(HCO)+2c(H2CO3);
(7)向Na2CO3溶液中加入明矾会产生沉淀和气体,铝离子和碳酸根离子发生双水解反应生成氢氧化铝和二氧化碳,离子方程式为3CO+2Al3++3H2O=2Al(OH)3↓+3CO2↑。
17.(1)1.0×10-7 mol/L
(2)2
(3)否
(4)1.435×10-4
【详解】(1)反应前,,
;反应后剩余的Cl-为0.1×10-3 mol,则混合溶液中, 。
(2)H+没有参与反应,沉淀完全后,,pH=2。
(3)因为加入的盐酸中和反应后所得溶液中的相同,没有改变,变小,所以,没有沉淀产生。
(4)
18.(1)3.7
(2)AC
(3)>
(4),故有尿酸钠晶体析出
(5)吸热
(6)ACD
【详解】(1)由尿酸的电离平衡:HUr(尿酸,aq)(尿酸根,aq),,解得,pH约为3.7,答案:3.7;
(2)A.NaUr溶液显碱性,说明是强碱弱酸盐,A正确;
B.HUr溶液可使石蕊溶液变红说明具有酸性,B错误;
C.常温下,等浓度的尿酸溶液导电性比盐酸弱,说明是弱酸,C正确;
D.10mL溶液与10mLNaOH溶液完全反应只能说明具有酸性,D错误;
故选AC。
(3)37℃时,模拟关节滑液pH=7.4,,遵循电荷守恒,所以:>,答案:>;
(4)37℃时,模拟关节滑液,当时故有尿酸钠晶体析出,答案:,故有尿酸钠晶体析出;
(5)关节炎的原因归结于在关节滑液中形成了尿酸钠晶体,夏天症状减轻,冬天症状加重,依据平衡温度降低平衡逆向移动,逆向是放热反应,正反应方向为吸热反应,答案:吸热;
(6)A.多喝水,食用新鲜蔬果,A正确;
B.饮食宜多盐、多脂,B错误;
C.适度运动,注意关节保暖,C正确;
D.减少摄入易代谢出尿酸的食物,D正确;
故选ACD。
19.(1) <
(2) 当最后半滴高猛酸钾溶液滴入时,溶液变为浅红色,且半分钟内不褪去 90% D
【详解】(1)①氰氢酸是弱酸,发生部分电离,答案:;
②=,答案:;
③0.2 的KOH溶液与0.4 的HCN溶液等体积混合后,可认为是和等浓度混合溶液,由题干信息和②答案可知在此溶液中,的电离小于的水解,混合溶液中和浓度大小关系是<,答案:<;
④=,答案:;
(2)①高锰酸钾和草酸发生氧化还原反应,之后褪色,故滴定终点的现象是:当最后半滴高锰酸钾溶液滴入时,溶液变为浅红色,且半分钟内不退去;
②因第三次与第一次、第二次测得体积相差较大,则平均消耗体积,故消耗;由,得n(=,则,则草酸晶体的质量分数= ;
③A.锥形瓶用待测液润洗,使待测液的量增加,则消耗标准液体积增大,最终导致测定结果偏高,A错误;
B.没用高锰酸钾标准液润洗酸式滴定管,使标准液浓度偏小,消耗标准液体积偏大,则导致测定结果偏高,B错误;
C.测得标准液体积比实际体积大,则导致计算得出的测定结果偏高,C错误;
D.俯视读取体积比实际体积小,则导致计算得出测定结果偏低,D正确;
故选D。
20.(1) 搅拌 适当增加硫酸浓度、适当加热等(任选二)
(2)
(3) 3.7~5.6(或3.7≤pH<5.6)
(4)
(5)将溶液加热
【分析】根据题意,用含有、、的辉铜矿石,制备碱式碳酸铜,开始加入稀硫酸酸浸并且用将氧化为而沉淀而除去。溶液中加入,促进水解生成而除去,溶液中剩余的阳离子为、,用将沉淀,加热除去溶液中的,最后将溶液处理,得到碱式碳酸铜。
【详解】(1)影响反应速率的方法有:适当升高温度、适当增大浓度、增大接触面、搅拌等。
(2)辉铜矿中含有、和,加入和后,,,和硫酸不发生反应,滤渣Ⅰ中的主要成分除外还有。
(3)加入调节,可以使完全沉淀,根据表中的数据,完全沉淀,≤3.7,开始沉淀<5.6,调节的范围为:3.7~5.6(或3.7≤pH<5.6)。加入调节=5,, ,溶液中的浓度为。
(4)向溶液中加入除去,生成沉淀,发生反应的方程式:。
(5)气体在溶液中的溶解度随着温度的升高而降低,故可以将溶液加热。
21.(1)<
(2)
(3)降温(冷却) 结晶
(4) 偏低
(5) 滴入最后半(或一)滴溶液时,溶液刚好变为血红色且半分钟内不变色 防止AgCl转化成AgSCN或其他合理答案
(6) 偏小
【详解】(1)和过量盐酸反应生成氯化钡、二氧化碳和水,,得到溶液M成分为氯化钡和盐酸,常温下,溶液M的pH<7,答案:<。
(2)少量氯化钡和盐酸溶液蒸干,盐酸挥发,得到固体,答案:。
(3)氯化钡和盐酸溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到产品,答案:降温(冷却) 结晶;
(4)ng样品加足量的溶液和盐酸,反生反应,过滤、洗涤、干燥,最后得到mg,物质的量为mol,产品纯度为=,若用滤纸包裹在电炉中烘干,会因温度过高,导致炭黑还原部分,则测得m偏小,所求样品纯度偏低,答案:,偏低;
(5)指示剂为溶液,用溶液滴定过量的至终点,先和生成沉淀,当达到滴定终点,和指示剂溶液反应,使溶液呈红色。所以滴定终点的现象是滴入最后半(或一)滴溶液时,溶液刚好变为血红色且半分钟内不变色。加硝基苯使沉淀表面被有机物覆盖,所以硝基苯的作用是防止AgCl转化成AgSCN。答案:滴入最后半(或一)滴溶液时,溶液刚好变为血红色且半分钟内不变色;防止AgCl转化成AgSCN或其他合理答案;
(6)物质的量为V110-4mol,剩余硝酸银物质的量为,和氯化钡反应硝酸银物质的量为V110-4mol-=(0.1V1-cV2) mol,样品中氯元素质量分数=,若取消步骤3,AgCl转化成AgSCN,会使V2偏大,则测定结果偏小。答案:;偏小。
22.(1)BCE
(2) 当滴入最后半滴标准KSCN溶液,锥形瓶内的溶液由无色变为红色且半分钟内不褪色 防止影响溶液颜色的观察
(3)过滤
(4)
(5) 5mL 10mL
【详解】(1)配制溶液的一般步骤需要计算、称量、溶解、冷却、转移定容,配制溶液所需的玻璃仪器有烧杯、量筒和玻璃棒、容量瓶、和滴管,故答案为BCE;
(2)用0.01moL/LKSCN溶液滴定所取的15.00mL滤液中的,滴定原理为:(白色固体),滤液中有Fe3+,滴定终点是当滴入最后半滴标准KSCN溶液,锥形瓶内的溶液由无色变为红色且半分钟内不褪色;滴定时过滤除去Ag单质的目的是防止影响溶液颜色的观察;
(3)测定平衡体系中浓度,可以利用pH为9~11.5条件下和磺基水杨酸()生成稳定的黄色络合物,取平衡后的浊液,过滤,取5.00mL滤液,2mL2%磺基水杨酸溶液,加入pH为9~11.5的缓冲溶液,测定吸光度;
(4)将0.0100mol/L溶液与0.0400mo/L溶液等体积混合,,,发生,测得平衡体系中浓度为cmol/L,故平衡时、,;
(5)研究常温下稀释对该平衡移动方向的影响。用一定浓度的溶液和溶液,按下表配制总体积相同的系列溶液,I的总体积为20mL,II的总体积也为20mL,a=5mL,b=10mL,加水稀释平衡向着微粒数增多的方向移动,平衡逆向移动,和的体积都稀释了2倍,平衡逆向移动的浓度。
