3.4 羧酸 羧酸衍生物 同步练习(含答案)) 高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.4 羧酸 羧酸衍生物 同步练习(含答案)) 高二化学人教版(2019)选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-10 06:53:05 | ||
图片预览




文档简介
3.4 羧酸 羧酸衍生物 同步练习 高二化学人教版(2019)选择性必修3
一、单选题
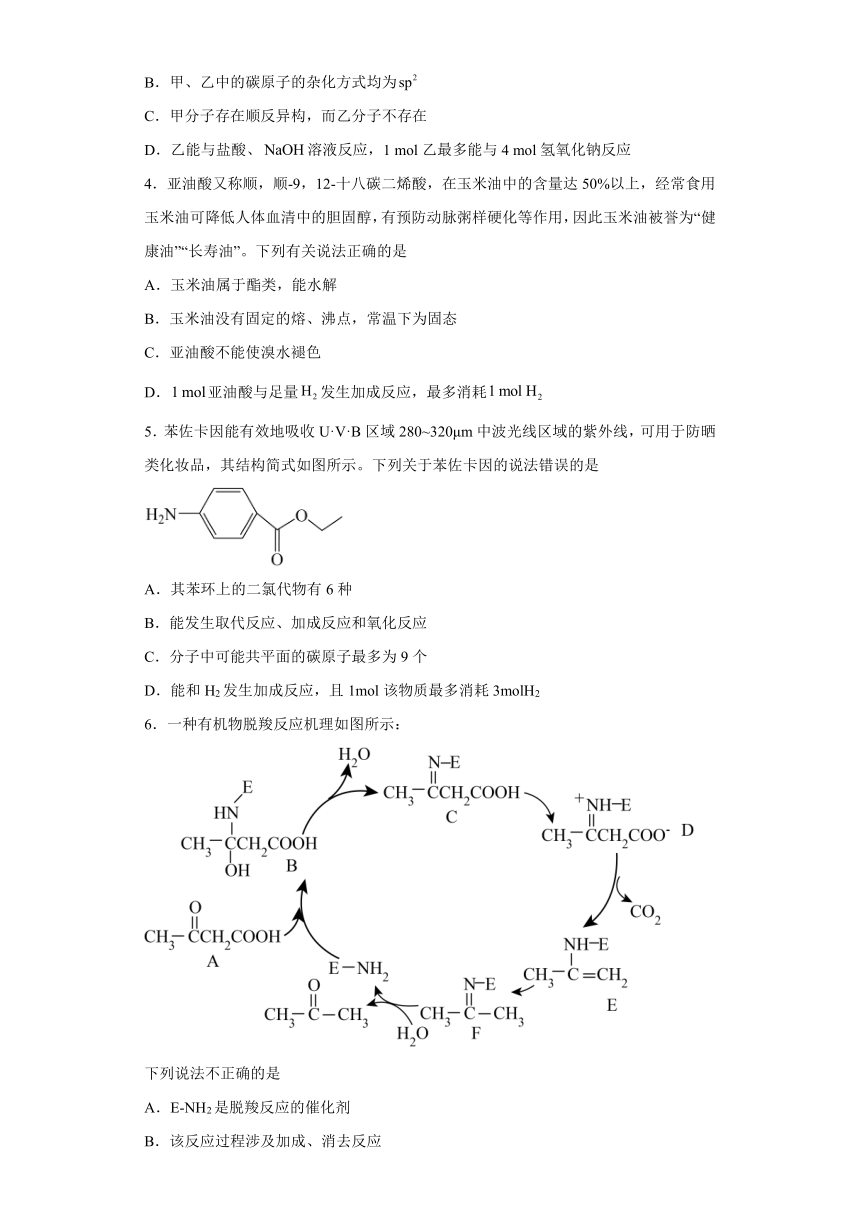
1.下列关于有机物说法正确的是
A.氟利昂-12(CF2Cl2)性质稳定,不易燃烧,有两种空间结构
B.某芳香烃的结构简式为(),它的二氯代物共有10种(不包括立体异构)
C.有机物HCOOCH2CH2COOH与HOOC-CH2-COOH是同系物
D.除去乙酸乙酯中的乙醇和乙酸,可以加入足量的烧碱溶液,然后分液即得乙酸乙酯
2.用下列仪器或装置(图中夹持略)进行相应实验,不能达到实验目的的是
A B C D
分离苯与水 检验乙烷中是否混有乙烯 制备并收集少量乙酸乙酯 实验室制取并收集乙烯
A.A B.B C.C D.D
3.化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关化合物甲、乙的说法正确的是
A.乙分子中含有3个手性碳原子
B.甲、乙中的碳原子的杂化方式均为
C.甲分子存在顺反异构,而乙分子不存在
D.乙能与盐酸、溶液反应,1 mol乙最多能与4 mol氢氧化钠反应
4.亚油酸又称顺,顺-9,12-十八碳二烯酸,在玉米油中的含量达50%以上,经常食用玉米油可降低人体血清中的胆固醇,有预防动脉粥样硬化等作用,因此玉米油被誉为“健康油”“长寿油”。下列有关说法正确的是
A.玉米油属于酯类,能水解
B.玉米油没有固定的熔、沸点,常温下为固态
C.亚油酸不能使溴水褪色
D.亚油酸与足量发生加成反应,最多消耗
5.苯佐卡因能有效地吸收U·V·B区域280~320μm中波光线区域的紫外线,可用于防晒类化妆品,其结构简式如图所示。下列关于苯佐卡因的说法错误的是
A.其苯环上的二氯代物有6种
B.能发生取代反应、加成反应和氧化反应
C.分子中可能共平面的碳原子最多为9个
D.能和H2发生加成反应,且1mol该物质最多消耗3molH2
6.一种有机物脱羧反应机理如图所示:
下列说法不正确的是
A.E-NH2是脱羧反应的催化剂
B.该反应过程涉及加成、消去反应
C.E和F互为同分异构体
D.也可按照该反应机理生成
7.在长时间剧烈运动后,人体常常表现出肌肉酸痛、疲劳乏力、精神不佳等情况,这都是乳酸堆积的具体表现。乳酸的结构简式为。下列有关乳酸的说法中错误的是
A.乳酸既可以与乙醇反应,也可以与乙酸反应
B.1mol乳酸与足量的反应可生成2mol
C.乳酸可以发生取代反应、氧化反应
D.与乳酸具有相同官能团且与乳酸互为同分异构体的有机物只有一种
8.下列方案设计、现象和结论有不正确的是
目的 方案设计 现象和结论
A 氨水中NH3检验 在一支洁净的试管中滴加几滴氨水,将湿润的红色石蕊试纸粘在玻璃棒上靠近试管口,观察试纸颜色变化。 若试纸由红色变为蓝色, 则有NH3
B 海带中碘元素的检验 取3g干燥的海带灼烧,在灰分中加入蒸馏水,过滤,在滤液中加入适量稀硫酸,再加入适量新制氯水,取出少许混合液于试管中,滴入几滴淀粉溶液。 若溶液显蓝色,则含碘元素。
C 火柴头中氯元素的检验 摘下几根火柴的火柴头, 将火柴头浸于蒸馏水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液。 若出现白色沉淀,则含氯元素
D 乙酸乙酯水解条件的比较 取两支试管编号为1、2,1中加入4mL蒸馏水+2滴甲基橙+2mL乙酸乙酯,2中加入4 mL4mol/LNaOH溶液+2滴石蕊溶液+2mL乙酸乙酯,振荡后同时插入75°C热水浴,加热约5分钟。观察现象。 1中颜色无变化,2中颜色蓝色变浅,说明水解程度 2大于1.
A.A B.B C.C D.D
9.绿原酸是金银花的主要抗菌、抗病毒有效药理成分之一,在体内能被蛋白质灭活,结构简式如图所示。下列说法正确的是
A.1mol绿原酸最多可与4molBr2发生加成反应
B.1mol氢化绿原酸与足量饱和NaHCO3溶液反应,可放出33.6L(标准状况)CO2
C.绿原酸在酸性条件下发生水解反应得到的产物均可以与FeCl3溶液发生显色反应
D.一定量的氢化绿原酸分别与足量Na、NaOH反应,消耗二者物质的量之比为3∶1
10.某物质结构为,它在一定条件下可能发生的反应有
①加成反应 ②水解反应 ③消去反应 ④取代反应 ⑤与Na2CO3反应 ⑥加聚反应
A.①②④ B.①②③④⑤ C.③④⑤⑥ D.①②④⑤
二、填空题
11.丙烯酸乙酯是一种食用香料,用乙烯、丙烯等石油化工产品为原料合成丙烯酸乙酯的路线如图所示。
回答下列问题:
(1)CH2=CH2 是重要的化工原料,CH2=CH2的电子式为___________,CH2=CH2能使溴的四氯化碳溶液褪色,该反应的化学方程式为_____________。
(2)化合物B中所含官能团的名称为_______。
(3)CH2=CH2→A,A+B→丙烯酸乙酯的反应类型分别为_______、__________。
(4)CH2=CHCH3与CH2=CH2互为同系物,CH2=CHCH3的同分异构体的结构简式为__。
(5)丙烯酸乙酯一定条件下会发生聚合反应,该聚合物有较好的弹性,可用于生产织物。该聚合反应的化学方程式为______。
12.有机物的表示方法多种多样,下面是常用的有机物的表示方法:
①②③④⑤⑥⑦⑧ ⑨ ⑩
(1)写出⑧的分子式___________;
(2)用系统命名法给⑨命名,其名称为___________。
(3)属于酯的是___________(填序号,下同),与②互为同分异构体的是___________。
(4)上述表示方法中属于结构式的为___________;属于键线式的为___________;
13.请填写下表。
物质名称 甲醇 苯酚 甲醛 乙醛 甲酸 乙酸乙酯
状态 (常温、常压) _________ _________ _________ _________ _________ _________
水溶性 _________ _________ _________ _________ _________ _________
14.回答下列问题:
(1)根据核磁共振氢谱图可以确定有机物分子中氢原子的种类和相对数目。
①下列分子中,其核磁共振氢谱中只有一组峰的物质是_______(填字母)。
A. B. C. D.
②化合物A和B的分子式都是,A的核磁共振氢谱如下图所示,则A的结构简式为_______,请预测B的核磁共振氢谱上有_______组峰。
③若用核磁共振氢谱来研究的结构,请简要说明根据核磁共振氢谱的结果来确定分子结构的方法是_______。
(2)有机物C常用于食品行业。已知9.0gC在足量中充分燃烧,将所得的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为。
①C分子的质谱图如图所示,从图中可知其相对分子质量是_______,则C的分子式是_______。
②C能与溶液发生反应生成,C一定含有的官能团名称是_______。
③C分子的核磁共振氢谱有4组峰,峰面积之比是1:1:1:3,则C的结构简式是_______。
④0.1molC与足量Na反应,在标准状况下产生的体积是_______L。
三、计算题
15.现有一些只含C、H、O三种元素的有机物,它们燃烧时消耗的O2和生成的CO2的体积比是3:4。
(1)这些有机物中,相对分子质量最小的化合物的分子式是_______________。
(2)某两种碳原子数相同的上述有机物,若它们的相对分子质量分别为a和b(a(3)在这些有机物中有一种化合物,它含有两个羧基。取0.2625g该化合物恰好能跟25.00mL0.1000moL·L-1NaOH溶液完全中和。由此可以得知该化合物的相对分子质量应是______,并可推导出它的分子式应是____________。
四、实验题
16.某化学兴趣小组设计实验制备苯甲酸异丙酯,其反应原理为
+十H2O。
用如图所示装置进行实验:
物质的部分物理性质如表所示:
物质 相对分子质量 密度/ g·cm-3 沸点/°C 水溶性
苯甲酸 122 1.27 249 微溶
异丙醇 60 0.79 82 易溶
苯甲酸异丙酯 164 1.17 218 不溶
实验步骤:
步骤I.在干燥的仪器a中加入38.1 g苯甲酸、30 mL异丙醇和15 mL浓硫酸,再加入几粒沸石;
步骤II.加热至70 °C左右,保持恒温半小时;
步骤III.将仪器a中液体进行如下所示操作得到粗产品;
步骤IV.将粗产品用图乙所示装置进行精制。
试回答下列问题:
(1)步骤I中加入三种试剂的先后顺序一定错误的是_ (填字母)。
A.异丙醇、苯甲酸、浓硫酸
B.异丙醇、浓硫酸、苯甲酸
C.浓硫酸、异丙醇、苯甲酸
(2)图乙中仪器b的名称为_。 加入的苯甲酸和异丙醇中,需过量的是异丙醇,目的是___________。
(3)本实验一般采用的加热方式为___________,因为温度过高会影响产率。
(4)操作I的分离方法名称为___________,其中第二次水洗的目的是___________,操作II中加入无水硫酸镁的作用为___________。
(5)如果得到的苯甲酸异丙酯的质量为38.360g,则该实验的产率为___________%(结果保留2位有效数字)。
五、有机推断题
17.丙烯是基本的有机化工原料,由丙烯经如下步骤可合成N-异丙基丙烯酰胺,其可用于合成随温度变化的药物控制释放材料。
丙烯,
(1)丙烯的结构简式为_______。
(2)反应I的反应类型为_______。
(3)反应II_______(填“能”或“不能”)用酸性溶液作为氧化剂,理由是_______。
(4)检验生成的B中是否含有A的方法是_______;若含有A,写出A参与反应的化学方程式:_______。
(5)M与A互为同系物,相对分子质量比A大14,写出M所有可能的结构:_______(不考虑立体异构)。
(6)反应III的另一种反应物的键线式为_______。
六、元素或物质推断题
18.物质M可用作调味剂、乳化剂、抗氧化增效剂、吸湿剂、pH调节剂、增香剂、缓冲剂。其结构式如图所示,其组成元素X、Y、Z、Q为原子序数依次增大的短周期主族元素,且Y的一种核素常用于检测文物的年代。
请回答下列问题:
(1)元素Q在周期表中的位置为_______,工业上采用_______法治炼Q的单质。
(2)物质M中所含化学键的类型为_______,物质M与稀硫酸反应生成有机物N,N中所含官能团的名称为_______。
(3)相同条件下,等质量的Y的两种单质、分别在足量中燃烧,放出热量前者大于后者。则两种单质中,_______(填“”或“”)更稳定。Y与Z分别形成的简单氢化物的沸点由高到低的顺序为_______(填化学式)。
(4)QX的电子式为_______,与水反应的化学方程式为_______。
七、工业流程题
19.青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯,可溶于甲醇、乙醇、乙醚、石油醚,几乎不溶于水中,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知乙醚的沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____。操作II的名称是____。操作III的主要过程可能是____(填序号)。
a.加水溶解,蒸发浓缩、冷却结晶
b.加95%的乙醇,浓缩、结晶、过滤
c.加入乙醚,进行萃取分液
(2)用下列实验装置测定青蒿素分子式的方法如图:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再点燃酒精灯充分反应,精确测定装置E和F实验前后的质量,根据所测数据计算。
①装置E中盛放的物质是____,装置F中盛放的物质是____。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是____。
③用合理改进后的装置进行实验,称得:
装置 实验前/g 实验后/g
E 22.6 42.4
F 80.2 146.2
则测得的青蒿素的最简式是_____。
(3)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____(填序号)具有相似的性质。
a.乙醇 b.乙酸 c.乙酸乙酯 d.葡萄糖
(4)某科研小组经多次提取青蒿素实验,认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响。
由图可知控制其他实验条件不变,最佳原料粒度、提取时间和提取温度为_____(填序号)。
a.80目、100min、50℃ b.60目、120min、50℃ c.60目、120min、55℃
(5)在青蒿素发现、提取和合成研究之后,相继开发出其衍生物:二氢青蒿素、青蒿琥酯钠等。该类衍生物与青蒿素相比,具有____的优点,可显著提高疗效。
八、原理综合题
20.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平。请回答下列问题:
(1)乙烯的结构简式为_______。
(2)鉴别甲烷和乙烯的试剂是_______(填字母)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是_______(填字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)若以乙烯为主要原料合成乙酸,其合成路线如图所示。
乙烯(A)CH3CH2OHCH3CHO乙酸(B)
则反应①的反应类型为_______,反应①的化学方程式为_______。
参考答案:
1.B
2.C
3.C
4.A
5.A
6.D
7.B
8.D
9.D
10.D
11. CH2=CH2+Br2→CH2BrCH2Br 碳碳双键、羧基 加成反应 取代反应(酯化反应) 或 nCH2=CH-COOC2H5
12.(1)
(2)2,2-二甲基戊烷
(3) ⑦ ③
(4) ②⑥⑧
13. 液态 固态 气态 液态 液态 液态 易溶 可溶 易溶 易溶 易溶 不溶
14.(1) AD 2 通过其核磁共振氢谱中峰的数目可以判断:有3组峰时,分子结构为;有1组峰时,分子结构为
(2) 90 羧基 CH3CH(OH)COOH 2.24
15. C2H2O2 18 210 C6H10O8
16.(1)C
(2) 蒸馏烧瓶 有利于酯化反应向正反应方向进行,提高苯甲酸的转化率
(3)水浴加热
(4) 分液 除去残留的碳酸钠 除去残留的水
(5)75
17.(1)
(2)氧化反应
(3) 不能 酸性溶液会将碳碳双键氧化
(4) 取适量生成的B先与一定量的溶液充分混合,再与适量新制氢氧化铜共热,若产生砖红色沉淀,说明含有A,否则不含
(5)、、
(6)
18. 第三周期第ⅠA族 电解 离子键、共价键 羟基、羧基
19.(1) 增大青蒿与乙醚的接触面积,提高青蒿素的浸取率 蒸馏 b
(2) CaCl2或P2O5 碱石灰 在装置F后连接一个装有碱石灰的球形干燥管,以防止空气中的CO2和水蒸气进入F装置 C15H22O5
(3)c
(4)b
(5)水溶性好
20. CH2=CH2 BD ACD 加成反应 CH2=CH2+H2OCH3CH2OH
一、单选题
1.下列关于有机物说法正确的是
A.氟利昂-12(CF2Cl2)性质稳定,不易燃烧,有两种空间结构
B.某芳香烃的结构简式为(),它的二氯代物共有10种(不包括立体异构)
C.有机物HCOOCH2CH2COOH与HOOC-CH2-COOH是同系物
D.除去乙酸乙酯中的乙醇和乙酸,可以加入足量的烧碱溶液,然后分液即得乙酸乙酯
2.用下列仪器或装置(图中夹持略)进行相应实验,不能达到实验目的的是
A B C D
分离苯与水 检验乙烷中是否混有乙烯 制备并收集少量乙酸乙酯 实验室制取并收集乙烯
A.A B.B C.C D.D
3.化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关化合物甲、乙的说法正确的是
A.乙分子中含有3个手性碳原子
B.甲、乙中的碳原子的杂化方式均为
C.甲分子存在顺反异构,而乙分子不存在
D.乙能与盐酸、溶液反应,1 mol乙最多能与4 mol氢氧化钠反应
4.亚油酸又称顺,顺-9,12-十八碳二烯酸,在玉米油中的含量达50%以上,经常食用玉米油可降低人体血清中的胆固醇,有预防动脉粥样硬化等作用,因此玉米油被誉为“健康油”“长寿油”。下列有关说法正确的是
A.玉米油属于酯类,能水解
B.玉米油没有固定的熔、沸点,常温下为固态
C.亚油酸不能使溴水褪色
D.亚油酸与足量发生加成反应,最多消耗
5.苯佐卡因能有效地吸收U·V·B区域280~320μm中波光线区域的紫外线,可用于防晒类化妆品,其结构简式如图所示。下列关于苯佐卡因的说法错误的是
A.其苯环上的二氯代物有6种
B.能发生取代反应、加成反应和氧化反应
C.分子中可能共平面的碳原子最多为9个
D.能和H2发生加成反应,且1mol该物质最多消耗3molH2
6.一种有机物脱羧反应机理如图所示:
下列说法不正确的是
A.E-NH2是脱羧反应的催化剂
B.该反应过程涉及加成、消去反应
C.E和F互为同分异构体
D.也可按照该反应机理生成
7.在长时间剧烈运动后,人体常常表现出肌肉酸痛、疲劳乏力、精神不佳等情况,这都是乳酸堆积的具体表现。乳酸的结构简式为。下列有关乳酸的说法中错误的是
A.乳酸既可以与乙醇反应,也可以与乙酸反应
B.1mol乳酸与足量的反应可生成2mol
C.乳酸可以发生取代反应、氧化反应
D.与乳酸具有相同官能团且与乳酸互为同分异构体的有机物只有一种
8.下列方案设计、现象和结论有不正确的是
目的 方案设计 现象和结论
A 氨水中NH3检验 在一支洁净的试管中滴加几滴氨水,将湿润的红色石蕊试纸粘在玻璃棒上靠近试管口,观察试纸颜色变化。 若试纸由红色变为蓝色, 则有NH3
B 海带中碘元素的检验 取3g干燥的海带灼烧,在灰分中加入蒸馏水,过滤,在滤液中加入适量稀硫酸,再加入适量新制氯水,取出少许混合液于试管中,滴入几滴淀粉溶液。 若溶液显蓝色,则含碘元素。
C 火柴头中氯元素的检验 摘下几根火柴的火柴头, 将火柴头浸于蒸馏水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液。 若出现白色沉淀,则含氯元素
D 乙酸乙酯水解条件的比较 取两支试管编号为1、2,1中加入4mL蒸馏水+2滴甲基橙+2mL乙酸乙酯,2中加入4 mL4mol/LNaOH溶液+2滴石蕊溶液+2mL乙酸乙酯,振荡后同时插入75°C热水浴,加热约5分钟。观察现象。 1中颜色无变化,2中颜色蓝色变浅,说明水解程度 2大于1.
A.A B.B C.C D.D
9.绿原酸是金银花的主要抗菌、抗病毒有效药理成分之一,在体内能被蛋白质灭活,结构简式如图所示。下列说法正确的是
A.1mol绿原酸最多可与4molBr2发生加成反应
B.1mol氢化绿原酸与足量饱和NaHCO3溶液反应,可放出33.6L(标准状况)CO2
C.绿原酸在酸性条件下发生水解反应得到的产物均可以与FeCl3溶液发生显色反应
D.一定量的氢化绿原酸分别与足量Na、NaOH反应,消耗二者物质的量之比为3∶1
10.某物质结构为,它在一定条件下可能发生的反应有
①加成反应 ②水解反应 ③消去反应 ④取代反应 ⑤与Na2CO3反应 ⑥加聚反应
A.①②④ B.①②③④⑤ C.③④⑤⑥ D.①②④⑤
二、填空题
11.丙烯酸乙酯是一种食用香料,用乙烯、丙烯等石油化工产品为原料合成丙烯酸乙酯的路线如图所示。
回答下列问题:
(1)CH2=CH2 是重要的化工原料,CH2=CH2的电子式为___________,CH2=CH2能使溴的四氯化碳溶液褪色,该反应的化学方程式为_____________。
(2)化合物B中所含官能团的名称为_______。
(3)CH2=CH2→A,A+B→丙烯酸乙酯的反应类型分别为_______、__________。
(4)CH2=CHCH3与CH2=CH2互为同系物,CH2=CHCH3的同分异构体的结构简式为__。
(5)丙烯酸乙酯一定条件下会发生聚合反应,该聚合物有较好的弹性,可用于生产织物。该聚合反应的化学方程式为______。
12.有机物的表示方法多种多样,下面是常用的有机物的表示方法:
①②③④⑤⑥⑦⑧ ⑨ ⑩
(1)写出⑧的分子式___________;
(2)用系统命名法给⑨命名,其名称为___________。
(3)属于酯的是___________(填序号,下同),与②互为同分异构体的是___________。
(4)上述表示方法中属于结构式的为___________;属于键线式的为___________;
13.请填写下表。
物质名称 甲醇 苯酚 甲醛 乙醛 甲酸 乙酸乙酯
状态 (常温、常压) _________ _________ _________ _________ _________ _________
水溶性 _________ _________ _________ _________ _________ _________
14.回答下列问题:
(1)根据核磁共振氢谱图可以确定有机物分子中氢原子的种类和相对数目。
①下列分子中,其核磁共振氢谱中只有一组峰的物质是_______(填字母)。
A. B. C. D.
②化合物A和B的分子式都是,A的核磁共振氢谱如下图所示,则A的结构简式为_______,请预测B的核磁共振氢谱上有_______组峰。
③若用核磁共振氢谱来研究的结构,请简要说明根据核磁共振氢谱的结果来确定分子结构的方法是_______。
(2)有机物C常用于食品行业。已知9.0gC在足量中充分燃烧,将所得的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为。
①C分子的质谱图如图所示,从图中可知其相对分子质量是_______,则C的分子式是_______。
②C能与溶液发生反应生成,C一定含有的官能团名称是_______。
③C分子的核磁共振氢谱有4组峰,峰面积之比是1:1:1:3,则C的结构简式是_______。
④0.1molC与足量Na反应,在标准状况下产生的体积是_______L。
三、计算题
15.现有一些只含C、H、O三种元素的有机物,它们燃烧时消耗的O2和生成的CO2的体积比是3:4。
(1)这些有机物中,相对分子质量最小的化合物的分子式是_______________。
(2)某两种碳原子数相同的上述有机物,若它们的相对分子质量分别为a和b(a
四、实验题
16.某化学兴趣小组设计实验制备苯甲酸异丙酯,其反应原理为
+十H2O。
用如图所示装置进行实验:
物质的部分物理性质如表所示:
物质 相对分子质量 密度/ g·cm-3 沸点/°C 水溶性
苯甲酸 122 1.27 249 微溶
异丙醇 60 0.79 82 易溶
苯甲酸异丙酯 164 1.17 218 不溶
实验步骤:
步骤I.在干燥的仪器a中加入38.1 g苯甲酸、30 mL异丙醇和15 mL浓硫酸,再加入几粒沸石;
步骤II.加热至70 °C左右,保持恒温半小时;
步骤III.将仪器a中液体进行如下所示操作得到粗产品;
步骤IV.将粗产品用图乙所示装置进行精制。
试回答下列问题:
(1)步骤I中加入三种试剂的先后顺序一定错误的是_ (填字母)。
A.异丙醇、苯甲酸、浓硫酸
B.异丙醇、浓硫酸、苯甲酸
C.浓硫酸、异丙醇、苯甲酸
(2)图乙中仪器b的名称为_。 加入的苯甲酸和异丙醇中,需过量的是异丙醇,目的是___________。
(3)本实验一般采用的加热方式为___________,因为温度过高会影响产率。
(4)操作I的分离方法名称为___________,其中第二次水洗的目的是___________,操作II中加入无水硫酸镁的作用为___________。
(5)如果得到的苯甲酸异丙酯的质量为38.360g,则该实验的产率为___________%(结果保留2位有效数字)。
五、有机推断题
17.丙烯是基本的有机化工原料,由丙烯经如下步骤可合成N-异丙基丙烯酰胺,其可用于合成随温度变化的药物控制释放材料。
丙烯,
(1)丙烯的结构简式为_______。
(2)反应I的反应类型为_______。
(3)反应II_______(填“能”或“不能”)用酸性溶液作为氧化剂,理由是_______。
(4)检验生成的B中是否含有A的方法是_______;若含有A,写出A参与反应的化学方程式:_______。
(5)M与A互为同系物,相对分子质量比A大14,写出M所有可能的结构:_______(不考虑立体异构)。
(6)反应III的另一种反应物的键线式为_______。
六、元素或物质推断题
18.物质M可用作调味剂、乳化剂、抗氧化增效剂、吸湿剂、pH调节剂、增香剂、缓冲剂。其结构式如图所示,其组成元素X、Y、Z、Q为原子序数依次增大的短周期主族元素,且Y的一种核素常用于检测文物的年代。
请回答下列问题:
(1)元素Q在周期表中的位置为_______,工业上采用_______法治炼Q的单质。
(2)物质M中所含化学键的类型为_______,物质M与稀硫酸反应生成有机物N,N中所含官能团的名称为_______。
(3)相同条件下,等质量的Y的两种单质、分别在足量中燃烧,放出热量前者大于后者。则两种单质中,_______(填“”或“”)更稳定。Y与Z分别形成的简单氢化物的沸点由高到低的顺序为_______(填化学式)。
(4)QX的电子式为_______,与水反应的化学方程式为_______。
七、工业流程题
19.青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯,可溶于甲醇、乙醇、乙醚、石油醚,几乎不溶于水中,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知乙醚的沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____。操作II的名称是____。操作III的主要过程可能是____(填序号)。
a.加水溶解,蒸发浓缩、冷却结晶
b.加95%的乙醇,浓缩、结晶、过滤
c.加入乙醚,进行萃取分液
(2)用下列实验装置测定青蒿素分子式的方法如图:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再点燃酒精灯充分反应,精确测定装置E和F实验前后的质量,根据所测数据计算。
①装置E中盛放的物质是____,装置F中盛放的物质是____。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是____。
③用合理改进后的装置进行实验,称得:
装置 实验前/g 实验后/g
E 22.6 42.4
F 80.2 146.2
则测得的青蒿素的最简式是_____。
(3)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____(填序号)具有相似的性质。
a.乙醇 b.乙酸 c.乙酸乙酯 d.葡萄糖
(4)某科研小组经多次提取青蒿素实验,认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响。
由图可知控制其他实验条件不变,最佳原料粒度、提取时间和提取温度为_____(填序号)。
a.80目、100min、50℃ b.60目、120min、50℃ c.60目、120min、55℃
(5)在青蒿素发现、提取和合成研究之后,相继开发出其衍生物:二氢青蒿素、青蒿琥酯钠等。该类衍生物与青蒿素相比,具有____的优点,可显著提高疗效。
八、原理综合题
20.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平。请回答下列问题:
(1)乙烯的结构简式为_______。
(2)鉴别甲烷和乙烯的试剂是_______(填字母)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是_______(填字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)若以乙烯为主要原料合成乙酸,其合成路线如图所示。
乙烯(A)CH3CH2OHCH3CHO乙酸(B)
则反应①的反应类型为_______,反应①的化学方程式为_______。
参考答案:
1.B
2.C
3.C
4.A
5.A
6.D
7.B
8.D
9.D
10.D
11. CH2=CH2+Br2→CH2BrCH2Br 碳碳双键、羧基 加成反应 取代反应(酯化反应) 或 nCH2=CH-COOC2H5
12.(1)
(2)2,2-二甲基戊烷
(3) ⑦ ③
(4) ②⑥⑧
13. 液态 固态 气态 液态 液态 液态 易溶 可溶 易溶 易溶 易溶 不溶
14.(1) AD 2 通过其核磁共振氢谱中峰的数目可以判断:有3组峰时,分子结构为;有1组峰时,分子结构为
(2) 90 羧基 CH3CH(OH)COOH 2.24
15. C2H2O2 18 210 C6H10O8
16.(1)C
(2) 蒸馏烧瓶 有利于酯化反应向正反应方向进行,提高苯甲酸的转化率
(3)水浴加热
(4) 分液 除去残留的碳酸钠 除去残留的水
(5)75
17.(1)
(2)氧化反应
(3) 不能 酸性溶液会将碳碳双键氧化
(4) 取适量生成的B先与一定量的溶液充分混合,再与适量新制氢氧化铜共热,若产生砖红色沉淀,说明含有A,否则不含
(5)、、
(6)
18. 第三周期第ⅠA族 电解 离子键、共价键 羟基、羧基
19.(1) 增大青蒿与乙醚的接触面积,提高青蒿素的浸取率 蒸馏 b
(2) CaCl2或P2O5 碱石灰 在装置F后连接一个装有碱石灰的球形干燥管,以防止空气中的CO2和水蒸气进入F装置 C15H22O5
(3)c
(4)b
(5)水溶性好
20. CH2=CH2 BD ACD 加成反应 CH2=CH2+H2OCH3CH2OH
