第3章物质的性质与转化测试题(含答案)高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第3章物质的性质与转化测试题(含答案)高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-10 06:56:21 | ||
图片预览


文档简介
第3章《物质的性质与转化》测试题
一、单选题(共13题)
1.下列有关实验的操作正确的是
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有0刻度:它们使用时均需水洗后再润洗
B.为观察条在气体中的燃烧,在一个底部铺有少量沙子的集气瓶中收集满气体,取一小段除去表面氧化膜的条用坩埚钳夹持伸入集气瓶中燃烧
C.检验某溶液是否含有时,应取少量该溶液,依次加入溶液和稀硝酸
D.用干燥且洁净的玻璃棒蘸取溶液,滴到放在桌面的试纸上测值
2.下列关于SO2的性质用途叙述错误的是
A.SO2不能用作食品添加剂
B.SO2可用于杀菌消毒
C.SO2能使品红褪色
D.工业上常用SO2来漂白纸浆、毛、丝等
3.是一种常见的化肥,其溶解度随着温度的升高而增大,某工厂用石膏、、和制备的工艺流程如图:
下列说法正确的是
A.通入和的顺序可以互换
B.操作2为将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可得
C.步骤②中反应的离子方程式为
D.通入的和均应过量,且工艺流程中可循环利用
4.下列关于铁及其化合物的说法正确的是
A.红热的铁能与水蒸气反应,生成和
B.在空气中充分灼烧得到FeO
C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速转化成红棕色粉末
D.过量铁与氯气或者稀盐酸反应均可制得
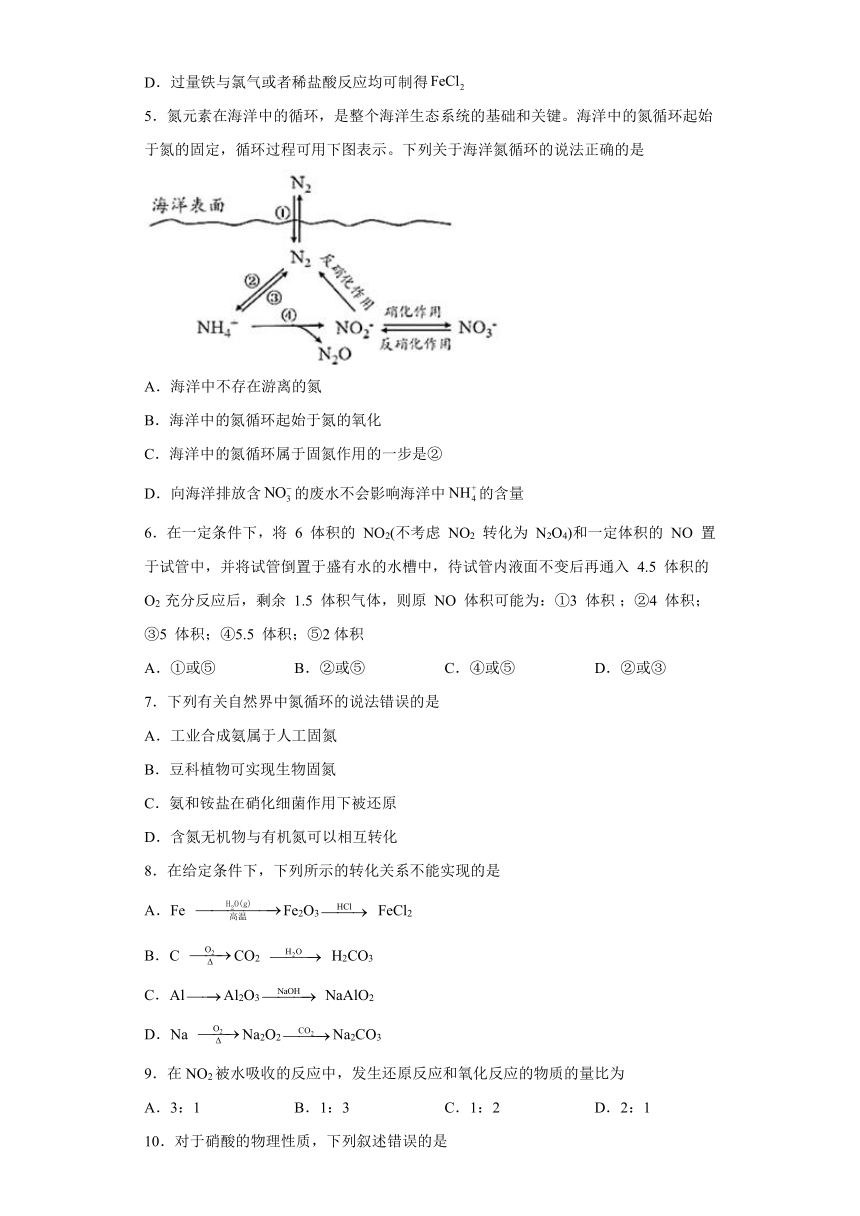
5.氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中的氮循环起始于氮的固定,循环过程可用下图表示。下列关于海洋氮循环的说法正确的是
A.海洋中不存在游离的氮
B.海洋中的氮循环起始于氮的氧化
C.海洋中的氮循环属于固氮作用的一步是②
D.向海洋排放含的废水不会影响海洋中的含量
6.在一定条件下,将 6 体积的 NO2(不考虑 NO2 转化为 N2O4)和一定体积的 NO 置于试管中,并将试管倒置于盛有水的水槽中,待试管内液面不变后再通入 4.5 体积的 O2 充分反应后,剩余 1.5 体积气体,则原 NO 体积可能为:①3 体积 ;②4 体积;③5 体积;④5.5 体积;⑤2体积
A.①或⑤ B.②或⑤ C.④或⑤ D.②或③
7.下列有关自然界中氮循环的说法错误的是
A.工业合成氨属于人工固氮
B.豆科植物可实现生物固氮
C.氨和铵盐在硝化细菌作用下被还原
D.含氮无机物与有机氮可以相互转化
8.在给定条件下,下列所示的转化关系不能实现的是
A.Fe Fe2O3 FeCl2
B.C CO2 H2CO3
C.AlAl2O3 NaAlO2
D.Na Na2O2Na2CO3
9.在NO2被水吸收的反应中,发生还原反应和氧化反应的物质的量比为
A.3:1 B.1:3 C.1:2 D.2:1
10.对于硝酸的物理性质,下列叙述错误的是
A.可以与水以任意比互溶 B.不易挥发
C.有刺激性气味 D.无色液体
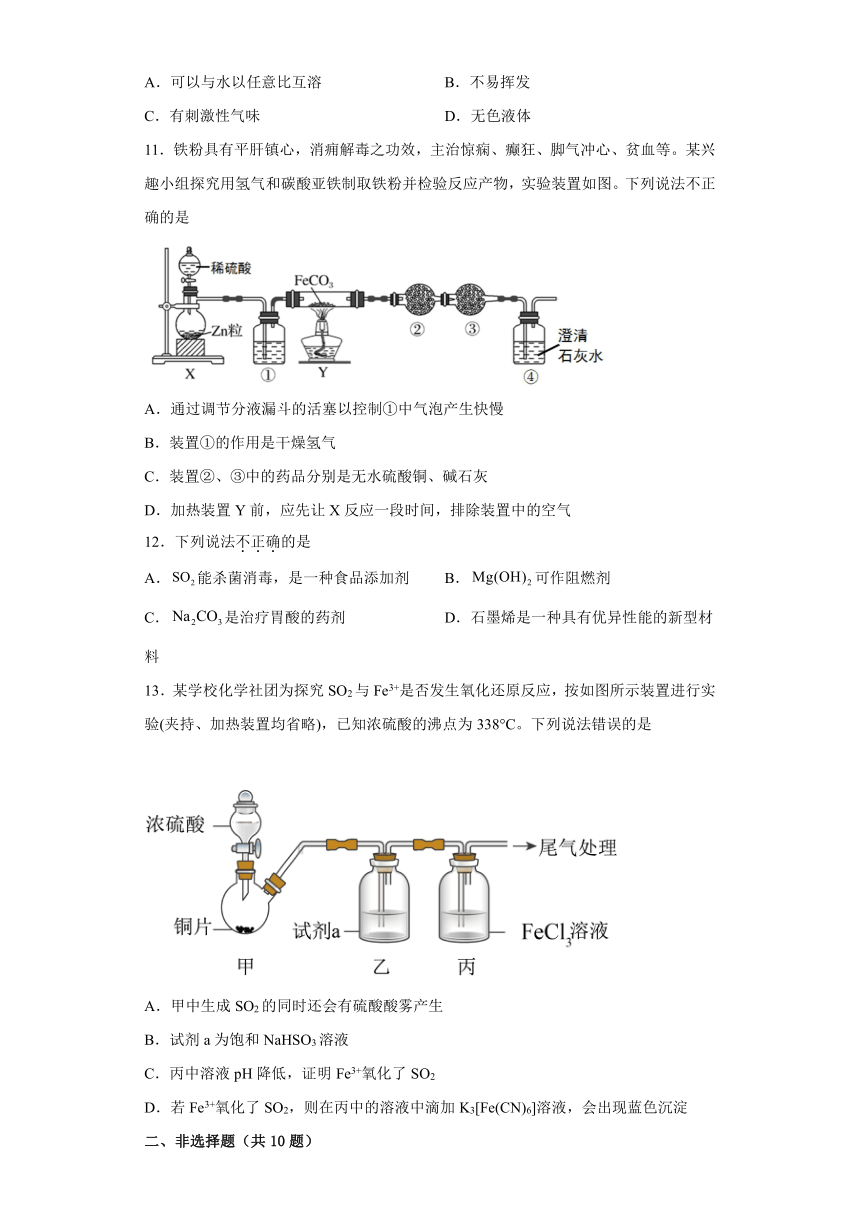
11.铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法不正确的是
A.通过调节分液漏斗的活塞以控制①中气泡产生快慢
B.装置①的作用是干燥氢气
C.装置②、③中的药品分别是无水硫酸铜、碱石灰
D.加热装置Y前,应先让X反应一段时间,排除装置中的空气
12.下列说法不正确的是
A.能杀菌消毒,是一种食品添加剂 B.可作阻燃剂
C.是治疗胃酸的药剂 D.石墨烯是一种具有优异性能的新型材料
13.某学校化学社团为探究SO2与Fe3+是否发生氧化还原反应,按如图所示装置进行实验(夹持、加热装置均省略),已知浓硫酸的沸点为338°C。下列说法错误的是
A.甲中生成SO2的同时还会有硫酸酸雾产生
B.试剂a为饱和NaHSO3溶液
C.丙中溶液pH降低,证明Fe3+氧化了SO2
D.若Fe3+氧化了SO2,则在丙中的溶液中滴加K3[Fe(CN)6]溶液,会出现蓝色沉淀
二、非选择题(共10题)
14.工业上用NH3做原料,制取硝酸,要经过三步主要反应,请写出第二步和第三步反应的化学方程式。
第一步反应:4NH3+5O2 4NO+6H2O
第二步反应:_____________________;
第三步反应:____________________。
15.金属及非金属在高中化学中占有重要地位。
(1)为了验证某溶液中含有而不含有,正确的方法是 ______(填字母)。
A.直接滴加溶液
B.先通入足量氯气,再滴入溶液
C.先滴入溶液,再通入氯气
D.先加入足量铁粉,充分振荡后再滴加溶液
(2)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,原因是 ______(用化学方程式表示)。
(3)如图所示,将氯气依次通过盛有干燥有色布条、潮湿有色布条的广口瓶可观察到的现象是_____ ,说明起漂白性的物质是 _____(填化学式)。
(4)无水易升华,可用作有机合成的催化剂等。工业上由铝土矿(、)为原料制备无水的工艺流程如图。
①氯化炉中,、和C反应中的氧化产物是 ______(填化学式)。
②用溶液可除去冷却器排出尾气中的,此反应的离子方程式为_________。
③流程中需要向升华器内加入少量Al,其作用是 ________。
16.某研究小组通过以下方法测定某铁矿石样品(主要成分为)中铁元素的质量分数:取20.0g铁矿石样品,粉碎后加入足量盐酸,充分反应后过滤,向滤液中加入足量氢氧化钠溶液,过滤、洗涤,将所得的沉淀灼烧,冷却后称得固体质量为16.0g。请根据以上信息计算该铁矿石样品中铁元素的质量分数___________。(假设杂质不与盐酸反应)
17.某磁黄铁矿的主要成分是FexS(S为=-2价),磁黄铁矿中既含有二价铁又含有三价铁。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应),生成1.6g硫单质、0.45molFeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。请计算并回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+(二价铁)与Fe3+(三价铁)的物质的量之比为_______。
(2)该磁黄铁矿FexS中,x=_______。
18.将40g铁粉放入600g稀硝酸中,若两者恰好完全反应,且稀硝酸被还原成NO,求:稀硝酸的质量分数___。
19.如图所示,此装置可用来制取和观察Fe(OH)2在空气中被被氧化的颜色变化。实验时必须使用铁屑和6mol L-1的硫酸,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是__。A中反应的离子方程式是__。
(2)实验开始时先将活塞a__(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:__。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为__。
(5)下列各图示中,___能较长时间看到Fe(OH)2白色沉淀。(填序号)
20.I:铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境。为使实验的设计符合绿色化学的思想,某兴趣小组设计出如图所示装置来改进“铜与硝酸反应”的实验。
(1)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是___________,再由a向c中加2 mL蒸馏水,c中有关气体的实验现象是___________。
(2)表中是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是___________,理由是___________。
方案 反应物
甲 Cu、浓硝酸
乙 Cu、稀硝酸
丙 Cu、O2、稀硝酸
I II
II:探究NO2、O2混合气体的喷泉实验。|
(3) G装置中浓硫酸有三种作用:①___________;②混合NO2、O2气体;③观察气泡的速率,控制混合气体的比例。
(4)将G装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体全部被吸收,则所得溶液物质的量浓度为___________mol/ L (保留两位有效数字)
21.中学化学中几种常见物质的转化关系如下:
将饱和D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)A、B、H的化学式:A___________;B___________;H___________。
(2)A元素在元素周期表中的位置为:___________;红褐色胶体中F粒子直径大小的范围:___________。
(3)①Na2O2的电子式:___________;NH3极易溶于水的原因:___________。
②写出C的酸性溶液与双氧水反应的离子方程式:___________。
(4)写出鉴定E中阳离子的实验方法和现象:___________。
22.A、B、C、D四种物质之间的转化关系如图所示(部分产物略去),根据所学知识回答下列问题:
(1)若A为NaAlO2溶液,写出A与过量B反应的离子方程式____。
(2)若A为Fe,B为稀HNO3,则反应①(还原产物为NO)中氧化剂与还原剂的物质的量之比为____,稀硝酸在反应过程中除了起氧化剂的作用外,还有____的作用。
(3)若A为Cl2,B为NH3,当NH3过量时,则二者相遇有白烟生成,写出反应①的化学方程式:_____。
(4)若A为1L0.1mol·L-1NaOH溶液,B为SO2,当向A中通入0.07molSO2气体时,溶液中的溶质为_____(填化学式,下同)、____,物质的量分别为____、___。
23.已知A为常见的金属单质,根据如图所示的关系,请回答下列问题。
(1)写出下列物质的化学式A:_______、B:_______、C:_______、F:_______。
(2)写出反应③的离子方程式:_______。
(3)写出反应⑧的化学方程式:_______。
(4)若由D→C加入的为铁粉,写出反应⑤的离子方程式:_______。
(5)检验D中金属阳离子操作方法是_______。
参考答案:
1.B 2.A 3.B 4.A 5.C 6.C 7.C 8.A 9.C 10.B 11.C 12.C
13.C
14. 2NO+O2 =2NO2 3NO2+H2O =2HNO3+NO
15. C SiO2+2NaOH= Na2SiO3+H2O 褪色 HClO CO Cl2+2OH-=Cl-+ClO-+H2O 除去FeCl3
16.56.0%
17.(1)7:2
(2)0.9
18.20%~30%
19. 铁屑 Fe+2H+=Fe2++H2↑ 打开 关闭活塞a,使FeSO4溶液压入B瓶中进行反应 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ①②③⑤
20. Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 气体颜色变浅 丙 制取等量的硝酸铜时,丙方案消耗的硝酸最少,且不会产生污染性气体 干燥NO2、O2 0.036mol·L-1
21.(1) Fe FeS H2SO4
(2) 第四周期第VIII族 1 nm-100 nm
(3) NH3可以与水形成氢键 2Fe2++H2O2+2H+═2Fe3++2H2O
(4)取少量E于试管中,用胶头滴管加入NaOH浓溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝。
22.(1)AlO+4H+==Al3++2H2O
(2) 1∶1 酸
(3)3Cl2+8NH3==N2+6NH4Cl
(4) Na2SO3(或NaHSO3) NaHSO3(或Na2SO3) 0.03mol(或0.04mol) 0.04mol(或0.03mol)
23.(1) Fe Fe3O4 FeCl2 Fe(OH)3
(2)Fe3O4+8H+=Fe2++2Fe3++4H2O
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)2Fe3++Fe=3Fe2+
(5)取少量溶液于试管中,加入少量硫氰化钾溶液,若溶液为血红色,证明有铁离子
一、单选题(共13题)
1.下列有关实验的操作正确的是
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有0刻度:它们使用时均需水洗后再润洗
B.为观察条在气体中的燃烧,在一个底部铺有少量沙子的集气瓶中收集满气体,取一小段除去表面氧化膜的条用坩埚钳夹持伸入集气瓶中燃烧
C.检验某溶液是否含有时,应取少量该溶液,依次加入溶液和稀硝酸
D.用干燥且洁净的玻璃棒蘸取溶液,滴到放在桌面的试纸上测值
2.下列关于SO2的性质用途叙述错误的是
A.SO2不能用作食品添加剂
B.SO2可用于杀菌消毒
C.SO2能使品红褪色
D.工业上常用SO2来漂白纸浆、毛、丝等
3.是一种常见的化肥,其溶解度随着温度的升高而增大,某工厂用石膏、、和制备的工艺流程如图:
下列说法正确的是
A.通入和的顺序可以互换
B.操作2为将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可得
C.步骤②中反应的离子方程式为
D.通入的和均应过量,且工艺流程中可循环利用
4.下列关于铁及其化合物的说法正确的是
A.红热的铁能与水蒸气反应,生成和
B.在空气中充分灼烧得到FeO
C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速转化成红棕色粉末
D.过量铁与氯气或者稀盐酸反应均可制得
5.氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中的氮循环起始于氮的固定,循环过程可用下图表示。下列关于海洋氮循环的说法正确的是
A.海洋中不存在游离的氮
B.海洋中的氮循环起始于氮的氧化
C.海洋中的氮循环属于固氮作用的一步是②
D.向海洋排放含的废水不会影响海洋中的含量
6.在一定条件下,将 6 体积的 NO2(不考虑 NO2 转化为 N2O4)和一定体积的 NO 置于试管中,并将试管倒置于盛有水的水槽中,待试管内液面不变后再通入 4.5 体积的 O2 充分反应后,剩余 1.5 体积气体,则原 NO 体积可能为:①3 体积 ;②4 体积;③5 体积;④5.5 体积;⑤2体积
A.①或⑤ B.②或⑤ C.④或⑤ D.②或③
7.下列有关自然界中氮循环的说法错误的是
A.工业合成氨属于人工固氮
B.豆科植物可实现生物固氮
C.氨和铵盐在硝化细菌作用下被还原
D.含氮无机物与有机氮可以相互转化
8.在给定条件下,下列所示的转化关系不能实现的是
A.Fe Fe2O3 FeCl2
B.C CO2 H2CO3
C.AlAl2O3 NaAlO2
D.Na Na2O2Na2CO3
9.在NO2被水吸收的反应中,发生还原反应和氧化反应的物质的量比为
A.3:1 B.1:3 C.1:2 D.2:1
10.对于硝酸的物理性质,下列叙述错误的是
A.可以与水以任意比互溶 B.不易挥发
C.有刺激性气味 D.无色液体
11.铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法不正确的是
A.通过调节分液漏斗的活塞以控制①中气泡产生快慢
B.装置①的作用是干燥氢气
C.装置②、③中的药品分别是无水硫酸铜、碱石灰
D.加热装置Y前,应先让X反应一段时间,排除装置中的空气
12.下列说法不正确的是
A.能杀菌消毒,是一种食品添加剂 B.可作阻燃剂
C.是治疗胃酸的药剂 D.石墨烯是一种具有优异性能的新型材料
13.某学校化学社团为探究SO2与Fe3+是否发生氧化还原反应,按如图所示装置进行实验(夹持、加热装置均省略),已知浓硫酸的沸点为338°C。下列说法错误的是
A.甲中生成SO2的同时还会有硫酸酸雾产生
B.试剂a为饱和NaHSO3溶液
C.丙中溶液pH降低,证明Fe3+氧化了SO2
D.若Fe3+氧化了SO2,则在丙中的溶液中滴加K3[Fe(CN)6]溶液,会出现蓝色沉淀
二、非选择题(共10题)
14.工业上用NH3做原料,制取硝酸,要经过三步主要反应,请写出第二步和第三步反应的化学方程式。
第一步反应:4NH3+5O2 4NO+6H2O
第二步反应:_____________________;
第三步反应:____________________。
15.金属及非金属在高中化学中占有重要地位。
(1)为了验证某溶液中含有而不含有,正确的方法是 ______(填字母)。
A.直接滴加溶液
B.先通入足量氯气,再滴入溶液
C.先滴入溶液,再通入氯气
D.先加入足量铁粉,充分振荡后再滴加溶液
(2)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,原因是 ______(用化学方程式表示)。
(3)如图所示,将氯气依次通过盛有干燥有色布条、潮湿有色布条的广口瓶可观察到的现象是_____ ,说明起漂白性的物质是 _____(填化学式)。
(4)无水易升华,可用作有机合成的催化剂等。工业上由铝土矿(、)为原料制备无水的工艺流程如图。
①氯化炉中,、和C反应中的氧化产物是 ______(填化学式)。
②用溶液可除去冷却器排出尾气中的,此反应的离子方程式为_________。
③流程中需要向升华器内加入少量Al,其作用是 ________。
16.某研究小组通过以下方法测定某铁矿石样品(主要成分为)中铁元素的质量分数:取20.0g铁矿石样品,粉碎后加入足量盐酸,充分反应后过滤,向滤液中加入足量氢氧化钠溶液,过滤、洗涤,将所得的沉淀灼烧,冷却后称得固体质量为16.0g。请根据以上信息计算该铁矿石样品中铁元素的质量分数___________。(假设杂质不与盐酸反应)
17.某磁黄铁矿的主要成分是FexS(S为=-2价),磁黄铁矿中既含有二价铁又含有三价铁。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应),生成1.6g硫单质、0.45molFeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。请计算并回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+(二价铁)与Fe3+(三价铁)的物质的量之比为_______。
(2)该磁黄铁矿FexS中,x=_______。
18.将40g铁粉放入600g稀硝酸中,若两者恰好完全反应,且稀硝酸被还原成NO,求:稀硝酸的质量分数___。
19.如图所示,此装置可用来制取和观察Fe(OH)2在空气中被被氧化的颜色变化。实验时必须使用铁屑和6mol L-1的硫酸,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是__。A中反应的离子方程式是__。
(2)实验开始时先将活塞a__(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:__。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为__。
(5)下列各图示中,___能较长时间看到Fe(OH)2白色沉淀。(填序号)
20.I:铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境。为使实验的设计符合绿色化学的思想,某兴趣小组设计出如图所示装置来改进“铜与硝酸反应”的实验。
(1)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是___________,再由a向c中加2 mL蒸馏水,c中有关气体的实验现象是___________。
(2)表中是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是___________,理由是___________。
方案 反应物
甲 Cu、浓硝酸
乙 Cu、稀硝酸
丙 Cu、O2、稀硝酸
I II
II:探究NO2、O2混合气体的喷泉实验。|
(3) G装置中浓硫酸有三种作用:①___________;②混合NO2、O2气体;③观察气泡的速率,控制混合气体的比例。
(4)将G装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体全部被吸收,则所得溶液物质的量浓度为___________mol/ L (保留两位有效数字)
21.中学化学中几种常见物质的转化关系如下:
将饱和D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)A、B、H的化学式:A___________;B___________;H___________。
(2)A元素在元素周期表中的位置为:___________;红褐色胶体中F粒子直径大小的范围:___________。
(3)①Na2O2的电子式:___________;NH3极易溶于水的原因:___________。
②写出C的酸性溶液与双氧水反应的离子方程式:___________。
(4)写出鉴定E中阳离子的实验方法和现象:___________。
22.A、B、C、D四种物质之间的转化关系如图所示(部分产物略去),根据所学知识回答下列问题:
(1)若A为NaAlO2溶液,写出A与过量B反应的离子方程式____。
(2)若A为Fe,B为稀HNO3,则反应①(还原产物为NO)中氧化剂与还原剂的物质的量之比为____,稀硝酸在反应过程中除了起氧化剂的作用外,还有____的作用。
(3)若A为Cl2,B为NH3,当NH3过量时,则二者相遇有白烟生成,写出反应①的化学方程式:_____。
(4)若A为1L0.1mol·L-1NaOH溶液,B为SO2,当向A中通入0.07molSO2气体时,溶液中的溶质为_____(填化学式,下同)、____,物质的量分别为____、___。
23.已知A为常见的金属单质,根据如图所示的关系,请回答下列问题。
(1)写出下列物质的化学式A:_______、B:_______、C:_______、F:_______。
(2)写出反应③的离子方程式:_______。
(3)写出反应⑧的化学方程式:_______。
(4)若由D→C加入的为铁粉,写出反应⑤的离子方程式:_______。
(5)检验D中金属阳离子操作方法是_______。
参考答案:
1.B 2.A 3.B 4.A 5.C 6.C 7.C 8.A 9.C 10.B 11.C 12.C
13.C
14. 2NO+O2 =2NO2 3NO2+H2O =2HNO3+NO
15. C SiO2+2NaOH= Na2SiO3+H2O 褪色 HClO CO Cl2+2OH-=Cl-+ClO-+H2O 除去FeCl3
16.56.0%
17.(1)7:2
(2)0.9
18.20%~30%
19. 铁屑 Fe+2H+=Fe2++H2↑ 打开 关闭活塞a,使FeSO4溶液压入B瓶中进行反应 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ①②③⑤
20. Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 气体颜色变浅 丙 制取等量的硝酸铜时,丙方案消耗的硝酸最少,且不会产生污染性气体 干燥NO2、O2 0.036mol·L-1
21.(1) Fe FeS H2SO4
(2) 第四周期第VIII族 1 nm-100 nm
(3) NH3可以与水形成氢键 2Fe2++H2O2+2H+═2Fe3++2H2O
(4)取少量E于试管中,用胶头滴管加入NaOH浓溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝。
22.(1)AlO+4H+==Al3++2H2O
(2) 1∶1 酸
(3)3Cl2+8NH3==N2+6NH4Cl
(4) Na2SO3(或NaHSO3) NaHSO3(或Na2SO3) 0.03mol(或0.04mol) 0.04mol(或0.03mol)
23.(1) Fe Fe3O4 FeCl2 Fe(OH)3
(2)Fe3O4+8H+=Fe2++2Fe3++4H2O
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)2Fe3++Fe=3Fe2+
(5)取少量溶液于试管中,加入少量硫氰化钾溶液,若溶液为血红色,证明有铁离子
