第二节化学计量在化学实验中的应用(1)
文档属性
| 名称 | 第二节化学计量在化学实验中的应用(1) |  | |
| 格式 | zip | ||
| 文件大小 | 21.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-09-17 12:45:04 | ||
图片预览





文档简介
课件16张PPT。第一章
从实验学化学第二节
化学计量在化学实验中的应用
(1)一、物质的量的单位——摩尔 1、物质的量 概念:是用来解决宏观物质和微观粒子之间关系问题的表示含有一定数目粒子的集体的物理量。a、是七个国际基本物理量之一
b、是一个专有名词,由固定字数组成,不能分割、不能增减。
c、符号为“n”
d、微粒是指:分子、原子、离子、中子、电子等
e、粒子必须十分明确,且用化学式表示2、摩尔
(1)概念:是物质的量的单位,简称摩。
(2)符号:mol
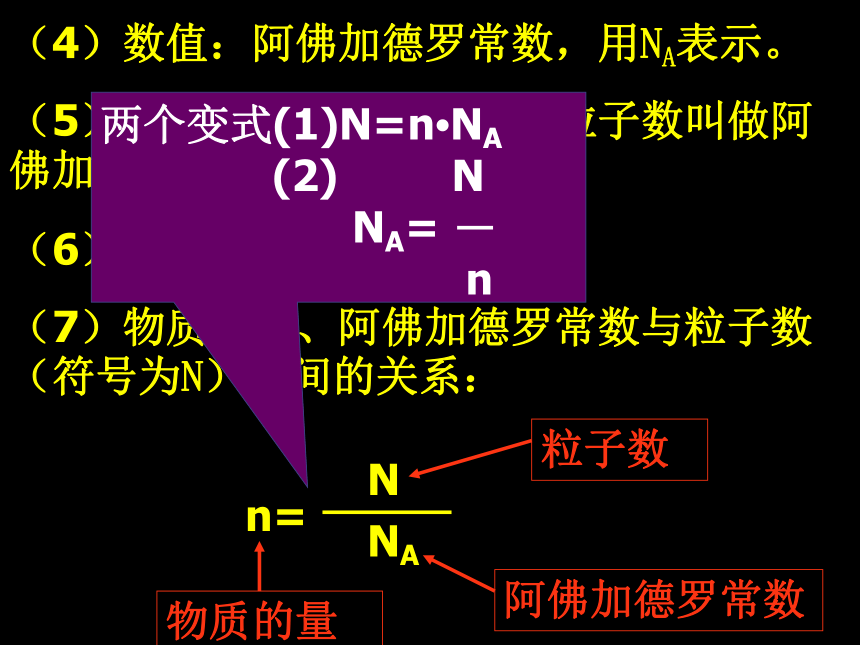
(3)基准:每摩尔物质中含有6.02×1023个微粒阿伏加德罗常数(课本)阿伏加德罗常数(原意):以12g 12C中所含的原子数目为标准的,也就是说,如果在一定量的粒子集体中所含有的粒子数与12g 12C中所含的碳原子数目相同,则它的物质的量为1mol,而这个数值(粒子数)就叫阿伏加德罗常数(4)数值:阿佛加德罗常数,用NA表示。
(5)规定:1mol任何粒子的粒子数叫做阿佛加德罗常数。
(6)近似值:6.02?1023
(7)物质的量、阿佛加德罗常数与粒子数(符号为N)之间的关系:思考:已知:一个碳原子的质量为 1.993 × 10-23g
求: 12g 碳-12 中所含的碳原子数?解:判断下列说法是否正确
(A)1 摩尔氧
(B)1 摩尔氧原子
(C)2 摩尔分子氢
(D)3 摩尔 水
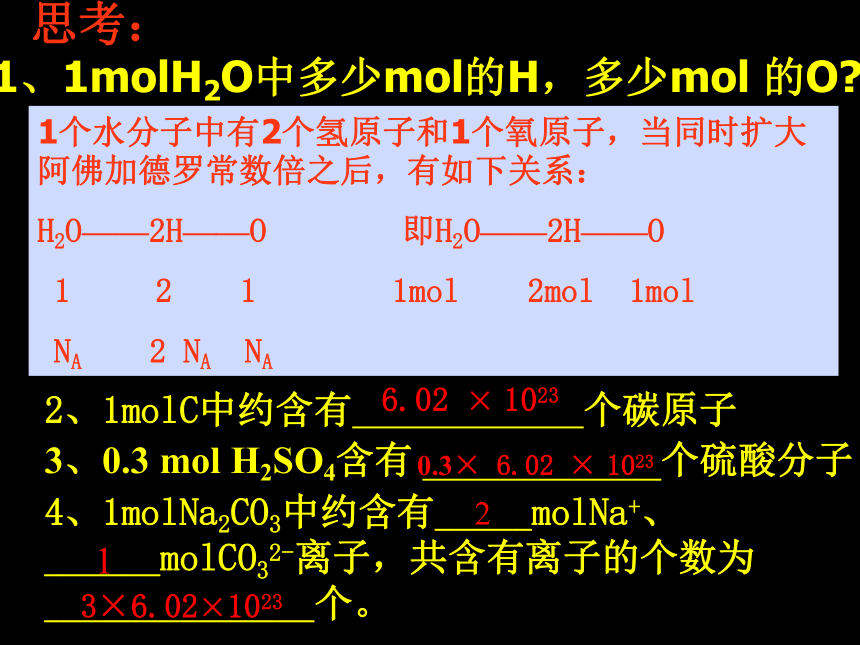
(E)0.5 摩 二氧化碳思考: 错误,必须指明微粒的种类,是氧原子、氧分子还是氧离子正确 1mol O错误,2mol H2正确 3mol H2O正确 0.5mol CO2 思考:2、1molC中约含有 个碳原子3、0.3 mol H2SO4含有 个硫酸分子4、1molNa2CO3中约含有_____molNa+、______molCO32-离子,共含有离子的个数为______________个。6.02 × 1023 0.3× 6.02 × 1023213×6.02×10231、1molH2O中多少mol的H,多少mol 的O?1个水分子中有2个氢原子和1个氧原子,当同时扩大阿佛加德罗常数倍之后,有如下关系:
H2O——2H——O 即H2O——2H——O
1 2 1 1mol 2mol 1mol
NA 2 NA NA 课堂练习: 1、0.5molNa2SO4含有 mol
Na+; molSO42-;含 个O。
2、0.1molNH4+中含有 个N,含有 个H.10.51.204 × 10246.02 × 10222.408 × 10231mol物质的质量到底有多大?NANANANANANA1256981823173、分析以上计算结果可得出什么规律?(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。结论:1mol任何微粒或物质的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。课堂练习:填空:
(1)1molCu质量是 克
(2)1molO2质量是 克
(3) 1molCO2质量是 克
(4) 1molCl-质量是 克
(5) 1molNa+质量是 克
(6) 1molNaCl质量 克64324435.52358.5二、摩尔质量
(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。
(2)符号:M
(3)单位:g/mol或kg/mol
(4)数值:等于物质或粒子的式量
(5)物质的量(n)、物质的质量(m)和摩尔质量(M)之间的关系:
n(mol)=m(g)M(g/mol)注意:(6)物质的量、摩尔质量、物质的质量;阿伏加得罗常数、 6.02X1023等之间的区别。课堂练习(1)O2的摩尔质量是多少?
(2)H2SO4的摩尔质量是多少?
(3)100molH2O的质量是多少克?
(4)0.1molOH-的质量是多少克?课堂练习1、24.5gH2SO4的物质的量是多少?
2、71gNa2SO4中含有Na+和SO42-的物质的量各是多少?3、含有1.5X1022个分子的物质,其质量为0.7g,求该物质的相对分子质量。
4、0.2gKClO3中所含的Cl原子数与多少克CaCl2中所含的Cl-离子个数相等?5、一定条件下,16gA和22gB恰好反应生成C和4.5gD,在相同条件下8gA和15gB反应可生成D和0.125molC,则C的式量是多少?作业: 仔细阅读课本有关内容,注意概念及解题规范。
从实验学化学第二节
化学计量在化学实验中的应用
(1)一、物质的量的单位——摩尔 1、物质的量 概念:是用来解决宏观物质和微观粒子之间关系问题的表示含有一定数目粒子的集体的物理量。a、是七个国际基本物理量之一
b、是一个专有名词,由固定字数组成,不能分割、不能增减。
c、符号为“n”
d、微粒是指:分子、原子、离子、中子、电子等
e、粒子必须十分明确,且用化学式表示2、摩尔
(1)概念:是物质的量的单位,简称摩。
(2)符号:mol
(3)基准:每摩尔物质中含有6.02×1023个微粒阿伏加德罗常数(课本)阿伏加德罗常数(原意):以12g 12C中所含的原子数目为标准的,也就是说,如果在一定量的粒子集体中所含有的粒子数与12g 12C中所含的碳原子数目相同,则它的物质的量为1mol,而这个数值(粒子数)就叫阿伏加德罗常数(4)数值:阿佛加德罗常数,用NA表示。
(5)规定:1mol任何粒子的粒子数叫做阿佛加德罗常数。
(6)近似值:6.02?1023
(7)物质的量、阿佛加德罗常数与粒子数(符号为N)之间的关系:思考:已知:一个碳原子的质量为 1.993 × 10-23g
求: 12g 碳-12 中所含的碳原子数?解:判断下列说法是否正确
(A)1 摩尔氧
(B)1 摩尔氧原子
(C)2 摩尔分子氢
(D)3 摩尔 水
(E)0.5 摩 二氧化碳思考: 错误,必须指明微粒的种类,是氧原子、氧分子还是氧离子正确 1mol O错误,2mol H2正确 3mol H2O正确 0.5mol CO2 思考:2、1molC中约含有 个碳原子3、0.3 mol H2SO4含有 个硫酸分子4、1molNa2CO3中约含有_____molNa+、______molCO32-离子,共含有离子的个数为______________个。6.02 × 1023 0.3× 6.02 × 1023213×6.02×10231、1molH2O中多少mol的H,多少mol 的O?1个水分子中有2个氢原子和1个氧原子,当同时扩大阿佛加德罗常数倍之后,有如下关系:
H2O——2H——O 即H2O——2H——O
1 2 1 1mol 2mol 1mol
NA 2 NA NA 课堂练习: 1、0.5molNa2SO4含有 mol
Na+; molSO42-;含 个O。
2、0.1molNH4+中含有 个N,含有 个H.10.51.204 × 10246.02 × 10222.408 × 10231mol物质的质量到底有多大?NANANANANANA1256981823173、分析以上计算结果可得出什么规律?(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。结论:1mol任何微粒或物质的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。课堂练习:填空:
(1)1molCu质量是 克
(2)1molO2质量是 克
(3) 1molCO2质量是 克
(4) 1molCl-质量是 克
(5) 1molNa+质量是 克
(6) 1molNaCl质量 克64324435.52358.5二、摩尔质量
(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。
(2)符号:M
(3)单位:g/mol或kg/mol
(4)数值:等于物质或粒子的式量
(5)物质的量(n)、物质的质量(m)和摩尔质量(M)之间的关系:
n(mol)=m(g)M(g/mol)注意:(6)物质的量、摩尔质量、物质的质量;阿伏加得罗常数、 6.02X1023等之间的区别。课堂练习(1)O2的摩尔质量是多少?
(2)H2SO4的摩尔质量是多少?
(3)100molH2O的质量是多少克?
(4)0.1molOH-的质量是多少克?课堂练习1、24.5gH2SO4的物质的量是多少?
2、71gNa2SO4中含有Na+和SO42-的物质的量各是多少?3、含有1.5X1022个分子的物质,其质量为0.7g,求该物质的相对分子质量。
4、0.2gKClO3中所含的Cl原子数与多少克CaCl2中所含的Cl-离子个数相等?5、一定条件下,16gA和22gB恰好反应生成C和4.5gD,在相同条件下8gA和15gB反应可生成D和0.125molC,则C的式量是多少?作业: 仔细阅读课本有关内容,注意概念及解题规范。
