吉林省长春市新解放学校2022-2023学年高一下学期6月期中考试化学试题(含答案)
文档属性
| 名称 | 吉林省长春市新解放学校2022-2023学年高一下学期6月期中考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 257.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-10 20:07:30 | ||
图片预览


文档简介
新解放学校2022-2023学年高一下学期6月期中考试
化学
考试时间:60分钟 卷面分数:100分
可能用到的相对原子质量为:H 1 C 12 N14 O 16 Al 27 Fe 56
一、单项选择题(每题3分,15小题共45分)
1. 下列反应中属于氮的固定的是( )
A.N2+3H22NH3
B.2NO+O2=2NO2
C.4NH3+5O2=4NO+6H2O
D.NH3+H2O+CO2=NH4HCO3
2.化学与生产生活密切相关,下列说法正确的是( )
A.太阳能光催化技术可以将二氧化碳转化为燃料,该燃料属于一次能源
B.75%酒精可用于杀死新冠病毒,如果用90%酒精效果更好
C.二氧化硫具有氧化性,因此可作食品的漂白剂
D.氮气的化学性质稳定,因此可用作食品的保鲜剂
3.下列有关硅及其化合物的说法正确的是( )
A.Si用途广泛,是太阳能电池和光导纤维的主要成分
B.不能用磨口玻璃塞的试剂瓶盛装碱性溶液
C.SiO2属于酸性氧化物,因此SiO2不与任何酸发生反应
D.水泥、玻璃、陶瓷、水晶饰物都是硅酸盐制品
4.如图所示,烧杯甲中盛有少量液态冰醋酸,烧杯乙中盛有NH4Cl晶体,在烧杯乙中再加入适量氢氧化钡晶体[Ba(OH)2·8H2O],搅拌,可观察到冰醋酸逐渐凝结为固体。下列有关判断正确的是( )
A.NH4Cl与Ba(OH)2·8H2O的反应是放热反应
B.反应物的总能量高于生成物的总能量
C.反应中有热能转化为产物内部的能量
D.反应中断裂的化学键只有离子键
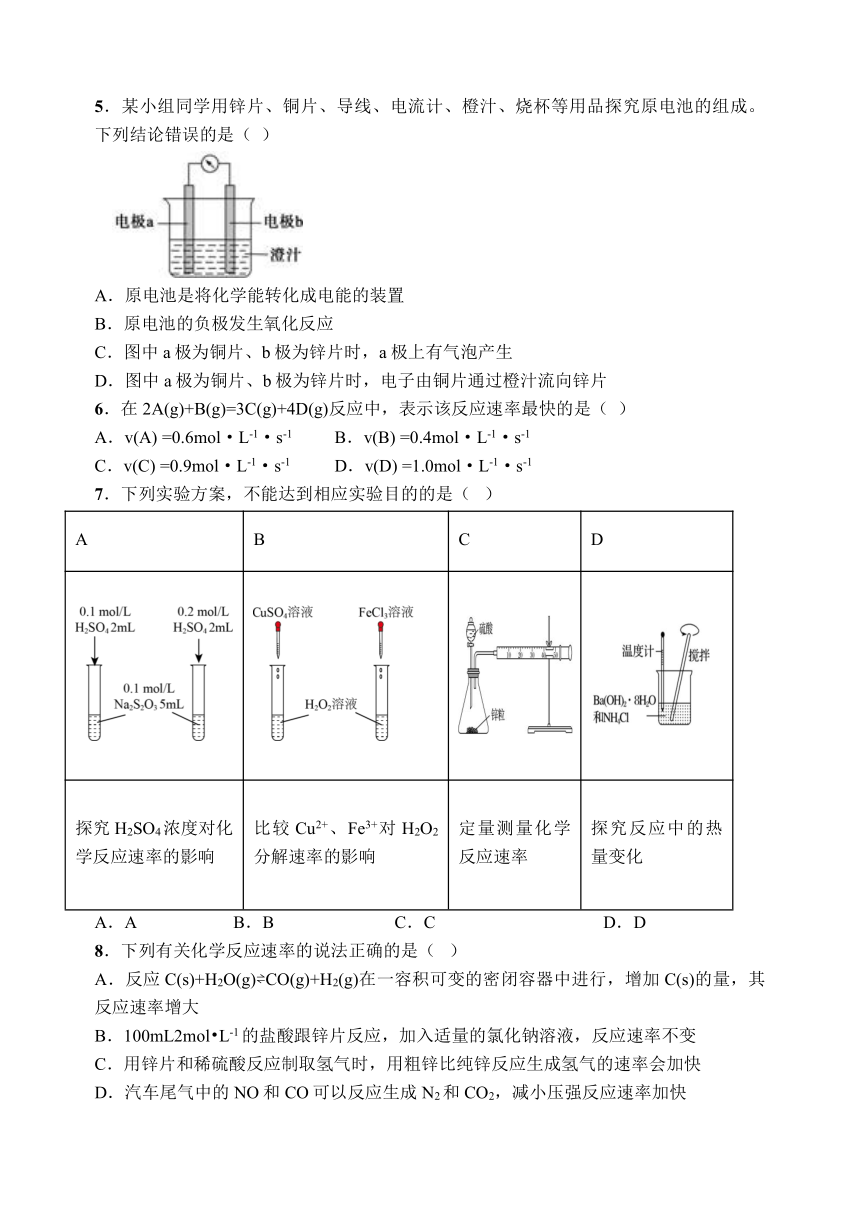
5.某小组同学用锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是( )
A.原电池是将化学能转化成电能的装置
B.原电池的负极发生氧化反应
C.图中a极为铜片、b极为锌片时,a极上有气泡产生
D.图中a极为铜片、b极为锌片时,电子由铜片通过橙汁流向锌片
6.在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A) =0.6mol·L-1·s-1 B.v(B) =0.4mol·L-1·s-1
C.v(C) =0.9mol·L-1·s-1 D.v(D) =1.0mol·L-1·s-1
7.下列实验方案,不能达到相应实验目的的是( )
A B C D
探究H2SO4浓度对化学反应速率的影响 比较Cu2+、Fe3+对H2O2分解速率的影响 定量测量化学反应速率 探究反应中的热量变化
A.A B.B C.C D.D
8.下列有关化学反应速率的说法正确的是( )
A.反应C(s)+H2O(g) CO(g)+H2(g)在一容积可变的密闭容器中进行,增加C(s)的量,其反应速率增大
B.100mL2mol L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.用锌片和稀硫酸反应制取氢气时,用粗锌比纯锌反应生成氢气的速率会加快
D.汽车尾气中的NO和CO可以反应生成N2和CO2,减小压强反应速率加快
9.在一定温度下的恒容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内 A、C、D 三种气体的浓度之比为 2∶1∶1
⑤单位时间内生成 n mol C,同时生成 n mol D
⑥单位时间内生成 n mol D,同时生成 2n mol A
A.①②⑤ B.②③⑤ C.②③⑥ D.①③⑥
10.下列说法正确的是( )
A.乙烯的结构简式为CH2CH2
B.甲烷和乙烯互称为同系物
C.和互称为同分异构体
D.乙醇能与Na反应产生H2是因为分子中—OH可电离出H+而显酸性
11.我国本土药学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理学或医学奖。已知二羟甲戊酸()是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法不正确的是( )
A.能与乙醇发生酯化反应
B.不能发生加成反应,但能发生取代反应
C.能与氢氧化钠发生反应
D.标准状况下1 mol该有机物可以与足量金属钠反应产生22.4 L H2
12.乙醇、乙酸分子中的各种化学键如图所示,下列反应中断键的位置错误的是
A.乙醇与金属钠反应,断裂①键
B.乙酸与乙醇发生酯化反应,断裂②键、a键
C.乙醇在铜催化共热下与O2反应,断裂①③键
D.乙酸变成乙酸酐的反应2CH3COOH→(CH3CO)2O+H2O,断裂a、b键
13.下列反应中,属于加成反应的是( )
A.CH3CH=CH2+Br2CH3CHBrCH2Br
B.CH3CH2OHCH2=CH2↑+H2O
C.CH3COOH+CH3OHCH3COOCH3+H2O
D.+HNO3+H2O
14.中学化学实验可用如图所示的装置制取乙酸乙酯,下列说法正确的是( )
A.反应混合液的加入顺序依次为浓硫酸、乙醇、冰乙酸
B.浓硫酸不仅可以加快该反应的速率,还能提高该反应的产率
C.右侧长导管起到了冷凝回流的作用,应深入液面下
D.饱和碳酸钠溶液可用氢氧化钠溶液代替
15.根据乙烯和乙酸的性质推测,丙烯酸(CH2=CH—COOH)可能发生的反应有( )
①加成反应 ②取代反应 ③酯化反应 ④中和反应 ⑤氧化反应
A.①②③ B.①③④ C.①③④⑤ D.全部
二、非选择题(共3题,55分)
16.(14分)某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质(夹持装置已略去)。
(1)试管①中反应的化学方程式是 ;浓硫酸表现出了____性和____性。
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是 ;
若试管②中的试剂为新制氯水则对应的离子方程式为 。
(3)试管③中的试剂为NaOH溶液,其作用是 ,反应的化学方程式是 。
17.(21分)氢气是理想的能源,可由天然气和水反应制备,其主要反应为,反应过程中能量变化如图所示:
(1)该反应是_______(填“吸热”或“放热”)反应。
(2)某温度下,在10L恒容密闭容器中充入2mol和3mol制备氢气,反应中的物质的量变化如图所示,5min时反应达到平衡状态。
①5min前,该反应的正反应速率_______(填“大于”、“小于”或“等于”)逆反应速率,逆反应速率不断_______(填“增大”或“减小”)。
②下列能说明该反应已达到化学平衡状态的是_______(填字母)。
a.容器内混合气体的密度不再发生变化
b.容器内气体原子总数不再发生变化
c.混合气体的平均相对分子质量不再发生变化
d.单位时间内,4molC-H键断裂的同时有2molC=O键断裂
③0~5min内,以的浓度变化表示该反应的平均速率为_______
④若要加快化学反应速率,可采用的方法是___(填“升高”或“降低”)温度。
(3)某同学依据氧化还原反应:设计的原电池如图所示:
①负极的材料是___________,发生的电极反应式为 ;
②外电路中的电子是从___________电极流向___________电极。(写出电极材料的名称)
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移的电子数目是___________。(阿伏伽德罗常数为NA)
18.(20分)来自石油的有机化工原料A是一个国家化工生产水平标志,可以发生如下转化:
已知:B、D都是生活中常见有机物,E是具果香味的有机物,F是一种高分子化合物。请回答下列问题。
B分子中的官能团名称是 ;D分子中的官能团名称是____ __;
A分子中的官能团名称是 ;E分子式为 。
(2)反应②的化学方程式为 ,该反应属于__ ___反应。(填有机反应类型,下同)
(3)反应③的化学方程式为 ,该反应属于 ____反应。
(4)反应④的化学方程式为 ,该反应属于 反应。
高一期中化学考试答案
一选择题(每题3分,共45分)
1.A 2.D 3.B 4.C 5.D 6.B 7.B 8.C 9.C 10.C
11.D 12.B 13.A 14.B 15.D
二.填空题
16.每空2分
(1) Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (物质全对给1分)
氧化 、 酸
(2) 品红溶液褪色 、 Cl2+SO2+2H2O=4H++SO+2Cl-
(3) 吸收尾气防污染 、 SO2+2NaOH=Na2SO3+H2O
17.第(1)为1分其余每空2分
(1)吸热(1分)
(2) ① 大于 、增大 ② cd ③ 0.096 ④ 升高
(3)① 铜 (或者Cu) 、 ② 铜 、 银 ③ 0.05NA(或)
18.(每空2分)
(1) 羟基 、 羧基 、 碳碳双键 、 C4H8O2
(2) 2CH3CH2OH + O2 → 2CH3CHO + 2H2O (Cu 做催化剂 加热) 、氧化
(3) CH3COOH+C2H5OHCH3COOC2H5+H2O 、 取代(或酯化)
(4) nCH2=CH2 、 加聚(或聚合)
化学
考试时间:60分钟 卷面分数:100分
可能用到的相对原子质量为:H 1 C 12 N14 O 16 Al 27 Fe 56
一、单项选择题(每题3分,15小题共45分)
1. 下列反应中属于氮的固定的是( )
A.N2+3H22NH3
B.2NO+O2=2NO2
C.4NH3+5O2=4NO+6H2O
D.NH3+H2O+CO2=NH4HCO3
2.化学与生产生活密切相关,下列说法正确的是( )
A.太阳能光催化技术可以将二氧化碳转化为燃料,该燃料属于一次能源
B.75%酒精可用于杀死新冠病毒,如果用90%酒精效果更好
C.二氧化硫具有氧化性,因此可作食品的漂白剂
D.氮气的化学性质稳定,因此可用作食品的保鲜剂
3.下列有关硅及其化合物的说法正确的是( )
A.Si用途广泛,是太阳能电池和光导纤维的主要成分
B.不能用磨口玻璃塞的试剂瓶盛装碱性溶液
C.SiO2属于酸性氧化物,因此SiO2不与任何酸发生反应
D.水泥、玻璃、陶瓷、水晶饰物都是硅酸盐制品
4.如图所示,烧杯甲中盛有少量液态冰醋酸,烧杯乙中盛有NH4Cl晶体,在烧杯乙中再加入适量氢氧化钡晶体[Ba(OH)2·8H2O],搅拌,可观察到冰醋酸逐渐凝结为固体。下列有关判断正确的是( )
A.NH4Cl与Ba(OH)2·8H2O的反应是放热反应
B.反应物的总能量高于生成物的总能量
C.反应中有热能转化为产物内部的能量
D.反应中断裂的化学键只有离子键
5.某小组同学用锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是( )
A.原电池是将化学能转化成电能的装置
B.原电池的负极发生氧化反应
C.图中a极为铜片、b极为锌片时,a极上有气泡产生
D.图中a极为铜片、b极为锌片时,电子由铜片通过橙汁流向锌片
6.在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A) =0.6mol·L-1·s-1 B.v(B) =0.4mol·L-1·s-1
C.v(C) =0.9mol·L-1·s-1 D.v(D) =1.0mol·L-1·s-1
7.下列实验方案,不能达到相应实验目的的是( )
A B C D
探究H2SO4浓度对化学反应速率的影响 比较Cu2+、Fe3+对H2O2分解速率的影响 定量测量化学反应速率 探究反应中的热量变化
A.A B.B C.C D.D
8.下列有关化学反应速率的说法正确的是( )
A.反应C(s)+H2O(g) CO(g)+H2(g)在一容积可变的密闭容器中进行,增加C(s)的量,其反应速率增大
B.100mL2mol L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.用锌片和稀硫酸反应制取氢气时,用粗锌比纯锌反应生成氢气的速率会加快
D.汽车尾气中的NO和CO可以反应生成N2和CO2,减小压强反应速率加快
9.在一定温度下的恒容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内 A、C、D 三种气体的浓度之比为 2∶1∶1
⑤单位时间内生成 n mol C,同时生成 n mol D
⑥单位时间内生成 n mol D,同时生成 2n mol A
A.①②⑤ B.②③⑤ C.②③⑥ D.①③⑥
10.下列说法正确的是( )
A.乙烯的结构简式为CH2CH2
B.甲烷和乙烯互称为同系物
C.和互称为同分异构体
D.乙醇能与Na反应产生H2是因为分子中—OH可电离出H+而显酸性
11.我国本土药学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理学或医学奖。已知二羟甲戊酸()是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法不正确的是( )
A.能与乙醇发生酯化反应
B.不能发生加成反应,但能发生取代反应
C.能与氢氧化钠发生反应
D.标准状况下1 mol该有机物可以与足量金属钠反应产生22.4 L H2
12.乙醇、乙酸分子中的各种化学键如图所示,下列反应中断键的位置错误的是
A.乙醇与金属钠反应,断裂①键
B.乙酸与乙醇发生酯化反应,断裂②键、a键
C.乙醇在铜催化共热下与O2反应,断裂①③键
D.乙酸变成乙酸酐的反应2CH3COOH→(CH3CO)2O+H2O,断裂a、b键
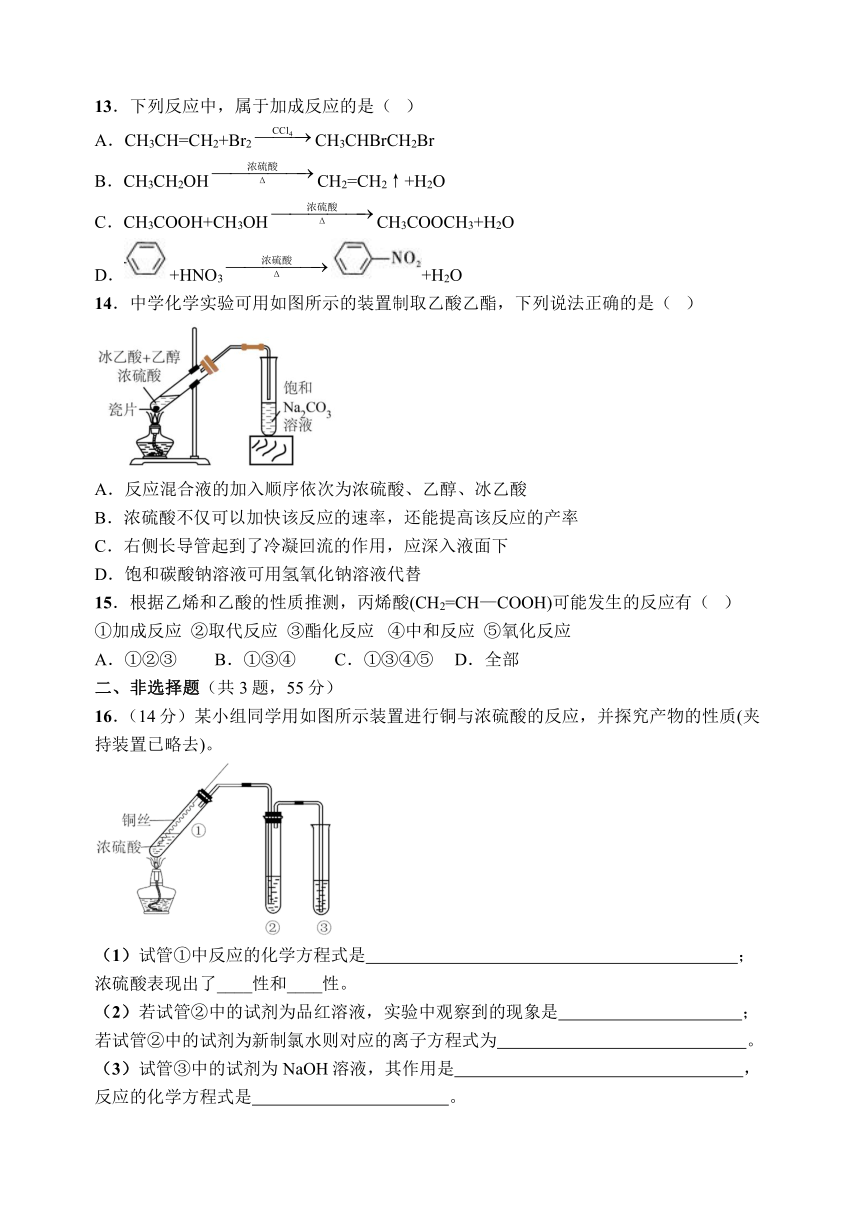
13.下列反应中,属于加成反应的是( )
A.CH3CH=CH2+Br2CH3CHBrCH2Br
B.CH3CH2OHCH2=CH2↑+H2O
C.CH3COOH+CH3OHCH3COOCH3+H2O
D.+HNO3+H2O
14.中学化学实验可用如图所示的装置制取乙酸乙酯,下列说法正确的是( )
A.反应混合液的加入顺序依次为浓硫酸、乙醇、冰乙酸
B.浓硫酸不仅可以加快该反应的速率,还能提高该反应的产率
C.右侧长导管起到了冷凝回流的作用,应深入液面下
D.饱和碳酸钠溶液可用氢氧化钠溶液代替
15.根据乙烯和乙酸的性质推测,丙烯酸(CH2=CH—COOH)可能发生的反应有( )
①加成反应 ②取代反应 ③酯化反应 ④中和反应 ⑤氧化反应
A.①②③ B.①③④ C.①③④⑤ D.全部
二、非选择题(共3题,55分)
16.(14分)某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质(夹持装置已略去)。
(1)试管①中反应的化学方程式是 ;浓硫酸表现出了____性和____性。
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是 ;
若试管②中的试剂为新制氯水则对应的离子方程式为 。
(3)试管③中的试剂为NaOH溶液,其作用是 ,反应的化学方程式是 。
17.(21分)氢气是理想的能源,可由天然气和水反应制备,其主要反应为,反应过程中能量变化如图所示:
(1)该反应是_______(填“吸热”或“放热”)反应。
(2)某温度下,在10L恒容密闭容器中充入2mol和3mol制备氢气,反应中的物质的量变化如图所示,5min时反应达到平衡状态。
①5min前,该反应的正反应速率_______(填“大于”、“小于”或“等于”)逆反应速率,逆反应速率不断_______(填“增大”或“减小”)。
②下列能说明该反应已达到化学平衡状态的是_______(填字母)。
a.容器内混合气体的密度不再发生变化
b.容器内气体原子总数不再发生变化
c.混合气体的平均相对分子质量不再发生变化
d.单位时间内,4molC-H键断裂的同时有2molC=O键断裂
③0~5min内,以的浓度变化表示该反应的平均速率为_______
④若要加快化学反应速率,可采用的方法是___(填“升高”或“降低”)温度。
(3)某同学依据氧化还原反应:设计的原电池如图所示:
①负极的材料是___________,发生的电极反应式为 ;
②外电路中的电子是从___________电极流向___________电极。(写出电极材料的名称)
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移的电子数目是___________。(阿伏伽德罗常数为NA)
18.(20分)来自石油的有机化工原料A是一个国家化工生产水平标志,可以发生如下转化:
已知:B、D都是生活中常见有机物,E是具果香味的有机物,F是一种高分子化合物。请回答下列问题。
B分子中的官能团名称是 ;D分子中的官能团名称是____ __;
A分子中的官能团名称是 ;E分子式为 。
(2)反应②的化学方程式为 ,该反应属于__ ___反应。(填有机反应类型,下同)
(3)反应③的化学方程式为 ,该反应属于 ____反应。
(4)反应④的化学方程式为 ,该反应属于 反应。
高一期中化学考试答案
一选择题(每题3分,共45分)
1.A 2.D 3.B 4.C 5.D 6.B 7.B 8.C 9.C 10.C
11.D 12.B 13.A 14.B 15.D
二.填空题
16.每空2分
(1) Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (物质全对给1分)
氧化 、 酸
(2) 品红溶液褪色 、 Cl2+SO2+2H2O=4H++SO+2Cl-
(3) 吸收尾气防污染 、 SO2+2NaOH=Na2SO3+H2O
17.第(1)为1分其余每空2分
(1)吸热(1分)
(2) ① 大于 、增大 ② cd ③ 0.096 ④ 升高
(3)① 铜 (或者Cu) 、 ② 铜 、 银 ③ 0.05NA(或)
18.(每空2分)
(1) 羟基 、 羧基 、 碳碳双键 、 C4H8O2
(2) 2CH3CH2OH + O2 → 2CH3CHO + 2H2O (Cu 做催化剂 加热) 、氧化
(3) CH3COOH+C2H5OHCH3COOC2H5+H2O 、 取代(或酯化)
(4) nCH2=CH2 、 加聚(或聚合)
同课章节目录
