2023年中考化学复习(四)溶 液课件(共30张PPT)
文档属性
| 名称 | 2023年中考化学复习(四)溶 液课件(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 572.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-10 21:49:49 | ||
图片预览










文档简介
(共30张PPT)
(四)溶 液
1. (2022 衡阳)下列关于溶液的说法正确的是( A )
A. 溶液是具有均一性、稳定性的混合物
B. 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
C. 打开汽水瓶盖后有气泡冒出,主要是因为温度升高,气体的溶解度减小
D. 溶液都是无色透明的液体
A
【解析】A. 溶液是由溶质和溶剂混合而成的均一、稳定的混合物,符合题意。B. 饱和溶液不一定是浓溶液,如常温下,氢氧化钙的饱和溶液是稀溶液,不饱和溶液不一定是稀溶液,不符合题意。C. 打开汽水瓶盖后有气泡冒出,主要是因为压强减小,气体的溶解度减小,不符合题意。D. 溶液是透明的,但是不一定是无色的,如硫酸铜溶液是蓝色的,不符合题意。故选A。
2. (2022·东莞市校级一模)将20 g KCl固体投入到盛有50 g水的烧杯中,搅拌,测得0 ℃、20 ℃、40 ℃、60 ℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。下列说法不正确的是( D )
A. A点溶液达到了饱和状态
B. 20 ℃时,KCl的溶解度为34 g
C. 溶质质量分数的比较:C > B > A
D. D点溶液降低到40 ℃时,有KCl晶体析出
D
【解析】D点溶液降低到40 ℃时,溶液的质量还为70 g,不会有KCl晶体析出。故选D。
3. (2022·岳阳)已知A、B、C三种物质的溶解度随温度的变化情况如图所示。现将a g A、b g B、c g C分别在10 ℃、20 ℃、30 ℃时加入到100 g水中,下列分析正确的是( D )
A. a、b、c 三点表示的溶液均为饱和溶液
B. 三种溶液中溶质质量分数最大的是A
C. c 点恰好形成无色、均一、稳定的溶液
D. 升温至30 ℃时,三种溶液的溶质质量分数关系为A = C > B
D
【解析】A. 溶解度曲线上的点表示恰好饱和溶液,溶解度曲线上方的点表示饱和溶液且有未溶解的溶质,溶解度曲线下方的点表示不饱和溶液,故a、c两点表示饱和溶液,b点表示不饱和溶液,错误。B. 由图象可知:b < a = c,10 ℃时a g A不能全部溶于100 g水中,30 ℃时c g C恰好溶于100 g水中,20 ℃时b g B完全溶解在100 g水中,故三种溶液中溶质质量分数最大的是C,错误。C. c点形成的是恰好饱和溶液,溶液是均一、稳定的混合物,但不一定是无色的,与是否饱和无关,错误。
D.升温至30 ℃时,A的溶解度大于a g,a g A能够完全溶解在100 g水中, C的溶解度等于c g,c g C能完全溶解在100 g水中,B的溶解度大于b g,b g B也能完全溶解在100 g水中;等量的溶剂中,溶质越多溶质质量分数越大,由图象可知a = c > b,故升温至 30 ℃时,三种溶液的溶质质量分数关系为A = C > B,正确。故选D。
做题技法:饱和溶液温度发生变化后溶液的溶质质量分数的判断方法比较不同物质饱和溶液温度发生变化后溶液的溶质质量分数,可利用“溶解度增大平行走(溶质质量分数不变)、溶解度减小沿线走(变成另一温度时的饱和溶液)快速判断得出结论。
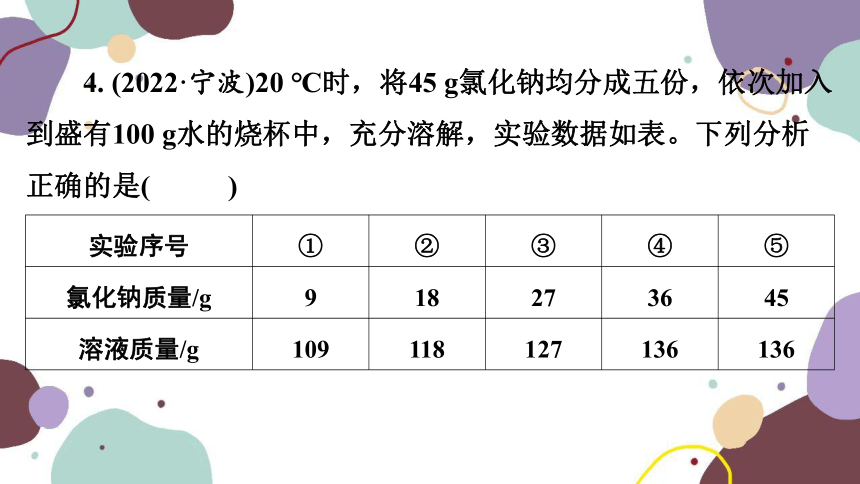
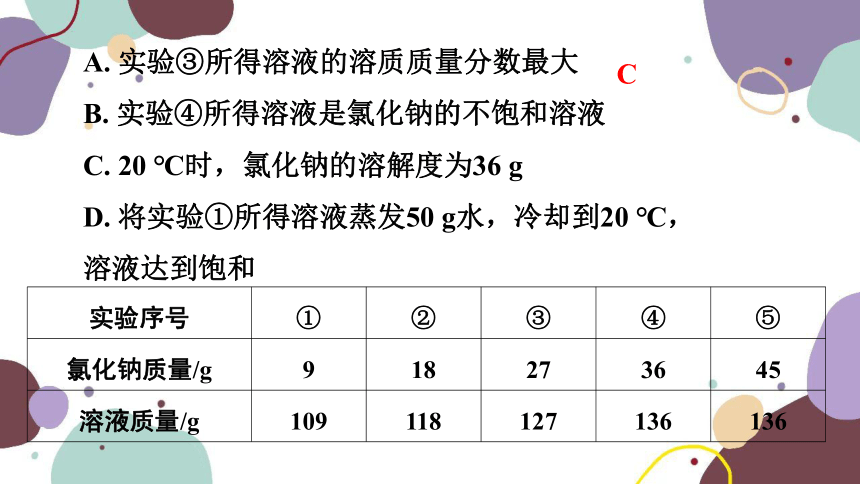
4. (2022·宁波)20 ℃时,将45 g氯化钠均分成五份,依次加入到盛有100 g水的烧杯中,充分溶解,实验数据如表。下列分析正确的是( C )
实验序号 ① ② ③ ④ ⑤
氯化钠质量/g 9 18 27 36 45
溶液质量/g 109 118 127 136 136
A. 实验③所得溶液的溶质质量分数最大
B. 实验④所得溶液是氯化钠的不饱和溶液
C. 20 ℃时,氯化钠的溶解度为36 g
D. 将实验①所得溶液蒸发50 g水,冷却到20 ℃,溶液达到饱和
C
实验序号 ① ② ③ ④ ⑤
氯化钠质量/g 9 18 27 36 45
溶液质量/g 109 118 127 136 136
【解析】由表格中的数据可知,20 ℃时,100 g水中最多能溶解氯化钠的质量为36 g,则实验③所得溶液的溶质质量分数并不是最大,而是实验④和⑤中溶质质量分数最大,故A错误,C正确;由实验④和⑤可知,该温度下的100 g水中最多能溶解36 g氯化钠,因此实验④所得溶液是20 ℃时氯化钠的饱和溶液,故B错误;因为20 ℃时,氯化钠的溶解度为36 g,则该温度下的50 g水中最多能溶解18 g氯化钠,因此将实验①所得溶液蒸发50 g水,冷却到20 ℃,溶液为不饱和溶液,故D错误。故选C。
5. (2022·澄城县二模)2022年3月23日,“天宫课堂”第二课在中国空间站开讲。航天员王亚平演示了太空“冰雪”实验:从一个装有过饱和乙酸钠溶液的袋子中缓缓挤出一个圆圆的液体球,随后用沾有晶体粉末的小棍触碰一下,液体球迅速“结冰”,成为一个通体洁白的“冰球”悬浮在空中,但摸上去却是温热的。液体球“结冰”实际是溶液中析出了晶体。溶液结晶过程中,下列有关溶液的判断正确的是( A )
A
A. 溶质一定减少
B. 溶质质量分数一定减小
C. 温度一定降低
D. 溶剂一定减少
【解析】B. 若原溶液是饱和溶液,采用的是恒温蒸发溶剂的方法,溶液中有晶体析出,所得溶液仍为该温度下的饱和溶液,溶质质量分数不变,故选项说法错误。C. 液体球迅速“结冰”,成为一个通体洁白的“冰球”悬浮在空中,但摸上去却是温热的,则温度不一定降低,故选项说法错误。D. 溶液结晶过程中,溶剂不一定减少,若采用的是降温结晶的方法,溶剂的质量不变,故选项说法错误。故选A。
6. (2022·自贡)用100克溶质质量分数为30%的过氧化氢溶液配制成溶质质量分数为5%的过氧化氢溶液,需加水 500 克。
500
【解析】设需加水的质量为x。100 g × 30% = (100 g + x) × 5%,x = 500 g。
7. 多角度认识溶液,有助于我们更好地了解其在生产生活中的重要作用。
Ⅰ. 溶液的形成:将适量调味品加入水中,充分搅拌后不能形成溶液的是 C (填字母)。
A. 食盐 B. 蔗糖 C. 花生油
C
Ⅱ. 溶液的性质:(1)下列关于溶液的说法正确的是 B (填字母)。
A. 盐酸是纯净物
B. 溶液是均一、稳定的
C. 溶液的酸碱度可用石蕊溶液测定
D. 饱和溶液一定是浓溶液
B
①该物质的溶解度随温度升高而 减小 (填“增大”或“减小”)。
②往溶液乙中加入少量高锰酸钾完全溶解,溶液呈紫红色。据此现象,写出对“饱和溶液”概念的理解 一定温度下,某物质的饱和溶液对于其他物质不一定是饱和的 。
减小
一定温度下,某物质
的饱和溶液对于其他物质不一定是饱和的
(2)常温下,将某固态物质A溶于水中,形成饱和溶液甲(如图1),进行实验。回答下列问题:
(3)常温时,某物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图2所示。
①常温时,该物质的溶解度是 40 g。
②D点时,该溶液的溶质质量分数为 28.6 (精确到0.1%)。
28.6%
40
③将A点状态的溶液变化到C点状态的操作步骤为 常温下,往A状态的溶液中加入20 g溶质和20 g水,使之充分溶解 。
④图中A、B、C三个点中的溶液的溶质质量分数从大到小的顺序是 C > A > B 。
常温下,往A状态的溶液中加入20 g溶质和20 g水,
使之充分溶解
C > A > B
Ⅲ. 溶液的用途:防范新冠疫情,我们除了戴口罩、勤洗手、勤通风外,还用到多种消毒液。
(1)请从微观角度解释:教室进行消杀后室内充满消毒液气味的原因是 分子在不断运动 。
(2)某消毒液稀释后pH = 6,则稀释前其pH < (填“>”“=”或“<”)6。
(3)在疫情期间要学会正确的洗手方法。沾有油污的手,可使用洗洁精清洗,洗洁精的作用是 乳化油污 。
分子在不断运动
<
乳化油污
做题技法:饱和溶液与不饱和溶液的相互转化
8. 某同学配制100 g溶质质量分数为10%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 ②①⑤③④ (填序号),其中操作错误的是 ① (填序号)。
②①⑤③④
①
(2)需称量氯化钠的质量为 10.0 g。
(3)量取水时选用量筒的量程最合适的是 A (填字母),读数时视线要与量筒内液体的凹液面最低处保持水平。
A. 100 mL B. 25 mL
C. 10 mL D. 50 mL
10.0
A
(4)经检测,该同学配制的溶液的溶质质量分数偏小,可能的原因是 AD (填字母)。
A. 氯化钠固体不纯
B. 用生锈的砝码称量
C. 装瓶时有少量溶液洒出
D. 溶解时烧杯内壁有水珠
AD
(5)将溶液配制完成后,取10 g该溶液将其配制成质量分数为4%的溶液,则需要加入水的质量为 15 g。
15
【解析】(2)溶质质量 = 溶液质量 × 溶质质量分数,配制100 g 10%的氯化钠溶液,需称量氯化钠的质量为 100 g × 10% = 10 g。(3)溶剂质量 = 溶液质量 - 溶质质量,所需溶剂的质量为100 g - 10 g = 90 g(合90 mL),应用规格为100 mL的量筒量取水的体积,故选A。(4)A. 氯化钠固体不纯,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。B. 用生锈的砝码称量,会造成实际所取的溶质的质量偏大,则使溶质质量分数偏大。
C. 溶液具有均一性,装瓶时有少量溶液洒出,溶质质量分数不变。D. 溶解时烧杯内壁有水珠,会造成实际水的质量偏大,则使溶质质量分数偏小。故选AD。(5)设需要加入水的质量为x,10 g × 10% = (10 g + x) × 4%,x = 15 g。
(四)溶 液
1. (2022 衡阳)下列关于溶液的说法正确的是( A )
A. 溶液是具有均一性、稳定性的混合物
B. 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
C. 打开汽水瓶盖后有气泡冒出,主要是因为温度升高,气体的溶解度减小
D. 溶液都是无色透明的液体
A
【解析】A. 溶液是由溶质和溶剂混合而成的均一、稳定的混合物,符合题意。B. 饱和溶液不一定是浓溶液,如常温下,氢氧化钙的饱和溶液是稀溶液,不饱和溶液不一定是稀溶液,不符合题意。C. 打开汽水瓶盖后有气泡冒出,主要是因为压强减小,气体的溶解度减小,不符合题意。D. 溶液是透明的,但是不一定是无色的,如硫酸铜溶液是蓝色的,不符合题意。故选A。
2. (2022·东莞市校级一模)将20 g KCl固体投入到盛有50 g水的烧杯中,搅拌,测得0 ℃、20 ℃、40 ℃、60 ℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。下列说法不正确的是( D )
A. A点溶液达到了饱和状态
B. 20 ℃时,KCl的溶解度为34 g
C. 溶质质量分数的比较:C > B > A
D. D点溶液降低到40 ℃时,有KCl晶体析出
D
【解析】D点溶液降低到40 ℃时,溶液的质量还为70 g,不会有KCl晶体析出。故选D。
3. (2022·岳阳)已知A、B、C三种物质的溶解度随温度的变化情况如图所示。现将a g A、b g B、c g C分别在10 ℃、20 ℃、30 ℃时加入到100 g水中,下列分析正确的是( D )
A. a、b、c 三点表示的溶液均为饱和溶液
B. 三种溶液中溶质质量分数最大的是A
C. c 点恰好形成无色、均一、稳定的溶液
D. 升温至30 ℃时,三种溶液的溶质质量分数关系为A = C > B
D
【解析】A. 溶解度曲线上的点表示恰好饱和溶液,溶解度曲线上方的点表示饱和溶液且有未溶解的溶质,溶解度曲线下方的点表示不饱和溶液,故a、c两点表示饱和溶液,b点表示不饱和溶液,错误。B. 由图象可知:b < a = c,10 ℃时a g A不能全部溶于100 g水中,30 ℃时c g C恰好溶于100 g水中,20 ℃时b g B完全溶解在100 g水中,故三种溶液中溶质质量分数最大的是C,错误。C. c点形成的是恰好饱和溶液,溶液是均一、稳定的混合物,但不一定是无色的,与是否饱和无关,错误。
D.升温至30 ℃时,A的溶解度大于a g,a g A能够完全溶解在100 g水中, C的溶解度等于c g,c g C能完全溶解在100 g水中,B的溶解度大于b g,b g B也能完全溶解在100 g水中;等量的溶剂中,溶质越多溶质质量分数越大,由图象可知a = c > b,故升温至 30 ℃时,三种溶液的溶质质量分数关系为A = C > B,正确。故选D。
做题技法:饱和溶液温度发生变化后溶液的溶质质量分数的判断方法比较不同物质饱和溶液温度发生变化后溶液的溶质质量分数,可利用“溶解度增大平行走(溶质质量分数不变)、溶解度减小沿线走(变成另一温度时的饱和溶液)快速判断得出结论。
4. (2022·宁波)20 ℃时,将45 g氯化钠均分成五份,依次加入到盛有100 g水的烧杯中,充分溶解,实验数据如表。下列分析正确的是( C )
实验序号 ① ② ③ ④ ⑤
氯化钠质量/g 9 18 27 36 45
溶液质量/g 109 118 127 136 136
A. 实验③所得溶液的溶质质量分数最大
B. 实验④所得溶液是氯化钠的不饱和溶液
C. 20 ℃时,氯化钠的溶解度为36 g
D. 将实验①所得溶液蒸发50 g水,冷却到20 ℃,溶液达到饱和
C
实验序号 ① ② ③ ④ ⑤
氯化钠质量/g 9 18 27 36 45
溶液质量/g 109 118 127 136 136
【解析】由表格中的数据可知,20 ℃时,100 g水中最多能溶解氯化钠的质量为36 g,则实验③所得溶液的溶质质量分数并不是最大,而是实验④和⑤中溶质质量分数最大,故A错误,C正确;由实验④和⑤可知,该温度下的100 g水中最多能溶解36 g氯化钠,因此实验④所得溶液是20 ℃时氯化钠的饱和溶液,故B错误;因为20 ℃时,氯化钠的溶解度为36 g,则该温度下的50 g水中最多能溶解18 g氯化钠,因此将实验①所得溶液蒸发50 g水,冷却到20 ℃,溶液为不饱和溶液,故D错误。故选C。
5. (2022·澄城县二模)2022年3月23日,“天宫课堂”第二课在中国空间站开讲。航天员王亚平演示了太空“冰雪”实验:从一个装有过饱和乙酸钠溶液的袋子中缓缓挤出一个圆圆的液体球,随后用沾有晶体粉末的小棍触碰一下,液体球迅速“结冰”,成为一个通体洁白的“冰球”悬浮在空中,但摸上去却是温热的。液体球“结冰”实际是溶液中析出了晶体。溶液结晶过程中,下列有关溶液的判断正确的是( A )
A
A. 溶质一定减少
B. 溶质质量分数一定减小
C. 温度一定降低
D. 溶剂一定减少
【解析】B. 若原溶液是饱和溶液,采用的是恒温蒸发溶剂的方法,溶液中有晶体析出,所得溶液仍为该温度下的饱和溶液,溶质质量分数不变,故选项说法错误。C. 液体球迅速“结冰”,成为一个通体洁白的“冰球”悬浮在空中,但摸上去却是温热的,则温度不一定降低,故选项说法错误。D. 溶液结晶过程中,溶剂不一定减少,若采用的是降温结晶的方法,溶剂的质量不变,故选项说法错误。故选A。
6. (2022·自贡)用100克溶质质量分数为30%的过氧化氢溶液配制成溶质质量分数为5%的过氧化氢溶液,需加水 500 克。
500
【解析】设需加水的质量为x。100 g × 30% = (100 g + x) × 5%,x = 500 g。
7. 多角度认识溶液,有助于我们更好地了解其在生产生活中的重要作用。
Ⅰ. 溶液的形成:将适量调味品加入水中,充分搅拌后不能形成溶液的是 C (填字母)。
A. 食盐 B. 蔗糖 C. 花生油
C
Ⅱ. 溶液的性质:(1)下列关于溶液的说法正确的是 B (填字母)。
A. 盐酸是纯净物
B. 溶液是均一、稳定的
C. 溶液的酸碱度可用石蕊溶液测定
D. 饱和溶液一定是浓溶液
B
①该物质的溶解度随温度升高而 减小 (填“增大”或“减小”)。
②往溶液乙中加入少量高锰酸钾完全溶解,溶液呈紫红色。据此现象,写出对“饱和溶液”概念的理解 一定温度下,某物质的饱和溶液对于其他物质不一定是饱和的 。
减小
一定温度下,某物质
的饱和溶液对于其他物质不一定是饱和的
(2)常温下,将某固态物质A溶于水中,形成饱和溶液甲(如图1),进行实验。回答下列问题:
(3)常温时,某物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图2所示。
①常温时,该物质的溶解度是 40 g。
②D点时,该溶液的溶质质量分数为 28.6 (精确到0.1%)。
28.6%
40
③将A点状态的溶液变化到C点状态的操作步骤为 常温下,往A状态的溶液中加入20 g溶质和20 g水,使之充分溶解 。
④图中A、B、C三个点中的溶液的溶质质量分数从大到小的顺序是 C > A > B 。
常温下,往A状态的溶液中加入20 g溶质和20 g水,
使之充分溶解
C > A > B
Ⅲ. 溶液的用途:防范新冠疫情,我们除了戴口罩、勤洗手、勤通风外,还用到多种消毒液。
(1)请从微观角度解释:教室进行消杀后室内充满消毒液气味的原因是 分子在不断运动 。
(2)某消毒液稀释后pH = 6,则稀释前其pH < (填“>”“=”或“<”)6。
(3)在疫情期间要学会正确的洗手方法。沾有油污的手,可使用洗洁精清洗,洗洁精的作用是 乳化油污 。
分子在不断运动
<
乳化油污
做题技法:饱和溶液与不饱和溶液的相互转化
8. 某同学配制100 g溶质质量分数为10%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 ②①⑤③④ (填序号),其中操作错误的是 ① (填序号)。
②①⑤③④
①
(2)需称量氯化钠的质量为 10.0 g。
(3)量取水时选用量筒的量程最合适的是 A (填字母),读数时视线要与量筒内液体的凹液面最低处保持水平。
A. 100 mL B. 25 mL
C. 10 mL D. 50 mL
10.0
A
(4)经检测,该同学配制的溶液的溶质质量分数偏小,可能的原因是 AD (填字母)。
A. 氯化钠固体不纯
B. 用生锈的砝码称量
C. 装瓶时有少量溶液洒出
D. 溶解时烧杯内壁有水珠
AD
(5)将溶液配制完成后,取10 g该溶液将其配制成质量分数为4%的溶液,则需要加入水的质量为 15 g。
15
【解析】(2)溶质质量 = 溶液质量 × 溶质质量分数,配制100 g 10%的氯化钠溶液,需称量氯化钠的质量为 100 g × 10% = 10 g。(3)溶剂质量 = 溶液质量 - 溶质质量,所需溶剂的质量为100 g - 10 g = 90 g(合90 mL),应用规格为100 mL的量筒量取水的体积,故选A。(4)A. 氯化钠固体不纯,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。B. 用生锈的砝码称量,会造成实际所取的溶质的质量偏大,则使溶质质量分数偏大。
C. 溶液具有均一性,装瓶时有少量溶液洒出,溶质质量分数不变。D. 溶解时烧杯内壁有水珠,会造成实际水的质量偏大,则使溶质质量分数偏小。故选AD。(5)设需要加入水的质量为x,10 g × 10% = (10 g + x) × 4%,x = 15 g。
同课章节目录
