第1章 化学反应与能量转化同步习题(含解析) 高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第1章 化学反应与能量转化同步习题(含解析) 高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-11 07:37:52 | ||
图片预览


文档简介
第一章:化学反应与能量转化 同步习题
一、单选题
1.1L某溶液中含有的离子如下表:
离子
物质的量浓度 1 1 1
用惰性电极电解该溶液,当电路中有通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
A.电解后混合溶液的pH=0 B.a=3
C.阳极生成 D.阴极析出的金属是铜与铝
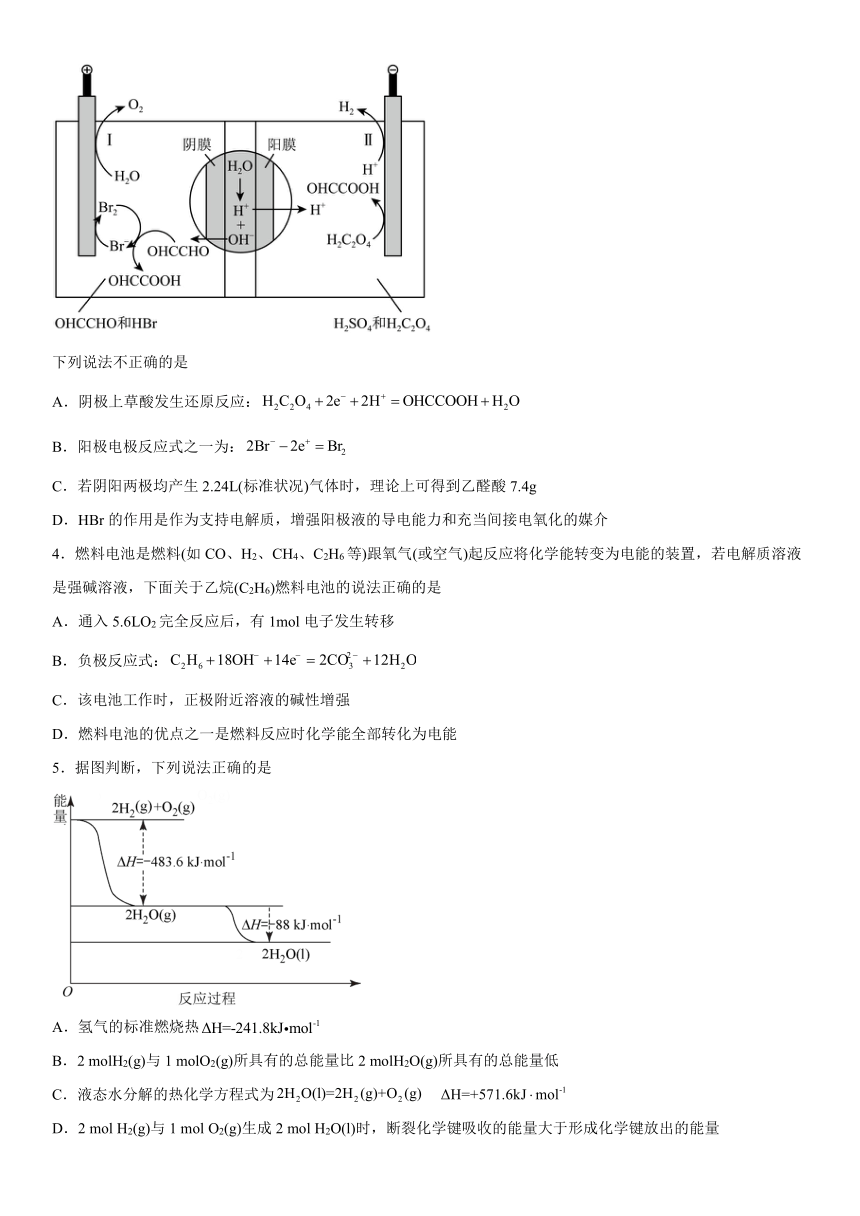
2.下图是采用新能源储能器件将CO2 转化为固体产物,实现CO2 的固定和储能灵活应用的装置。储能器件使用的Li-CO2电池组成为钌电极/CO2-饱和LiClO4-DMSO电解液/锂片。下列说法正确的是
A.Li -CO2 电池电解液由LiClO4和DMSO溶于水得到
B.CO2 的固定中,每转移8mole-,生成3mol气体
C.过程Ⅱ中电能转化为化学能
D.过程Ⅰ的钌电极的电极反应式为2Li2CO3 +C-4e-=4Li++3CO2↑
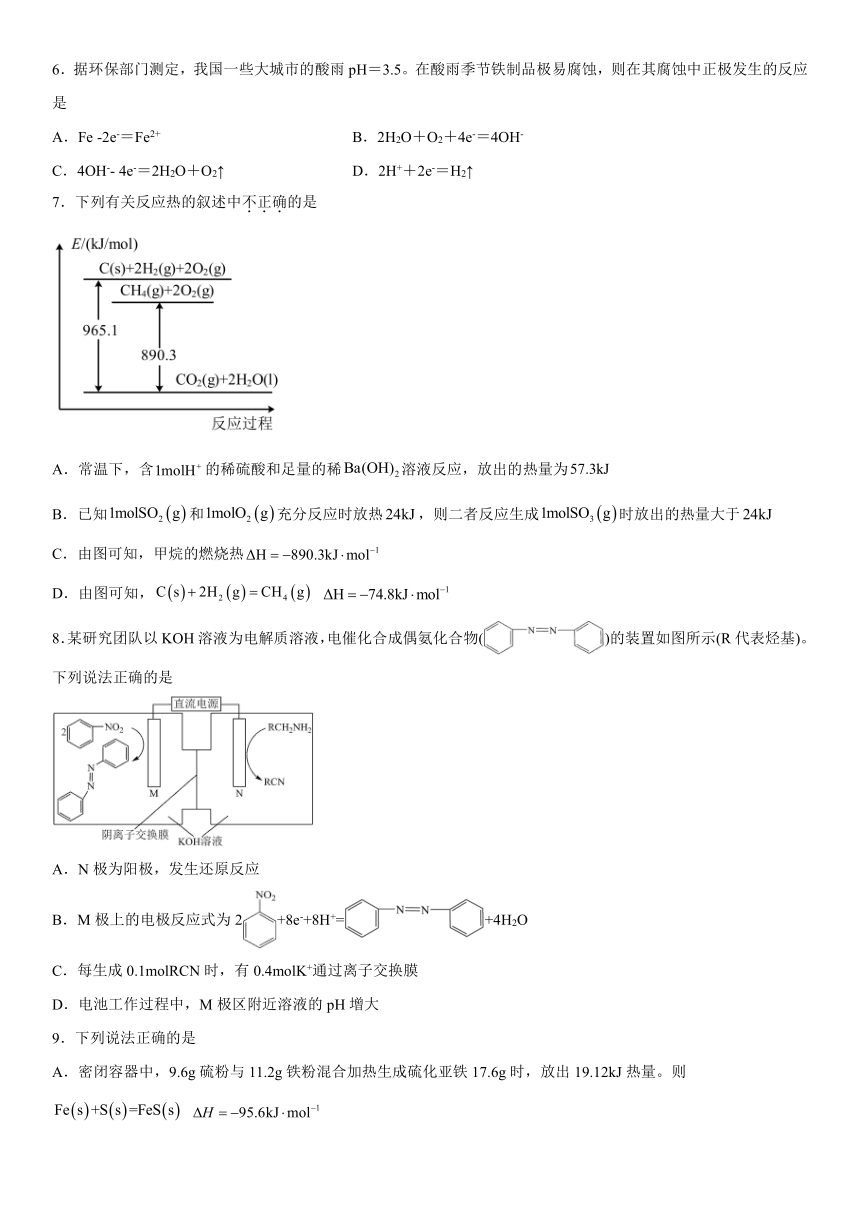
3.双极膜(BM)是一种新型的离子交换复合膜,它是由阴离子交换层和阳离子交换层复合而成。在直流电场作用下,双极膜可将水高解,在膜两侧分别得到和。工业上用“双极膜双成对电解法”生产乙醛酸(OHCCOOH),原理如图所示,装置中阴、阳两极均为情性电极。
下列说法不正确的是
A.阴极上草酸发生还原反应:
B.阳极电极反应式之一为:
C.若阴阳两极均产生2.24L(标准状况)气体时,理论上可得到乙醛酸7.4g
D.HBr的作用是作为支持电解质,增强阳极液的导电能力和充当间接电氧化的媒介
4.燃料电池是燃料(如CO、H2、CH4、C2H6等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于乙烷(C2H6)燃料电池的说法正确的是
A.通入5.6LO2完全反应后,有1mol电子发生转移
B.负极反应式:
C.该电池工作时,正极附近溶液的碱性增强
D.燃料电池的优点之一是燃料反应时化学能全部转化为电能
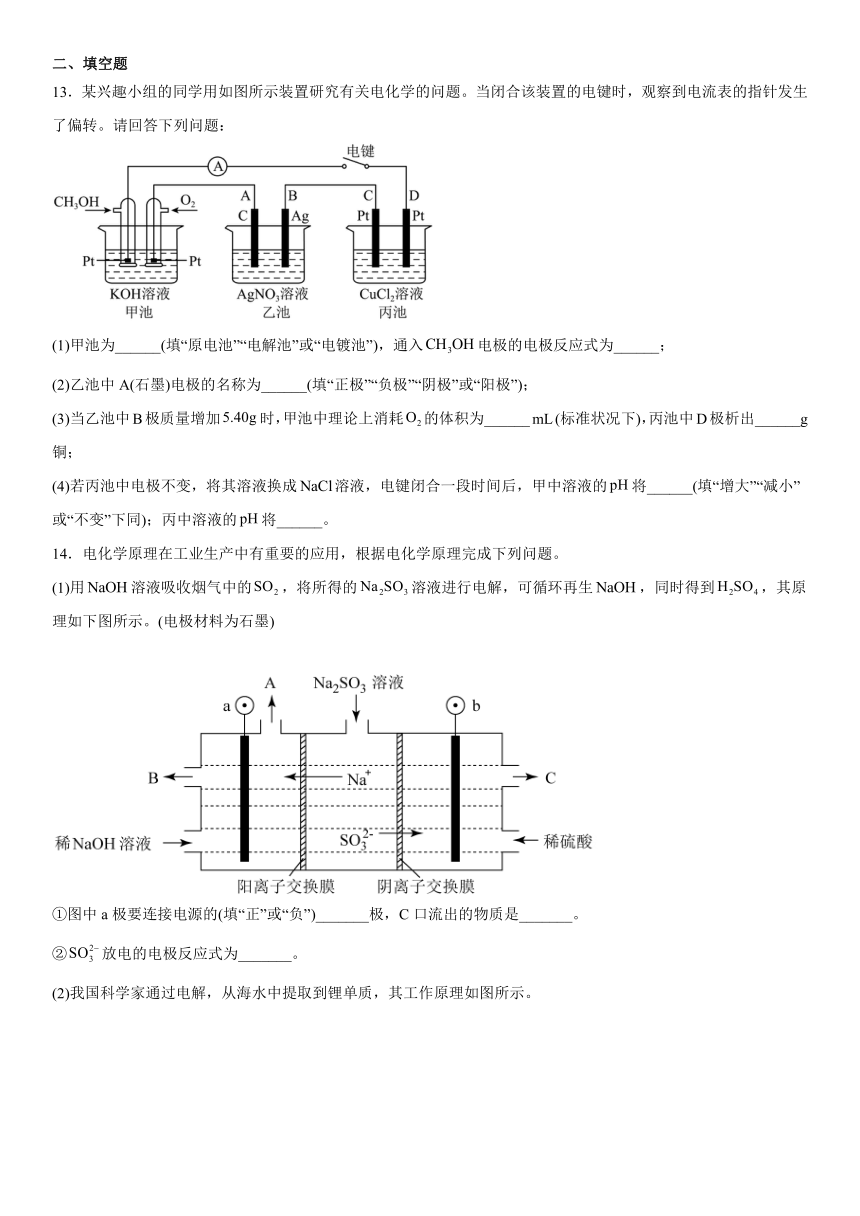
5.据图判断,下列说法正确的是
A.氢气的标准燃烧热
B.2 molH2(g)与1 molO2(g)所具有的总能量比2 molH2O(g)所具有的总能量低
C.液态水分解的热化学方程式为
D.2 mol H2(g)与1 mol O2(g)生成2 mol H2O(l)时,断裂化学键吸收的能量大于形成化学键放出的能量
6.据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是
A.Fe -2e-=Fe2+ B.2H2O+O2+4e-=4OH-
C.4OH-- 4e-=2H2O+O2↑ D.2H++2e-=H2↑
7.下列有关反应热的叙述中不正确的是
A.常温下,含的稀硫酸和足量的稀溶液反应,放出的热量为
B.已知和充分反应时放热,则二者反应生成时放出的热量大于
C.由图可知,甲烷的燃烧热
D.由图可知,
8.某研究团队以KOH溶液为电解质溶液,电催化合成偶氨化合物()的装置如图所示(R代表烃基)。下列说法正确的是
A.N极为阳极,发生还原反应
B.M极上的电极反应式为2+8e-+8H+=+4H2O
C.每生成0.1molRCN时,有0.4molK+通过离子交换膜
D.电池工作过程中,M极区附近溶液的pH增大
9.下列说法正确的是
A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量。则
B.已知 ,在中和热的测定时实际加入的酸碱的量的多少会影响该反应的
C.500℃、30MPa下,将0.5mol和1.5mol置于密闭的容器中充分反应生成,放热19.3kJ,其热化学方程式为:
D.相同条件下,在两个相同的恒容密闭容器中,2mol和6mol反应放出的热量是1mol和3mol反应放出的热量的2倍
10.下列过程吸收热量的是
A.食物腐败 B.干冰升华
C.浓硫酸与锌粉的反应 D.镁条二氧化碳中的燃烧
11.“乌铜走银”是我国非物质文化遗产之一,该工艺将部分氧化的银丝镶嵌于铜器表面,艺人用“出汗的手”边捂边揉搓铜器,铜器表面逐渐变黑,银丝变得银光闪闪,下列说法正确的是
A.“乌铜走银”利用的是电解原理
B.“乌铜走银”的总反应为
C.银丝一极的电极反应式为
D.每生成时转移电子
12.科学家发明了一种Al-PbO2电池,电解质溶液分别为K2SO4溶液、H2SO4溶液、KOH溶液,通过x膜和y膜两种离子交换膜将电解质溶液隔开,形成M、R、N三个电解质溶液区域,结构示意图如图所示。下列说法正确的是
A.K+通过x膜移向M区
B.R区的电解质溶液浓度逐渐减小
C.x膜和y膜均为阳离子交换膜
D.M区消耗1.8gAl时,N区电解质溶液质量减少16.0g
二、填空题
13.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。请回答下列问题:
(1)甲池为______(填“原电池”“电解池”或“电镀池”),通入电极的电极反应式为______;
(2)乙池中A(石墨)电极的名称为______(填“正极”“负极”“阴极”或“阳极”);
(3)当乙池中B极质量增加时,甲池中理论上消耗的体积为______(标准状况下),丙池中D极析出______g铜;
(4)若丙池中电极不变,将其溶液换成溶液,电键闭合一段时间后,甲中溶液的将______(填“增大”“减小”或“不变”下同);丙中溶液的将______。
14.电化学原理在工业生产中有重要的应用,根据电化学原理完成下列问题。
(1)用溶液吸收烟气中的,将所得的溶液进行电解,可循环再生,同时得到,其原理如下图所示。(电极材料为石墨)
①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②放电的电极反应式为_______。
(2)我国科学家通过电解,从海水中提取到锂单质,其工作原理如图所示。
①生成锂单质的电极反应式是_______。
②理论分析,阳极电解产物可能有。
ⅰ.生成的电极反应式是_______。
ⅱ.实验室模拟上述过程,气体中未检测到,推测可能是溶于水。写出与水反应的化学方程式_______。
15.根据反应:,可以设计出如图所示的原电池。
(1)若左右两根电极均为碳棒,A烧杯中盛有的混合液,B烧杯中盛有的混合液,开始时电流计指针有偏转,一段时间后指针无偏转,此时反应________(填“停止”或“没有停止”)。向B烧杯中加入浓盐酸时发现电流计指针偏转,此时原电池正极的电极反应式为______________________。
(2)向B烧杯中加入40%的溶液时发现电流计指针也偏转,此时原电池负极的电极反应式为________________________。
16.观察下列装置,回答下列问题。
(1) 甲装置中通入乙醇的电极反应式为_______________________________________。
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上的电极反应式是________,在Ag电极附近观察到的现象是_____________________________。
(3) 电解一段时间,当甲池消耗了112 mLO2(标况下),此时乙装置中溶液的pH为_______(忽略电解前后体积变化)。若要将该溶液完全恢复到电解前的浓度和pH,需要补充的物质是_____________,其物质的量为___________。
(4) 丙装置中总反应的离子方程式为____________________________________________。
三、计算题
17.0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量。已知H2O(l)转化为H2O(g)的ΔH=+44 kJ·mol-1,试写出气态乙硼烷完全燃烧生成气态水时的热化学方程式___________。
18.按要求书写热化学方程式:
(1)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________________
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
③H2(g)+O2(g)=H2O(l)ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式________________
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
四、工业流程题
19.高氯酸铜易溶于水,在130℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜的一种工艺流程如图1所示:
(1)发生“电解Ⅰ”时,所用的交换膜是_______(填“阳”或“阴”)离子交换膜。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为。
①“歧化反应”的化学方程式为_______。
②“歧化反应”阶段所采用的不同温度对产率的影响结果如图2所示。则该反应最适宜的温度是____。
(3)操作a的名称是_______,该流程中可循环利用的物质是_______(填化学式)。
(4)用该工艺流程制备高氯酸铜时,若起始时的质量为t,最终制得的为t,则产率为_______(用含a、b的代数式表示)。
(5)某温度下,高氯酸铜按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。A方式为,若4高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为,则B方式为_______(用化学方程式表示)。
20.在石墨材料性能提升的帮助下,锂离子电池的性能也得到了大幅提升,华为公司曾开发出石墨烯锂离子电池,其工作原理如图1所示,该锂离子电池正极铝钴膜主要含有、等,处理该正极废料的一种流程如图2所示:
请回答下列问题:
(1)“碱浸”时发生反应的离子方程式为_______。
(2)滤渣的主要成分的化学式为_______。
(3)“酸溶”时的作用是_______,“酸溶”时温度不宜过高的原因是_______。盐酸可以代替和的混合液,但工业上都不采用盐酸,其原因是_______。
(4)用图1中锂离子电池作电源电解制备的装置如图3所示,d与锂离子电池的_______极相连(填“a”或“b”),电解池中发生的总反应离子方程式为_______。当锂离子电池中有移向正极时,电解池中阴极区溶液质量的变化量为_______g。
参考答案:
1.A
【分析】由溶液电荷守恒可知2c(Cu2+)+3c(Al3+)=c(NO3-)+c(Cl-),可求得c(NO3-)=4moL/L,
由于离子放电顺序Cu2+>H+>Al3+,Cl->OH->NO3-,电解时阳极首先发生:2Cl--2e-=Cl2↑,然后发生4OH--4e-=O2↑+2H2O,阴极首先发生:Cu2++2e-=Cu,然后发生2H++2e-=H2↑,结合相关离子的物质的量进行解答。
【详解】氯离子的物质的量=1mol/L×1L=1mol,铜离子的物质的量=1mol/L×1L=1mol,依据电解过程中存在电子守恒,结合电极反应计算分析产物,用惰性电极电解该溶液,当电路中有3mole 通过时
阳极电极反应为: 2Cl 2e =Cl2↑;
1mol 1mol 0.5mol
4OH 4e =2H2O+O2↑
2mol(3-1)mol 1mol
阴极电极反应为:Cu2++2e =Cu
1mol 2mol 1mol
2H++2e =H2↑
1mol (3-2)mol 0.5mol
A. 电解后溶液PH计算,依据两电极上的反应计算,阳极减少2mol氢氧根离子,同时阴极上减少1mol氢离子,综合计算分析得到溶液中增加氢离子物质的量为1mol,氢离子浓度为1mol/L,pH=0,故A正确;
B.依据溶液中电荷守恒计算忽略氢离子和氢氧根离子浓度:2c(Cu2+)+3c(Al3+)=c(Cl )+c(NO3 ),计算得到c(NO3 )=4mol/L,即a=4,故B错误;
C. 依据电极反应电子守恒可知阳极生成0.5molCl2,故C错误;
D.由于在阴极的放电顺序为: H+>Al3+,故Al3+不可能放电,故D错误;
答案选A。
2.D
【详解】A.金属锂能够与水反应,电解液不能由LiClO4和DMSO溶于水得到,A错误;
B.由反应式2Li2CO3 =4Li++2CO2↑+O2↑+4e-可知,得到4 mole-,生成2mol二氧化碳和1mol氧气,现转移8 mole-,生成6mol气体,B错误;
C.通过图示可知,电子不断的流出,过程Ⅱ中化学能转化为电能,C错误;
D.由图示可知,碳变为二氧化碳,发生氧化反应,过程Ⅰ的钌电极为负极,电极反应式为2Li2CO3 +C-4e-=4Li++3CO2↑,D正确;
正确选项D。
3.C
【分析】该装置为电解池,电解水产生氧气的一极为阳极,电极反应式为:2H2O-4e-=O2+4H+,还有,阴极反应式为:2H++2e-=H2,还有;
【详解】A.草酸在阴极得电子生成OHCCOOH,发生还原反应,电极反应式为:,A正确;
B.阳极发生氧化反应,电极反应式之一为:,B正确;
C.标准状况下2.24L气体的物质的量为,阴极发生2H++2e-=H2,转移0.2mol电子,由生成0.1mol乙醛酸,阳极发生2H2O-4e-=O2+4H+,转移0.4mol电子,由生成0.2mol Br2,H2O+OHCCHO+Br2=OHCCOOH+2Br-+2H+生成0.2mol乙醛酸,则可得到乙醛酸质量为m=nM=(0.1+0.2)mol×74g/mol=22.2g,C错误;
D .OHCCHO导电能力较弱,HBr的作用是作为支持电解质,增强阳极液的导电能力,OHCCHO被氧化为OHCCOOH,HBr充当间接电氧化的媒介,D正确;
故选:C。
4.C
【分析】燃料电池中,通入燃料的一极为负极,负极发生氧化反应,通入氧气的一极为正极,正极发生还原反应。
【详解】A.气体所处的状态未知,不能计算5.6LO2的物质的量,故A错误;
B.乙烷燃料电池中,负极上乙烷失去电子发生氧化反应,电解质溶液为碱性,则其电极反应式为,故B错误;
C.该电池工作时,正极反应为,生成OH-,正极附近溶液的碱性增强,故C正确;
D.燃料电池燃料的化学能不能全部转化为电能,还转化为热能等其它形式的能量,故D错误;
故答案选C。
5.C
【详解】A.氢气的标准燃烧热△H=-×(483.6+88)kJ/mol=-285.8 kJ/mol,A错误;
B.根据图示可知2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量高,B错误;
C.根据图示可知:2 mol H2(g)与1 mol O2(g)生成2 mol H2O(l)时放出热量为Q=(483.6+88)kJ=571.6 kJ,则2 mol H2O(l)分解产生2 mol H2(g)与1 mol O2(g)时吸收热量是571.6 kJ,故液态水分解的热化学方程式为,C正确;
D.根据图示可知2 mol H2(g)与1 mol O2(g)比2 mol H2O(l)能量多571.6 kJ,说明断裂化学键吸收的能量小于形成化学键放出的能量,D错误;
故合理选项是C。
6.D
【详解】在酸雨季节钢铁表面的溶液显酸性,所以此时主要发生析氢腐蚀。原电池中正极得到电子,所以正极是氢离子得到电子,生成氢气,答案选D。
7.A
【详解】A.生成硫酸钡放热,含的稀硫酸和足量的稀溶液反应,放出的热量大于,故A错误;
B.二氧化硫与氧气反应生成三氧化硫,属于可逆反应,生成时放出的热量大于24kJ,故 B正确;
C.由图可知,甲烷燃烧的热化学方程式可表示为,甲烷的燃烧热,故C正确;
D.由图可知,该反应为放热反应, ,故D正确。
故选A。
8.D
【分析】RCH2NH2中C元素显-1价,RCN中C元素显+3价,则N极上RCH2NH2→RCN,失电子作阳极,M极为阴极。
【详解】A.该装置为电解池,N极上RCH2NH2失电子生成RCN,发生氧化反应,A项错误;
B.M极上硝基苯转化为偶氮化合物,得电子发生还原反应,M极为电解池的阴极,电极反应为2+8e-+4H2O =+8OH-,B项错误;
C.该装置中的离子交换膜为阴离子交换膜,K+不能通过,C项错误;
D.电池工作过程中,M极发生的反应为2+8e-+4H2O =+8OH-,则溶液的pH增大,D正确;
故选D。
9.A
【详解】A.9.6g硫粉的物质的量为,11.2g铁粉的物质的量为,二者混合加热的化学方程式为,生成硫化亚铁17.6g()时,放出19.12kJ热量,所以1mol铁完全反应放热,对应的热化学方程式为,选项A正确;
B.中和热是指在稀溶液中,强酸与强碱反应生成1mol水时放出的热量,所以实际加入的酸碱的量的多少不会影响该反应的,选项B错误;
C.0.5mol和1.5mol置于密闭的容器中充分反应生成,放热19.3kJ,因反应为可逆反应,不能进行到底,生成的NH3(g)小于1mol,则密闭的容器中充分反应生成2mol NH3(g),放热大于38.6 kJ,则热化学反应方程式中的反应热数值错误,选项C错误;
D.相同条件下,在两个相同的恒容密闭容器中2molN2和6molH2反应的转化率比1molN2和3molH2反应的大,则2molN2和6molH2反应放出的热量大于lmolN2和3molH2反应放出的热量的2倍,选项D错误;
答案选A。
10.B
【详解】A.食物腐败过程中放出热量,故A不符合题意;
B.干冰升华过程中,物质由固体转化为气态,其过程吸收热量,故B符合题意;
C.浓硫酸与锌粉的反应属于放热反应,故C不符合题意;
D.镁条在二氧化碳中的燃烧是放热反应,故D不符合题意;
本题答案B。
11.B
【分析】“乌铜走银”是部分氧化的银丝镶嵌于铜器表面,艺人用手边捂边揉搓铜器,铜表面逐渐变黑,银丝变得银光闪闪,构成原电池的反应,银丝发生还原反应,氧化银转化为单质银,电极反应为:Ag2O+2e-+H2O=2Ag+2OH-,Cu为正极,电极反应为:Cu-2e-+2OH-=CuO+H2O,单质银活泼性较弱,可长时间保持光亮,据此分析解题。
【详解】A.由分析可知,“乌铜走银”利用的是原电池原理,A错误;
B.由分析可知,银丝发生还原反应,氧化银转化为单质银,电极反应为:Ag2O+2e-+H2O=2Ag+2OH-,Cu为正极,电极反应为:Cu-2e-+2OH-=CuO+H2O,故“乌铜走银”的总反应为,B正确;
C.由分析可知,银丝一极的电极反应式为,C错误;
D.由反应方程式Cu-2e-+2OH-=CuO+H2O可知,每生成时转移电子,D错误;
故答案为:B。
12.D
【分析】由物质转化关系可知,Al作负极,电极反应式为,PbO2作正极,电解反应式为,M区的电解质溶液为KOH溶液,据此作答。
【详解】A. 根据分析,K+由x膜向R区移动,故x膜为阳离子交换膜,A错误;
B.M区的电解质溶液为KOH溶液,由题图知N区的电解质溶液为H2SO4溶液,则R区的电解质溶液为K2SO4溶液,由N区通过y膜移向R区,再结合由M区迁移过来的K+,使R区K2SO4溶液浓度增大,B错误;
C.根据B的分析,y膜为阴离子交换膜,C错误;
D.M区消耗时,转移电子,则N区消耗、,同时有移向R区,相当于减少,同时生成,则R区的电解质溶液实际减少的质量为,D正确;
故选D。
13. 原电池 阳极 280 1.60 减小 增大
【分析】由图可知,甲池为燃料电池,通入甲醇的的Pt电极为负极,碱性条件下,甲醇在负极失去电子发生氧化反应生成碳酸根离子和水,通入氧气的Pt电极为正极,碱性条件下,氧气在正极得到电子发生还原反应生成氢氧根离子;乙池为电解池,A电极为电解池的阳极,水在阳极失去电子发生氧化反应生成氧气,B电极为阴极,银离子在阴极得到电子发生还原反应生成银;丙池为电解池,C电极为阳极,氯离子在阳极失去电子发生氧化反应生成氯气,D电极为阴极,铜离子在阴极得到电子发生还原反应生成铜。
【详解】(1)由分析可知,甲池为燃料电池,通入甲醇的的Pt电极为负极,碱性条件下,甲醇在负极失去电子发生氧化反应生成碳酸根离子和水,故答案为:原电池;;
(2) 由分析可知,乙池为电解池,A电极为电解池的阳极,故答案为:阳极;
(3)5.04g银的物质的量为=0.05mol,由得失电子数目守恒可知,甲池中理论上消耗氧气的体积为0.05mol××22.4L/mol×1000mL/L=280mL,丙池中D极析出铜的质量为0.05mol××64g/mol=1.60g,故答案为:280;1.60;
(4) 若丙池中电极不变,将其溶液换成氯化钠溶液,电键闭合一段时间后,甲池中的总反应为2CH3OH + 3O2 + 4OH-= 2CO + 6H2O,反应中消耗氢氧根离子,溶液的pH将减小;丙池中电解氯化钠溶液的方程式为2NaCl + 2H2O2NaOH + H2↑ + Cl2↑,反应中生成氢氧钠,溶液的pH将增大,故答案为:减小;增大。
14.(1) 负极; 浓硫酸; SO-2e-+H2O=SO+2H+;
(2) Li++e-=Li; 2H2O-4e-=O2↑+4H+; Cl2+H2O=HCl+HClO;
【详解】(1)电解池中阴离子朝阳离子移动,阴离子朝阴极移动,根据图示,a为阴极接电源负极,b为阳极接电源正极。SO在b电极失电子生成SO,电极反应式为:SO-2e-+H2O=SO+2H+,C处流出的物质为浓硫酸;
(2)Li+得电子生成Li,电极反应式为:Li++e-=Li;海水中的水在阳极失电子生成O2,电极反应式:2H2O-4e-=O2↑+4H+;氯气与水反应生成盐酸和次氯酸:Cl2+H2O=HCl+HClO。
15. 没有停止
【详解】(1)该电池对应的氧化还原反应是一个可逆反应,可逆反应的特点是不能进行完全,达到平衡时反应仍在进行,没有停止;向B烧杯中加入浓盐酸时,该可逆反应正向进行,正极发生还原反应,电极反应式为;
(2)向B烧杯中加入40%的溶液时,被氧化成,负极发生氧化反应,电极反应式为。
16. C2H5OH-12e-+16OH-==2CO32-+11H2O 4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+ 有红色固体(Cu)析出 1 CuO或CuCO3 0.01mol Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑。
【分析】甲池为燃料电池,乙池和丙池都为电解池。甲池中,加入乙醇的电极为负极,通氧气的电极为正极;则乙池中石墨电极为阳极,Ag电极为阴极;丙池中,左边Pt电极为阳极,右边Pt电极为阴极。
(1) 甲装置中加入乙醇的电极为负极,乙醇失电子,生成的产物再与KOH溶液反应,最后生成碳酸盐和水。
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上发生H2O失电子生成O2和H+的反应,在Ag电极上发生Cu2+得电子生成Cu的反应,由此可确定此电极附近观察到的现象。
(3) 电解一段时间,当甲池消耗了112 mLO2(标况下),利用电荷守恒,可求出乙装置中生成n(H+),从而求出溶液的pH。若要将该溶液完全恢复到电解前的浓度和pH,则需往溶液中加入阴、阳极生成物发生化合反应的产物。
(4) 丙装置中电解MgCl2溶液,可利用电解饱和食盐水的反应进行类推,同时要注意差异性,即生成Mg(OH)2沉淀。
【详解】(1)甲装置中加入乙醇的电极为负极,乙醇失电子,生成的产物再与KOH溶液反应,最后生成碳酸盐和水,电极反应式为C2H5OH-12e-+16OH-==2CO32-+11H2O。答案为:C2H5OH-12e-+16OH-==2CO32-+11H2O;
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极(阳极)上发生H2O失电子生成O2和H+的反应,电极反应式为4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+;在Ag电极(阴极)上发生反应Cu2++2e-=Cu,此电极附近观察到的现象为有红色固体(Cu)析出。答案为:4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+;有红色固体(Cu)析出;
(3)n(O2)==0.005mol,由O2——4H+,可求出n(H+)=0.005mol×4=0.02mol,c(H+)==0.1mol/L,pH=1。阳极生成O2(0.005mol),阴极生成Cu(0.01mol),2Cu+O2=2CuO(0.01mol),所以需往电解后的溶液中加入0.01mol CuO或CuCO3,可将该溶液完全恢复到电解前的浓度和pH。答案为:有红色固体(Cu)析出;1;CuO或CuCO3;0.01mol;
(4) 丙装置中电解MgCl2溶液,可利用电解饱和食盐水的反应进行类推,从而得出总反应的离子方程式为Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑。答案为:Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑。
【点睛】电解反应发生后,要恢复原有电解质的组成和性质,需要往电解后的溶液中加入物质,该物质通常为阴、阳极电解产物(离开电解质溶液)发生化合反应的产物,或相当于它们的物质。如本题中,加入CuO,也可以加入CuCO3(与酸反应生成盐,CO2和水,CO2逸出,相当于加入CuO),但若加入Cu(OH)2,相当于多加了水,必然造成电解质浓度减小。
17.B2H6(g)+3O2(g)=B2O3(s)+3H2O(g) ΔH=-2033kJ·mol-1
【分析】结合热化学方程式和盖斯定律计算,再写出发生反应的热化学方程式。
【详解】0.3molB2H6气体在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,则1molB2H6完全反应放出2165 kJ热量,则该热化学反应方程式为①B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165 kJ mol-1 ;H2O(l)转化为H2O(g)的ΔH=+44 kJ·mol-1,即②H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,根据盖斯定律①+②×3可得B2H6(g)+3O2(g)=B2O3(s)+3H2O(g),此时ΔH=(-2165 kJ mol-1)+(+44 kJ·mol-1)×3=-2033kJ·mol-1,则气态乙硼烷完全燃烧生成气态水时的热化学方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(g) ΔH=-2033kJ·mol-1。
【点睛】应用盖斯定律进行简单计算的基本方法是参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般2~3个)进行合理“变形”,如热化学方程式颠倒、乘除以某一个数,然后将它们相加、减,得到目标热化学方程式,求出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。
18. H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=-725.76kJ/mol 2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=-488.3kJ/mol N2(g)+3H2(g)═2NH3(g)△H=-92kJ/mol
【详解】(1)中和热是生成1molH2O时放出的热量,即表示H2SO4与NaOH反应的中和热的热化学方程式为H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol;
(2)利用△H与化学计量数的关系,燃烧1g甲醇放热22.68kJ,得出燃烧1mol甲醇放出的热量为22.68kJ =725.76kJ,甲醇燃烧热的热化学方程式为CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=-725.76kJ/mol;
(3)已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+O2(g)=H2O(l) ΔH3=-285.8kJ/mol
根据盖斯定律,由②×2+③×2-①得出:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=ΔH2×2+ΔH3×2-ΔH1=-488.3kJ/mol;
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,反应为N2+3H2═2NH3;反应焓变△H=拆化学键吸收能量-形成化学键放出的能量=946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92kJ/mol;则N2与H2反应生成NH3的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-92kJ/mol。
19. 阳 60℃ 蒸发浓缩
【分析】电解Ⅰ中会生成氯气、氢气、氢氧化钠,氯气与碳酸钠发生歧化生成、二氧化碳和NaCl,电解Ⅱ中失电子氧化为,加入盐酸使歧化反应生成的氯化钠析出,经过滤除去, 反应Ⅱ为高氯酸和碱式碳酸铜反应得到,据此分析解题。
【详解】(1)电解食盐水制备氯气:,为了防止阴极产生的氢氧根向阳极移动与氯气反应,所用的离子交换膜应为阳离子交换膜。
(2)①歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为,“歧化反应”的化学方程式为:。
②根据图中信息可知,“歧化反应”阶段在60℃时,产率最高在80%以上。
(3)将“操作a”获得60%以上高氯酸,“操作a”的名称为蒸发浓缩;由流程图可知“反应Ⅰ”经蒸发结晶后得到的晶体可循环利用。
(4)根据流程图及以上物质转化分析可得关系式:,产率,,产率为。
(5)根据A方式化合价的升降可知,该反应中1分解转移电子数为16,4在该温度下按A、B各占50%的方式完全分解,说明A方式中2高氯酸铜反应转移电子的物质的量为32,再根据A、B两种方式转移的电子数之比为,故B方式中2高氯酸铜反应转移电子的物质的量应为28,而铜元素化合价不变,因此B方式中氯元素由+7价变为0价,得到电子为,氧元素由-2价变为0价,失去电子为,利用电子守恒配平,故可知生成物为、和,则B方式为:。
20. 还原剂,将三价钴还原成二价钴 温度过高,会分解 生成的氯气会造成污染,且盐酸易挥发,浪费很大 b 57
【分析】该锂离子电池正极铝钴膜主要含有、等,处理该正极废料的一种流程如图,第一步碱溶,氢氧化钠和铝反应生成偏铝酸钠,过滤后,第二步酸溶,和硫酸和过氧化氢反应,过氧化氢把正三价的钴还原为正二价的钴,生成硫酸钴,同时生成硫酸锂,第三步加氨水调pH除锂,硫酸锂与氨水反应生成沉淀,第四步加草酸铵沉钴,草酸铵和硫酸钴反应生成草酸钴沉淀。在图1锂离子电池中,a极为锂电池的正极,b极为锂电池的负极。在图3电解池中失去电子生成,则所在电极为阳极, c应与锂电池的正极a极相连,d应与锂电池的负极b相连。
【详解】(1) 该锂离子电池正极铝钴膜主要含有、等,处理该正极废料第一步碱溶,氢氧化钠和铝反应生成偏铝酸钠,反应的离子方程式为 故答案为;
(2) 第三步加氨水调pH除锂,硫酸锂与氨水反应生成沉淀,滤渣的主要成分的化学式为,故答案为;
(3)第二步酸溶,和硫酸和过氧化氢反应,过氧化氢把正三价的钴还原为正二价的钴,生成硫酸钴,同时生成硫酸锂,“酸溶”时作还原剂,把正三价的钴还原为正二价的钴;过氧化氢不稳定,受热易分解,所以“酸溶”时温度不宜过高;盐酸可以代和的混合液,但工业上都不采用盐酸,是因为把氯离子氧化生成氯气,氯气有毒,易污染环境,且盐酸易挥发,也会产生污染和浪费。故答案为:还原剂,将三价钴还原成二价钴;温度过高,会分解;生成的氯气会造成污染,且盐酸易挥发,浪费很大;
(4)图1中的锂离子电池,a是正极,b是负极,而图3中的电解池中失去电子生成,则所在电极为阳极, c应与锂电池的正极a极相连,d应与锂电池的负极b相连。电解池中阳极失去电子生成,阴极氢离子得到电子生成氢气,总反应离子方程式为;当电池中有移向正极时,在电解池中阳离子会向阴极移动,因为是阳离子交换膜,所以电解池左侧的钾离子会透过阳离子交换膜进入右侧,则阴极区溶液质量会增加,的物质的量为1.5mol,则进入右侧的钾离子也为1.5mol,则钾离子的质量为1.5mol×39g/mol=58.5g,同时会有0.75mol的氢气放出,则氢气的质量为0.75mol×2g/mol=1.5g,则阴极区的质量变化量为58.5g-1.5g=57g,故答案为:b;
;57g;
一、单选题
1.1L某溶液中含有的离子如下表:
离子
物质的量浓度 1 1 1
用惰性电极电解该溶液,当电路中有通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
A.电解后混合溶液的pH=0 B.a=3
C.阳极生成 D.阴极析出的金属是铜与铝
2.下图是采用新能源储能器件将CO2 转化为固体产物,实现CO2 的固定和储能灵活应用的装置。储能器件使用的Li-CO2电池组成为钌电极/CO2-饱和LiClO4-DMSO电解液/锂片。下列说法正确的是
A.Li -CO2 电池电解液由LiClO4和DMSO溶于水得到
B.CO2 的固定中,每转移8mole-,生成3mol气体
C.过程Ⅱ中电能转化为化学能
D.过程Ⅰ的钌电极的电极反应式为2Li2CO3 +C-4e-=4Li++3CO2↑
3.双极膜(BM)是一种新型的离子交换复合膜,它是由阴离子交换层和阳离子交换层复合而成。在直流电场作用下,双极膜可将水高解,在膜两侧分别得到和。工业上用“双极膜双成对电解法”生产乙醛酸(OHCCOOH),原理如图所示,装置中阴、阳两极均为情性电极。
下列说法不正确的是
A.阴极上草酸发生还原反应:
B.阳极电极反应式之一为:
C.若阴阳两极均产生2.24L(标准状况)气体时,理论上可得到乙醛酸7.4g
D.HBr的作用是作为支持电解质,增强阳极液的导电能力和充当间接电氧化的媒介
4.燃料电池是燃料(如CO、H2、CH4、C2H6等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于乙烷(C2H6)燃料电池的说法正确的是
A.通入5.6LO2完全反应后,有1mol电子发生转移
B.负极反应式:
C.该电池工作时,正极附近溶液的碱性增强
D.燃料电池的优点之一是燃料反应时化学能全部转化为电能
5.据图判断,下列说法正确的是
A.氢气的标准燃烧热
B.2 molH2(g)与1 molO2(g)所具有的总能量比2 molH2O(g)所具有的总能量低
C.液态水分解的热化学方程式为
D.2 mol H2(g)与1 mol O2(g)生成2 mol H2O(l)时,断裂化学键吸收的能量大于形成化学键放出的能量
6.据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是
A.Fe -2e-=Fe2+ B.2H2O+O2+4e-=4OH-
C.4OH-- 4e-=2H2O+O2↑ D.2H++2e-=H2↑
7.下列有关反应热的叙述中不正确的是
A.常温下,含的稀硫酸和足量的稀溶液反应,放出的热量为
B.已知和充分反应时放热,则二者反应生成时放出的热量大于
C.由图可知,甲烷的燃烧热
D.由图可知,
8.某研究团队以KOH溶液为电解质溶液,电催化合成偶氨化合物()的装置如图所示(R代表烃基)。下列说法正确的是
A.N极为阳极,发生还原反应
B.M极上的电极反应式为2+8e-+8H+=+4H2O
C.每生成0.1molRCN时,有0.4molK+通过离子交换膜
D.电池工作过程中,M极区附近溶液的pH增大
9.下列说法正确的是
A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量。则
B.已知 ,在中和热的测定时实际加入的酸碱的量的多少会影响该反应的
C.500℃、30MPa下,将0.5mol和1.5mol置于密闭的容器中充分反应生成,放热19.3kJ,其热化学方程式为:
D.相同条件下,在两个相同的恒容密闭容器中,2mol和6mol反应放出的热量是1mol和3mol反应放出的热量的2倍
10.下列过程吸收热量的是
A.食物腐败 B.干冰升华
C.浓硫酸与锌粉的反应 D.镁条二氧化碳中的燃烧
11.“乌铜走银”是我国非物质文化遗产之一,该工艺将部分氧化的银丝镶嵌于铜器表面,艺人用“出汗的手”边捂边揉搓铜器,铜器表面逐渐变黑,银丝变得银光闪闪,下列说法正确的是
A.“乌铜走银”利用的是电解原理
B.“乌铜走银”的总反应为
C.银丝一极的电极反应式为
D.每生成时转移电子
12.科学家发明了一种Al-PbO2电池,电解质溶液分别为K2SO4溶液、H2SO4溶液、KOH溶液,通过x膜和y膜两种离子交换膜将电解质溶液隔开,形成M、R、N三个电解质溶液区域,结构示意图如图所示。下列说法正确的是
A.K+通过x膜移向M区
B.R区的电解质溶液浓度逐渐减小
C.x膜和y膜均为阳离子交换膜
D.M区消耗1.8gAl时,N区电解质溶液质量减少16.0g
二、填空题
13.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。请回答下列问题:
(1)甲池为______(填“原电池”“电解池”或“电镀池”),通入电极的电极反应式为______;
(2)乙池中A(石墨)电极的名称为______(填“正极”“负极”“阴极”或“阳极”);
(3)当乙池中B极质量增加时,甲池中理论上消耗的体积为______(标准状况下),丙池中D极析出______g铜;
(4)若丙池中电极不变,将其溶液换成溶液,电键闭合一段时间后,甲中溶液的将______(填“增大”“减小”或“不变”下同);丙中溶液的将______。
14.电化学原理在工业生产中有重要的应用,根据电化学原理完成下列问题。
(1)用溶液吸收烟气中的,将所得的溶液进行电解,可循环再生,同时得到,其原理如下图所示。(电极材料为石墨)
①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②放电的电极反应式为_______。
(2)我国科学家通过电解,从海水中提取到锂单质,其工作原理如图所示。
①生成锂单质的电极反应式是_______。
②理论分析,阳极电解产物可能有。
ⅰ.生成的电极反应式是_______。
ⅱ.实验室模拟上述过程,气体中未检测到,推测可能是溶于水。写出与水反应的化学方程式_______。
15.根据反应:,可以设计出如图所示的原电池。
(1)若左右两根电极均为碳棒,A烧杯中盛有的混合液,B烧杯中盛有的混合液,开始时电流计指针有偏转,一段时间后指针无偏转,此时反应________(填“停止”或“没有停止”)。向B烧杯中加入浓盐酸时发现电流计指针偏转,此时原电池正极的电极反应式为______________________。
(2)向B烧杯中加入40%的溶液时发现电流计指针也偏转,此时原电池负极的电极反应式为________________________。
16.观察下列装置,回答下列问题。
(1) 甲装置中通入乙醇的电极反应式为_______________________________________。
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上的电极反应式是________,在Ag电极附近观察到的现象是_____________________________。
(3) 电解一段时间,当甲池消耗了112 mLO2(标况下),此时乙装置中溶液的pH为_______(忽略电解前后体积变化)。若要将该溶液完全恢复到电解前的浓度和pH,需要补充的物质是_____________,其物质的量为___________。
(4) 丙装置中总反应的离子方程式为____________________________________________。
三、计算题
17.0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量。已知H2O(l)转化为H2O(g)的ΔH=+44 kJ·mol-1,试写出气态乙硼烷完全燃烧生成气态水时的热化学方程式___________。
18.按要求书写热化学方程式:
(1)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________________
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
③H2(g)+O2(g)=H2O(l)ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式________________
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
四、工业流程题
19.高氯酸铜易溶于水,在130℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜的一种工艺流程如图1所示:
(1)发生“电解Ⅰ”时,所用的交换膜是_______(填“阳”或“阴”)离子交换膜。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为。
①“歧化反应”的化学方程式为_______。
②“歧化反应”阶段所采用的不同温度对产率的影响结果如图2所示。则该反应最适宜的温度是____。
(3)操作a的名称是_______,该流程中可循环利用的物质是_______(填化学式)。
(4)用该工艺流程制备高氯酸铜时,若起始时的质量为t,最终制得的为t,则产率为_______(用含a、b的代数式表示)。
(5)某温度下,高氯酸铜按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。A方式为,若4高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为,则B方式为_______(用化学方程式表示)。
20.在石墨材料性能提升的帮助下,锂离子电池的性能也得到了大幅提升,华为公司曾开发出石墨烯锂离子电池,其工作原理如图1所示,该锂离子电池正极铝钴膜主要含有、等,处理该正极废料的一种流程如图2所示:
请回答下列问题:
(1)“碱浸”时发生反应的离子方程式为_______。
(2)滤渣的主要成分的化学式为_______。
(3)“酸溶”时的作用是_______,“酸溶”时温度不宜过高的原因是_______。盐酸可以代替和的混合液,但工业上都不采用盐酸,其原因是_______。
(4)用图1中锂离子电池作电源电解制备的装置如图3所示,d与锂离子电池的_______极相连(填“a”或“b”),电解池中发生的总反应离子方程式为_______。当锂离子电池中有移向正极时,电解池中阴极区溶液质量的变化量为_______g。
参考答案:
1.A
【分析】由溶液电荷守恒可知2c(Cu2+)+3c(Al3+)=c(NO3-)+c(Cl-),可求得c(NO3-)=4moL/L,
由于离子放电顺序Cu2+>H+>Al3+,Cl->OH->NO3-,电解时阳极首先发生:2Cl--2e-=Cl2↑,然后发生4OH--4e-=O2↑+2H2O,阴极首先发生:Cu2++2e-=Cu,然后发生2H++2e-=H2↑,结合相关离子的物质的量进行解答。
【详解】氯离子的物质的量=1mol/L×1L=1mol,铜离子的物质的量=1mol/L×1L=1mol,依据电解过程中存在电子守恒,结合电极反应计算分析产物,用惰性电极电解该溶液,当电路中有3mole 通过时
阳极电极反应为: 2Cl 2e =Cl2↑;
1mol 1mol 0.5mol
4OH 4e =2H2O+O2↑
2mol(3-1)mol 1mol
阴极电极反应为:Cu2++2e =Cu
1mol 2mol 1mol
2H++2e =H2↑
1mol (3-2)mol 0.5mol
A. 电解后溶液PH计算,依据两电极上的反应计算,阳极减少2mol氢氧根离子,同时阴极上减少1mol氢离子,综合计算分析得到溶液中增加氢离子物质的量为1mol,氢离子浓度为1mol/L,pH=0,故A正确;
B.依据溶液中电荷守恒计算忽略氢离子和氢氧根离子浓度:2c(Cu2+)+3c(Al3+)=c(Cl )+c(NO3 ),计算得到c(NO3 )=4mol/L,即a=4,故B错误;
C. 依据电极反应电子守恒可知阳极生成0.5molCl2,故C错误;
D.由于在阴极的放电顺序为: H+>Al3+,故Al3+不可能放电,故D错误;
答案选A。
2.D
【详解】A.金属锂能够与水反应,电解液不能由LiClO4和DMSO溶于水得到,A错误;
B.由反应式2Li2CO3 =4Li++2CO2↑+O2↑+4e-可知,得到4 mole-,生成2mol二氧化碳和1mol氧气,现转移8 mole-,生成6mol气体,B错误;
C.通过图示可知,电子不断的流出,过程Ⅱ中化学能转化为电能,C错误;
D.由图示可知,碳变为二氧化碳,发生氧化反应,过程Ⅰ的钌电极为负极,电极反应式为2Li2CO3 +C-4e-=4Li++3CO2↑,D正确;
正确选项D。
3.C
【分析】该装置为电解池,电解水产生氧气的一极为阳极,电极反应式为:2H2O-4e-=O2+4H+,还有,阴极反应式为:2H++2e-=H2,还有;
【详解】A.草酸在阴极得电子生成OHCCOOH,发生还原反应,电极反应式为:,A正确;
B.阳极发生氧化反应,电极反应式之一为:,B正确;
C.标准状况下2.24L气体的物质的量为,阴极发生2H++2e-=H2,转移0.2mol电子,由生成0.1mol乙醛酸,阳极发生2H2O-4e-=O2+4H+,转移0.4mol电子,由生成0.2mol Br2,H2O+OHCCHO+Br2=OHCCOOH+2Br-+2H+生成0.2mol乙醛酸,则可得到乙醛酸质量为m=nM=(0.1+0.2)mol×74g/mol=22.2g,C错误;
D .OHCCHO导电能力较弱,HBr的作用是作为支持电解质,增强阳极液的导电能力,OHCCHO被氧化为OHCCOOH,HBr充当间接电氧化的媒介,D正确;
故选:C。
4.C
【分析】燃料电池中,通入燃料的一极为负极,负极发生氧化反应,通入氧气的一极为正极,正极发生还原反应。
【详解】A.气体所处的状态未知,不能计算5.6LO2的物质的量,故A错误;
B.乙烷燃料电池中,负极上乙烷失去电子发生氧化反应,电解质溶液为碱性,则其电极反应式为,故B错误;
C.该电池工作时,正极反应为,生成OH-,正极附近溶液的碱性增强,故C正确;
D.燃料电池燃料的化学能不能全部转化为电能,还转化为热能等其它形式的能量,故D错误;
故答案选C。
5.C
【详解】A.氢气的标准燃烧热△H=-×(483.6+88)kJ/mol=-285.8 kJ/mol,A错误;
B.根据图示可知2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量高,B错误;
C.根据图示可知:2 mol H2(g)与1 mol O2(g)生成2 mol H2O(l)时放出热量为Q=(483.6+88)kJ=571.6 kJ,则2 mol H2O(l)分解产生2 mol H2(g)与1 mol O2(g)时吸收热量是571.6 kJ,故液态水分解的热化学方程式为,C正确;
D.根据图示可知2 mol H2(g)与1 mol O2(g)比2 mol H2O(l)能量多571.6 kJ,说明断裂化学键吸收的能量小于形成化学键放出的能量,D错误;
故合理选项是C。
6.D
【详解】在酸雨季节钢铁表面的溶液显酸性,所以此时主要发生析氢腐蚀。原电池中正极得到电子,所以正极是氢离子得到电子,生成氢气,答案选D。
7.A
【详解】A.生成硫酸钡放热,含的稀硫酸和足量的稀溶液反应,放出的热量大于,故A错误;
B.二氧化硫与氧气反应生成三氧化硫,属于可逆反应,生成时放出的热量大于24kJ,故 B正确;
C.由图可知,甲烷燃烧的热化学方程式可表示为,甲烷的燃烧热,故C正确;
D.由图可知,该反应为放热反应, ,故D正确。
故选A。
8.D
【分析】RCH2NH2中C元素显-1价,RCN中C元素显+3价,则N极上RCH2NH2→RCN,失电子作阳极,M极为阴极。
【详解】A.该装置为电解池,N极上RCH2NH2失电子生成RCN,发生氧化反应,A项错误;
B.M极上硝基苯转化为偶氮化合物,得电子发生还原反应,M极为电解池的阴极,电极反应为2+8e-+4H2O =+8OH-,B项错误;
C.该装置中的离子交换膜为阴离子交换膜,K+不能通过,C项错误;
D.电池工作过程中,M极发生的反应为2+8e-+4H2O =+8OH-,则溶液的pH增大,D正确;
故选D。
9.A
【详解】A.9.6g硫粉的物质的量为,11.2g铁粉的物质的量为,二者混合加热的化学方程式为,生成硫化亚铁17.6g()时,放出19.12kJ热量,所以1mol铁完全反应放热,对应的热化学方程式为,选项A正确;
B.中和热是指在稀溶液中,强酸与强碱反应生成1mol水时放出的热量,所以实际加入的酸碱的量的多少不会影响该反应的,选项B错误;
C.0.5mol和1.5mol置于密闭的容器中充分反应生成,放热19.3kJ,因反应为可逆反应,不能进行到底,生成的NH3(g)小于1mol,则密闭的容器中充分反应生成2mol NH3(g),放热大于38.6 kJ,则热化学反应方程式中的反应热数值错误,选项C错误;
D.相同条件下,在两个相同的恒容密闭容器中2molN2和6molH2反应的转化率比1molN2和3molH2反应的大,则2molN2和6molH2反应放出的热量大于lmolN2和3molH2反应放出的热量的2倍,选项D错误;
答案选A。
10.B
【详解】A.食物腐败过程中放出热量,故A不符合题意;
B.干冰升华过程中,物质由固体转化为气态,其过程吸收热量,故B符合题意;
C.浓硫酸与锌粉的反应属于放热反应,故C不符合题意;
D.镁条在二氧化碳中的燃烧是放热反应,故D不符合题意;
本题答案B。
11.B
【分析】“乌铜走银”是部分氧化的银丝镶嵌于铜器表面,艺人用手边捂边揉搓铜器,铜表面逐渐变黑,银丝变得银光闪闪,构成原电池的反应,银丝发生还原反应,氧化银转化为单质银,电极反应为:Ag2O+2e-+H2O=2Ag+2OH-,Cu为正极,电极反应为:Cu-2e-+2OH-=CuO+H2O,单质银活泼性较弱,可长时间保持光亮,据此分析解题。
【详解】A.由分析可知,“乌铜走银”利用的是原电池原理,A错误;
B.由分析可知,银丝发生还原反应,氧化银转化为单质银,电极反应为:Ag2O+2e-+H2O=2Ag+2OH-,Cu为正极,电极反应为:Cu-2e-+2OH-=CuO+H2O,故“乌铜走银”的总反应为,B正确;
C.由分析可知,银丝一极的电极反应式为,C错误;
D.由反应方程式Cu-2e-+2OH-=CuO+H2O可知,每生成时转移电子,D错误;
故答案为:B。
12.D
【分析】由物质转化关系可知,Al作负极,电极反应式为,PbO2作正极,电解反应式为,M区的电解质溶液为KOH溶液,据此作答。
【详解】A. 根据分析,K+由x膜向R区移动,故x膜为阳离子交换膜,A错误;
B.M区的电解质溶液为KOH溶液,由题图知N区的电解质溶液为H2SO4溶液,则R区的电解质溶液为K2SO4溶液,由N区通过y膜移向R区,再结合由M区迁移过来的K+,使R区K2SO4溶液浓度增大,B错误;
C.根据B的分析,y膜为阴离子交换膜,C错误;
D.M区消耗时,转移电子,则N区消耗、,同时有移向R区,相当于减少,同时生成,则R区的电解质溶液实际减少的质量为,D正确;
故选D。
13. 原电池 阳极 280 1.60 减小 增大
【分析】由图可知,甲池为燃料电池,通入甲醇的的Pt电极为负极,碱性条件下,甲醇在负极失去电子发生氧化反应生成碳酸根离子和水,通入氧气的Pt电极为正极,碱性条件下,氧气在正极得到电子发生还原反应生成氢氧根离子;乙池为电解池,A电极为电解池的阳极,水在阳极失去电子发生氧化反应生成氧气,B电极为阴极,银离子在阴极得到电子发生还原反应生成银;丙池为电解池,C电极为阳极,氯离子在阳极失去电子发生氧化反应生成氯气,D电极为阴极,铜离子在阴极得到电子发生还原反应生成铜。
【详解】(1)由分析可知,甲池为燃料电池,通入甲醇的的Pt电极为负极,碱性条件下,甲醇在负极失去电子发生氧化反应生成碳酸根离子和水,故答案为:原电池;;
(2) 由分析可知,乙池为电解池,A电极为电解池的阳极,故答案为:阳极;
(3)5.04g银的物质的量为=0.05mol,由得失电子数目守恒可知,甲池中理论上消耗氧气的体积为0.05mol××22.4L/mol×1000mL/L=280mL,丙池中D极析出铜的质量为0.05mol××64g/mol=1.60g,故答案为:280;1.60;
(4) 若丙池中电极不变,将其溶液换成氯化钠溶液,电键闭合一段时间后,甲池中的总反应为2CH3OH + 3O2 + 4OH-= 2CO + 6H2O,反应中消耗氢氧根离子,溶液的pH将减小;丙池中电解氯化钠溶液的方程式为2NaCl + 2H2O2NaOH + H2↑ + Cl2↑,反应中生成氢氧钠,溶液的pH将增大,故答案为:减小;增大。
14.(1) 负极; 浓硫酸; SO-2e-+H2O=SO+2H+;
(2) Li++e-=Li; 2H2O-4e-=O2↑+4H+; Cl2+H2O=HCl+HClO;
【详解】(1)电解池中阴离子朝阳离子移动,阴离子朝阴极移动,根据图示,a为阴极接电源负极,b为阳极接电源正极。SO在b电极失电子生成SO,电极反应式为:SO-2e-+H2O=SO+2H+,C处流出的物质为浓硫酸;
(2)Li+得电子生成Li,电极反应式为:Li++e-=Li;海水中的水在阳极失电子生成O2,电极反应式:2H2O-4e-=O2↑+4H+;氯气与水反应生成盐酸和次氯酸:Cl2+H2O=HCl+HClO。
15. 没有停止
【详解】(1)该电池对应的氧化还原反应是一个可逆反应,可逆反应的特点是不能进行完全,达到平衡时反应仍在进行,没有停止;向B烧杯中加入浓盐酸时,该可逆反应正向进行,正极发生还原反应,电极反应式为;
(2)向B烧杯中加入40%的溶液时,被氧化成,负极发生氧化反应,电极反应式为。
16. C2H5OH-12e-+16OH-==2CO32-+11H2O 4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+ 有红色固体(Cu)析出 1 CuO或CuCO3 0.01mol Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑。
【分析】甲池为燃料电池,乙池和丙池都为电解池。甲池中,加入乙醇的电极为负极,通氧气的电极为正极;则乙池中石墨电极为阳极,Ag电极为阴极;丙池中,左边Pt电极为阳极,右边Pt电极为阴极。
(1) 甲装置中加入乙醇的电极为负极,乙醇失电子,生成的产物再与KOH溶液反应,最后生成碳酸盐和水。
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上发生H2O失电子生成O2和H+的反应,在Ag电极上发生Cu2+得电子生成Cu的反应,由此可确定此电极附近观察到的现象。
(3) 电解一段时间,当甲池消耗了112 mLO2(标况下),利用电荷守恒,可求出乙装置中生成n(H+),从而求出溶液的pH。若要将该溶液完全恢复到电解前的浓度和pH,则需往溶液中加入阴、阳极生成物发生化合反应的产物。
(4) 丙装置中电解MgCl2溶液,可利用电解饱和食盐水的反应进行类推,同时要注意差异性,即生成Mg(OH)2沉淀。
【详解】(1)甲装置中加入乙醇的电极为负极,乙醇失电子,生成的产物再与KOH溶液反应,最后生成碳酸盐和水,电极反应式为C2H5OH-12e-+16OH-==2CO32-+11H2O。答案为:C2H5OH-12e-+16OH-==2CO32-+11H2O;
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极(阳极)上发生H2O失电子生成O2和H+的反应,电极反应式为4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+;在Ag电极(阴极)上发生反应Cu2++2e-=Cu,此电极附近观察到的现象为有红色固体(Cu)析出。答案为:4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+;有红色固体(Cu)析出;
(3)n(O2)==0.005mol,由O2——4H+,可求出n(H+)=0.005mol×4=0.02mol,c(H+)==0.1mol/L,pH=1。阳极生成O2(0.005mol),阴极生成Cu(0.01mol),2Cu+O2=2CuO(0.01mol),所以需往电解后的溶液中加入0.01mol CuO或CuCO3,可将该溶液完全恢复到电解前的浓度和pH。答案为:有红色固体(Cu)析出;1;CuO或CuCO3;0.01mol;
(4) 丙装置中电解MgCl2溶液,可利用电解饱和食盐水的反应进行类推,从而得出总反应的离子方程式为Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑。答案为:Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑。
【点睛】电解反应发生后,要恢复原有电解质的组成和性质,需要往电解后的溶液中加入物质,该物质通常为阴、阳极电解产物(离开电解质溶液)发生化合反应的产物,或相当于它们的物质。如本题中,加入CuO,也可以加入CuCO3(与酸反应生成盐,CO2和水,CO2逸出,相当于加入CuO),但若加入Cu(OH)2,相当于多加了水,必然造成电解质浓度减小。
17.B2H6(g)+3O2(g)=B2O3(s)+3H2O(g) ΔH=-2033kJ·mol-1
【分析】结合热化学方程式和盖斯定律计算,再写出发生反应的热化学方程式。
【详解】0.3molB2H6气体在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,则1molB2H6完全反应放出2165 kJ热量,则该热化学反应方程式为①B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165 kJ mol-1 ;H2O(l)转化为H2O(g)的ΔH=+44 kJ·mol-1,即②H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,根据盖斯定律①+②×3可得B2H6(g)+3O2(g)=B2O3(s)+3H2O(g),此时ΔH=(-2165 kJ mol-1)+(+44 kJ·mol-1)×3=-2033kJ·mol-1,则气态乙硼烷完全燃烧生成气态水时的热化学方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(g) ΔH=-2033kJ·mol-1。
【点睛】应用盖斯定律进行简单计算的基本方法是参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般2~3个)进行合理“变形”,如热化学方程式颠倒、乘除以某一个数,然后将它们相加、减,得到目标热化学方程式,求出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。
18. H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=-725.76kJ/mol 2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=-488.3kJ/mol N2(g)+3H2(g)═2NH3(g)△H=-92kJ/mol
【详解】(1)中和热是生成1molH2O时放出的热量,即表示H2SO4与NaOH反应的中和热的热化学方程式为H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol;
(2)利用△H与化学计量数的关系,燃烧1g甲醇放热22.68kJ,得出燃烧1mol甲醇放出的热量为22.68kJ =725.76kJ,甲醇燃烧热的热化学方程式为CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=-725.76kJ/mol;
(3)已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+O2(g)=H2O(l) ΔH3=-285.8kJ/mol
根据盖斯定律,由②×2+③×2-①得出:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=ΔH2×2+ΔH3×2-ΔH1=-488.3kJ/mol;
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,反应为N2+3H2═2NH3;反应焓变△H=拆化学键吸收能量-形成化学键放出的能量=946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92kJ/mol;则N2与H2反应生成NH3的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-92kJ/mol。
19. 阳 60℃ 蒸发浓缩
【分析】电解Ⅰ中会生成氯气、氢气、氢氧化钠,氯气与碳酸钠发生歧化生成、二氧化碳和NaCl,电解Ⅱ中失电子氧化为,加入盐酸使歧化反应生成的氯化钠析出,经过滤除去, 反应Ⅱ为高氯酸和碱式碳酸铜反应得到,据此分析解题。
【详解】(1)电解食盐水制备氯气:,为了防止阴极产生的氢氧根向阳极移动与氯气反应,所用的离子交换膜应为阳离子交换膜。
(2)①歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为,“歧化反应”的化学方程式为:。
②根据图中信息可知,“歧化反应”阶段在60℃时,产率最高在80%以上。
(3)将“操作a”获得60%以上高氯酸,“操作a”的名称为蒸发浓缩;由流程图可知“反应Ⅰ”经蒸发结晶后得到的晶体可循环利用。
(4)根据流程图及以上物质转化分析可得关系式:,产率,,产率为。
(5)根据A方式化合价的升降可知,该反应中1分解转移电子数为16,4在该温度下按A、B各占50%的方式完全分解,说明A方式中2高氯酸铜反应转移电子的物质的量为32,再根据A、B两种方式转移的电子数之比为,故B方式中2高氯酸铜反应转移电子的物质的量应为28,而铜元素化合价不变,因此B方式中氯元素由+7价变为0价,得到电子为,氧元素由-2价变为0价,失去电子为,利用电子守恒配平,故可知生成物为、和,则B方式为:。
20. 还原剂,将三价钴还原成二价钴 温度过高,会分解 生成的氯气会造成污染,且盐酸易挥发,浪费很大 b 57
【分析】该锂离子电池正极铝钴膜主要含有、等,处理该正极废料的一种流程如图,第一步碱溶,氢氧化钠和铝反应生成偏铝酸钠,过滤后,第二步酸溶,和硫酸和过氧化氢反应,过氧化氢把正三价的钴还原为正二价的钴,生成硫酸钴,同时生成硫酸锂,第三步加氨水调pH除锂,硫酸锂与氨水反应生成沉淀,第四步加草酸铵沉钴,草酸铵和硫酸钴反应生成草酸钴沉淀。在图1锂离子电池中,a极为锂电池的正极,b极为锂电池的负极。在图3电解池中失去电子生成,则所在电极为阳极, c应与锂电池的正极a极相连,d应与锂电池的负极b相连。
【详解】(1) 该锂离子电池正极铝钴膜主要含有、等,处理该正极废料第一步碱溶,氢氧化钠和铝反应生成偏铝酸钠,反应的离子方程式为 故答案为;
(2) 第三步加氨水调pH除锂,硫酸锂与氨水反应生成沉淀,滤渣的主要成分的化学式为,故答案为;
(3)第二步酸溶,和硫酸和过氧化氢反应,过氧化氢把正三价的钴还原为正二价的钴,生成硫酸钴,同时生成硫酸锂,“酸溶”时作还原剂,把正三价的钴还原为正二价的钴;过氧化氢不稳定,受热易分解,所以“酸溶”时温度不宜过高;盐酸可以代和的混合液,但工业上都不采用盐酸,是因为把氯离子氧化生成氯气,氯气有毒,易污染环境,且盐酸易挥发,也会产生污染和浪费。故答案为:还原剂,将三价钴还原成二价钴;温度过高,会分解;生成的氯气会造成污染,且盐酸易挥发,浪费很大;
(4)图1中的锂离子电池,a是正极,b是负极,而图3中的电解池中失去电子生成,则所在电极为阳极, c应与锂电池的正极a极相连,d应与锂电池的负极b相连。电解池中阳极失去电子生成,阴极氢离子得到电子生成氢气,总反应离子方程式为;当电池中有移向正极时,在电解池中阳离子会向阴极移动,因为是阳离子交换膜,所以电解池左侧的钾离子会透过阳离子交换膜进入右侧,则阴极区溶液质量会增加,的物质的量为1.5mol,则进入右侧的钾离子也为1.5mol,则钾离子的质量为1.5mol×39g/mol=58.5g,同时会有0.75mol的氢气放出,则氢气的质量为0.75mol×2g/mol=1.5g,则阴极区的质量变化量为58.5g-1.5g=57g,故答案为:b;
;57g;
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
