化学人教版(2019)必修第二册7.3.2乙酸(共47张ppt) 课件官能团与有机物的分类
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.2乙酸(共47张ppt) 课件官能团与有机物的分类 |  | |
| 格式 | pptx | ||
| 文件大小 | 70.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-11 09:24:40 | ||
图片预览










文档简介
(共47张PPT)
生活中的常识
你知道吗?
如果开瓶后多余的葡萄酒密封不够严实,时间久了就会发酸,你知道其中的科学原理吗?
米酒香甜可口,保持期不长,久置即酸,这是为什么?
第三节
乙醇与乙酸
第七章 有机化合物
第2课时乙酸
官能团与有机物的分类
食醋是生活中常见的调味品,其主要成分就是乙酸,其中含有3% ~ 5%的乙酸,所以乙酸又被称为醋酸
01
乙酸的物理性质
结合生活经验以及所学知识,想想乙酸的物理性质
课本P79
颜色 气味 状态(通常) 熔点 沸点 溶解性
16.6 ℃ 118 ℃
无色
强烈刺激
性气味
液态
易溶于水
和乙醇
说明:当温度低于乙酸的熔点时,乙酸会凝结成类似冰一样的晶体,故纯净的乙酸又称为冰醋酸。
分子间存在“氢键”的缘故
1.乙酸的物理性质
氢键
氢键
乙醇能与水分子形成氢键
乙醇与水以任意比互溶的原因
回忆
乙醇与乙醇能形成氢键
请你联想!
乙酸和乙醇的结构相似吗?
02
乙酸的结构
2.乙酸的分子组成与结构
乙酸的分子式为C2H4O2,依据C、H、O三种原子成键特征,请写出可能的结构。
价键原理说明:分子中每个碳原子可连接四个原子、每个氧原子可连接两个原子、每个氢原子只连接一个原子。
乙酸的分子结构
分子式 结构式 结构简式 官能团 球棍模型 空间填充模型
C2H4O2
羧基
CH3COOH
O
CH3 C-OH
或
H
O
H
H—C—C—O—H
—COOH
或
羧基
—COOH
官能团
气
羊
酉
夋
羊
夋
羧基是含氧的酸性官能团!
乙酸是烃的含氧衍生物,有机羧酸
羧的来源
羧基
乙酸在生活中除了调味,你知道还有其他应用呢
课本P79
CaCO3 +2CH3COOH→(CH3COO)2Ca +CO2↑+H2O
CH3COOH CH3COO-+H+
03
乙酸的化学性质
在羧基官能团中是什么键断裂导致酸性?
H+
+
CH3COOH>H2CO3
设计一个实验,验证酸性:CH3COOH>H2CO3
3.乙酸的酸性
(1)A试剂为_________________,B试剂为___________。
(2)证明乙酸强于碳酸的实验现象:_______________________________________________________________。
某化学小组要证实乙酸的酸性强于碳酸的酸性,设计如图装置。
选择试剂:0.1 mol· L-1稀醋酸,碳酸钠粉末,醋酸钠,水。
试回答下列问题:
0.1 mol·L-1稀醋酸
碳酸钠粉末
当0.1 mol·L-1稀醋酸滴入圆底烧瓶时,产生无色气泡,澄清石灰水变浑浊
(3)涉及的化学反应方程式为______________________________________
____________________________________________。
2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O;
CO2+Ca(OH)2===CaCO3↓+H2O
练习
设计一个实验,验证酸性:HCl>CH3COOH
①用相同浓度的盐酸和醋酸分别和碳酸钙反应,根据反应速率判断;
②相同温度和物质的量浓度的醋酸和盐酸分别与镁反应,反应盐酸激烈
HCl>CH3COOH>H2CO3
思考:如何设计实验证明酸性: CH3COOH > H2CO3 > H2SiO3
具有酸的通性(断O—H键)
3.乙酸的酸性
乙酸的酸性
乙酸是一种重要的有机弱酸,具有酸的通性。
①与活泼金属Zn反应:________________________________________。
②与金属氧化物CuO反应:________________________________________。
③与碱NaOH中和反应:_______________________________________。
④食醋浸泡含有水垢的水壶,除去水垢的化学方程式为___________________________________________________,此反应说明CH3COOH的酸性比H2CO3的强。
2CH3COOH+Zn→(CH3COO)2Zn+H2↑
2CH3COOH+CuO→(CH3COO)2Cu+H2O
CH3COOH+NaOH→CH3COONa+H2O
2CH3COOH+CaCO3→(CH3COO)2Ca+CO2↑+H2O
CH3COOH CH3COO- +H+
根据不同基团之间的相互影响分析乙酸、水、乙醇中,羟基氢的活泼性强弱
实验证明下列物质:①C2H5OH ②水 ③醋酸溶液,都能与金属钠反应放出H2,产生H2的速率由大到小的顺序是 。
③>②>①
羟基上H的活动性:
CH3COOH > H2O > C2H5OH
氢键
乙酸能与水分子形成氢键
乙酸易溶于乙醇,水的原因
解释
乙酸与乙醇能形成氢键
氢键
氢键
羟基
比醇羟基氢易电离:显酸性
乙酸的化学性质主要由其分子中的羧基 决定,根据不同基团之间的相互影响分析乙酸的酸性的原因。
乙酸的电离断O—H键
其他键是否可以断裂?
你知道为什么吗?
生活经验,在做鱼时会加醋和酒,鱼会更香醇鲜美
烧鱼时乙酸与乙醇发生了什么反应?
反应中乙酸断了什么键?
请思考:
实验探究课本P80实验探究
实验现象:
饱和碳酸钠溶液的液面上有__________________,且能闻到香味。
无色透明的油状液体
醇与酸反应生成酯和水的反应叫做酯化反应,是可逆反应,属于取代反应。
乙醇和乙酸在浓硫酸的作用下生成了一种不易溶于水的,具有香味的物质
乙酸与乙醇反应的化学方程式为
酯化反应
酯化反应
+
+
H2O
CH3COOCH2CH3+H2O
CH3COOH+CH3CH2OH
乙酸
乙醇
乙酸分子与乙醇分子反应时,各自断什么键结合成乙酸乙酯分子?
×
浓H2SO4
b、 O O
CH3—C—O—H+HO—C2H5 CH3—C—O—C2H5 + H2O
a、
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
可能一
可能二
请你写一下!
根据乙酸和乙醇发生酯化反应可能的断键方式书写方程式
同位素示踪法
18
+
18
+
即:酸脱羟基,醇脱氢
酯化反应断键规律
酯化反应既是醇的性质,也是酸的性质
碎瓷片防暴沸
导管在饱和Na2CO3液面上:防止倒吸
长导管冷凝、回流、导气作用
加物顺序:乙醇→浓硫酸→乙酸
饱和Na2CO3作用
①溶解乙醇;
②中和乙酸;
③降低乙酸乙酯的溶解度,利于酯的析出
浓硫酸:催化剂、吸水剂
酯化反应注意事项
小心加热:减少乙酸、乙醇的挥发。
加热:加快反应速率,蒸出乙酸乙酯,提高乙酸转化率。
分离碳酸钠和乙酸乙酯:分液
实验中的注意事项
(1)试剂的加入顺序
先加入乙醇,然后沿器壁慢慢加入浓硫酸,冷却后再加入CH3COOH。
(2)装置特点
①均匀加热目的:能增大反应速率,并将生成的乙酸乙酯及时蒸出,有利于乙酸乙酯的生成;
②大试管倾斜45°角目的:增大受热面积;
③小试管内导气管末端要在液面以上,不能伸入液面以下,以防止倒吸。
(3)酯的分离:用分液法分离出乙酸乙酯。
(4)试剂的作用
①浓硫酸:
a.催化剂——增大反应速率,缩短达到平衡所需时间;
b.吸水剂——吸收反应中生成的水,促使反应向生成乙酸乙酯的方向进行,提高CH3COOH、CH3CH2OH的转化率。
②饱和Na2CO3溶液:
a.中和挥发出来的乙酸;
b.溶解挥发出来的乙醇;
c.减小乙酸乙酯在水中的溶解度,便于分层,得到乙酸乙酯。
分子式 结构式 结构简式 官能团 球棍模型
C4H8O2
酯基
CH3
O
C
O
C2H5
CH3COOCH2CH3
—COOR
O
C
O
乙酸乙酯是酯类物质中的一种
不溶于水,易溶于有机溶剂,密度比水小,低级酯有香味
课本P82-6 请描述下列物质与水混合并静置后的现象,结合该物质的性质进行解释
练习
① , 转化为 。
② , 转化为 。
烯烃
醇类
写出如下转化中反应的化学方程式,并分析官能团及有机物类别变化
醇类
醛类
③ , 转化为 。
④ , 转化为 。
醛类
羧酸类
羧酸和醇
酯
练习
04
官能团与有机物的分类
课本P81
根据有机物分子中所含官能团不同,常见有机化合物有如下分类,并写出官能团名称或结构简式
有机物
—C≡C—
4.官能团与有机化合物的分类
有机物
—OH
(酯基)
碳卤键
—CHO
羟基
醛基
(12)
(13)
(14)
(15)
按官能团对这些化合物进行分类:
烷烃
烷烃
烯烃
烯烃
炔烃
炔烃
卤代烃
卤代烃
醇
醇
羧酸
芳香烃
芳香烃
环烷烃
环烷烃
(1)CH4
CH3
(2)CH3CHCH2CH3
(3)CH2=CH2
CH3
(4)CH3-C=CHCH3
(5)CH≡CH
(6)CH3C≡CH
(7)CH3-Cl
(8)CH3CH2Br
(9)CH3OH
(10)CH3CH2OH
CH3
(11)CH3C-OH
O
练习
官能团 主要性质
与酸性KMnO4溶液的氧化反应
与溴水或溴的CCl4溶液的加成反应
加聚反应
醇羟基(—OH) 与活泼金属的置换反应
在Cu或Ag的催化作用下的氧化反应
与羧酸的酯化反应、取代反应
羧基(—COOH) 酸性:中和反应,与活泼金属反应
与盐反应,与金属氧化物反应等
与醇的酯化反应、取代反应
酸、碱性条件下的水解反应、取代反应
写出下列物质间转化的化学方程式,并注明反应条件,分析转化过程中官能团与有机物类别的变化。
C2H5OH
CH3COOC2H5
C2H4
CH3CHO
练习
课本P82-8
1. 有关官能团和物质类别关系,下列说法正确的是( )
A.有机物分子中含有 官能团,则该有机物一定为烯烃类
B. 和 分子中都含有 (醛基),则两者同属于醛类
C.CH3CH2Br可以看作CH3CH3的一个氢原子被—Br代替的产物,因此
CH3CH2Br属于烃类
D. 的官能团为—OH(羟基),属于醇类
D
练习
2. 下列关于乙酸的说法中不正确的是( )
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要的有机酸,是有强烈刺激性气味的液体D.乙酸分子中有四个氢原子,所以不是一元酸
D
3. 下列物质和乙酸为同系物的是( )
A. B.CH2==CH—COOH
C. D.
A
练习
1、装药品的顺序如何?
2、浓硫酸的作用是什么?
3、加热的目的是什么?
4、导管有什么作用?
5、为何用饱和Na2CO3溶液作为吸收液?
先加乙醇再加浓H2SO4最后加乙酸
催化剂、吸水剂
提高反应速率
导气、冷凝
①中和乙酸②溶解乙醇③降低乙酸乙酯在水中的溶解度
6、为什么导管不插入饱和Na2CO3溶液中?
防止溶液倒吸
乙酸乙酯的制备实验中的几个为什么?
加强记忆
防倒吸的方法还可以如下:
A.其分子式为C15H20O4
B.该物质不能使酸性KMnO4溶液褪色
C.能发生加成反应、取代反应、氧化反应、酯化反应
D.1 mol该物质与足量NaOH溶液反应,最多消耗1 mol NaOH
4.北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开。S-诱抗素的分子结构如图所示,下列关于该分子的说法不正确的是
B
练习
(1)1 mol该有机物和过量的金属钠反应最多可以生成_________H2。
(2)该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为_________。
1.5 mol
3∶2∶2
5.某有机物的结构简式如图所示:
谢谢观看
生活中的常识
你知道吗?
如果开瓶后多余的葡萄酒密封不够严实,时间久了就会发酸,你知道其中的科学原理吗?
米酒香甜可口,保持期不长,久置即酸,这是为什么?
第三节
乙醇与乙酸
第七章 有机化合物
第2课时乙酸
官能团与有机物的分类
食醋是生活中常见的调味品,其主要成分就是乙酸,其中含有3% ~ 5%的乙酸,所以乙酸又被称为醋酸
01
乙酸的物理性质
结合生活经验以及所学知识,想想乙酸的物理性质
课本P79
颜色 气味 状态(通常) 熔点 沸点 溶解性
16.6 ℃ 118 ℃
无色
强烈刺激
性气味
液态
易溶于水
和乙醇
说明:当温度低于乙酸的熔点时,乙酸会凝结成类似冰一样的晶体,故纯净的乙酸又称为冰醋酸。
分子间存在“氢键”的缘故
1.乙酸的物理性质
氢键
氢键
乙醇能与水分子形成氢键
乙醇与水以任意比互溶的原因
回忆
乙醇与乙醇能形成氢键
请你联想!
乙酸和乙醇的结构相似吗?
02
乙酸的结构
2.乙酸的分子组成与结构
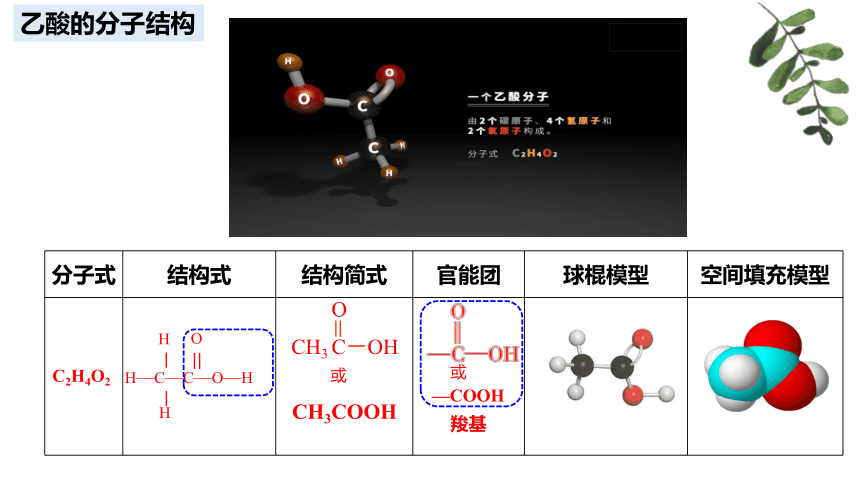
乙酸的分子式为C2H4O2,依据C、H、O三种原子成键特征,请写出可能的结构。
价键原理说明:分子中每个碳原子可连接四个原子、每个氧原子可连接两个原子、每个氢原子只连接一个原子。
乙酸的分子结构
分子式 结构式 结构简式 官能团 球棍模型 空间填充模型
C2H4O2
羧基
CH3COOH
O
CH3 C-OH
或
H
O
H
H—C—C—O—H
—COOH
或
羧基
—COOH
官能团
气
羊
酉
夋
羊
夋
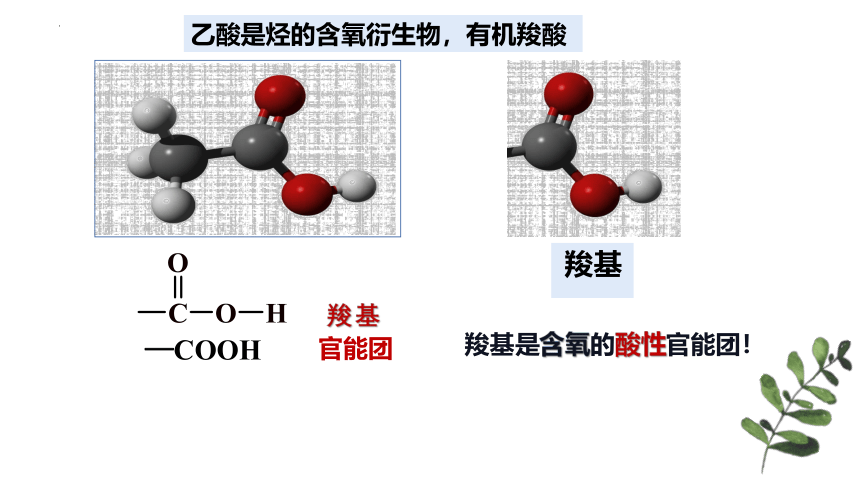
羧基是含氧的酸性官能团!
乙酸是烃的含氧衍生物,有机羧酸
羧的来源
羧基
乙酸在生活中除了调味,你知道还有其他应用呢
课本P79
CaCO3 +2CH3COOH→(CH3COO)2Ca +CO2↑+H2O
CH3COOH CH3COO-+H+
03
乙酸的化学性质
在羧基官能团中是什么键断裂导致酸性?
H+
+
CH3COOH>H2CO3
设计一个实验,验证酸性:CH3COOH>H2CO3
3.乙酸的酸性
(1)A试剂为_________________,B试剂为___________。
(2)证明乙酸强于碳酸的实验现象:_______________________________________________________________。
某化学小组要证实乙酸的酸性强于碳酸的酸性,设计如图装置。
选择试剂:0.1 mol· L-1稀醋酸,碳酸钠粉末,醋酸钠,水。
试回答下列问题:
0.1 mol·L-1稀醋酸
碳酸钠粉末
当0.1 mol·L-1稀醋酸滴入圆底烧瓶时,产生无色气泡,澄清石灰水变浑浊
(3)涉及的化学反应方程式为______________________________________
____________________________________________。
2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O;
CO2+Ca(OH)2===CaCO3↓+H2O
练习
设计一个实验,验证酸性:HCl>CH3COOH
①用相同浓度的盐酸和醋酸分别和碳酸钙反应,根据反应速率判断;
②相同温度和物质的量浓度的醋酸和盐酸分别与镁反应,反应盐酸激烈
HCl>CH3COOH>H2CO3
思考:如何设计实验证明酸性: CH3COOH > H2CO3 > H2SiO3
具有酸的通性(断O—H键)
3.乙酸的酸性
乙酸的酸性
乙酸是一种重要的有机弱酸,具有酸的通性。
①与活泼金属Zn反应:________________________________________。
②与金属氧化物CuO反应:________________________________________。
③与碱NaOH中和反应:_______________________________________。
④食醋浸泡含有水垢的水壶,除去水垢的化学方程式为___________________________________________________,此反应说明CH3COOH的酸性比H2CO3的强。
2CH3COOH+Zn→(CH3COO)2Zn+H2↑
2CH3COOH+CuO→(CH3COO)2Cu+H2O
CH3COOH+NaOH→CH3COONa+H2O
2CH3COOH+CaCO3→(CH3COO)2Ca+CO2↑+H2O
CH3COOH CH3COO- +H+
根据不同基团之间的相互影响分析乙酸、水、乙醇中,羟基氢的活泼性强弱
实验证明下列物质:①C2H5OH ②水 ③醋酸溶液,都能与金属钠反应放出H2,产生H2的速率由大到小的顺序是 。
③>②>①
羟基上H的活动性:
CH3COOH > H2O > C2H5OH
氢键
乙酸能与水分子形成氢键
乙酸易溶于乙醇,水的原因
解释
乙酸与乙醇能形成氢键
氢键
氢键
羟基
比醇羟基氢易电离:显酸性
乙酸的化学性质主要由其分子中的羧基 决定,根据不同基团之间的相互影响分析乙酸的酸性的原因。
乙酸的电离断O—H键
其他键是否可以断裂?
你知道为什么吗?
生活经验,在做鱼时会加醋和酒,鱼会更香醇鲜美
烧鱼时乙酸与乙醇发生了什么反应?
反应中乙酸断了什么键?
请思考:
实验探究课本P80实验探究
实验现象:
饱和碳酸钠溶液的液面上有__________________,且能闻到香味。
无色透明的油状液体
醇与酸反应生成酯和水的反应叫做酯化反应,是可逆反应,属于取代反应。
乙醇和乙酸在浓硫酸的作用下生成了一种不易溶于水的,具有香味的物质
乙酸与乙醇反应的化学方程式为
酯化反应
酯化反应
+
+
H2O
CH3COOCH2CH3+H2O
CH3COOH+CH3CH2OH
乙酸
乙醇
乙酸分子与乙醇分子反应时,各自断什么键结合成乙酸乙酯分子?
×
浓H2SO4
b、 O O
CH3—C—O—H+HO—C2H5 CH3—C—O—C2H5 + H2O
a、
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
可能一
可能二
请你写一下!
根据乙酸和乙醇发生酯化反应可能的断键方式书写方程式
同位素示踪法
18
+
18
+
即:酸脱羟基,醇脱氢
酯化反应断键规律
酯化反应既是醇的性质,也是酸的性质
碎瓷片防暴沸
导管在饱和Na2CO3液面上:防止倒吸
长导管冷凝、回流、导气作用
加物顺序:乙醇→浓硫酸→乙酸
饱和Na2CO3作用
①溶解乙醇;
②中和乙酸;
③降低乙酸乙酯的溶解度,利于酯的析出
浓硫酸:催化剂、吸水剂
酯化反应注意事项
小心加热:减少乙酸、乙醇的挥发。
加热:加快反应速率,蒸出乙酸乙酯,提高乙酸转化率。
分离碳酸钠和乙酸乙酯:分液
实验中的注意事项
(1)试剂的加入顺序
先加入乙醇,然后沿器壁慢慢加入浓硫酸,冷却后再加入CH3COOH。
(2)装置特点
①均匀加热目的:能增大反应速率,并将生成的乙酸乙酯及时蒸出,有利于乙酸乙酯的生成;
②大试管倾斜45°角目的:增大受热面积;
③小试管内导气管末端要在液面以上,不能伸入液面以下,以防止倒吸。
(3)酯的分离:用分液法分离出乙酸乙酯。
(4)试剂的作用
①浓硫酸:
a.催化剂——增大反应速率,缩短达到平衡所需时间;
b.吸水剂——吸收反应中生成的水,促使反应向生成乙酸乙酯的方向进行,提高CH3COOH、CH3CH2OH的转化率。
②饱和Na2CO3溶液:
a.中和挥发出来的乙酸;
b.溶解挥发出来的乙醇;
c.减小乙酸乙酯在水中的溶解度,便于分层,得到乙酸乙酯。
分子式 结构式 结构简式 官能团 球棍模型
C4H8O2
酯基
CH3
O
C
O
C2H5
CH3COOCH2CH3
—COOR
O
C
O
乙酸乙酯是酯类物质中的一种
不溶于水,易溶于有机溶剂,密度比水小,低级酯有香味
课本P82-6 请描述下列物质与水混合并静置后的现象,结合该物质的性质进行解释
练习
① , 转化为 。
② , 转化为 。
烯烃
醇类
写出如下转化中反应的化学方程式,并分析官能团及有机物类别变化
醇类
醛类
③ , 转化为 。
④ , 转化为 。
醛类
羧酸类
羧酸和醇
酯
练习
04
官能团与有机物的分类
课本P81
根据有机物分子中所含官能团不同,常见有机化合物有如下分类,并写出官能团名称或结构简式
有机物
—C≡C—
4.官能团与有机化合物的分类
有机物
—OH
(酯基)
碳卤键
—CHO
羟基
醛基
(12)
(13)
(14)
(15)
按官能团对这些化合物进行分类:
烷烃
烷烃
烯烃
烯烃
炔烃
炔烃
卤代烃
卤代烃
醇
醇
羧酸
芳香烃
芳香烃
环烷烃
环烷烃
(1)CH4
CH3
(2)CH3CHCH2CH3
(3)CH2=CH2
CH3
(4)CH3-C=CHCH3
(5)CH≡CH
(6)CH3C≡CH
(7)CH3-Cl
(8)CH3CH2Br
(9)CH3OH
(10)CH3CH2OH
CH3
(11)CH3C-OH
O
练习
官能团 主要性质
与酸性KMnO4溶液的氧化反应
与溴水或溴的CCl4溶液的加成反应
加聚反应
醇羟基(—OH) 与活泼金属的置换反应
在Cu或Ag的催化作用下的氧化反应
与羧酸的酯化反应、取代反应
羧基(—COOH) 酸性:中和反应,与活泼金属反应
与盐反应,与金属氧化物反应等
与醇的酯化反应、取代反应
酸、碱性条件下的水解反应、取代反应
写出下列物质间转化的化学方程式,并注明反应条件,分析转化过程中官能团与有机物类别的变化。
C2H5OH
CH3COOC2H5
C2H4
CH3CHO
练习
课本P82-8
1. 有关官能团和物质类别关系,下列说法正确的是( )
A.有机物分子中含有 官能团,则该有机物一定为烯烃类
B. 和 分子中都含有 (醛基),则两者同属于醛类
C.CH3CH2Br可以看作CH3CH3的一个氢原子被—Br代替的产物,因此
CH3CH2Br属于烃类
D. 的官能团为—OH(羟基),属于醇类
D
练习
2. 下列关于乙酸的说法中不正确的是( )
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要的有机酸,是有强烈刺激性气味的液体D.乙酸分子中有四个氢原子,所以不是一元酸
D
3. 下列物质和乙酸为同系物的是( )
A. B.CH2==CH—COOH
C. D.
A
练习
1、装药品的顺序如何?
2、浓硫酸的作用是什么?
3、加热的目的是什么?
4、导管有什么作用?
5、为何用饱和Na2CO3溶液作为吸收液?
先加乙醇再加浓H2SO4最后加乙酸
催化剂、吸水剂
提高反应速率
导气、冷凝
①中和乙酸②溶解乙醇③降低乙酸乙酯在水中的溶解度
6、为什么导管不插入饱和Na2CO3溶液中?
防止溶液倒吸
乙酸乙酯的制备实验中的几个为什么?
加强记忆
防倒吸的方法还可以如下:
A.其分子式为C15H20O4
B.该物质不能使酸性KMnO4溶液褪色
C.能发生加成反应、取代反应、氧化反应、酯化反应
D.1 mol该物质与足量NaOH溶液反应,最多消耗1 mol NaOH
4.北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开。S-诱抗素的分子结构如图所示,下列关于该分子的说法不正确的是
B
练习
(1)1 mol该有机物和过量的金属钠反应最多可以生成_________H2。
(2)该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为_________。
1.5 mol
3∶2∶2
5.某有机物的结构简式如图所示:
谢谢观看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
