化学人教版(2019)选择性必修1 4.1原电池 课件(共42张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1原电池 课件(共42张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 28.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-11 09:29:28 | ||
图片预览






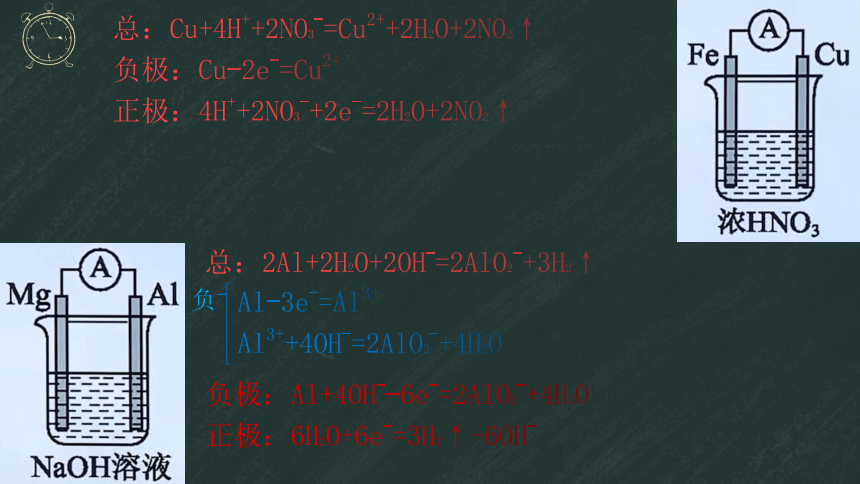




文档简介
(共42张PPT)
电化学
原电池
一、化学能转化为电能
1、火力发电——化学能间接转化为电能
化学能→热能→机械能→电能
火力发电弊端
→排放大量温室气体(CO2等)
→排放的废气可能导致酸雨(SO2等)
→产生废渣、废水
→化石燃料储存量有限
→能量转化率很低
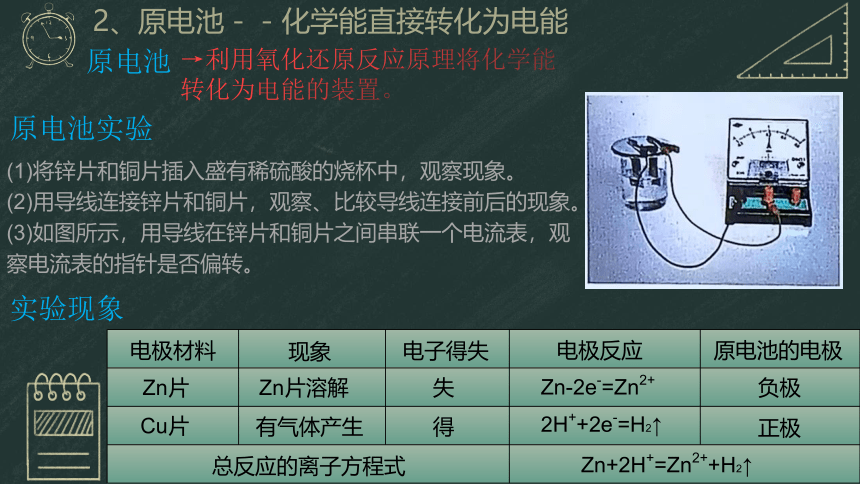
2、原电池--化学能直接转化为电能
原电池
→利用氧化还原反应原理将化学能转化为电能的装置。
原电池实验
(1)将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
(2)用导线连接锌片和铜片,观察、比较导线连接前后的现象。
(3)如图所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
实验现象
电极材料
现象
电子得失
电极反应
原电池的电极
Zn片
Cu片
Zn片溶解
有气体产生
失
得
Zn-2e-=Zn2+
2H++2e-=H2↑
负极
正极
总反应的离子方程式
Zn+2H+=Zn2++H2↑
二、原电池的工作原理
1、原电池的构成条件
反应
→自发完成的氧化还原反应
电极
→活泼性不同的两电极
电解质溶液
→有电解质溶液或熔融电解质
电路
→形成闭合回路
2、原电池的工作原理
总反应
→Zn+2H+=Zn2++H2↑
负失氧←
负极
→负极发生失电子的氧化反应
负极:Zn-2e-=Zn2+
正得还←
正极
→正极发生得电子的还原反应
正极:2H++2e-=H2↑
电流方向
→电流从正极出发经外电路到达负极(电子方向与电流相反)
离子方向
→阴离子移向负极,阳离子移向正极
3.原电池正负极的判断
根据电极材料判断
→一般活泼金属作负极,不活泼金属作正极
根据电流方向/电子方向判断
→电流 正极→外电路→负极
电子 负极→外电路→正极
根据电解质溶液中离子移动方向判断
→阴离子→负极(阳),阳离子→正极(阴)
根据两极产生的现象判断
→正极一般体现增重或有气体放出
负极一般体现减轻(实质是发生反应溶解)
根据原电池两极发生氧化/还原反应判断
→负失氧,正得还
→电子不下水,离子不上岸
正极
负极
①不活泼金属或石墨
②导线上电子流入的电极
③溶液中阳离子移向的电极
④发生还原反应的电极
①活泼金属
②导线上电子流出的电极
③溶液中阴离子移向的电极
④发生氧化反应的电极
(Mg-Al-NaOH除外)
三、原电池电极反应方程式的书写
1、电极反应式书写注意
★负失氧、正得还
★注意溶液的酸碱性,适当在电极反应方程式两边添加H+、OH-、H2O等,以遵循电荷守恒和质量守恒
★注意电极反应产物是否与电解质溶液反应
★活泼金属不一定为负极,如镁、铝、氢氧化钠电池中,不活泼的铝为负极
2、电极反应式的书写方法
先写总反应方程,再写负极/正极方程
→写出总反应
→写出其中容易写出的一个半反应(正极或负极)
→用总反应减去正极/负极反应,即得另一电极反应式
如:负极:Li-e-=Li+
如:Li+LiMn2O4=Li2Mn2O4
如:正极:LiMn2O4+Li++e-=Li2Mn2O4
先写总反应方程,再拆分总反应为氧化/还原反应两部分
→写出原电池的总反应
如:2Fe3++Cu=2Fe2++Cu2+
→把总反应按氧化反应和还原反应拆分为两个半反应,注明正、负极,并依据质量守恒、电荷守恒及电子得失守恒配平两个半反应
如:正极:2Fe3++2e-= 2Fe2+
负极:Cu-2e-=Cu2+
写出右图中原电池的电极反应方程式
总:Mg+2H+=Mg2++H2↑
负极:Mg-2e-=Mg2+
正极:2H++2e-=H2↑
总:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
负极:Cu-2e-=Cu2+
正极:4H++2NO3-+2e-=2H2O+2NO2↑
总:2Al+2H2O+2OH-=2AlO2-+3H2↑
负
Al-3e-=Al3+
Al3++4OH-=2AlO2-+4H2O
负极:Al+4OH--6e-=2AlO2-+4H2O
正极:6H2O+6e-=3H2↑+6OH-
四、一次性电池(干电池)
化学电源
一次性电池(干电池)
二次电池(可充电电池/蓄电池)
燃料电池
普通锌锰电池
碱性锌锰电池
银锌纽扣电池
铅蓄电池
镍镉电池
锂离子电池
氢氧燃料电池
甲醇燃料电池
2、普通锌锰电池
电池电解质溶液
→MnO2糊NH4Cl糊
负极(锌皮):
Zn-2e-=Zn2+
正极(石墨棒):
说法①2MnO2+2NH4++2e-=2MnO(OH)+2NH3
说法②2MnO2+2H++2e-=2MnO(OH)
说法③2MnO2+2NH4++2e-=Mn2O3+H2O+2NH3
总反应:
说法①Zn+2MnO2+2NH4+=Zn2++2MnO(OH)+2NH3
说法②Zn+2MnO2+2H+=Zn2++2MnO(OH)
说法③Zn+2MnO2+2NH4+=Zn2++Mn2O3+H2O+2NH3↑
→锌锰干电池因为电解质是NH4Cl,具有酸性因此无法长期储存。
→锌锰干电池放电过程中容易发生胀气或漏液,导致用电器损坏。
→一次电池,放电后无法充电,因为所发生的氧化还原反应不可逆。
3.碱性锌锰电池
电解质溶液
→湿的KOH
负极(锌皮):
Zn -2e- + 20H- = Zn(OH)2
正极(石墨棒):
说法①2MnO2+2H2O+2e-=2MnO(OH)+20H-
说法②2MnO2+H2O+2e-=Mn2O3+20H-
总反应:
说法① Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH)
说法②Zn+2MnO2+H2O=Zn(OH)2+Mn2O3
→碱性锌锰干电池电解质改进为KOH,使内部物质不易发生化学反应,有利于长期储存。
→碱性锌锰干电池由锌皮改成锌粉,如增加了防腐金属外壳或塑料包裹,还可制成防漏电电池。
→碱性条件下Zn2+无法稳定存在,会生成Zn(OH)2(S)
4.银锌纽扣电池
电解质溶液
→浸了KOH溶液的隔板
负极(锌皮):
Zn -2e- + 20H- = Zn(OH)2
正极(Ag2O):
Ag2O+H2O+2e-=2Ag+20H-
总反应:
Zn+Ag2O+H2O=2Ag+Zn(OH)2
→银锌电池具有体积小,电压稳定,电池比能量大,非常适合小电流连续长时间放电。
五、二次电池(蓄电池/充电电池)
1、铅蓄电池
→铅蓄电池是最常见的二次电池,正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液。
放电-负极(Pb板):
Pb+SO42--2e-=PbSO4
电子/离子移动方向:
电子经外电路流出,电流经外电路流入,阴-靠近负极(阳极)
放电-正极(PbO2板):
PbO2+SO42-+4H++2e-=PbS04+2H2O
电子/离子移动方向:
电子经外电路流入,电流经外电路流出,阳+靠近负极(阴极)
放电总反应:
PbO2+2H2SO4+Pb=2PbS04+2H2O
放电
Pb、PbO2、PbSO4都不溶于水,放电反应中产物虽然不溶于水,但是反应物有固体参与,因此不写沉淀符号
放电反应
五、二次电池(蓄电池/充电电池)
1、铅蓄电池
→铅蓄电池是最常见的二次电池,正极板上覆盖有PO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液。
充电-阴极(原负极):
PbSO4+2e-=Pb+SO42-
电子/离子移动方向:
电子由电源负极流入,电流与电子方向相反,阳+靠近负极(阴极)
充电-阳极(原正极):
PbSO4-2e-+2H2O=PbO2+SO42-+4H+
电子/离子移动方向:
电流由电源正极流出,电子与电流方向相反,阳+靠近正极(阳极)
充电总反应:
2PbS04+2H2O=PbO2+2H2SO4+Pb
充电
→充电总反应是放电总反应的逆过程,符号相反,但不互为可逆反应,因为条件不同。
充电反应
2.镍镉电池(了解)
→镍镉电池是出现于上世纪50年代的可充电碱性电池,充放电速度快,电压平稳,可充放电500次以上,寿命比铅酸电池长,但是有记忆效应,且Cd2+是致癌物质,对环境有很大危害。
电解质溶液
→湿的KOH
负极(Cd):
Cd+20H--2e-=Cd(OH)2
正极[NiO(OH)]:
2NiO (OH) +2H2O+2e-=2Ni (OH) 2+20H-
总反应:
2NiO(OH)+2H2O+Cd 2Ni(OH)2+Cd(OH)2
放电
充电
3.锂离子电池
→无记忆效应,比能量高,质地轻,可循环次数多,可用于制造手机等数码产品电池。
负极(Li):
Li-e-=Li+
→锂很活泼,因此锂电池里不能含水,一般用有机介质。
六、燃料电池
→燃料电池是一种连续地将燃料和氧化剂的化学能直接转化为电能的装置,与火力发电相比燃料利用率高、能量转化率高,在放电时需要外部持续供给燃料和氧化剂(通常是O2)
1.氢氧燃料电池
燃料电池
正极(O2)
酸性:
碱性/中性:
4H++O2+4e-=2H2O
2H2O+O2+4e-=40H-
酸性环境
总反应:
负极:
正极:
2H2+O2=2H2O
2H2-4e-=4H+
4H++O2+4e-=2H2O
中性环境
总反应:
负极:
正极:
2H2+O2=2H2O
2H2-4e-=4H+
2H2O+O2+4e-=40H-
碱性环境
总反应:
负极:
正极:
2H2+O2=2H2O
2H2+40H--4e-=4H2O
2H2O+02+4e-=40H-
2、甲烷燃料电池
酸性环境
负极:
正极:
总反应:
中性环境
负极:
正极:
总反应:
碱性环境
负极:
正极:
总反应:
CH4+202=CO2+2H2O
CH4+2H20-8e-=CO2+8H+
8H++202+8e-=4H2O
CH4+202=CO2+2H2O
CH4+2H20-8e-=CO2+8H+
4H20+202+8e-=80H-
CH4+2O2+20H-=CO32-+3H2O
CH4+10OH--8e-=CO32-+7H2O
4H20+202+8e-=80H-
七、新型电池——铝-空气-海水电池
电解质溶液
→海水
负极(铝):
4Al-12e-=4Al3+
正极(石墨-O2):
302+12e-+6H20=120H-
总反应:
4Al+302+6H20=4Al(OH)3
八、原电池原理的四大应用
金属活动性强弱
→一般活泼金属作负极,不活泼金属作正极
加快化学反应速率
→如用锌粒和稀硫酸反应制取氢气时,加入少许CuSO4溶液
用于金属的防护
→如钢闸门的防护可以用牺牲阳极的阴极保护法
设计原电池
→根据自发完成的氧化还原反应设计原电池
例:依据反应2Fe3++Cu=2Fe2++Cu2+设计原电池
谢谢观看
电化学
原电池
一、化学能转化为电能
1、火力发电——化学能间接转化为电能
化学能→热能→机械能→电能
火力发电弊端
→排放大量温室气体(CO2等)
→排放的废气可能导致酸雨(SO2等)
→产生废渣、废水
→化石燃料储存量有限
→能量转化率很低
2、原电池--化学能直接转化为电能
原电池
→利用氧化还原反应原理将化学能转化为电能的装置。
原电池实验
(1)将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
(2)用导线连接锌片和铜片,观察、比较导线连接前后的现象。
(3)如图所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
实验现象
电极材料
现象
电子得失
电极反应
原电池的电极
Zn片
Cu片
Zn片溶解
有气体产生
失
得
Zn-2e-=Zn2+
2H++2e-=H2↑
负极
正极
总反应的离子方程式
Zn+2H+=Zn2++H2↑
二、原电池的工作原理
1、原电池的构成条件
反应
→自发完成的氧化还原反应
电极
→活泼性不同的两电极
电解质溶液
→有电解质溶液或熔融电解质
电路
→形成闭合回路
2、原电池的工作原理
总反应
→Zn+2H+=Zn2++H2↑
负失氧←
负极
→负极发生失电子的氧化反应
负极:Zn-2e-=Zn2+
正得还←
正极
→正极发生得电子的还原反应
正极:2H++2e-=H2↑
电流方向
→电流从正极出发经外电路到达负极(电子方向与电流相反)
离子方向
→阴离子移向负极,阳离子移向正极
3.原电池正负极的判断
根据电极材料判断
→一般活泼金属作负极,不活泼金属作正极
根据电流方向/电子方向判断
→电流 正极→外电路→负极
电子 负极→外电路→正极
根据电解质溶液中离子移动方向判断
→阴离子→负极(阳),阳离子→正极(阴)
根据两极产生的现象判断
→正极一般体现增重或有气体放出
负极一般体现减轻(实质是发生反应溶解)
根据原电池两极发生氧化/还原反应判断
→负失氧,正得还
→电子不下水,离子不上岸
正极
负极
①不活泼金属或石墨
②导线上电子流入的电极
③溶液中阳离子移向的电极
④发生还原反应的电极
①活泼金属
②导线上电子流出的电极
③溶液中阴离子移向的电极
④发生氧化反应的电极
(Mg-Al-NaOH除外)
三、原电池电极反应方程式的书写
1、电极反应式书写注意
★负失氧、正得还
★注意溶液的酸碱性,适当在电极反应方程式两边添加H+、OH-、H2O等,以遵循电荷守恒和质量守恒
★注意电极反应产物是否与电解质溶液反应
★活泼金属不一定为负极,如镁、铝、氢氧化钠电池中,不活泼的铝为负极
2、电极反应式的书写方法
先写总反应方程,再写负极/正极方程
→写出总反应
→写出其中容易写出的一个半反应(正极或负极)
→用总反应减去正极/负极反应,即得另一电极反应式
如:负极:Li-e-=Li+
如:Li+LiMn2O4=Li2Mn2O4
如:正极:LiMn2O4+Li++e-=Li2Mn2O4
先写总反应方程,再拆分总反应为氧化/还原反应两部分
→写出原电池的总反应
如:2Fe3++Cu=2Fe2++Cu2+
→把总反应按氧化反应和还原反应拆分为两个半反应,注明正、负极,并依据质量守恒、电荷守恒及电子得失守恒配平两个半反应
如:正极:2Fe3++2e-= 2Fe2+
负极:Cu-2e-=Cu2+
写出右图中原电池的电极反应方程式
总:Mg+2H+=Mg2++H2↑
负极:Mg-2e-=Mg2+
正极:2H++2e-=H2↑
总:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
负极:Cu-2e-=Cu2+
正极:4H++2NO3-+2e-=2H2O+2NO2↑
总:2Al+2H2O+2OH-=2AlO2-+3H2↑
负
Al-3e-=Al3+
Al3++4OH-=2AlO2-+4H2O
负极:Al+4OH--6e-=2AlO2-+4H2O
正极:6H2O+6e-=3H2↑+6OH-
四、一次性电池(干电池)
化学电源
一次性电池(干电池)
二次电池(可充电电池/蓄电池)
燃料电池
普通锌锰电池
碱性锌锰电池
银锌纽扣电池
铅蓄电池
镍镉电池
锂离子电池
氢氧燃料电池
甲醇燃料电池
2、普通锌锰电池
电池电解质溶液
→MnO2糊NH4Cl糊
负极(锌皮):
Zn-2e-=Zn2+
正极(石墨棒):
说法①2MnO2+2NH4++2e-=2MnO(OH)+2NH3
说法②2MnO2+2H++2e-=2MnO(OH)
说法③2MnO2+2NH4++2e-=Mn2O3+H2O+2NH3
总反应:
说法①Zn+2MnO2+2NH4+=Zn2++2MnO(OH)+2NH3
说法②Zn+2MnO2+2H+=Zn2++2MnO(OH)
说法③Zn+2MnO2+2NH4+=Zn2++Mn2O3+H2O+2NH3↑
→锌锰干电池因为电解质是NH4Cl,具有酸性因此无法长期储存。
→锌锰干电池放电过程中容易发生胀气或漏液,导致用电器损坏。
→一次电池,放电后无法充电,因为所发生的氧化还原反应不可逆。
3.碱性锌锰电池
电解质溶液
→湿的KOH
负极(锌皮):
Zn -2e- + 20H- = Zn(OH)2
正极(石墨棒):
说法①2MnO2+2H2O+2e-=2MnO(OH)+20H-
说法②2MnO2+H2O+2e-=Mn2O3+20H-
总反应:
说法① Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH)
说法②Zn+2MnO2+H2O=Zn(OH)2+Mn2O3
→碱性锌锰干电池电解质改进为KOH,使内部物质不易发生化学反应,有利于长期储存。
→碱性锌锰干电池由锌皮改成锌粉,如增加了防腐金属外壳或塑料包裹,还可制成防漏电电池。
→碱性条件下Zn2+无法稳定存在,会生成Zn(OH)2(S)
4.银锌纽扣电池
电解质溶液
→浸了KOH溶液的隔板
负极(锌皮):
Zn -2e- + 20H- = Zn(OH)2
正极(Ag2O):
Ag2O+H2O+2e-=2Ag+20H-
总反应:
Zn+Ag2O+H2O=2Ag+Zn(OH)2
→银锌电池具有体积小,电压稳定,电池比能量大,非常适合小电流连续长时间放电。
五、二次电池(蓄电池/充电电池)
1、铅蓄电池
→铅蓄电池是最常见的二次电池,正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液。
放电-负极(Pb板):
Pb+SO42--2e-=PbSO4
电子/离子移动方向:
电子经外电路流出,电流经外电路流入,阴-靠近负极(阳极)
放电-正极(PbO2板):
PbO2+SO42-+4H++2e-=PbS04+2H2O
电子/离子移动方向:
电子经外电路流入,电流经外电路流出,阳+靠近负极(阴极)
放电总反应:
PbO2+2H2SO4+Pb=2PbS04+2H2O
放电
Pb、PbO2、PbSO4都不溶于水,放电反应中产物虽然不溶于水,但是反应物有固体参与,因此不写沉淀符号
放电反应
五、二次电池(蓄电池/充电电池)
1、铅蓄电池
→铅蓄电池是最常见的二次电池,正极板上覆盖有PO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液。
充电-阴极(原负极):
PbSO4+2e-=Pb+SO42-
电子/离子移动方向:
电子由电源负极流入,电流与电子方向相反,阳+靠近负极(阴极)
充电-阳极(原正极):
PbSO4-2e-+2H2O=PbO2+SO42-+4H+
电子/离子移动方向:
电流由电源正极流出,电子与电流方向相反,阳+靠近正极(阳极)
充电总反应:
2PbS04+2H2O=PbO2+2H2SO4+Pb
充电
→充电总反应是放电总反应的逆过程,符号相反,但不互为可逆反应,因为条件不同。
充电反应
2.镍镉电池(了解)
→镍镉电池是出现于上世纪50年代的可充电碱性电池,充放电速度快,电压平稳,可充放电500次以上,寿命比铅酸电池长,但是有记忆效应,且Cd2+是致癌物质,对环境有很大危害。
电解质溶液
→湿的KOH
负极(Cd):
Cd+20H--2e-=Cd(OH)2
正极[NiO(OH)]:
2NiO (OH) +2H2O+2e-=2Ni (OH) 2+20H-
总反应:
2NiO(OH)+2H2O+Cd 2Ni(OH)2+Cd(OH)2
放电
充电
3.锂离子电池
→无记忆效应,比能量高,质地轻,可循环次数多,可用于制造手机等数码产品电池。
负极(Li):
Li-e-=Li+
→锂很活泼,因此锂电池里不能含水,一般用有机介质。
六、燃料电池
→燃料电池是一种连续地将燃料和氧化剂的化学能直接转化为电能的装置,与火力发电相比燃料利用率高、能量转化率高,在放电时需要外部持续供给燃料和氧化剂(通常是O2)
1.氢氧燃料电池
燃料电池
正极(O2)
酸性:
碱性/中性:
4H++O2+4e-=2H2O
2H2O+O2+4e-=40H-
酸性环境
总反应:
负极:
正极:
2H2+O2=2H2O
2H2-4e-=4H+
4H++O2+4e-=2H2O
中性环境
总反应:
负极:
正极:
2H2+O2=2H2O
2H2-4e-=4H+
2H2O+O2+4e-=40H-
碱性环境
总反应:
负极:
正极:
2H2+O2=2H2O
2H2+40H--4e-=4H2O
2H2O+02+4e-=40H-
2、甲烷燃料电池
酸性环境
负极:
正极:
总反应:
中性环境
负极:
正极:
总反应:
碱性环境
负极:
正极:
总反应:
CH4+202=CO2+2H2O
CH4+2H20-8e-=CO2+8H+
8H++202+8e-=4H2O
CH4+202=CO2+2H2O
CH4+2H20-8e-=CO2+8H+
4H20+202+8e-=80H-
CH4+2O2+20H-=CO32-+3H2O
CH4+10OH--8e-=CO32-+7H2O
4H20+202+8e-=80H-
七、新型电池——铝-空气-海水电池
电解质溶液
→海水
负极(铝):
4Al-12e-=4Al3+
正极(石墨-O2):
302+12e-+6H20=120H-
总反应:
4Al+302+6H20=4Al(OH)3
八、原电池原理的四大应用
金属活动性强弱
→一般活泼金属作负极,不活泼金属作正极
加快化学反应速率
→如用锌粒和稀硫酸反应制取氢气时,加入少许CuSO4溶液
用于金属的防护
→如钢闸门的防护可以用牺牲阳极的阴极保护法
设计原电池
→根据自发完成的氧化还原反应设计原电池
例:依据反应2Fe3++Cu=2Fe2++Cu2+设计原电池
谢谢观看
