专题3微粒间作用力与物质性质单元测试卷(含解析)高二下学期化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题3微粒间作用力与物质性质单元测试卷(含解析)高二下学期化学苏教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-11 20:03:34 | ||
图片预览


文档简介
专题3 微粒间作用力与物质性质 单元测试卷
一、单选题
1.下列关于铜的一种核素Cu的说法正确的是
A.Cu的核电荷数为29 B.Cu的质子数为35
C.Cu的中子数为64 D.Cu的核外电子数为64
2.下列不是同素异形体的是
A.氧气和臭氧 B.红磷和白磷 C.金刚石和石墨 D.烧碱和纯碱
3.刚玉(主要成分为)硬度仅次于金刚石,常用于高级研磨材料,它
A.是分子晶体 B.是共价化合物
C.可做铝热剂 D.熔融状态下能导电
4.下列说法正确的是
A.含有金属元素的化合物一定是离子化合物
B.完全由非金属元素组成的化合物可能是离子化合物
C.IA族和VIIA族元素原子间只能形成离子键
D.金属键只存在于金属单质中
5.下列各组物质的晶体类型相同的是
A.SO2和SO3 B.I2和NaCl C.Cu和Ar D.SiC和MgO
6.下列说法正确的是
A.石墨和金刚石互为同位素
B.共价化合物中一定不含离子键
C.只有在标准状况下才有气体摩尔体积Vm
D.原子最外层有2个电子的短周期元素都在第ⅡA族
7.下列说法不正确的是
A.化学反应可分为吸热反应和放热反应
B.化学反应中的能量变化都是以热能的形式表现出来
C.化学反应的实质是旧键的断裂与新键的生成
D.化学反应能量变化的实质是旧键断裂吸收的能量与新键形成释放的能量大小不同
8.下列各组物质,所含化学键类型完全相同的是
A.MgCl2和KCl B.NaOH和NaCl
C.H2O2和Na2O2 D.NH3和NH4Cl
9.下列物质中,由极性分子结合而成的分子晶体是
A.SiO2 B.CaCl2 C.HCl D.CO2
10.下列各种物质的晶体中,化学键类型和晶体类型均完全相同的是
A.KCl和Na2O2 B.CH3CH2ONa和CH3COOH
C.CS2和SiC D.[Ag(NH3)2]Cl和[Cu(NH3)4]SO4
11.水溶液呈碱性,且含有共价键的盐是
A.NaClO B.Mg3N2 C.NaHSO4 D.NaOH
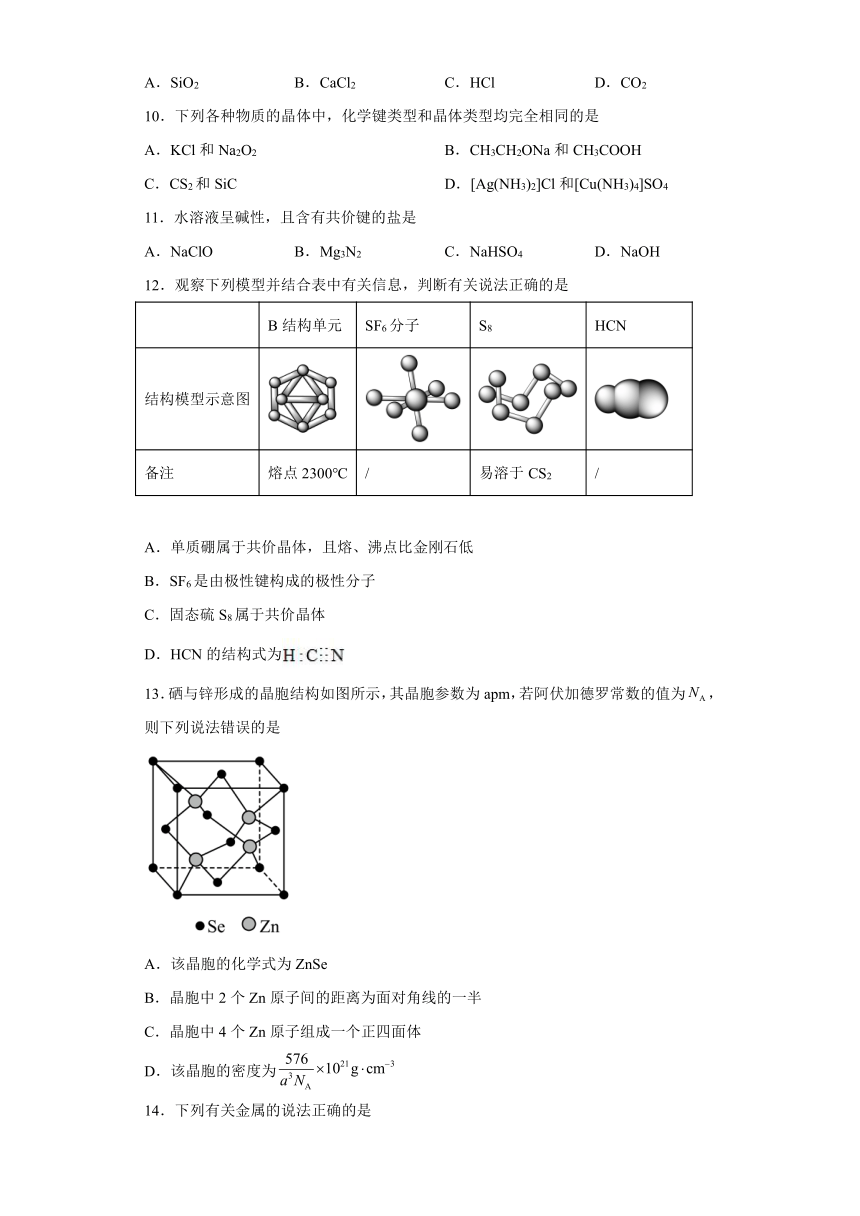
12.观察下列模型并结合表中有关信息,判断有关说法正确的是
B结构单元 SF6分子 S8 HCN
结构模型示意图
备注 熔点2300℃ / 易溶于CS2 /
A.单质硼属于共价晶体,且熔、沸点比金刚石低
B.SF6是由极性键构成的极性分子
C.固态硫S8属于共价晶体
D.HCN的结构式为
13.硒与锌形成的晶胞结构如图所示,其晶胞参数为apm,若阿伏加德罗常数的值为,则下列说法错误的是
A.该晶胞的化学式为ZnSe
B.晶胞中2个Zn原子间的距离为面对角线的一半
C.晶胞中4个Zn原子组成一个正四面体
D.该晶胞的密度为
14.下列有关金属的说法正确的是
A.金属原子的核外电子在金属晶体中都是“自由电子”
B.金属导电的实质是金属阳离子在外电场作用下的定向移动
C.金属原子的价电子数越多,其金属性就越强
D.Na晶胞和Ca晶胞中实际含有的原子个数之比为1:2
15.相同条件下,下列物质的熔沸点最高的是
A.S8 B.NaCl C.SiO2 D.K
二、填空题
16.填空。
(1)MgCl2的熔点714℃,MgO熔点2852℃,从结构上看其原因是___________。
(2)金刚石是自然界硬度最大的物质,硫磺则脆而易碎,从结构上来看其原因是___________。
17.试用有关知识解释下列现象:
(1)乙醚()的相对分子质量大于乙醇,但乙醇的沸点却比乙醚高很多,原因是______。
(2)从氨合成塔里出来的、、的混合物中分离,常采用加压使液化的方法,原因为______。
(3)水在常温下,其组成的化学式可用表示,原因是______。
18.氧、硫、硒(Se)、碲(Te)、钋(Po)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)硒(Se)的原子结构示意图为___________。
(2)氧和硫的氢化物性质的比较:
①热稳定性:H2O___________H2S(填“>”或“<”),判断依据是___________。
②沸点:H2O___________H2S(填“>”或“<”),判断依据是___________。
(3)H2O与NH3反应产物中所含化学键类型为___________;H2S与NH3反应的产物中所含化学键类型为___________(填离子键或共价键)。
(4)钠的硫化物Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO 被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶13,则x的值为___________。
三、实验题
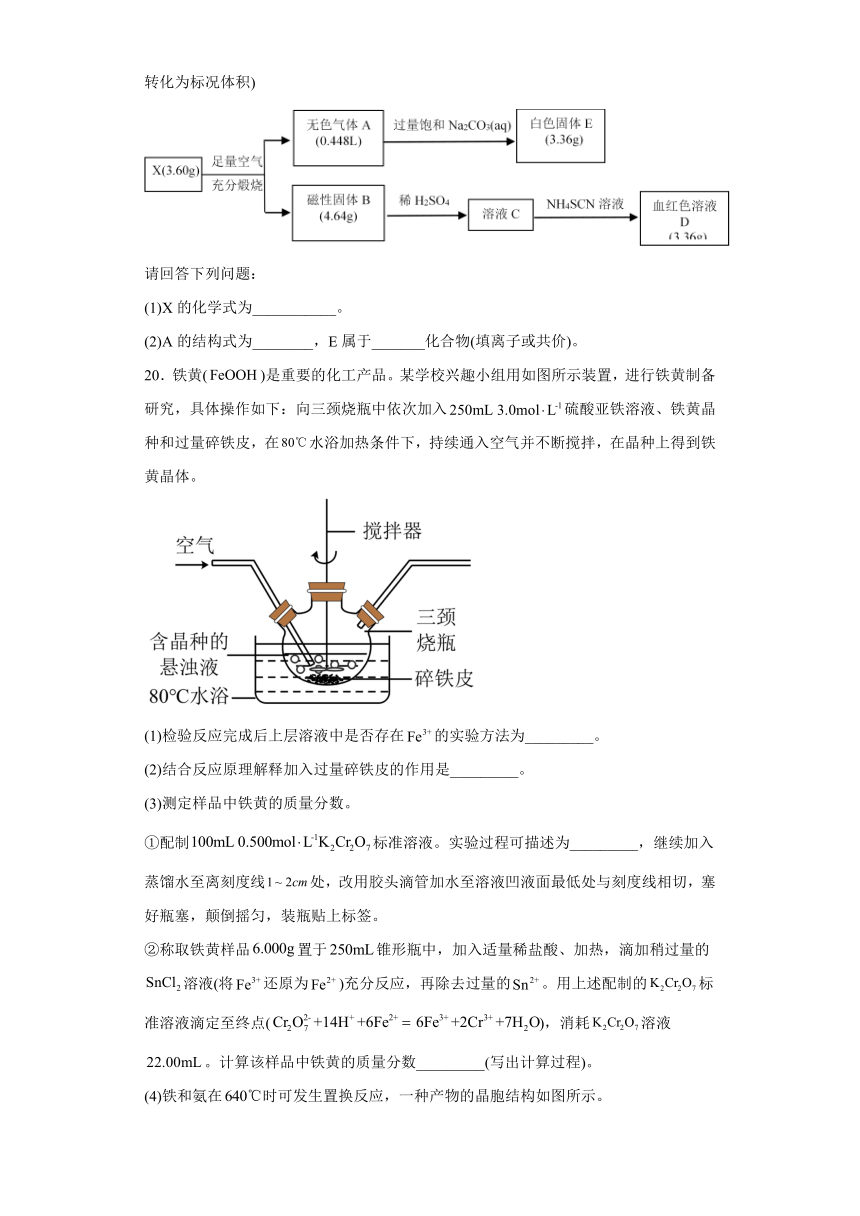
19.为探究某物质X(仅含两种元素)的组成和性质,设计并完成如下实验。(气体体积已转化为标况体积)
请回答下列问题:
(1)X的化学式为___________。
(2)A的结构式为________,E属于_______化合物(填离子或共价)。
20.铁黄()是重要的化工产品。某学校兴趣小组用如图所示装置,进行铁黄制备研究,具体操作如下:向三颈烧瓶中依次加入硫酸亚铁溶液、铁黄晶种和过量碎铁皮,在水浴加热条件下,持续通入空气并不断搅拌,在晶种上得到铁黄晶体。
(1)检验反应完成后上层溶液中是否存在的实验方法为_________。
(2)结合反应原理解释加入过量碎铁皮的作用是_________。
(3)测定样品中铁黄的质量分数。
①配制标准溶液。实验过程可描述为_________,继续加入蒸馏水至离刻度线处,改用胶头滴管加水至溶液凹液面最低处与刻度线相切,塞好瓶塞,颠倒摇匀,装瓶贴上标签。
②称取铁黄样品置于锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的溶液(将还原为)充分反应,再除去过量的。用上述配制的标准溶液滴定至终点(),消耗溶液。计算该样品中铁黄的质量分数_________(写出计算过程)。
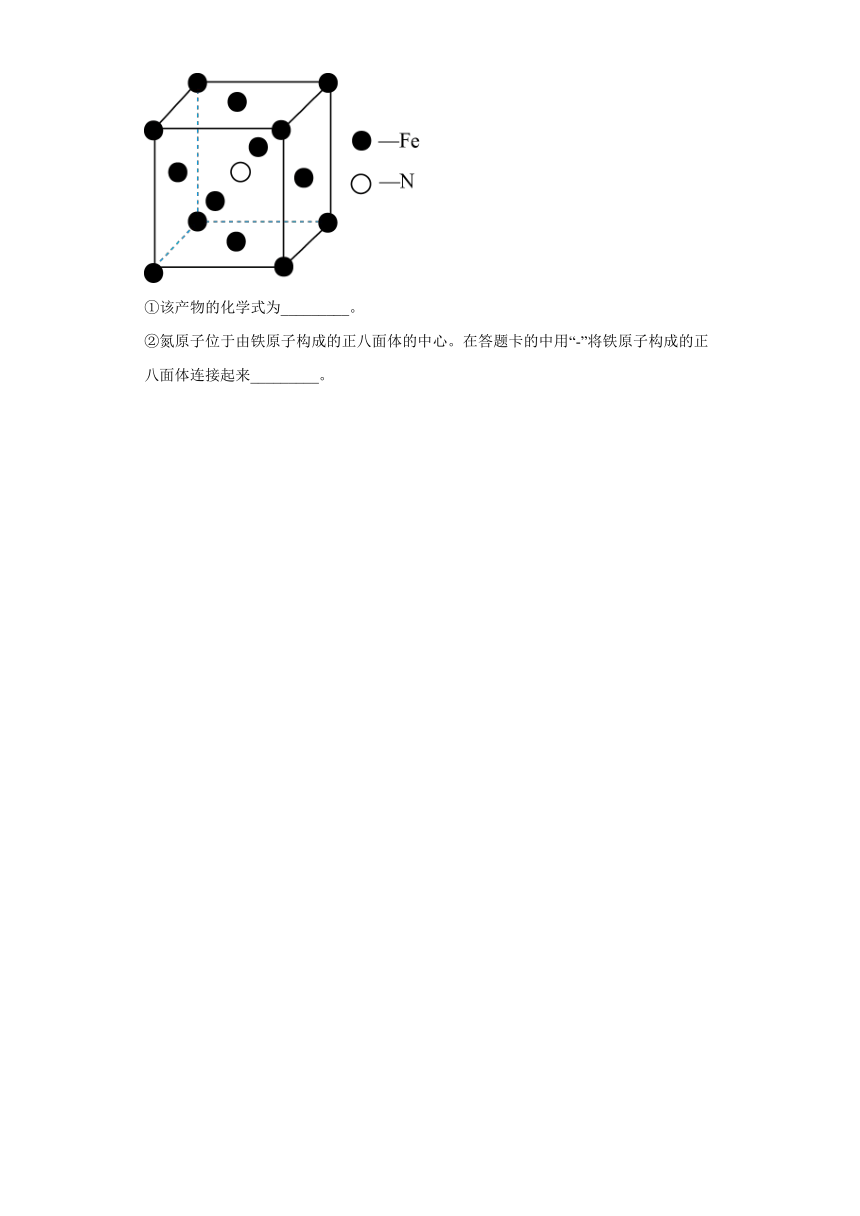
(4)铁和氨在时可发生置换反应,一种产物的晶胞结构如图所示。
①该产物的化学式为_________。
②氮原子位于由铁原子构成的正八面体的中心。在答题卡的中用“-”将铁原子构成的正八面体连接起来_________。
参考答案:
1.A
【来源】2023年广东省普通高中学业水平合格性考试化学科模拟测试卷(四)
【详解】核素的表示方法为:元素符号左下角为质子数,左上角为质量数;核素Cu,其质量数为64,原子中核电荷数=质子数=核外电子数=29,中子数=64-29=35;
故A正确。
2.D
【来源】【浙江新东方】在线化学17
【详解】A.氧气和臭氧是氧元素形成的不同单质,互为同素异形体,故A不选;
B.红磷和白磷是磷元素形成的不同单质,互为同素异形体,故B不选;
C.金刚石和石墨是碳元素形成的不同单质,互为同素异形体,故C不选;
D.烧碱是NaOH,纯碱是Na2CO3,是两种化合物,不是同种元素形成的不同单质,不能互称为同素异形体,故D选;
故选D。
3.D
【来源】上海市浦东新区2022-2023学年高三下学期4月模拟质量调研化学试题
【详解】A.刚玉(主要成分为)硬度仅次于金刚石,所以不属于分子晶体,事实上氧化铝属于过渡晶体,偏向共价晶体,A不符合题意;
B.氧化铝中铝元素与氧元素之间为离子键,所以属于离子化合物,B不符合题意;
C.铝热剂是铝粉和难熔金属氧化物的混合物,所以氧化铝不能做铝热剂,C不符合题意;
D.氧化铝为离子化合物,熔融状态下可电离成铝离子和氧离子,可导电,D符合题意;
故选D。
4.B
【来源】(鲁科版2019)选择性必修2第2章微粒间相互作用与物质性质第3节离子键、配位键与金属键
【详解】A.含有金属元素的化合物不一定是离子化合物,如是共价化合物,故A错误;
B.完全由非金属元素组成的化合物可能是离子化合物,如,故B正确;
C.IA族和VIIA族元素原子间可能形成离子键也可能形成共价键,如中只含共价键,中只含离子键,故C错误;
D.金属键存在于金属单质或合金中,故D错误。
故选:B。
5.A
【来源】江苏省阜宁中学2022-2023学年高二上学期期中考试化学试题
【分析】阴阳离子间通过离子键形成的晶体为离子晶体;分子间通过分子间作用力形成的晶体为分子晶体;相邻原子间通过共价键结合而成的立体网状的晶体为共价晶体;由金属阳离子和自由电子间相互作用形成的晶体为金属晶体。
【详解】A.SO2和SO3均属于分子晶体,晶体类型相同,故A项选;
B.I2属于分子晶体,NaCl属于离子晶体,晶体类型不同,故B项不选;
C.Cu属于金属晶体,Ar属于分子晶体,晶体类型不同,故C项不选;
D.SiC属于原子晶体,MgO属于离子晶体,晶体类型不同,故D项不选;
综上所述,答案为A。
6.B
【来源】辽宁省辽阳市2020-2021学年高一上学期期末考试化学试题
【详解】A.石墨和金刚石均是由C元素组成的单质,互为同素异形体,A错误;
B.由共价键构成分子的化合物称为共价化合物,因此共价化合物中一定不含离子键,B正确;
C.任何温度和压强下都有对应的气体摩尔体积Vm,C错误;
D.原子最外层有2个电子的短周期元素不一定都在第ⅡA族,如He在零族,D错误。
答案选B。
7.B
【来源】上海市闵行(文绮)中学2022-2023学年高二上学期期中考试化学试题
【详解】A.化学反应从能量变化的角度可分为吸热反应和放热反应,A正确;
B.化学反应中的能量变化形式可以是热能、电能、光能等,B错误;
C.化学反应的实质是旧键的断裂与新键的生成,C正确;
D.化学反应能量变化的实质是旧键断裂吸收的能量与新键形成释放的能量大小不同,D正确;
故选B。
8.A
【来源】广东省佛山市2020-2021学年高一上学期期末考试化学试题
【详解】A.MgCl2和KCl均为离子化合物,只存在离子键,A正确;
B. NaCl中只含离子键、NaOH中既含共价键又含离子键,B错误;
C. H2O2分子中只存在共价键, Na2O2中既有离子键又有共价键,C错误;
D. NH3分子中只存在共价键,NH4Cl中既有离子键又有共价键,D错误;
答案选A。
9.C
【来源】海南省海南鑫源高级中学2020-2021学年高二下学期第一次月考化学试题
【详解】SiO2形成的是原子晶体(共价晶体),CaCl2形成的是离子晶体,HCl与CO2形成分子晶体,其中CO2是非极性分子,HCl是极性分子;
故本题选C。
10.D
【来源】湖北省武汉市部分重点中学2022-2023学年高二下学期期中联考化学试题
【详解】A.KCl含有离子键,Na2O2含有离子键和非极性键,都属于离子晶体,故A不符合题意;
B.CH3CH2ONa含有离子键和极性键、非极性键,CH3COOH含有极性键,非极性键,前者是离子晶体,后者是分子晶体,故B不符合题意;
C.CS2含有极性键,SiC含有极性键,前者是分子该晶体,后者是共价晶体,故C不符合题意;
D.[Ag(NH3)2]Cl含有离子键、极性键、配位键,[Cu(NH3)4]SO4含有离子键、极性键、配位键,都属于离子晶体,故D符合题意。
综上所述,答案为D。
11.A
【来源】浙江省十校联盟2021届高三10月联考化学试题
【详解】A.NaClO中钠离子和次氯酸根离子之间存在离子键、O原子和H原子之间存在共价键,而且属于盐强碱弱酸盐,水溶液呈碱性,故A符合题意;
B.Mg3N2中只含有离子键,不存在共价键,故B不符合题意;
C.NaHSO4在水中完全电离出氢离子,显强酸性,不显碱性,故C不符合题意;
D.NaOH是碱,不是盐,故D不符合题意;
故选:A。
12.A
【来源】吉林省四平市实验中学2021-2022学年高二下学期第一次月考化学试题
【详解】A.根据B的结构模型可看出,B原子之间仅有共价键,结合熔点数据可推知单质硼与金刚石一样属于共价晶体,但因为原子半径:B>C,所以共价键的键能相比,B-B键键能小于C-C键键能,所以单质硼的熔点低于金刚石的熔点,A正确;
B.根据结构模型可知,SF6空间构型为对称结构分子,其分子的极性相互抵消,正负电荷的重心重合,电荷分布均匀,所以SF6为极性键组成的非极性分子,B错误;
C.固态硫是由S8分子构成的,且根据S8“易溶于CS2”的物理性质,结合相似相溶原理可知,固态硫S8属于分子晶体,C错误;
D.由比例模型可以看出分子中有1个碳原子和1个氮原子,1个氢原子,碳原子半径大于氮原子半径,氮原子半径大于氢原子半径,所以该比例模型中最左端的是氢原子,中间的是碳原子,最右边的是氮原子,其结构式为H-C≡N,D错误;
答案选A。
13.D
【来源】河北省保定市唐县第一中学2021-2022学年高二下学期期末考试化学试题
【详解】A.根据晶胞结构图,晶胞中Se有8个位于顶点,6个位于面心,个数为:,Zn有4个位于晶胞内部,个数为4,化学式为ZnSe,A正确;
B.根据晶胞结构图可知,晶胞中2个Zn原子间的距离为面对角线的一半,B正确;
C.4个Zn位于4个相间的立方体中心,构成正四面体,C正确;
D.根据公式,可得,D错误;
故选D。
14.D
【来源】(鲁科版2019)选择性必修2第3章不同聚集状态的物质与性质第2节几种简单的晶体结构模型
【详解】A.因金属元素的电负性和电离能较小,则金属原子的价电子容易脱离原子核的束缚成为晶体中的“自由电子”,选项A错误;
B.金属导电的实质是在外电场的作用下,“自由电子”定向移动而产生电流,选项B错误;
C.金属性的强弱与价电子数的多少无必然联系,选项C错误;
D.晶胞中原子在顶点和体心,含有的原子个数为,晶胞中原子在顶点和面心,含有的原子个数为,实际含有的原子个数之比为2:4=1:2,选项D正确。
答案选D。
15.C
【来源】湖南省湘鄂冀三省长沙平高、永顺平高等七校2021-2022学年高二下学期3月联考化学试题
【详解】一般情况下不同类型的晶体中物质的熔沸点高低顺序是:共价晶体>离子晶体>分子晶体,金属晶体中有的物质熔点很高如W,有的很低,如Hg在室温下呈液态。在题目已知物质中,S8属于分子晶体,NaCl属于离子晶体,SiO2属于共价晶体,K为金属晶体,物质的熔点最高的为SiO2,故合理选项是C。
16.(1)O2-离子比Cl-半径小、电荷高,MgO中离子键比MgCl2中离子键强,故熔点更高
(2)金刚石是共价(原子)晶体,硫磺是分子晶体,金刚石中碳碳共价键比硫磺分子间作用力强得多,故金刚石比硫磺硬度大得多
【来源】浙江省杭州学军中学2021-2022学年高三上学期12月适应性考试化学试题
【解析】(1)
MgCl2和MgO都是离子晶体,O2-离子比Cl-半径小、电荷高,所以MgO中离子键比MgCl2中离子键强,熔化需克服的键能高,故熔点更高,即O2-离子比Cl-半径小、电荷高,MgO中离子键比MgCl2中离子键强,故熔点更高;
(2)
金刚石是C原子之间通过共价键形成的共价(原子)晶体,硫磺是S原子之间以共价键结合成的分子,属于分子晶体,金刚石中碳碳共价键比硫磺分子间作用力强得多,故金刚石比硫磺硬度大得多,即金刚石是共价(原子)晶体,硫磺是分子晶体,金刚石中碳碳共价键比硫磺分子间作用力强得多,故金刚石比硫磺硬度大得多。
17. 乙醇分子间形成的氢键作用远大于乙醚分子间的范德华力,故乙醇的沸点比乙醚的高很多 分子间可以形成氢键,而、分子间的范德华力很小,故可采用加压液化的方法从混合物中分离 常温下,液态水中水分子间通过氢键缔合成较大的分子团,而不是以单个水分子形式存在,所以用表示
【来源】(人教版2019)选择性必修2第二章分子结构与性质第三节分子结构与物质的性质课时2分子间的作用力
【详解】(1)乙醇的沸点比乙醚高很多的原因是:乙醇分子间形成的氢键作用远大于乙醚分子间的范德华力,故乙醇的沸点比乙醚的高很多;
(2)分子间可以形成氢键,而、分子间的范德华力很小,故可采用加压液化的方法从混合物中分离;
(3)常温下,液态水中水分子间通过氢键缔合成较大的分子团,而不是以单个水分子形式存在,所以用表示。
18. > 氧和硫是同族元素,氧原子半径小,得电子能力强,非金属性强,故氧的简单气态氢化物稳定性强 > H2O分子间存在氢键 共价键 离子键、共价键 4
【来源】黑龙江省大庆实验中学2020-2021学年高一上学期第一次线上教学质量检测(1月)化学试题
【分析】氧、硫、硒(Se)、碲(Te)、钋(Po)为元素周期表中原子序数依次增大的同族元素,位于第ⅥA族。
【详解】(1)Se位于第四周期第ⅥA族,核外电子层数为4,最外层电子数为6,原子序数为34,则其原子结构示意图为。
(2)①非金属越强,氢化物的稳定性越强,同主族元素,从上到下,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,所以非金属性O>S,则热稳定性:H2O>H2S。
②由于水分子间有氢键,所以水的沸点高于H2S。
(3)H2O与NH3反应产物为NH3 H2O,所含化学键类型为共价键;H2S与NH3反应的产物为NH4HS或(NH4)2S,均为离子化合物,阳离子和阴离子以离子键结合,在 中,N和H以共价键结合。
(4)钠的硫化物Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,硫的化合价从-升高到+6价,而NaClO 被还原为NaCl,氯的化合价从+1价降低到-1价,若反应中Na2Sx与NaClO的物质的量之比为1:13,根据电子守恒:x(6+ )=13×2,可求出x=4。
19. Fe3C O=C=O 离子
【来源】浙江省台州市书生中学2018-2019学年高二下学期第一次月考化学试题
【分析】根据溶液C中加入NH4SCN溶液,变为血红色的,可推知B中含有铁元素,B为磁性固体,所以B为Fe3O4,无色气体A为二氧化碳,E为碳酸氢钠,根据元素守恒,可知X中含有铁元素和碳元素,A的物质的量为0.02mol,B的物质的量为0.02mol,所以X中n(Fe): n(C)=3:1,故X的化学式为Fe3C。
【详解】(1)根据元素守恒,可知X中含有铁元素和碳元素,A(CO2)的物质的量为0.02mol,B(Fe3O4)的物质的量为0.02mol,所以X中n(Fe):n(C)=3:1,故X的化学式为Fe3C,故答案为Fe3C;
(2)A为二氧化碳,CO2是直线型,结构式为O=C=O,故答案为O=C=O;
(3)E为碳酸氢钠,属于离子化合物,故答案为离子。
20.(1)取少量上层清液,滴加2~3滴溶液,若存在,可观察到溶液变成血红色
(2)既能消除反应产生的,同时又能额外提供,实现硫酸亚铁的循环利用
(3) 用电子天平称取固体,并置于烧杯中用适量蒸馏水溶解,冷却后用玻璃棒转移至容量瓶中(已验漏),再用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液一并转移至容量瓶中 97.9%
(4)
【来源】江苏省盐城市2023届高三上学期期中考试化学试题
【详解】(1)检验反应完成后上层溶液中是否存在,取反应完后上层清液,滴加2~3滴溶液,若溶液变为红色,说明存在,若溶液不变红则不存在;
(2)该发生化学反应为,加入碎铁皮能消除反应产生的生成,生成的又能额外提供,实现硫酸亚铁的循环利用;
(3)①配制溶液的一般过程包括计算、称量、溶解、冷却转移、洗涤、定容、摇匀装瓶;配制标准溶液。,用电子天平称取固体,并置于烧杯中用适量蒸馏水溶解,冷却后用玻璃棒转移至容量瓶中(已验漏),再用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液一并转移至容量瓶中;
②根据方程式可知反应的关系式为,,该样品中铁黄的质量分数;
(4)①Fe原子位于顶点和面心,晶胞中Fe原子数为,N原子位于体心,晶胞中含有1个N原子,原子数之比为Fe:N=4:1,该产物的化学式为
②氮原子位于由铁原子构成的正八面体的中心。铁原子构成的正八面体为:;
一、单选题
1.下列关于铜的一种核素Cu的说法正确的是
A.Cu的核电荷数为29 B.Cu的质子数为35
C.Cu的中子数为64 D.Cu的核外电子数为64
2.下列不是同素异形体的是
A.氧气和臭氧 B.红磷和白磷 C.金刚石和石墨 D.烧碱和纯碱
3.刚玉(主要成分为)硬度仅次于金刚石,常用于高级研磨材料,它
A.是分子晶体 B.是共价化合物
C.可做铝热剂 D.熔融状态下能导电
4.下列说法正确的是
A.含有金属元素的化合物一定是离子化合物
B.完全由非金属元素组成的化合物可能是离子化合物
C.IA族和VIIA族元素原子间只能形成离子键
D.金属键只存在于金属单质中
5.下列各组物质的晶体类型相同的是
A.SO2和SO3 B.I2和NaCl C.Cu和Ar D.SiC和MgO
6.下列说法正确的是
A.石墨和金刚石互为同位素
B.共价化合物中一定不含离子键
C.只有在标准状况下才有气体摩尔体积Vm
D.原子最外层有2个电子的短周期元素都在第ⅡA族
7.下列说法不正确的是
A.化学反应可分为吸热反应和放热反应
B.化学反应中的能量变化都是以热能的形式表现出来
C.化学反应的实质是旧键的断裂与新键的生成
D.化学反应能量变化的实质是旧键断裂吸收的能量与新键形成释放的能量大小不同
8.下列各组物质,所含化学键类型完全相同的是
A.MgCl2和KCl B.NaOH和NaCl
C.H2O2和Na2O2 D.NH3和NH4Cl
9.下列物质中,由极性分子结合而成的分子晶体是
A.SiO2 B.CaCl2 C.HCl D.CO2
10.下列各种物质的晶体中,化学键类型和晶体类型均完全相同的是
A.KCl和Na2O2 B.CH3CH2ONa和CH3COOH
C.CS2和SiC D.[Ag(NH3)2]Cl和[Cu(NH3)4]SO4
11.水溶液呈碱性,且含有共价键的盐是
A.NaClO B.Mg3N2 C.NaHSO4 D.NaOH
12.观察下列模型并结合表中有关信息,判断有关说法正确的是
B结构单元 SF6分子 S8 HCN
结构模型示意图
备注 熔点2300℃ / 易溶于CS2 /
A.单质硼属于共价晶体,且熔、沸点比金刚石低
B.SF6是由极性键构成的极性分子
C.固态硫S8属于共价晶体
D.HCN的结构式为
13.硒与锌形成的晶胞结构如图所示,其晶胞参数为apm,若阿伏加德罗常数的值为,则下列说法错误的是
A.该晶胞的化学式为ZnSe
B.晶胞中2个Zn原子间的距离为面对角线的一半
C.晶胞中4个Zn原子组成一个正四面体
D.该晶胞的密度为
14.下列有关金属的说法正确的是
A.金属原子的核外电子在金属晶体中都是“自由电子”
B.金属导电的实质是金属阳离子在外电场作用下的定向移动
C.金属原子的价电子数越多,其金属性就越强
D.Na晶胞和Ca晶胞中实际含有的原子个数之比为1:2
15.相同条件下,下列物质的熔沸点最高的是
A.S8 B.NaCl C.SiO2 D.K
二、填空题
16.填空。
(1)MgCl2的熔点714℃,MgO熔点2852℃,从结构上看其原因是___________。
(2)金刚石是自然界硬度最大的物质,硫磺则脆而易碎,从结构上来看其原因是___________。
17.试用有关知识解释下列现象:
(1)乙醚()的相对分子质量大于乙醇,但乙醇的沸点却比乙醚高很多,原因是______。
(2)从氨合成塔里出来的、、的混合物中分离,常采用加压使液化的方法,原因为______。
(3)水在常温下,其组成的化学式可用表示,原因是______。
18.氧、硫、硒(Se)、碲(Te)、钋(Po)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)硒(Se)的原子结构示意图为___________。
(2)氧和硫的氢化物性质的比较:
①热稳定性:H2O___________H2S(填“>”或“<”),判断依据是___________。
②沸点:H2O___________H2S(填“>”或“<”),判断依据是___________。
(3)H2O与NH3反应产物中所含化学键类型为___________;H2S与NH3反应的产物中所含化学键类型为___________(填离子键或共价键)。
(4)钠的硫化物Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO 被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶13,则x的值为___________。
三、实验题
19.为探究某物质X(仅含两种元素)的组成和性质,设计并完成如下实验。(气体体积已转化为标况体积)
请回答下列问题:
(1)X的化学式为___________。
(2)A的结构式为________,E属于_______化合物(填离子或共价)。
20.铁黄()是重要的化工产品。某学校兴趣小组用如图所示装置,进行铁黄制备研究,具体操作如下:向三颈烧瓶中依次加入硫酸亚铁溶液、铁黄晶种和过量碎铁皮,在水浴加热条件下,持续通入空气并不断搅拌,在晶种上得到铁黄晶体。
(1)检验反应完成后上层溶液中是否存在的实验方法为_________。
(2)结合反应原理解释加入过量碎铁皮的作用是_________。
(3)测定样品中铁黄的质量分数。
①配制标准溶液。实验过程可描述为_________,继续加入蒸馏水至离刻度线处,改用胶头滴管加水至溶液凹液面最低处与刻度线相切,塞好瓶塞,颠倒摇匀,装瓶贴上标签。
②称取铁黄样品置于锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的溶液(将还原为)充分反应,再除去过量的。用上述配制的标准溶液滴定至终点(),消耗溶液。计算该样品中铁黄的质量分数_________(写出计算过程)。
(4)铁和氨在时可发生置换反应,一种产物的晶胞结构如图所示。
①该产物的化学式为_________。
②氮原子位于由铁原子构成的正八面体的中心。在答题卡的中用“-”将铁原子构成的正八面体连接起来_________。
参考答案:
1.A
【来源】2023年广东省普通高中学业水平合格性考试化学科模拟测试卷(四)
【详解】核素的表示方法为:元素符号左下角为质子数,左上角为质量数;核素Cu,其质量数为64,原子中核电荷数=质子数=核外电子数=29,中子数=64-29=35;
故A正确。
2.D
【来源】【浙江新东方】在线化学17
【详解】A.氧气和臭氧是氧元素形成的不同单质,互为同素异形体,故A不选;
B.红磷和白磷是磷元素形成的不同单质,互为同素异形体,故B不选;
C.金刚石和石墨是碳元素形成的不同单质,互为同素异形体,故C不选;
D.烧碱是NaOH,纯碱是Na2CO3,是两种化合物,不是同种元素形成的不同单质,不能互称为同素异形体,故D选;
故选D。
3.D
【来源】上海市浦东新区2022-2023学年高三下学期4月模拟质量调研化学试题
【详解】A.刚玉(主要成分为)硬度仅次于金刚石,所以不属于分子晶体,事实上氧化铝属于过渡晶体,偏向共价晶体,A不符合题意;
B.氧化铝中铝元素与氧元素之间为离子键,所以属于离子化合物,B不符合题意;
C.铝热剂是铝粉和难熔金属氧化物的混合物,所以氧化铝不能做铝热剂,C不符合题意;
D.氧化铝为离子化合物,熔融状态下可电离成铝离子和氧离子,可导电,D符合题意;
故选D。
4.B
【来源】(鲁科版2019)选择性必修2第2章微粒间相互作用与物质性质第3节离子键、配位键与金属键
【详解】A.含有金属元素的化合物不一定是离子化合物,如是共价化合物,故A错误;
B.完全由非金属元素组成的化合物可能是离子化合物,如,故B正确;
C.IA族和VIIA族元素原子间可能形成离子键也可能形成共价键,如中只含共价键,中只含离子键,故C错误;
D.金属键存在于金属单质或合金中,故D错误。
故选:B。
5.A
【来源】江苏省阜宁中学2022-2023学年高二上学期期中考试化学试题
【分析】阴阳离子间通过离子键形成的晶体为离子晶体;分子间通过分子间作用力形成的晶体为分子晶体;相邻原子间通过共价键结合而成的立体网状的晶体为共价晶体;由金属阳离子和自由电子间相互作用形成的晶体为金属晶体。
【详解】A.SO2和SO3均属于分子晶体,晶体类型相同,故A项选;
B.I2属于分子晶体,NaCl属于离子晶体,晶体类型不同,故B项不选;
C.Cu属于金属晶体,Ar属于分子晶体,晶体类型不同,故C项不选;
D.SiC属于原子晶体,MgO属于离子晶体,晶体类型不同,故D项不选;
综上所述,答案为A。
6.B
【来源】辽宁省辽阳市2020-2021学年高一上学期期末考试化学试题
【详解】A.石墨和金刚石均是由C元素组成的单质,互为同素异形体,A错误;
B.由共价键构成分子的化合物称为共价化合物,因此共价化合物中一定不含离子键,B正确;
C.任何温度和压强下都有对应的气体摩尔体积Vm,C错误;
D.原子最外层有2个电子的短周期元素不一定都在第ⅡA族,如He在零族,D错误。
答案选B。
7.B
【来源】上海市闵行(文绮)中学2022-2023学年高二上学期期中考试化学试题
【详解】A.化学反应从能量变化的角度可分为吸热反应和放热反应,A正确;
B.化学反应中的能量变化形式可以是热能、电能、光能等,B错误;
C.化学反应的实质是旧键的断裂与新键的生成,C正确;
D.化学反应能量变化的实质是旧键断裂吸收的能量与新键形成释放的能量大小不同,D正确;
故选B。
8.A
【来源】广东省佛山市2020-2021学年高一上学期期末考试化学试题
【详解】A.MgCl2和KCl均为离子化合物,只存在离子键,A正确;
B. NaCl中只含离子键、NaOH中既含共价键又含离子键,B错误;
C. H2O2分子中只存在共价键, Na2O2中既有离子键又有共价键,C错误;
D. NH3分子中只存在共价键,NH4Cl中既有离子键又有共价键,D错误;
答案选A。
9.C
【来源】海南省海南鑫源高级中学2020-2021学年高二下学期第一次月考化学试题
【详解】SiO2形成的是原子晶体(共价晶体),CaCl2形成的是离子晶体,HCl与CO2形成分子晶体,其中CO2是非极性分子,HCl是极性分子;
故本题选C。
10.D
【来源】湖北省武汉市部分重点中学2022-2023学年高二下学期期中联考化学试题
【详解】A.KCl含有离子键,Na2O2含有离子键和非极性键,都属于离子晶体,故A不符合题意;
B.CH3CH2ONa含有离子键和极性键、非极性键,CH3COOH含有极性键,非极性键,前者是离子晶体,后者是分子晶体,故B不符合题意;
C.CS2含有极性键,SiC含有极性键,前者是分子该晶体,后者是共价晶体,故C不符合题意;
D.[Ag(NH3)2]Cl含有离子键、极性键、配位键,[Cu(NH3)4]SO4含有离子键、极性键、配位键,都属于离子晶体,故D符合题意。
综上所述,答案为D。
11.A
【来源】浙江省十校联盟2021届高三10月联考化学试题
【详解】A.NaClO中钠离子和次氯酸根离子之间存在离子键、O原子和H原子之间存在共价键,而且属于盐强碱弱酸盐,水溶液呈碱性,故A符合题意;
B.Mg3N2中只含有离子键,不存在共价键,故B不符合题意;
C.NaHSO4在水中完全电离出氢离子,显强酸性,不显碱性,故C不符合题意;
D.NaOH是碱,不是盐,故D不符合题意;
故选:A。
12.A
【来源】吉林省四平市实验中学2021-2022学年高二下学期第一次月考化学试题
【详解】A.根据B的结构模型可看出,B原子之间仅有共价键,结合熔点数据可推知单质硼与金刚石一样属于共价晶体,但因为原子半径:B>C,所以共价键的键能相比,B-B键键能小于C-C键键能,所以单质硼的熔点低于金刚石的熔点,A正确;
B.根据结构模型可知,SF6空间构型为对称结构分子,其分子的极性相互抵消,正负电荷的重心重合,电荷分布均匀,所以SF6为极性键组成的非极性分子,B错误;
C.固态硫是由S8分子构成的,且根据S8“易溶于CS2”的物理性质,结合相似相溶原理可知,固态硫S8属于分子晶体,C错误;
D.由比例模型可以看出分子中有1个碳原子和1个氮原子,1个氢原子,碳原子半径大于氮原子半径,氮原子半径大于氢原子半径,所以该比例模型中最左端的是氢原子,中间的是碳原子,最右边的是氮原子,其结构式为H-C≡N,D错误;
答案选A。
13.D
【来源】河北省保定市唐县第一中学2021-2022学年高二下学期期末考试化学试题
【详解】A.根据晶胞结构图,晶胞中Se有8个位于顶点,6个位于面心,个数为:,Zn有4个位于晶胞内部,个数为4,化学式为ZnSe,A正确;
B.根据晶胞结构图可知,晶胞中2个Zn原子间的距离为面对角线的一半,B正确;
C.4个Zn位于4个相间的立方体中心,构成正四面体,C正确;
D.根据公式,可得,D错误;
故选D。
14.D
【来源】(鲁科版2019)选择性必修2第3章不同聚集状态的物质与性质第2节几种简单的晶体结构模型
【详解】A.因金属元素的电负性和电离能较小,则金属原子的价电子容易脱离原子核的束缚成为晶体中的“自由电子”,选项A错误;
B.金属导电的实质是在外电场的作用下,“自由电子”定向移动而产生电流,选项B错误;
C.金属性的强弱与价电子数的多少无必然联系,选项C错误;
D.晶胞中原子在顶点和体心,含有的原子个数为,晶胞中原子在顶点和面心,含有的原子个数为,实际含有的原子个数之比为2:4=1:2,选项D正确。
答案选D。
15.C
【来源】湖南省湘鄂冀三省长沙平高、永顺平高等七校2021-2022学年高二下学期3月联考化学试题
【详解】一般情况下不同类型的晶体中物质的熔沸点高低顺序是:共价晶体>离子晶体>分子晶体,金属晶体中有的物质熔点很高如W,有的很低,如Hg在室温下呈液态。在题目已知物质中,S8属于分子晶体,NaCl属于离子晶体,SiO2属于共价晶体,K为金属晶体,物质的熔点最高的为SiO2,故合理选项是C。
16.(1)O2-离子比Cl-半径小、电荷高,MgO中离子键比MgCl2中离子键强,故熔点更高
(2)金刚石是共价(原子)晶体,硫磺是分子晶体,金刚石中碳碳共价键比硫磺分子间作用力强得多,故金刚石比硫磺硬度大得多
【来源】浙江省杭州学军中学2021-2022学年高三上学期12月适应性考试化学试题
【解析】(1)
MgCl2和MgO都是离子晶体,O2-离子比Cl-半径小、电荷高,所以MgO中离子键比MgCl2中离子键强,熔化需克服的键能高,故熔点更高,即O2-离子比Cl-半径小、电荷高,MgO中离子键比MgCl2中离子键强,故熔点更高;
(2)
金刚石是C原子之间通过共价键形成的共价(原子)晶体,硫磺是S原子之间以共价键结合成的分子,属于分子晶体,金刚石中碳碳共价键比硫磺分子间作用力强得多,故金刚石比硫磺硬度大得多,即金刚石是共价(原子)晶体,硫磺是分子晶体,金刚石中碳碳共价键比硫磺分子间作用力强得多,故金刚石比硫磺硬度大得多。
17. 乙醇分子间形成的氢键作用远大于乙醚分子间的范德华力,故乙醇的沸点比乙醚的高很多 分子间可以形成氢键,而、分子间的范德华力很小,故可采用加压液化的方法从混合物中分离 常温下,液态水中水分子间通过氢键缔合成较大的分子团,而不是以单个水分子形式存在,所以用表示
【来源】(人教版2019)选择性必修2第二章分子结构与性质第三节分子结构与物质的性质课时2分子间的作用力
【详解】(1)乙醇的沸点比乙醚高很多的原因是:乙醇分子间形成的氢键作用远大于乙醚分子间的范德华力,故乙醇的沸点比乙醚的高很多;
(2)分子间可以形成氢键,而、分子间的范德华力很小,故可采用加压液化的方法从混合物中分离;
(3)常温下,液态水中水分子间通过氢键缔合成较大的分子团,而不是以单个水分子形式存在,所以用表示。
18. > 氧和硫是同族元素,氧原子半径小,得电子能力强,非金属性强,故氧的简单气态氢化物稳定性强 > H2O分子间存在氢键 共价键 离子键、共价键 4
【来源】黑龙江省大庆实验中学2020-2021学年高一上学期第一次线上教学质量检测(1月)化学试题
【分析】氧、硫、硒(Se)、碲(Te)、钋(Po)为元素周期表中原子序数依次增大的同族元素,位于第ⅥA族。
【详解】(1)Se位于第四周期第ⅥA族,核外电子层数为4,最外层电子数为6,原子序数为34,则其原子结构示意图为。
(2)①非金属越强,氢化物的稳定性越强,同主族元素,从上到下,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,所以非金属性O>S,则热稳定性:H2O>H2S。
②由于水分子间有氢键,所以水的沸点高于H2S。
(3)H2O与NH3反应产物为NH3 H2O,所含化学键类型为共价键;H2S与NH3反应的产物为NH4HS或(NH4)2S,均为离子化合物,阳离子和阴离子以离子键结合,在 中,N和H以共价键结合。
(4)钠的硫化物Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,硫的化合价从-升高到+6价,而NaClO 被还原为NaCl,氯的化合价从+1价降低到-1价,若反应中Na2Sx与NaClO的物质的量之比为1:13,根据电子守恒:x(6+ )=13×2,可求出x=4。
19. Fe3C O=C=O 离子
【来源】浙江省台州市书生中学2018-2019学年高二下学期第一次月考化学试题
【分析】根据溶液C中加入NH4SCN溶液,变为血红色的,可推知B中含有铁元素,B为磁性固体,所以B为Fe3O4,无色气体A为二氧化碳,E为碳酸氢钠,根据元素守恒,可知X中含有铁元素和碳元素,A的物质的量为0.02mol,B的物质的量为0.02mol,所以X中n(Fe): n(C)=3:1,故X的化学式为Fe3C。
【详解】(1)根据元素守恒,可知X中含有铁元素和碳元素,A(CO2)的物质的量为0.02mol,B(Fe3O4)的物质的量为0.02mol,所以X中n(Fe):n(C)=3:1,故X的化学式为Fe3C,故答案为Fe3C;
(2)A为二氧化碳,CO2是直线型,结构式为O=C=O,故答案为O=C=O;
(3)E为碳酸氢钠,属于离子化合物,故答案为离子。
20.(1)取少量上层清液,滴加2~3滴溶液,若存在,可观察到溶液变成血红色
(2)既能消除反应产生的,同时又能额外提供,实现硫酸亚铁的循环利用
(3) 用电子天平称取固体,并置于烧杯中用适量蒸馏水溶解,冷却后用玻璃棒转移至容量瓶中(已验漏),再用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液一并转移至容量瓶中 97.9%
(4)
【来源】江苏省盐城市2023届高三上学期期中考试化学试题
【详解】(1)检验反应完成后上层溶液中是否存在,取反应完后上层清液,滴加2~3滴溶液,若溶液变为红色,说明存在,若溶液不变红则不存在;
(2)该发生化学反应为,加入碎铁皮能消除反应产生的生成,生成的又能额外提供,实现硫酸亚铁的循环利用;
(3)①配制溶液的一般过程包括计算、称量、溶解、冷却转移、洗涤、定容、摇匀装瓶;配制标准溶液。,用电子天平称取固体,并置于烧杯中用适量蒸馏水溶解,冷却后用玻璃棒转移至容量瓶中(已验漏),再用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液一并转移至容量瓶中;
②根据方程式可知反应的关系式为,,该样品中铁黄的质量分数;
(4)①Fe原子位于顶点和面心,晶胞中Fe原子数为,N原子位于体心,晶胞中含有1个N原子,原子数之比为Fe:N=4:1,该产物的化学式为
②氮原子位于由铁原子构成的正八面体的中心。铁原子构成的正八面体为:;
