化学人教版(2019)选择性必修3 4.1.1糖类 课件(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 4.1.1糖类 课件(共27张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 147.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-11 20:04:58 | ||
图片预览








文档简介
(共27张PPT)
网
科
第一节 糖类
第四章 生物大分子
4.1.1 糖类的组成和分类、单糖
学习目标
教材内容:P100-103
1.了解糖类的概念、组成和性质特点。
2.了解葡萄糖的结构特点和主要性质,能通过实验探究认识葡萄糖的化学性质。深化对多官能团有机化合物中羟基和醛基性质的认识。
3.知道糖类物质的应用,了解糖类在人体供能、储能等方面的作用,了解糖类的摄入和代谢与人体健康之间的关系,科学合理地搭配饮食。
糖尿病是由于胰腺分泌功能缺陷或胰岛素作用缺陷引起的,以血糖升高为特征的代谢性疾病,称为现代疾病中仅次于癌症的第二杀手,全世界糖尿病患者已超过4亿人,我国的糖尿病患者已超过1.3亿人。
新课导入
有机物 元素组成 代表物 代表物分子 水溶性 性质
糖类 单糖 C、H、O 葡萄糖(属醛糖)、果糖(属酮糖) (互为同分异构体) C6H12O6 易溶 ①单糖不能水解;
②能发生银镜反应(或与新制Cu(OH)2悬浊液反应)的有葡萄糖、果糖、麦芽糖;
③淀粉遇碘变蓝;
④人体内无消化纤维素的酶,但能刺激肠胃蠕动
二糖 麦芽糖、蔗糖 (互为同分异构体) C12H22O11 易溶 多糖 淀粉、纤维素 (不是同分异构体,都是天然有机高分子) (C6H10O5)n 不溶
知识回顾
纤维(C6H10O5)n
葡萄糖(C6H12O6)
淀粉(C6H10O5)n
麦芽(C12H22O11)
蔗糖(C12H22O11)
果糖(C6H12O6)
生活中常见的糖类
糖类是一类重要的有机化合物,在自然界中分布广泛,日常食用的蔗糖、粮食中的淀粉、植物茎叶中的纤维素、人体血液中的葡萄糖等均属于糖类。糖类在生命活动中起着重要作用,是生物体所需能量的主要来源,也是重要的能量储存物质,如植物体内的淀粉和动物体内的糖原。糖类还是很多生物体的结构成分,如植物细胞壁的主要成分纤维素。
1.组成元素:
C、H、O
2.通式:
糖类
“碳水化合物”
糖类
有甜味
问1:符合该通式的一定是糖类?
糖类一定符合该通式?
问2:糖类都有甜味?
有甜味的物质一定是糖?
(不一定,如:乙酸CH3COOH 、乳酸C3H6O3 )
(不一定,如纤维素和淀粉无甜味)
(不一定,如:脱氧核糖C5H10O4 鼠李糖 C6H12O5 )
不一定,如:甘油、阿斯巴甜、糖精、木糖醇。
但,糖类习惯性叫碳水化合物,沿用至今
很多糖类分子中氢原子和氧原子的数目比恰好为______,
其组成可以用通式____________表示.
2:1
Cm(H2O)n
一、糖类的组成和分类
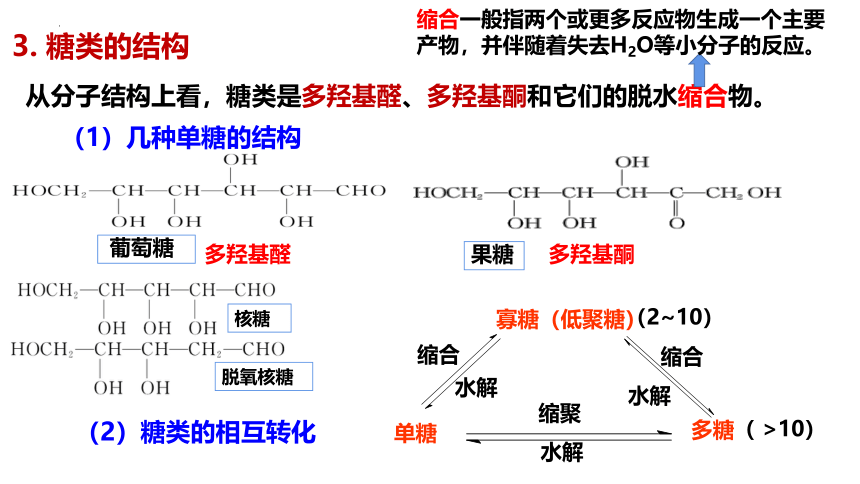
从分子结构上看,糖类是多羟基醛、多羟基酮和它们的脱水缩合物。
3. 糖类的结构
葡萄糖
果糖
(1)几种单糖的结构
多羟基醛
多羟基酮
寡糖(低聚糖)
单糖
多糖
水解
缩合
水解
缩聚
水解
缩合
(2~10)
( >10)
(2)糖类的相互转化
缩合一般指两个或更多反应物生成一个主要产物,并伴随着失去H2O等小分子的反应。
核糖
脱氧核糖
单糖(不能水解)
寡糖(低聚糖)(1mol水解产生2~10mol单糖)
多糖(1mol水解产生n mol(n >10)单糖)
葡萄糖、果糖C6H12O6;
其中水解生成2 mol单糖的糖又叫二糖,
如:麦芽糖、蔗糖、乳糖(C12H22O11)等。
淀粉、纤维素、糖原等
核糖(C5H10O5)、脱氧核糖(C5H10O4)等
4. 糖类的分类
(1)依据:是否水解及水解产物。
(2)依据:是否有还原性
糖类
还原性糖:能发生银镜反应的糖
非还原性糖:不能发生银镜反应的糖
如:葡萄糖、果糖(无醛基)、麦芽糖
如:蔗糖、淀粉、纤维素
糖类
(1)糖类化合物的分子通式都可用Cm(H2O)n来表示( )
(2)糖类都能发生水解反应( )
(3)糖类是多羟基醛或多羟基酮以及它们的脱水缩合物( )
(4)凡是由C、H、O三种元素组成的有机物都是糖类( )
(5)糖类物质又叫碳水化合物( )
(6)葡萄糖分子可表示为C6(H2O)6,则每个葡萄糖分子含有6个水分子( )
(7)葡萄糖是单糖的主要原因是其分子结构中只有一个醛基( )
(8)所有的糖类都是有甜味的物质,且在一定条件下都能发生水解反应( )
(9)依据糖类的现代定义分析,CH3—CH(OH)—CHO属于糖类( )
正误判断
×
×
√
×
√
×
×
×
×
对点训练
1. 葡萄糖
(2)物理性质:
(1)存在:葡萄糖存在于水果、蜂蜜,以及植物的种子、叶、根、花中。
动物的血液和淋巴液中也含有葡萄糖。
无色晶体(或白色粉末),熔点146℃,有甜味,但甜度不如蔗糖,
易溶于水,微溶于乙醇,不溶于乙醚。
因最早是从葡萄干中分离得到而得名。
自然界中分布最广的单糖
[代表物:葡萄糖、果糖、核糖与脱氧核糖]
二、单糖
(3)分子组成和结构
结构简式:
官能团:
分子式:
C6H12O6
CH2 CH CH CH CH CHO
OH
OH
OH
OH
OH
五羟基己醛
相对分子质量:
实验式:
CH2O
180
球棍模型
羟基—OH、
醛基—CHO
多羟基醛
还原性糖
或CH2OH(CHOH)4CHO;或
(4)化学性质
CH2OH(CHOH)4CHO+2Ag(NH3)2OH
CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
氧化
反应
加成反应:
CH2OH(CHOH)4CHO+H2
Ni
催化加氢
④ 生理氧化:
C6H12O6+6O2 6CO2+6H2O
CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH
CH2OH(CHOH)4COONa+Cu2O↓+3H2O
③与KMnO4(H+)、溴水等强氧化剂反应
羟基
醛基
与Na反应(1mol葡萄糖与足量的Na反应,产生 molH2)
置换反应:
取代反应
2.5
酯化反应
与HX反应
分子间脱水
消去反应
氧化反应
①银镜反应:
②与新制Cu(OH)2悬浊液反应:
CH2OH(CHOH)4CH2OH
1mol葡萄糖:最多5mol乙酸(含5个羟基)
葡萄糖酸铵
用于制镜工业
医学用于检验尿糖
提供维持生命活动所需要的能量
产物:己六醇
分别向新制氢氧化铜悬浊液中,
滴入等量乙醛、乙醇、丙三醇、葡萄糖,观察现象
乙醛
乙醇
丙三醇
葡萄糖
结论:
多羟基有机化合物:与新制氢氧化铜作用可产生绛蓝色溶液
依据以上实验现象,推测葡萄糖结构中,具有怎样的结构?
葡萄糖具有与甘油相似的性质,推测葡萄糖含有多个羟基
拓展实验
(5)葡萄糖的来源与用途(性质决定用途)
自然形成:植物在叶绿素催化下吸收太阳光将空气中CO2与水转化为葡萄糖
6CO2 +6H2O C6H12O6 +6O2
营养物质
制糖果
制镜、热水瓶胆镀银
酿酒
制药
用途
糖果制造业
镀银工业
制药工业
制酒工业
葡萄糖可直接被人体吸收。人生病不能正常饮食或低血糖时,
医生一般会静脉注射葡萄糖水溶液方式来迅速补充营养。
[CH2OH -(CHOH)4-COO]2Ca
葡萄糖生理氧化
—— 人体能量的主要来源
C6H12O6(s) + 6O2(g) 6CO2(g) + 6H2O(l)
△H = -2804 kJ/mol
葡萄糖
3.有些家庭自家酿制葡萄酒,你知道用葡萄酿酒的原理吗?
C6H12O6
2C2H5OH + 2CO2↑
酒化酶
葡萄糖
注意:Ⅰ.有机物反应涉及常见官能团转化时,要用结构简式:如葡萄糖发生银镜反应、酯化反应。
Ⅱ.对于糖类反应,如不涉及官能团转化,则可用分子式或分子通式表示糖类物质,
同时在其下方标明糖类物质的名称,以示区别!
1.当病人低血糖,常常注入葡萄糖溶液起什么作用?
发生生理氧化反应:
有氧呼吸
算一算:已知某中学生每日消耗的能量大约为10000kJ,假设这些能量都由葡萄糖参与有氧呼吸来提供,请计算该中学生每日应摄取的葡萄糖的质量为多少克?
M= ×180g/mol=641.9g
10000kJ
2804kJ/mol
2.长时间坐着写字会感到腰、肩酸痛。很久没有运动,偶尔去登山,第二天必定小腿 酸胀的厉害。你能解释产生这些现象的原因吗?
发生生理氧化反应:无氧呼吸
C6H12O6 2CH3CH(OH)COOH
酶
思考与交流
化学与生活:尿糖的检验
出现红色沉淀:有大量Cu2O生成,尿液中葡萄糖含量较高,
病情较重,用“++++”表示;
出现土黄色:含糖量为中等,用“+++”表示;
出现黄绿色:含糖量为少量,用“++”表示;
出现绿色:含糖量为微量,用“+”表示;
如仍保持原来的蓝色:证明尿液中不含葡萄糖,用“—”表示。
糖尿病患者的糖代谢功能紊乱,其血液和尿液中的葡萄糖含量会超出正常范围。测定患者血液或尿液中的葡萄糖含量有助于判断病情,可使用根据葡萄糖特征反应原理制备的试纸进行测试。
化学与生活
葡萄糖的环状结构
α-D- 吡喃葡萄糖
链状葡萄糖
β-D- 吡喃葡萄糖
葡萄糖分子中的醛基可以与分子内的羟基作用,形成两种六元环状结构。在葡萄糖水溶液中,存在着链状和环状结构葡萄糖之间的平衡,其中绝大部分葡萄糖为环状结构。很多单糖,以及寡糖和多糖中的单糖单元多以环状结构的形式存在。
单糖分子中的醛基与它自身的羟基相互作用,形成了半缩醛,1927年,英国化学家哈沃斯通过化学实验的方法测定出了葡萄糖等单糖的环状结构。
在有机化合物分子中,六元环的结构通常比较稳定。
拓展延伸
资料卡片
(1)葡萄糖分子式可表示为C6(H2O)6,则每个葡萄糖分子中含有6个H2O( )
(2)可用新制Cu(OH)2悬浊液检测病人尿液中的葡萄糖( )
(3)葡萄糖具有还原性,可使酸性KMnO4溶液褪色( )
(4)配制银氨溶液时,应将2%的AgNO3溶液滴入过量的2%的稀氨水中( )
(5)1 mol葡萄糖可以和5 mol乙酸发生酯化反应( )
(6)葡萄糖溶液呈酸性,可和NaHCO3反应生成CO2( )
1.判断正误
×
×
×
√
√
√
对点训练
(1)
CH2OH(CHOH)4CHO + H2
Ni
己六醇
CH2OH(CHOH)4CH2OH
+ Na
ONa
CH2-CH-CH-CH-CH-CHO
ONa
ONa
ONa
ONa
OH
CH2-CH-CH-CH-CH-CHO
OH
OH
OH
OH
+ H2↑
5
10
2
2
2.写出葡萄糖分别发生下列反应的化学方程式。
①H2 ②Na ③乙酸
(2)
(3)
CH2-(CH)4-CHO
OH
OH
+ CH3COOH
浓硫酸
△
CH2—(CH)4-CHO
OOCCH3
OOCCH3
五乙酸葡萄糖酯
5
对点训练
2.果糖
(1) 物性:
(2) 分子式:
(3) 结构简式:
无色晶体,易溶于水,熔点为103-105℃,它不易结晶,通常为黏稠性液体,易溶于水、乙醇和乙醚,吸湿性强。最甜
C6H12O6
多羟基酮
与葡萄糖互为同分异构体
O
CH2—CH—CH—CH—C—CH2
OH
OH
OH
OH
OH
=
或
CH2OH(CHOH)3COCH2OH
果糖在水果和蜂蜜中含量较高,广泛用于食品和医药的生成中。
(4) 官能团:
羟基
酮羰基
异构化反应
其主要原因是果糖中具有酮羰基,在碱性条件下易转化为烯二醇中间体,它可异构化为醛式,所以果糖也可以发生银镜反应和与新制Cu(OH)2反应 (碱性条件)
(碱性条件)
(4)化学性质
① 多元醇和酮的性质
如:与金属钠反应、酯化反应、能与H2加成反应等
② 体内氧化,程度缓慢
③ 特例:果糖也有还原性(碱性条件下,果糖会发生异构化反应生成葡萄糖)
葡萄糖是醛糖,具有还原性。果糖是酮糖,是否也像葡萄糖一样具有还原性?
请你设计实验探究果糖是否具有还原性
【实验】在试管中加入2 mL 10%NaOH溶液,滴加5%CuSO4溶液5滴,再加入2mL10%果糖溶液加热,有____________产生.
砖红色沉淀
思考1:能否用银氨溶液鉴别葡萄糖和果糖?
不能
在碱性条件下,果糖分子中羰基受多个羟基的影响有很强的还原性.
思考2:根据醛基可以被氧化剂氧化这一性质,应如何鉴别果糖和葡萄糖,并写出对应的化学方程式。
CH2OH(CHOH)4CHO+Br2+H2O→CH2OH(CHOH)4COOH+2HBr
结论:可用溴水区分葡萄糖和果糖。
提醒:在酸性条件下, 果糖不能被溴水氧化
提醒:在酸性条件下果糖分子不能发生结构异构化,所以果糖不被溴水氧化
葡萄糖能使溴水褪色。
科学探究
葡萄糖 果糖
分子式
结构简式
官能团
类别
物理性质
用途 用于制镜、糖果、医药等行业 主要用于食品工业
相互关系 C6H12O6
C6H12O6
CH2OH(CHOH)4CHO
—OH和—CHO
—OH和
互为同分异构体
单糖
单糖
白色晶体,有甜味,易溶于水,稍易溶于乙醇,不溶于乙醚
纯净的果糖是无色晶体,不易结晶,通常为黏稠性液体,易溶于水、乙醇和乙醚
对比归纳
1.有关葡萄糖与果糖的下列说法中,不正确的是( )
①二者互为同分异构体
②二者都易溶于水
③二者都能发生银镜反应、都能与新制的Cu(OH)2反应生成砖红色沉淀 ④葡萄糖能发生酯化反应,而果糖不能
⑤都能与H2发生加成反应生成六元醇
⑥果糖是最甜的糖,而葡萄糖没有甜味
A.①②③ B.④⑤ C.④⑥ D.⑥
C
对点训练
→核糖与脱氧核糖分别是生物体的遗传物质核糖核酸(RNA)与脱氧核糖核酸(DNA)的重要组成部分。
核糖 脱氧核糖
分子式
结构简式
特点 3.核糖与脱氧核糖
→它们都是含有
5个碳原子的单糖——戊糖。
二者都含有醛基,均属于醛糖,属于还原性糖
C5H10O5
C5H10O4
多羟基醛(双官能团)
核糖
脱氧核糖
教材P111练习与应用
√
√
√
√
①②③⑤
2.核糖是合成核酸的重要原料,结构简式为CH2OH-CHOH-CHOH-CHOH-CHO,下列关于核糖的叙述正确的是( )
A.与葡萄糖互为同分异构体 B.可与新制的Cu(OH)2作用生成砖红色沉淀
C.不能发生取代反应 D.可以使紫色的石蕊溶液变红
B
对点训练
1.
糖类分子与手性
1.手性碳原子:在分子中连有4个不同的原子或原子团的碳原子叫做不对称碳原子,也叫手性碳原子。
2.手性分子:含有手性碳原子存在(不能重叠、互为镜像的)对映异构体。人们把这样的分子称为手性分子。:如 (丙醛糖又称甘油醛——最简单的醛糖)
3.对映异构:
L-甘油醛
D-甘油醛
知识拓展:D构型和L构型(D/L法):
这种方法只考虑与羰基相距最远的一个手性碳的构型,此手性碳上的羟基在右边的D型,在左边的L型。
手性分子的两种构型,在生理活性等方面有很大差别。
自然界存在的葡萄糖和果糖都具有D构型,我们身体能代谢的也是D型,不过舌头则可以尝出L型葡萄糖的甜味,故理论上,如果只用L型葡萄糖去煮甜品,会是既好吃,又不会肥。
教材P102-103
资料卡片
木糖的分子式为C5H10O5,属于多羟基醛,木糖在浓硫酸作用下生成糠醛
(1)木糖的结构简式为________________,
木糖不可能具有的性质是____
A.水解反应 B.还原反应 C.氧化反应
D.取代反应 E.加成反应 F.酯化反应
A
糠醛
(2)形成糠醛的过程,1分子木糖脱去了____分子水。
3
(3)写出糠醛被新制的氢氧化铜氧化的化学方程式:________。
CH2 CH CH CH CHO
OH
OH
OH
OH
拓展训练
网
科
第一节 糖类
第四章 生物大分子
4.1.1 糖类的组成和分类、单糖
学习目标
教材内容:P100-103
1.了解糖类的概念、组成和性质特点。
2.了解葡萄糖的结构特点和主要性质,能通过实验探究认识葡萄糖的化学性质。深化对多官能团有机化合物中羟基和醛基性质的认识。
3.知道糖类物质的应用,了解糖类在人体供能、储能等方面的作用,了解糖类的摄入和代谢与人体健康之间的关系,科学合理地搭配饮食。
糖尿病是由于胰腺分泌功能缺陷或胰岛素作用缺陷引起的,以血糖升高为特征的代谢性疾病,称为现代疾病中仅次于癌症的第二杀手,全世界糖尿病患者已超过4亿人,我国的糖尿病患者已超过1.3亿人。
新课导入
有机物 元素组成 代表物 代表物分子 水溶性 性质
糖类 单糖 C、H、O 葡萄糖(属醛糖)、果糖(属酮糖) (互为同分异构体) C6H12O6 易溶 ①单糖不能水解;
②能发生银镜反应(或与新制Cu(OH)2悬浊液反应)的有葡萄糖、果糖、麦芽糖;
③淀粉遇碘变蓝;
④人体内无消化纤维素的酶,但能刺激肠胃蠕动
二糖 麦芽糖、蔗糖 (互为同分异构体) C12H22O11 易溶 多糖 淀粉、纤维素 (不是同分异构体,都是天然有机高分子) (C6H10O5)n 不溶
知识回顾
纤维(C6H10O5)n
葡萄糖(C6H12O6)
淀粉(C6H10O5)n
麦芽(C12H22O11)
蔗糖(C12H22O11)
果糖(C6H12O6)
生活中常见的糖类
糖类是一类重要的有机化合物,在自然界中分布广泛,日常食用的蔗糖、粮食中的淀粉、植物茎叶中的纤维素、人体血液中的葡萄糖等均属于糖类。糖类在生命活动中起着重要作用,是生物体所需能量的主要来源,也是重要的能量储存物质,如植物体内的淀粉和动物体内的糖原。糖类还是很多生物体的结构成分,如植物细胞壁的主要成分纤维素。
1.组成元素:
C、H、O
2.通式:
糖类
“碳水化合物”
糖类
有甜味
问1:符合该通式的一定是糖类?
糖类一定符合该通式?
问2:糖类都有甜味?
有甜味的物质一定是糖?
(不一定,如:乙酸CH3COOH 、乳酸C3H6O3 )
(不一定,如纤维素和淀粉无甜味)
(不一定,如:脱氧核糖C5H10O4 鼠李糖 C6H12O5 )
不一定,如:甘油、阿斯巴甜、糖精、木糖醇。
但,糖类习惯性叫碳水化合物,沿用至今
很多糖类分子中氢原子和氧原子的数目比恰好为______,
其组成可以用通式____________表示.
2:1
Cm(H2O)n
一、糖类的组成和分类
从分子结构上看,糖类是多羟基醛、多羟基酮和它们的脱水缩合物。
3. 糖类的结构
葡萄糖
果糖
(1)几种单糖的结构
多羟基醛
多羟基酮
寡糖(低聚糖)
单糖
多糖
水解
缩合
水解
缩聚
水解
缩合
(2~10)
( >10)
(2)糖类的相互转化
缩合一般指两个或更多反应物生成一个主要产物,并伴随着失去H2O等小分子的反应。
核糖
脱氧核糖
单糖(不能水解)
寡糖(低聚糖)(1mol水解产生2~10mol单糖)
多糖(1mol水解产生n mol(n >10)单糖)
葡萄糖、果糖C6H12O6;
其中水解生成2 mol单糖的糖又叫二糖,
如:麦芽糖、蔗糖、乳糖(C12H22O11)等。
淀粉、纤维素、糖原等
核糖(C5H10O5)、脱氧核糖(C5H10O4)等
4. 糖类的分类
(1)依据:是否水解及水解产物。
(2)依据:是否有还原性
糖类
还原性糖:能发生银镜反应的糖
非还原性糖:不能发生银镜反应的糖
如:葡萄糖、果糖(无醛基)、麦芽糖
如:蔗糖、淀粉、纤维素
糖类
(1)糖类化合物的分子通式都可用Cm(H2O)n来表示( )
(2)糖类都能发生水解反应( )
(3)糖类是多羟基醛或多羟基酮以及它们的脱水缩合物( )
(4)凡是由C、H、O三种元素组成的有机物都是糖类( )
(5)糖类物质又叫碳水化合物( )
(6)葡萄糖分子可表示为C6(H2O)6,则每个葡萄糖分子含有6个水分子( )
(7)葡萄糖是单糖的主要原因是其分子结构中只有一个醛基( )
(8)所有的糖类都是有甜味的物质,且在一定条件下都能发生水解反应( )
(9)依据糖类的现代定义分析,CH3—CH(OH)—CHO属于糖类( )
正误判断
×
×
√
×
√
×
×
×
×
对点训练
1. 葡萄糖
(2)物理性质:
(1)存在:葡萄糖存在于水果、蜂蜜,以及植物的种子、叶、根、花中。
动物的血液和淋巴液中也含有葡萄糖。
无色晶体(或白色粉末),熔点146℃,有甜味,但甜度不如蔗糖,
易溶于水,微溶于乙醇,不溶于乙醚。
因最早是从葡萄干中分离得到而得名。
自然界中分布最广的单糖
[代表物:葡萄糖、果糖、核糖与脱氧核糖]
二、单糖
(3)分子组成和结构
结构简式:
官能团:
分子式:
C6H12O6
CH2 CH CH CH CH CHO
OH
OH
OH
OH
OH
五羟基己醛
相对分子质量:
实验式:
CH2O
180
球棍模型
羟基—OH、
醛基—CHO
多羟基醛
还原性糖
或CH2OH(CHOH)4CHO;或
(4)化学性质
CH2OH(CHOH)4CHO+2Ag(NH3)2OH
CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
氧化
反应
加成反应:
CH2OH(CHOH)4CHO+H2
Ni
催化加氢
④ 生理氧化:
C6H12O6+6O2 6CO2+6H2O
CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH
CH2OH(CHOH)4COONa+Cu2O↓+3H2O
③与KMnO4(H+)、溴水等强氧化剂反应
羟基
醛基
与Na反应(1mol葡萄糖与足量的Na反应,产生 molH2)
置换反应:
取代反应
2.5
酯化反应
与HX反应
分子间脱水
消去反应
氧化反应
①银镜反应:
②与新制Cu(OH)2悬浊液反应:
CH2OH(CHOH)4CH2OH
1mol葡萄糖:最多5mol乙酸(含5个羟基)
葡萄糖酸铵
用于制镜工业
医学用于检验尿糖
提供维持生命活动所需要的能量
产物:己六醇
分别向新制氢氧化铜悬浊液中,
滴入等量乙醛、乙醇、丙三醇、葡萄糖,观察现象
乙醛
乙醇
丙三醇
葡萄糖
结论:
多羟基有机化合物:与新制氢氧化铜作用可产生绛蓝色溶液
依据以上实验现象,推测葡萄糖结构中,具有怎样的结构?
葡萄糖具有与甘油相似的性质,推测葡萄糖含有多个羟基
拓展实验
(5)葡萄糖的来源与用途(性质决定用途)
自然形成:植物在叶绿素催化下吸收太阳光将空气中CO2与水转化为葡萄糖
6CO2 +6H2O C6H12O6 +6O2
营养物质
制糖果
制镜、热水瓶胆镀银
酿酒
制药
用途
糖果制造业
镀银工业
制药工业
制酒工业
葡萄糖可直接被人体吸收。人生病不能正常饮食或低血糖时,
医生一般会静脉注射葡萄糖水溶液方式来迅速补充营养。
[CH2OH -(CHOH)4-COO]2Ca
葡萄糖生理氧化
—— 人体能量的主要来源
C6H12O6(s) + 6O2(g) 6CO2(g) + 6H2O(l)
△H = -2804 kJ/mol
葡萄糖
3.有些家庭自家酿制葡萄酒,你知道用葡萄酿酒的原理吗?
C6H12O6
2C2H5OH + 2CO2↑
酒化酶
葡萄糖
注意:Ⅰ.有机物反应涉及常见官能团转化时,要用结构简式:如葡萄糖发生银镜反应、酯化反应。
Ⅱ.对于糖类反应,如不涉及官能团转化,则可用分子式或分子通式表示糖类物质,
同时在其下方标明糖类物质的名称,以示区别!
1.当病人低血糖,常常注入葡萄糖溶液起什么作用?
发生生理氧化反应:
有氧呼吸
算一算:已知某中学生每日消耗的能量大约为10000kJ,假设这些能量都由葡萄糖参与有氧呼吸来提供,请计算该中学生每日应摄取的葡萄糖的质量为多少克?
M= ×180g/mol=641.9g
10000kJ
2804kJ/mol
2.长时间坐着写字会感到腰、肩酸痛。很久没有运动,偶尔去登山,第二天必定小腿 酸胀的厉害。你能解释产生这些现象的原因吗?
发生生理氧化反应:无氧呼吸
C6H12O6 2CH3CH(OH)COOH
酶
思考与交流
化学与生活:尿糖的检验
出现红色沉淀:有大量Cu2O生成,尿液中葡萄糖含量较高,
病情较重,用“++++”表示;
出现土黄色:含糖量为中等,用“+++”表示;
出现黄绿色:含糖量为少量,用“++”表示;
出现绿色:含糖量为微量,用“+”表示;
如仍保持原来的蓝色:证明尿液中不含葡萄糖,用“—”表示。
糖尿病患者的糖代谢功能紊乱,其血液和尿液中的葡萄糖含量会超出正常范围。测定患者血液或尿液中的葡萄糖含量有助于判断病情,可使用根据葡萄糖特征反应原理制备的试纸进行测试。
化学与生活
葡萄糖的环状结构
α-D- 吡喃葡萄糖
链状葡萄糖
β-D- 吡喃葡萄糖
葡萄糖分子中的醛基可以与分子内的羟基作用,形成两种六元环状结构。在葡萄糖水溶液中,存在着链状和环状结构葡萄糖之间的平衡,其中绝大部分葡萄糖为环状结构。很多单糖,以及寡糖和多糖中的单糖单元多以环状结构的形式存在。
单糖分子中的醛基与它自身的羟基相互作用,形成了半缩醛,1927年,英国化学家哈沃斯通过化学实验的方法测定出了葡萄糖等单糖的环状结构。
在有机化合物分子中,六元环的结构通常比较稳定。
拓展延伸
资料卡片
(1)葡萄糖分子式可表示为C6(H2O)6,则每个葡萄糖分子中含有6个H2O( )
(2)可用新制Cu(OH)2悬浊液检测病人尿液中的葡萄糖( )
(3)葡萄糖具有还原性,可使酸性KMnO4溶液褪色( )
(4)配制银氨溶液时,应将2%的AgNO3溶液滴入过量的2%的稀氨水中( )
(5)1 mol葡萄糖可以和5 mol乙酸发生酯化反应( )
(6)葡萄糖溶液呈酸性,可和NaHCO3反应生成CO2( )
1.判断正误
×
×
×
√
√
√
对点训练
(1)
CH2OH(CHOH)4CHO + H2
Ni
己六醇
CH2OH(CHOH)4CH2OH
+ Na
ONa
CH2-CH-CH-CH-CH-CHO
ONa
ONa
ONa
ONa
OH
CH2-CH-CH-CH-CH-CHO
OH
OH
OH
OH
+ H2↑
5
10
2
2
2.写出葡萄糖分别发生下列反应的化学方程式。
①H2 ②Na ③乙酸
(2)
(3)
CH2-(CH)4-CHO
OH
OH
+ CH3COOH
浓硫酸
△
CH2—(CH)4-CHO
OOCCH3
OOCCH3
五乙酸葡萄糖酯
5
对点训练
2.果糖
(1) 物性:
(2) 分子式:
(3) 结构简式:
无色晶体,易溶于水,熔点为103-105℃,它不易结晶,通常为黏稠性液体,易溶于水、乙醇和乙醚,吸湿性强。最甜
C6H12O6
多羟基酮
与葡萄糖互为同分异构体
O
CH2—CH—CH—CH—C—CH2
OH
OH
OH
OH
OH
=
或
CH2OH(CHOH)3COCH2OH
果糖在水果和蜂蜜中含量较高,广泛用于食品和医药的生成中。
(4) 官能团:
羟基
酮羰基
异构化反应
其主要原因是果糖中具有酮羰基,在碱性条件下易转化为烯二醇中间体,它可异构化为醛式,所以果糖也可以发生银镜反应和与新制Cu(OH)2反应 (碱性条件)
(碱性条件)
(4)化学性质
① 多元醇和酮的性质
如:与金属钠反应、酯化反应、能与H2加成反应等
② 体内氧化,程度缓慢
③ 特例:果糖也有还原性(碱性条件下,果糖会发生异构化反应生成葡萄糖)
葡萄糖是醛糖,具有还原性。果糖是酮糖,是否也像葡萄糖一样具有还原性?
请你设计实验探究果糖是否具有还原性
【实验】在试管中加入2 mL 10%NaOH溶液,滴加5%CuSO4溶液5滴,再加入2mL10%果糖溶液加热,有____________产生.
砖红色沉淀
思考1:能否用银氨溶液鉴别葡萄糖和果糖?
不能
在碱性条件下,果糖分子中羰基受多个羟基的影响有很强的还原性.
思考2:根据醛基可以被氧化剂氧化这一性质,应如何鉴别果糖和葡萄糖,并写出对应的化学方程式。
CH2OH(CHOH)4CHO+Br2+H2O→CH2OH(CHOH)4COOH+2HBr
结论:可用溴水区分葡萄糖和果糖。
提醒:在酸性条件下, 果糖不能被溴水氧化
提醒:在酸性条件下果糖分子不能发生结构异构化,所以果糖不被溴水氧化
葡萄糖能使溴水褪色。
科学探究
葡萄糖 果糖
分子式
结构简式
官能团
类别
物理性质
用途 用于制镜、糖果、医药等行业 主要用于食品工业
相互关系 C6H12O6
C6H12O6
CH2OH(CHOH)4CHO
—OH和—CHO
—OH和
互为同分异构体
单糖
单糖
白色晶体,有甜味,易溶于水,稍易溶于乙醇,不溶于乙醚
纯净的果糖是无色晶体,不易结晶,通常为黏稠性液体,易溶于水、乙醇和乙醚
对比归纳
1.有关葡萄糖与果糖的下列说法中,不正确的是( )
①二者互为同分异构体
②二者都易溶于水
③二者都能发生银镜反应、都能与新制的Cu(OH)2反应生成砖红色沉淀 ④葡萄糖能发生酯化反应,而果糖不能
⑤都能与H2发生加成反应生成六元醇
⑥果糖是最甜的糖,而葡萄糖没有甜味
A.①②③ B.④⑤ C.④⑥ D.⑥
C
对点训练
→核糖与脱氧核糖分别是生物体的遗传物质核糖核酸(RNA)与脱氧核糖核酸(DNA)的重要组成部分。
核糖 脱氧核糖
分子式
结构简式
特点 3.核糖与脱氧核糖
→它们都是含有
5个碳原子的单糖——戊糖。
二者都含有醛基,均属于醛糖,属于还原性糖
C5H10O5
C5H10O4
多羟基醛(双官能团)
核糖
脱氧核糖
教材P111练习与应用
√
√
√
√
①②③⑤
2.核糖是合成核酸的重要原料,结构简式为CH2OH-CHOH-CHOH-CHOH-CHO,下列关于核糖的叙述正确的是( )
A.与葡萄糖互为同分异构体 B.可与新制的Cu(OH)2作用生成砖红色沉淀
C.不能发生取代反应 D.可以使紫色的石蕊溶液变红
B
对点训练
1.
糖类分子与手性
1.手性碳原子:在分子中连有4个不同的原子或原子团的碳原子叫做不对称碳原子,也叫手性碳原子。
2.手性分子:含有手性碳原子存在(不能重叠、互为镜像的)对映异构体。人们把这样的分子称为手性分子。:如 (丙醛糖又称甘油醛——最简单的醛糖)
3.对映异构:
L-甘油醛
D-甘油醛
知识拓展:D构型和L构型(D/L法):
这种方法只考虑与羰基相距最远的一个手性碳的构型,此手性碳上的羟基在右边的D型,在左边的L型。
手性分子的两种构型,在生理活性等方面有很大差别。
自然界存在的葡萄糖和果糖都具有D构型,我们身体能代谢的也是D型,不过舌头则可以尝出L型葡萄糖的甜味,故理论上,如果只用L型葡萄糖去煮甜品,会是既好吃,又不会肥。
教材P102-103
资料卡片
木糖的分子式为C5H10O5,属于多羟基醛,木糖在浓硫酸作用下生成糠醛
(1)木糖的结构简式为________________,
木糖不可能具有的性质是____
A.水解反应 B.还原反应 C.氧化反应
D.取代反应 E.加成反应 F.酯化反应
A
糠醛
(2)形成糠醛的过程,1分子木糖脱去了____分子水。
3
(3)写出糠醛被新制的氢氧化铜氧化的化学方程式:________。
CH2 CH CH CH CHO
OH
OH
OH
OH
拓展训练
