1.3氧化还原反应同步练习题(含解析)高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3氧化还原反应同步练习题(含解析)高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 589.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-12 07:23:46 | ||
图片预览




文档简介
1.3 氧化还原反应 同步练习题
一、选择题
1.是常见的氧化剂,可氧化、、等离子,且已知还原性:。在和混合溶液中,通入一定量,溶液中存在的离子组不合理的是
A.、、 B.、、
C.、、 D.、、、
2.化学与生产、生活息息相关,下列过程不涉及氧化还原反应的是
A.氢氧化钠破坏铝的氧化物保护膜
B.服用维生素C以保证亚铁补血剂的吸收效果
C.高铁酸钠()用于自来水的杀菌、消毒
D.储氢合金与结合形成金属氢化物
3.已知在酸性溶液中易被还原成;、、、、的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A. B.
C. D.
4.和热的KOH溶液发生离子反应:①。而实验室用和盐酸制取发生离子反应:②。下列说法错误的是
A.反应①中既是氧化剂又是还原剂
B.反应②中每生成3 mol转移电子的物质的量为6mol
C.反应②中氧化产物和还原产物质量之比为5:1
D.反应①中氧化性;反应②中氧化性,原因是发生反应时的酸碱性环境不同
5.下列反反应中,水作还原剂的是
A.2H2O+2F2= 4HF+O2
B.3Fe+4H2OFe3O4+4H2
C.2Na+2H2O=2NaOH+H2↑
D.2H2O22H2O+O2↑
6.下列反应中,属于氧化还原反应的是
A.KOH+HCl = KCl+H2O B.SO3+H2O= H2SO4
C.3NO2+H2O= 2HNO3+NO D.SiO2+2NaOH=Na2SiO3+H2O
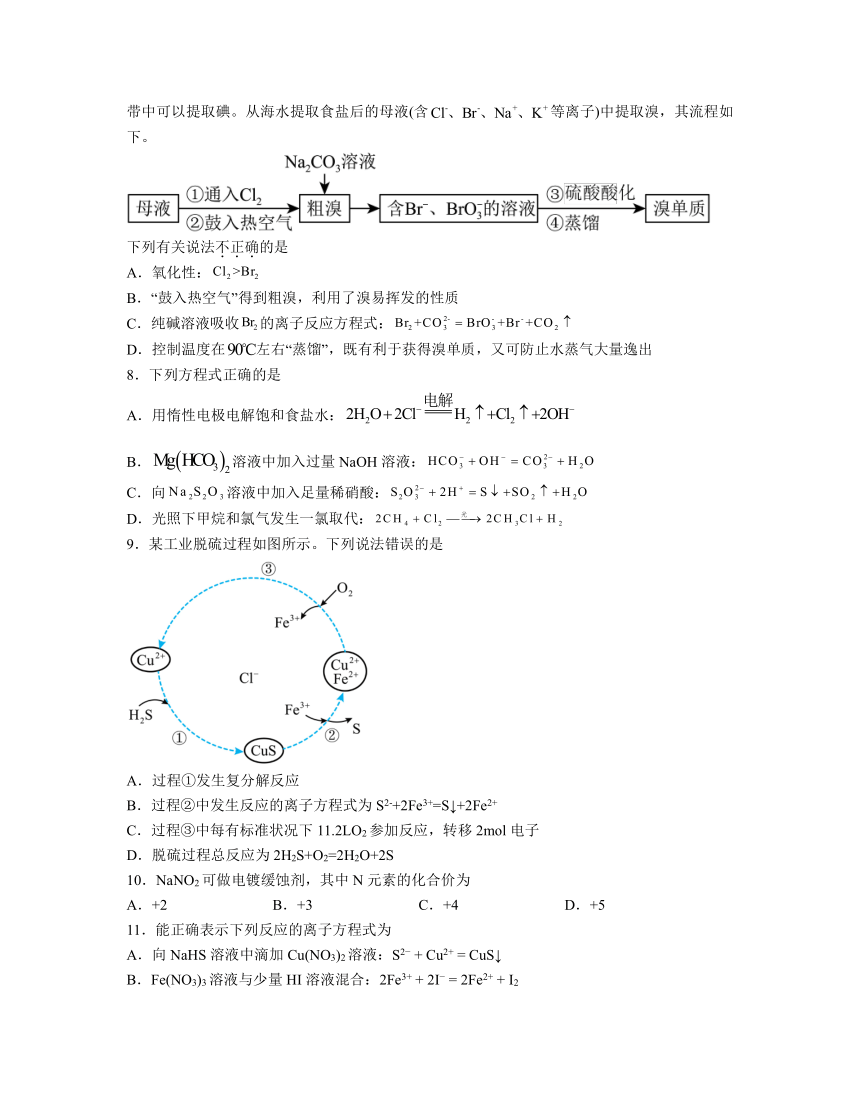
7.海水晒盐后精制得到;氯碱工业电解饱和溶液得到和;向海水晒盐得到的卤水中通可制溴;从海水中还能提取镁;海洋中许多藻类植物具有富集碘的能力,从海带中可以提取碘。从海水提取食盐后的母液(含等离子)中提取溴,其流程如下。
下列有关说法不正确的是
A.氧化性:
B.“鼓入热空气”得到粗溴,利用了溴易挥发的性质
C.纯碱溶液吸收的离子反应方程式:
D.控制温度在左右“蒸馏”,既有利于获得溴单质,又可防止水蒸气大量逸出
8.下列方程式正确的是
A.用惰性电极电解饱和食盐水:
B.溶液中加入过量NaOH溶液:
C.向溶液中加入足量稀硝酸:
D.光照下甲烷和氯气发生一氯取代:
9.某工业脱硫过程如图所示。下列说法错误的是
A.过程①发生复分解反应
B.过程②中发生反应的离子方程式为S2-+2Fe3+=S↓+2Fe2+
C.过程③中每有标准状况下11.2LO2参加反应,转移2mol电子
D.脱硫过程总反应为2H2S+O2=2H2O+2S
10.NaNO2可做电镀缓蚀剂,其中N元素的化合价为
A.+2 B.+3 C.+4 D.+5
11.能正确表示下列反应的离子方程式为
A.向NaHS溶液中滴加Cu(NO3)2溶液:S2 + Cu2+ = CuS↓
B.Fe(NO3)3溶液与少量HI溶液混合:2Fe3+ + 2I = 2Fe2+ + I2
C.向酸性KMnO4溶液中滴加双氧水:2 + H2O2 + 6H+ = 2Mn2+ + 3O2↑ + 4H2O
D.Mg(HCO3)2溶液与过量NaOH溶液混合:Mg2+ + 2 + 4OH = Mg(OH)2↓ + 2H2O + 2
12.在酸性环境中几种离子之间会发生如下转化:
下列说法中不正确的是
A.离子的还原性从弱到强的顺序是Ce3+<Mn2+<Fe2+<I-
B.反应可能会发生
C.在反应②中Fe2+作为还原剂
D.Fe3+与I-可以共存
13.是一种食品添加剂,在一定条件下能发生反应:,下列叙述中正确的是
A.该反应中被还原
B.是该反应的氧化产物
C.生成需消耗
D.□中的粒子是
14.同时满足四大基本反应类型之一、氧化还原反应、离子反应的变化是
A.NaHCO3粉末加热分解 B.Zn与CuSO4溶液反应
C.铜丝在Cl2中燃烧 D.稀盐酸与NaOH溶液反应
15.现有下列三个氧化还原反应:
①
②
③
若某溶液中含有、和,要除去而不氧化和,可以加入的试剂是
A. B. C. D.
二、填空题
16.黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),
(1)补全并配平该反应的化学方程式,标出电子转移的数目和方向:_______
□P4+□NaOH+□_______= □PH3↑+□NaH2PO2
标出电子转移的数目和方向:_________
方程式配平_______
(2)其中氧化剂和还原剂质量比为_______。
17.I、已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
请回答下列问题:
(1)请将上述反应改写成离子方程式:___________。
(2)上述反应中,被氧化的物质是___________(填化学式,下同),发生还原反应的物质是___________。
(3)用双线桥法标出该反应的电子转移方向和数目:___________。
II、过氧化氢(H2O2,氧显-1价)的水溶液俗称双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。已知过氧化氢可以发生如下反应:
①Ag2O+H2O2=2Ag+O2↑+H2O;
②2H2O22H2O+O2↑;
③3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O。
请回答下列问题:
(4)H2O2仅体现氧化性的反应是___________(填反应序号,下同),H2O2仅体现还原性的反应是___________,H2O2既体现氧化性,又体现还原性的反应是___________
(5)根据上述反应可知,H2O2、Ag2O、K2CrO4的氧化性由弱到强的顺序是___________。
三、计算题
18.ClO2是一 种消毒、 杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2 ↑+2H2O 。试回答下列问题。
(1)该反应中氧化产物的化学式是______________________
(2)若反应共产生了4. 48L气体(标准状况),则反应转移电子的物质的量为__________,消耗还原剂的物质的量为________
(3)标准状况下44. 8mL的ClO2气体恰好能与50mL0. 1mol/L的Na2SO3溶液完全反应生成Na2SO4,氯元素在产物中的化合价为_________,此过程说明 ClO2具有_______(填 “氧化”或“还原”)性。
四、元素或物质推断题
19.形成酸雨的原理之一可简单表示如图:
请回答下列问题:
(1)酸雨的pH___________(填“>”“<”或“=”)5.6;
(2)D物质的化学式为___________;C物质的化学式为___________;
(3)反应b的化学方程式为___________。
(4)写出汽车尾气中CO、NO相互作用生成可参与大气循环的两种气体的化学方程式___________:反应中氧化剂是___________。
五、实验题
20.利用“价类二维图”研究物质的性质,是一种有效的学习方法。如图是铁元素及其化合物的二维图的部分信息。回答下列问题:
(1)X的化学式为_______,图中只具有还原性的物质是_______(写化学式)。
(2)实验室制备时,常伴随着反应②发生,此时的实验现象是_______。
(3)为验证的性质,进行如下实验:
Ⅰ.向固体中加入稀盐酸,固体溶解并产生无色气体,溶液为浅绿色;向浅绿色溶液中加入溶液,无明显现象。
Ⅱ.向Ⅰ中所得溶液中滴入几滴氯水,溶液变色。
Ⅲ.向固体中加入蒸馏水,固体未见明显减少;置于空气中一段时间后,难溶物上方出现红褐色物质。
①Ⅰ中反应的化学方程式是_______。
②Ⅱ中,滴入氯水反应的离子方程式是_______,溶液变为_______色。
③根据Ⅲ中现象,完成下列方程式并配平:_______。
【参考答案】
一、选择题
1.B
【分析】由题意知还原性顺序是:,则氧化性顺序是:Cl2>Br2>Fe3+>I2,根据氧化还原反应规律,氧化性强的先与还原性强的物质反应,则发生反应的先后顺序为:Cl2+2I-=I2 +2Cl-,2Fe2++Cl2═2Fe3++2Cl-,Cl2+2Br-=Br2 +2Cl-。
解析:A.若溶液中存在Fe2+、Br-、Cl-,表明I-被完全氧化,符合反应发生的先后顺序,选项A正确;
B.若溶液中存在Fe2+、Cl-、I-,表明Br-被完全氧化,不符合反应发生的先后顺序,选项B错误;
C.若溶液中存在Fe3+、Br-、Cl-,表明I-、Fe2+被完全氧化,符合反应发生的先后顺序,选项C正确;
D.若溶液中存在Fe2+、Br-、Cl-、I-,表明各种离子均没有被完全氧化,说明Cl2的量很少,符合反应发生的先后顺序,选项D正确;
答案选B。
2.A
解析:A.氢氧化钠破坏铝的氧化物保护膜过程中发生反应,该反应过程中没有元素的化合价发生变化,不是氧化还原反应,故A符合题意;
B.服用维生素C可将Fe3+还原为Fe2+,该过程中发生氧化还原反应,故B不符合题意;
C. 具有强氧化性,可用于杀菌消毒,该过程中被还原成Fe3+,涉及氧化还原反应,故C不符合题意;
D.储氢合金与结合形成金属氢化物的过程中,H元素的化合价发生变化,发生氧化还原反应,故D不符合题意;
故答案选A。
3.A
解析:A.根据信息,I-的还原性强于Fe2+,因此Cl2先氧化I-,A符合题意;
B.还原性Fe2+>Br-,氯气先和Br-反应,过量的氯气再和Fe2+反应,氯气不足时只有亚铁离子被氧化为铁离子,B不符合题意;
C.Co2O3的氧化性强于Cl2,反应中有氯气生成,C不符合题意;
D.Fe3+的氧化性强于I2,因此会与碘离子发生反应生成碘单质,D不符合题意。
故选A。
4.B
解析:A.反应①中所含氯元素化合价,部分从0价升高到中的+5价,部分从0价降低到中的-1价,因此既是氧化剂又是还原剂,A正确;
B.反应②中所含氯元素化合价从+5价降低到中的0价,降低5价,则每生成3 mol转移电子的物质的量为5mol,B错误;
C.反应②每生成3mol共6mol的0价Cl中,有5mol的0价Cl是由化合价升高得到的,作氧化产物,剩下1mol的0价Cl是由所含氯元素化合价降低得到的,作还原产物,则氧化产物和还原产物的质量比为5:1,C正确;
D.同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,反应①中既是氧化剂又是还原剂,是氧化产物,则氧化性:,反应②中是氧化剂,既是氧化产物又是还原产物,则氧化性:,由于发生反应时的酸碱性环境不同导致和的氧化性不同,D正确;
故选B。
5.A
解析:A.反应2H2O+2F2= 4HF+O2中,O元素由-2价升高到0价,则H2O作还原剂,A符合题意;
B.反应3Fe+4H2OFe3O4+4H2中,H元素由+1价降低到0价,则H2O作氧化剂,B不符合题意;
C.反应2Na+2H2O=2NaOH+H2↑中,H元素由+1价部分降低到0价,则H2O作氧化剂,C不符合题意;
D.反应2H2O22H2O+O2↑中,O元素由-1价部分降低到-2价,部分升高到0价,则H2O2既作氧化剂又作还原剂,H2O是还原产物,D不符合题意;
故选A。
6.C
解析:A.KOH+HCl = KCl+H2O反应,没有元素化合价改变,属于非氧化还原反应,故不选A;
B.SO3+H2O= H2SO4反应,没有元素化合价改变,属于非氧化还原反应,故不选B;
C.3NO2+H2O= 2HNO3+NO反应,反应前后N元素化合价改变,属于氧化还原反应,故选C;
D.SiO2+2NaOH=Na2SiO3+H2O反应,没有元素化合价改变,属于非氧化还原反应,故不选D;
选C。
7.C
【分析】由题给流程可知,向母液中通入氯气将溶液中的溴离子氧化为溴,鼓入热空气将溴吹出得到
粗溴;向粗溴中加入碳酸钠溶液,溴与碳酸钠溶液反应得到含有溴离子和溴酸根离子的混合溶液;向混合溶液中加入稀硫酸,酸性条件下溴离子与溴酸根离子反应生成溴,蒸馏收集得到溴单质。
解析:A.向母液中通入氯气将溶液中的溴离子氧化为溴,根据氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:,故A正确;
B.由分析可知,鼓入热空气将溴吹出得到粗溴,则得到粗溴的操作利用了溴易挥发的性质,故B正确;
C.由分析可知,向粗溴中加入碳酸钠溶液,溴与碳酸钠溶液反应得到含有溴离子和溴酸根离子的混合溶液,逆向配平,中Br元素化合价变化5价,Br-中Br元素化合价变化1价,根据得失电子守恒和电荷守恒配平离子方程式为:,故C错误;
D.控制温度在左右“蒸馏”,既有利于获得溴单质,又可防止水蒸气大量逸出,故D正确;
故选C。
8.A
解析:A.电解饱和食盐水,氯化钠和水反应生成氢氧化钠和氢气和氯气,离子方程式为:,A正确;
B.碳酸氢镁溶中加入过量的氢氧化钠溶液生成氢氧化镁沉淀和碳酸钠,B错误;
C.硫代硫酸钠和硝酸反应,硝酸表现氧化性,生成一氧化氮,硫元素被氧化,生成硫酸钠,C错误;
D.甲烷和氯气反应生成一氯甲烷和氯化氢,D错误;
故选A。
9.B
解析:A.过程①中CuCl2和H2S反应生成CuS和HCl,属于复分解反应,故A正确;
B.据图可知过程②中CuS被Fe3+氧化得到S单质,CuS为沉淀不能拆,离子方程式为CuS+2Fe3+= S+2Fe2++Cu2+,故B错误;
C.由图可知,该过程中O2中O元素由0价下降到-2价,标准状况下11.2LO2的物质的量为0.5mol,0.5molO2参加反应,转移0.5mol×4=2mol电子,故C正确;
D.由①H2S+Cu2+=CuS↓+2H+、②CuS+2Fe3+= S+2Fe2++Cu2+、③4Fe2++O2+4H+=4Fe3++2H2O,相加可得回收S的总反应为2H2S+O2=2H2O+2S,故D正确;
故选B。
10.B
解析:元素正负化合价代数和为0,钠呈+1价、氧为-2价,则N为+3价;
选B。
11.D
解析:A.硫氢根离子不能拆成硫离子,A错误;
B.硝酸根离子在酸性条件下能氧化碘离子,不是铁离子氧化碘离子,B错误;
C.该反应中锰原子得到10个电子,而过氧化氢做还原剂,失去2个电子,电子不守恒,C错误;
D.碳酸氢镁和过氧化钠溶液混合生成氢氧化镁和碳酸钠,离子方程式为Mg2+ + 2 + 4OH = Mg(OH)2↓ + 2H2O + 2,D正确;
故选D。
12.D
解析:A.反应①为Ce4++Mn2+=Ce3++Mn3+,反应②为Mn3++Fe2+=Fe3++Mn2+,反应③为2Fe3++2I-=2Fe2++I2,还原剂的还原性强于还原产物的还原性,则还原性:Ce3+<Mn2+<Fe2+<I-,故A正确;
B.还原性:Mn2+<I-,则反应可能会发生,故B正确;
C.反应②为Mn3++Fe2+=Fe3++Mn2+,反应中Fe元素化合价升高,Fe2+作为还原剂,故C正确;
D.由图可知,反应③为2Fe3++2I-=2Fe2++I2,Fe3+与I-不能共存,故D错误;
故选D。
13.C
解析:A.中氮化合价升高,失去电子,则该反应中被氧化,故A错误;
B.是化合价降低得到的产物,则是该反应的还原产物,故B错误;
C.中锰化合价降低5个价态,中氮化合价升高2个价态,根据化合价升降守恒得到系数配2,系数配5,即生成5mol硝酸钠,消耗2mol高锰酸钾,因此生成需消耗,故C正确;
D.根据质量守恒和电荷守恒得到□中的粒子是,故D错误。
综上所述,答案为C。
14.B
解析:A.NaHCO3粉末加热分解,元素化合价不变,属于非氧化还原反应,未在水溶液中进行,不是离子反应,A不符合;
B.Zn与溶液发生反应Zn+=ZnSO4+Cu,属于置换反应;有离子参与反应,属于离子反应;Cu、Zn元素化合价改变,属于氧化还原反应,B符合;
C.铜丝在中燃烧生成氯化铜,不是在溶液中的反应,不属于离子反应,C不符合;
D.稀盐酸与溶液反应生成氯化钠和水,元素化合价不变,属于非氧化还原反应,D不符合;
故选B。
15.B
解析:氧化剂氧化性大于氧化产物,由:
①得氧化性:大于;
②得氧化性:Br2大于;
③得氧化性:Cl2大于Br2;
氧化性强的物质会生成氧化性弱的物质,若某溶液中含有、和,要除去而不氧化和,可以加入的氧化剂为铁离子;
故选B。
二、填空题
16.(1)
(2)1:3
解析:(1)反应中磷元素部分化合价由0变为-3、部分由0变为+1,根据质量守恒可知,还会有水参与反应,结合电子守恒,反应为 ;单线桥表示电子的转移情况,故表示为 ;
(2)反应中磷元素部分化合价由0变为-3发生还原反应为氧化剂、部分由0变为+1发生氧化反应为还原剂,根据电子守恒可知,氧化剂和还原剂质量比为1:3。
17.(1)3Cu+8H++2=3Cu2++2NO↑+4H2O
(2) Cu HNO3
(3)
(4) ③ ① ②
(5)K2CrO4解析:(1)将8HNO3和3Cu(NO3)2拆写成离子并删去未反应的硝酸根离子,改写成离子方程式为3Cu+8H++2=3Cu2++2NO↑+4H2O;
(2)述反应中,Cu元素化合价升高,被氧化的物质是Cu,N元素化合价升降低,发生还原反应的物质是HNO3;
(3)Cu元素化合价升高失去电子,硝酸中N元素化合价降低得到电子,用双线桥法标出该反应的电子转移方向和数目为;
(4)③反应中Cr元素化合价升高,过氧化氢中氧元素化合价降低,H2O2仅体现氧化性;①反应中银元素化合价降低,过氧化氢中氧元素化合价升高只作还原剂,H2O2仅体现还原性;②反应中过氧化氢中氧元素化合价部分升高部分降低,H2O2既体现氧化性,又体现还原性;
(5)根据①反应可知氧化性H2O2三、计算题
18. CO2 0.1mol 0.05mol -1 氧化性
解析:(1)2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2 ↑+2H2O中Cl元素的化合价由+5价降低为+4价得到电子被还原,C元素的化合价由+3价升高到+4价,因此氧化产物为:CO2;
(2)若反应共产生了4.48L气体(标准状况),气体的物质的量为:0.2mol,由化学反应方程式可知,生成的气体中ClO2的物质的量与CO2的物质的量相等,因此0.2mol气体中含有0.1molCO2,因此生成0.1mol的二氧化碳转移0.1mol的电子,消耗还原剂H2C2O4的物质的量为0.05mol;
(3)标准状况下44.8mL的ClO2气体的物质的是量为0.002mol,50mL 0.1mol L-1的Na2SO3溶液中Na2SO3的物质的量为:0.005mol,而0.005molNa2SO3生成Na2SO4,硫元素化合价升高2价,失去0.01mol的电子,所以氯元素化合价降低=5价,则反应后的化合价为-1价,二氧化氯在反应中化合价降低,是氧化剂,反应中具有氧化性。
四、元素或物质推断题
19.(1)<
(2) H2SO3 H2SO4
(3)2SO2+O2=2SO3
(4) 2CO+2NO=N2+2CO2 NO
解析:含硫燃料燃烧生成SO2,A为SO2,A和氧气生成SO3,B为SO3,SO3和水生成C硫酸,A和水生成D为H2SO3,H2SO3和O2氧化为C硫酸。
(1)正常雨水因为溶解了空气中的二氧化碳,其pH约为5.6。SO2溶于雨水后与水反应生成硫酸,雨水的酸性增强,pH减小,则酸雨的pH<5.6;
(2)由以上分析可知,D为H2SO3,C为H2SO4;
(3)SO2和氧气生成SO3的化学方程式为2SO2+O2=2SO3;
(4)CO、NO相互作用生成氮气和二氧化碳的化学方程式为2CO+2NO=N2+2CO2,反应中N的化合价降低生成氮气,故氧化剂为NO。
五、实验题
20.(1) Fe2O3 Fe
(2)白色沉淀迅速变为灰绿色,最后变为红褐色
(3) FeCO3+2HCl=FeCl2+H2O+CO2↑ 2Fe2++Cl2=2Fe3++2Cl- 红
解析:(1)由图示可知,X为含正三价铁的氧化物,化学式为Fe2O3,图中只具有还原性的物质是Fe。
(2)实验室制备氢氧化亚铁时,常伴随着反应②的发生,实验现象为白色沉淀迅速变为灰绿色,最后变为红褐色。
(3)①I中是碳酸亚铁与盐酸发生复分解反应,其化学方程式为:FeCO3+2HCl=FeCl2+H2O+CO2↑。
②向氯化亚铁溶液中滴入氯水,氯水与亚铁离子反应生成铁离子,因为溶液中有硫氰酸钾,因此溶液变为红色,其离子方程式为:2Fe2++Cl2=2Fe3++2Cl-。
③出现红褐色为氢氧化铁,是+2价的铁元素被空气中的氧气氧化成+3价的铁元素,氧元素由0价降低到-2价,依据得失电子守恒和原子守恒可知,配平方程式为:。
一、选择题
1.是常见的氧化剂,可氧化、、等离子,且已知还原性:。在和混合溶液中,通入一定量,溶液中存在的离子组不合理的是
A.、、 B.、、
C.、、 D.、、、
2.化学与生产、生活息息相关,下列过程不涉及氧化还原反应的是
A.氢氧化钠破坏铝的氧化物保护膜
B.服用维生素C以保证亚铁补血剂的吸收效果
C.高铁酸钠()用于自来水的杀菌、消毒
D.储氢合金与结合形成金属氢化物
3.已知在酸性溶液中易被还原成;、、、、的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A. B.
C. D.
4.和热的KOH溶液发生离子反应:①。而实验室用和盐酸制取发生离子反应:②。下列说法错误的是
A.反应①中既是氧化剂又是还原剂
B.反应②中每生成3 mol转移电子的物质的量为6mol
C.反应②中氧化产物和还原产物质量之比为5:1
D.反应①中氧化性;反应②中氧化性,原因是发生反应时的酸碱性环境不同
5.下列反反应中,水作还原剂的是
A.2H2O+2F2= 4HF+O2
B.3Fe+4H2OFe3O4+4H2
C.2Na+2H2O=2NaOH+H2↑
D.2H2O22H2O+O2↑
6.下列反应中,属于氧化还原反应的是
A.KOH+HCl = KCl+H2O B.SO3+H2O= H2SO4
C.3NO2+H2O= 2HNO3+NO D.SiO2+2NaOH=Na2SiO3+H2O
7.海水晒盐后精制得到;氯碱工业电解饱和溶液得到和;向海水晒盐得到的卤水中通可制溴;从海水中还能提取镁;海洋中许多藻类植物具有富集碘的能力,从海带中可以提取碘。从海水提取食盐后的母液(含等离子)中提取溴,其流程如下。
下列有关说法不正确的是
A.氧化性:
B.“鼓入热空气”得到粗溴,利用了溴易挥发的性质
C.纯碱溶液吸收的离子反应方程式:
D.控制温度在左右“蒸馏”,既有利于获得溴单质,又可防止水蒸气大量逸出
8.下列方程式正确的是
A.用惰性电极电解饱和食盐水:
B.溶液中加入过量NaOH溶液:
C.向溶液中加入足量稀硝酸:
D.光照下甲烷和氯气发生一氯取代:
9.某工业脱硫过程如图所示。下列说法错误的是
A.过程①发生复分解反应
B.过程②中发生反应的离子方程式为S2-+2Fe3+=S↓+2Fe2+
C.过程③中每有标准状况下11.2LO2参加反应,转移2mol电子
D.脱硫过程总反应为2H2S+O2=2H2O+2S
10.NaNO2可做电镀缓蚀剂,其中N元素的化合价为
A.+2 B.+3 C.+4 D.+5
11.能正确表示下列反应的离子方程式为
A.向NaHS溶液中滴加Cu(NO3)2溶液:S2 + Cu2+ = CuS↓
B.Fe(NO3)3溶液与少量HI溶液混合:2Fe3+ + 2I = 2Fe2+ + I2
C.向酸性KMnO4溶液中滴加双氧水:2 + H2O2 + 6H+ = 2Mn2+ + 3O2↑ + 4H2O
D.Mg(HCO3)2溶液与过量NaOH溶液混合:Mg2+ + 2 + 4OH = Mg(OH)2↓ + 2H2O + 2
12.在酸性环境中几种离子之间会发生如下转化:
下列说法中不正确的是
A.离子的还原性从弱到强的顺序是Ce3+<Mn2+<Fe2+<I-
B.反应可能会发生
C.在反应②中Fe2+作为还原剂
D.Fe3+与I-可以共存
13.是一种食品添加剂,在一定条件下能发生反应:,下列叙述中正确的是
A.该反应中被还原
B.是该反应的氧化产物
C.生成需消耗
D.□中的粒子是
14.同时满足四大基本反应类型之一、氧化还原反应、离子反应的变化是
A.NaHCO3粉末加热分解 B.Zn与CuSO4溶液反应
C.铜丝在Cl2中燃烧 D.稀盐酸与NaOH溶液反应
15.现有下列三个氧化还原反应:
①
②
③
若某溶液中含有、和,要除去而不氧化和,可以加入的试剂是
A. B. C. D.
二、填空题
16.黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),
(1)补全并配平该反应的化学方程式,标出电子转移的数目和方向:_______
□P4+□NaOH+□_______= □PH3↑+□NaH2PO2
标出电子转移的数目和方向:_________
方程式配平_______
(2)其中氧化剂和还原剂质量比为_______。
17.I、已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
请回答下列问题:
(1)请将上述反应改写成离子方程式:___________。
(2)上述反应中,被氧化的物质是___________(填化学式,下同),发生还原反应的物质是___________。
(3)用双线桥法标出该反应的电子转移方向和数目:___________。
II、过氧化氢(H2O2,氧显-1价)的水溶液俗称双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。已知过氧化氢可以发生如下反应:
①Ag2O+H2O2=2Ag+O2↑+H2O;
②2H2O22H2O+O2↑;
③3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O。
请回答下列问题:
(4)H2O2仅体现氧化性的反应是___________(填反应序号,下同),H2O2仅体现还原性的反应是___________,H2O2既体现氧化性,又体现还原性的反应是___________
(5)根据上述反应可知,H2O2、Ag2O、K2CrO4的氧化性由弱到强的顺序是___________。
三、计算题
18.ClO2是一 种消毒、 杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2 ↑+2H2O 。试回答下列问题。
(1)该反应中氧化产物的化学式是______________________
(2)若反应共产生了4. 48L气体(标准状况),则反应转移电子的物质的量为__________,消耗还原剂的物质的量为________
(3)标准状况下44. 8mL的ClO2气体恰好能与50mL0. 1mol/L的Na2SO3溶液完全反应生成Na2SO4,氯元素在产物中的化合价为_________,此过程说明 ClO2具有_______(填 “氧化”或“还原”)性。
四、元素或物质推断题
19.形成酸雨的原理之一可简单表示如图:
请回答下列问题:
(1)酸雨的pH___________(填“>”“<”或“=”)5.6;
(2)D物质的化学式为___________;C物质的化学式为___________;
(3)反应b的化学方程式为___________。
(4)写出汽车尾气中CO、NO相互作用生成可参与大气循环的两种气体的化学方程式___________:反应中氧化剂是___________。
五、实验题
20.利用“价类二维图”研究物质的性质,是一种有效的学习方法。如图是铁元素及其化合物的二维图的部分信息。回答下列问题:
(1)X的化学式为_______,图中只具有还原性的物质是_______(写化学式)。
(2)实验室制备时,常伴随着反应②发生,此时的实验现象是_______。
(3)为验证的性质,进行如下实验:
Ⅰ.向固体中加入稀盐酸,固体溶解并产生无色气体,溶液为浅绿色;向浅绿色溶液中加入溶液,无明显现象。
Ⅱ.向Ⅰ中所得溶液中滴入几滴氯水,溶液变色。
Ⅲ.向固体中加入蒸馏水,固体未见明显减少;置于空气中一段时间后,难溶物上方出现红褐色物质。
①Ⅰ中反应的化学方程式是_______。
②Ⅱ中,滴入氯水反应的离子方程式是_______,溶液变为_______色。
③根据Ⅲ中现象,完成下列方程式并配平:_______。
【参考答案】
一、选择题
1.B
【分析】由题意知还原性顺序是:,则氧化性顺序是:Cl2>Br2>Fe3+>I2,根据氧化还原反应规律,氧化性强的先与还原性强的物质反应,则发生反应的先后顺序为:Cl2+2I-=I2 +2Cl-,2Fe2++Cl2═2Fe3++2Cl-,Cl2+2Br-=Br2 +2Cl-。
解析:A.若溶液中存在Fe2+、Br-、Cl-,表明I-被完全氧化,符合反应发生的先后顺序,选项A正确;
B.若溶液中存在Fe2+、Cl-、I-,表明Br-被完全氧化,不符合反应发生的先后顺序,选项B错误;
C.若溶液中存在Fe3+、Br-、Cl-,表明I-、Fe2+被完全氧化,符合反应发生的先后顺序,选项C正确;
D.若溶液中存在Fe2+、Br-、Cl-、I-,表明各种离子均没有被完全氧化,说明Cl2的量很少,符合反应发生的先后顺序,选项D正确;
答案选B。
2.A
解析:A.氢氧化钠破坏铝的氧化物保护膜过程中发生反应,该反应过程中没有元素的化合价发生变化,不是氧化还原反应,故A符合题意;
B.服用维生素C可将Fe3+还原为Fe2+,该过程中发生氧化还原反应,故B不符合题意;
C. 具有强氧化性,可用于杀菌消毒,该过程中被还原成Fe3+,涉及氧化还原反应,故C不符合题意;
D.储氢合金与结合形成金属氢化物的过程中,H元素的化合价发生变化,发生氧化还原反应,故D不符合题意;
故答案选A。
3.A
解析:A.根据信息,I-的还原性强于Fe2+,因此Cl2先氧化I-,A符合题意;
B.还原性Fe2+>Br-,氯气先和Br-反应,过量的氯气再和Fe2+反应,氯气不足时只有亚铁离子被氧化为铁离子,B不符合题意;
C.Co2O3的氧化性强于Cl2,反应中有氯气生成,C不符合题意;
D.Fe3+的氧化性强于I2,因此会与碘离子发生反应生成碘单质,D不符合题意。
故选A。
4.B
解析:A.反应①中所含氯元素化合价,部分从0价升高到中的+5价,部分从0价降低到中的-1价,因此既是氧化剂又是还原剂,A正确;
B.反应②中所含氯元素化合价从+5价降低到中的0价,降低5价,则每生成3 mol转移电子的物质的量为5mol,B错误;
C.反应②每生成3mol共6mol的0价Cl中,有5mol的0价Cl是由化合价升高得到的,作氧化产物,剩下1mol的0价Cl是由所含氯元素化合价降低得到的,作还原产物,则氧化产物和还原产物的质量比为5:1,C正确;
D.同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,反应①中既是氧化剂又是还原剂,是氧化产物,则氧化性:,反应②中是氧化剂,既是氧化产物又是还原产物,则氧化性:,由于发生反应时的酸碱性环境不同导致和的氧化性不同,D正确;
故选B。
5.A
解析:A.反应2H2O+2F2= 4HF+O2中,O元素由-2价升高到0价,则H2O作还原剂,A符合题意;
B.反应3Fe+4H2OFe3O4+4H2中,H元素由+1价降低到0价,则H2O作氧化剂,B不符合题意;
C.反应2Na+2H2O=2NaOH+H2↑中,H元素由+1价部分降低到0价,则H2O作氧化剂,C不符合题意;
D.反应2H2O22H2O+O2↑中,O元素由-1价部分降低到-2价,部分升高到0价,则H2O2既作氧化剂又作还原剂,H2O是还原产物,D不符合题意;
故选A。
6.C
解析:A.KOH+HCl = KCl+H2O反应,没有元素化合价改变,属于非氧化还原反应,故不选A;
B.SO3+H2O= H2SO4反应,没有元素化合价改变,属于非氧化还原反应,故不选B;
C.3NO2+H2O= 2HNO3+NO反应,反应前后N元素化合价改变,属于氧化还原反应,故选C;
D.SiO2+2NaOH=Na2SiO3+H2O反应,没有元素化合价改变,属于非氧化还原反应,故不选D;
选C。
7.C
【分析】由题给流程可知,向母液中通入氯气将溶液中的溴离子氧化为溴,鼓入热空气将溴吹出得到
粗溴;向粗溴中加入碳酸钠溶液,溴与碳酸钠溶液反应得到含有溴离子和溴酸根离子的混合溶液;向混合溶液中加入稀硫酸,酸性条件下溴离子与溴酸根离子反应生成溴,蒸馏收集得到溴单质。
解析:A.向母液中通入氯气将溶液中的溴离子氧化为溴,根据氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:,故A正确;
B.由分析可知,鼓入热空气将溴吹出得到粗溴,则得到粗溴的操作利用了溴易挥发的性质,故B正确;
C.由分析可知,向粗溴中加入碳酸钠溶液,溴与碳酸钠溶液反应得到含有溴离子和溴酸根离子的混合溶液,逆向配平,中Br元素化合价变化5价,Br-中Br元素化合价变化1价,根据得失电子守恒和电荷守恒配平离子方程式为:,故C错误;
D.控制温度在左右“蒸馏”,既有利于获得溴单质,又可防止水蒸气大量逸出,故D正确;
故选C。
8.A
解析:A.电解饱和食盐水,氯化钠和水反应生成氢氧化钠和氢气和氯气,离子方程式为:,A正确;
B.碳酸氢镁溶中加入过量的氢氧化钠溶液生成氢氧化镁沉淀和碳酸钠,B错误;
C.硫代硫酸钠和硝酸反应,硝酸表现氧化性,生成一氧化氮,硫元素被氧化,生成硫酸钠,C错误;
D.甲烷和氯气反应生成一氯甲烷和氯化氢,D错误;
故选A。
9.B
解析:A.过程①中CuCl2和H2S反应生成CuS和HCl,属于复分解反应,故A正确;
B.据图可知过程②中CuS被Fe3+氧化得到S单质,CuS为沉淀不能拆,离子方程式为CuS+2Fe3+= S+2Fe2++Cu2+,故B错误;
C.由图可知,该过程中O2中O元素由0价下降到-2价,标准状况下11.2LO2的物质的量为0.5mol,0.5molO2参加反应,转移0.5mol×4=2mol电子,故C正确;
D.由①H2S+Cu2+=CuS↓+2H+、②CuS+2Fe3+= S+2Fe2++Cu2+、③4Fe2++O2+4H+=4Fe3++2H2O,相加可得回收S的总反应为2H2S+O2=2H2O+2S,故D正确;
故选B。
10.B
解析:元素正负化合价代数和为0,钠呈+1价、氧为-2价,则N为+3价;
选B。
11.D
解析:A.硫氢根离子不能拆成硫离子,A错误;
B.硝酸根离子在酸性条件下能氧化碘离子,不是铁离子氧化碘离子,B错误;
C.该反应中锰原子得到10个电子,而过氧化氢做还原剂,失去2个电子,电子不守恒,C错误;
D.碳酸氢镁和过氧化钠溶液混合生成氢氧化镁和碳酸钠,离子方程式为Mg2+ + 2 + 4OH = Mg(OH)2↓ + 2H2O + 2,D正确;
故选D。
12.D
解析:A.反应①为Ce4++Mn2+=Ce3++Mn3+,反应②为Mn3++Fe2+=Fe3++Mn2+,反应③为2Fe3++2I-=2Fe2++I2,还原剂的还原性强于还原产物的还原性,则还原性:Ce3+<Mn2+<Fe2+<I-,故A正确;
B.还原性:Mn2+<I-,则反应可能会发生,故B正确;
C.反应②为Mn3++Fe2+=Fe3++Mn2+,反应中Fe元素化合价升高,Fe2+作为还原剂,故C正确;
D.由图可知,反应③为2Fe3++2I-=2Fe2++I2,Fe3+与I-不能共存,故D错误;
故选D。
13.C
解析:A.中氮化合价升高,失去电子,则该反应中被氧化,故A错误;
B.是化合价降低得到的产物,则是该反应的还原产物,故B错误;
C.中锰化合价降低5个价态,中氮化合价升高2个价态,根据化合价升降守恒得到系数配2,系数配5,即生成5mol硝酸钠,消耗2mol高锰酸钾,因此生成需消耗,故C正确;
D.根据质量守恒和电荷守恒得到□中的粒子是,故D错误。
综上所述,答案为C。
14.B
解析:A.NaHCO3粉末加热分解,元素化合价不变,属于非氧化还原反应,未在水溶液中进行,不是离子反应,A不符合;
B.Zn与溶液发生反应Zn+=ZnSO4+Cu,属于置换反应;有离子参与反应,属于离子反应;Cu、Zn元素化合价改变,属于氧化还原反应,B符合;
C.铜丝在中燃烧生成氯化铜,不是在溶液中的反应,不属于离子反应,C不符合;
D.稀盐酸与溶液反应生成氯化钠和水,元素化合价不变,属于非氧化还原反应,D不符合;
故选B。
15.B
解析:氧化剂氧化性大于氧化产物,由:
①得氧化性:大于;
②得氧化性:Br2大于;
③得氧化性:Cl2大于Br2;
氧化性强的物质会生成氧化性弱的物质,若某溶液中含有、和,要除去而不氧化和,可以加入的氧化剂为铁离子;
故选B。
二、填空题
16.(1)
(2)1:3
解析:(1)反应中磷元素部分化合价由0变为-3、部分由0变为+1,根据质量守恒可知,还会有水参与反应,结合电子守恒,反应为 ;单线桥表示电子的转移情况,故表示为 ;
(2)反应中磷元素部分化合价由0变为-3发生还原反应为氧化剂、部分由0变为+1发生氧化反应为还原剂,根据电子守恒可知,氧化剂和还原剂质量比为1:3。
17.(1)3Cu+8H++2=3Cu2++2NO↑+4H2O
(2) Cu HNO3
(3)
(4) ③ ① ②
(5)K2CrO4
(2)述反应中,Cu元素化合价升高,被氧化的物质是Cu,N元素化合价升降低,发生还原反应的物质是HNO3;
(3)Cu元素化合价升高失去电子,硝酸中N元素化合价降低得到电子,用双线桥法标出该反应的电子转移方向和数目为;
(4)③反应中Cr元素化合价升高,过氧化氢中氧元素化合价降低,H2O2仅体现氧化性;①反应中银元素化合价降低,过氧化氢中氧元素化合价升高只作还原剂,H2O2仅体现还原性;②反应中过氧化氢中氧元素化合价部分升高部分降低,H2O2既体现氧化性,又体现还原性;
(5)根据①反应可知氧化性H2O2
18. CO2 0.1mol 0.05mol -1 氧化性
解析:(1)2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2 ↑+2H2O中Cl元素的化合价由+5价降低为+4价得到电子被还原,C元素的化合价由+3价升高到+4价,因此氧化产物为:CO2;
(2)若反应共产生了4.48L气体(标准状况),气体的物质的量为:0.2mol,由化学反应方程式可知,生成的气体中ClO2的物质的量与CO2的物质的量相等,因此0.2mol气体中含有0.1molCO2,因此生成0.1mol的二氧化碳转移0.1mol的电子,消耗还原剂H2C2O4的物质的量为0.05mol;
(3)标准状况下44.8mL的ClO2气体的物质的是量为0.002mol,50mL 0.1mol L-1的Na2SO3溶液中Na2SO3的物质的量为:0.005mol,而0.005molNa2SO3生成Na2SO4,硫元素化合价升高2价,失去0.01mol的电子,所以氯元素化合价降低=5价,则反应后的化合价为-1价,二氧化氯在反应中化合价降低,是氧化剂,反应中具有氧化性。
四、元素或物质推断题
19.(1)<
(2) H2SO3 H2SO4
(3)2SO2+O2=2SO3
(4) 2CO+2NO=N2+2CO2 NO
解析:含硫燃料燃烧生成SO2,A为SO2,A和氧气生成SO3,B为SO3,SO3和水生成C硫酸,A和水生成D为H2SO3,H2SO3和O2氧化为C硫酸。
(1)正常雨水因为溶解了空气中的二氧化碳,其pH约为5.6。SO2溶于雨水后与水反应生成硫酸,雨水的酸性增强,pH减小,则酸雨的pH<5.6;
(2)由以上分析可知,D为H2SO3,C为H2SO4;
(3)SO2和氧气生成SO3的化学方程式为2SO2+O2=2SO3;
(4)CO、NO相互作用生成氮气和二氧化碳的化学方程式为2CO+2NO=N2+2CO2,反应中N的化合价降低生成氮气,故氧化剂为NO。
五、实验题
20.(1) Fe2O3 Fe
(2)白色沉淀迅速变为灰绿色,最后变为红褐色
(3) FeCO3+2HCl=FeCl2+H2O+CO2↑ 2Fe2++Cl2=2Fe3++2Cl- 红
解析:(1)由图示可知,X为含正三价铁的氧化物,化学式为Fe2O3,图中只具有还原性的物质是Fe。
(2)实验室制备氢氧化亚铁时,常伴随着反应②的发生,实验现象为白色沉淀迅速变为灰绿色,最后变为红褐色。
(3)①I中是碳酸亚铁与盐酸发生复分解反应,其化学方程式为:FeCO3+2HCl=FeCl2+H2O+CO2↑。
②向氯化亚铁溶液中滴入氯水,氯水与亚铁离子反应生成铁离子,因为溶液中有硫氰酸钾,因此溶液变为红色,其离子方程式为:2Fe2++Cl2=2Fe3++2Cl-。
③出现红褐色为氢氧化铁,是+2价的铁元素被空气中的氧气氧化成+3价的铁元素,氧元素由0价降低到-2价,依据得失电子守恒和原子守恒可知,配平方程式为:。
