1.2反应热的计算同步练习题(含解析)高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.2反应热的计算同步练习题(含解析)高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1023.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-12 07:26:09 | ||
图片预览




文档简介
1.2反应热的计算同步练习题
一、选择题
1.某反应可有效降低汽车尾气污染物的排放,其反应热 kJ mol。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。下列说法正确的是
A.由盖斯定律知: kJ mol
B.三个基元反应中只有③是放热反应
C.与均是总反应的催化剂
D.该过程的总反应为
2.把煤作为燃料可通过下列两种途径。途径Ⅰ: ;
途径Ⅱ: ,
,
。
下列说法正确的是
A.
B.等质量的煤通过以上两种途径燃烧放出的热量:途径Ⅰ<途径Ⅱ
C.和反应生成放出热量为
D.反应的
3.和在一定条件下能发生反应: 已知:(a、b、c均大于零)下列说法正确的是
A.反应物的总能量低于生成物的总能量
B.断开1molH﹣H键和1molI﹣I键所需能量大于断开2molH﹣I键所需能量
C.在该条件下,向密闭容器中加入2mol(g)和2mol(g),充分反应后放出的热量小于2akJ
D.断开1molH﹣I键所需能量为(c+b+a)kJ
4.在、时,已知:
则与和间的关系正确的是
A. B.
C. D.
5.下列关于热化学方程式的叙述正确的是
A.已知,则白磷比红磷稳定
B.将甲醇蒸气转化为氢气的热化学方程式是,则的燃烧热为
C.;,则
D.在、催化下,将和置于密闭容器中充分反应放热,其热化学方程式为
6.已知红磷比白磷稳定。常温常压下,31g红磷或白磷分别与等量的发生反应的能量变化如图所示,下列说法正确的是
A.A物质是红磷和氯气
B.B→C的过程是放热反应,不需要加热
C.C物质一定是PCl3(g)或PCl5(s)中的一种
D.4P(红磷,s)=P4(白磷,s)
7.在生产、生活、科技中,氢能已获得越来越多的关注,是非常重要的能源。已知:
下列推断正确的是
A.H2O(l)吸收能量后,分子中氢氧键断裂而生成H2O(g)
B.2H2(g)+O2(g)=2H2O(g) =-484 kJ
C.若2H2(g)+O2(g)=2H2O(g)+Q1;2H2(g)+O2(l)=2H2O(g)+Q2;则Q1>Q2
D.将2 mol H2O(g)分解成H2(g)和O2(g),吸收4×463 kJ的热量
8.已知:。若生成键、键释放的能量分别为,则断裂键需要吸收的能量为
A. B. C. D.
9.北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷(),悉尼奥运会所用火炬燃料为65%丁烷()和丙烷。
已知:。
丙烷:。
正丁烷:。
异丁烷:。
下列有关说法正确的是
A.常温下,正丁烷的燃烧热为
B.相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气少产生的热量也多
C.常温下,的燃烧热为
D.人类利用的能源都是通过化学反应获得的
10.我国的航空航天事业取得了举世瞩目的成就。碳酰肼类化合物是一种优良的含能材料,可作为火箭推进剂的组分。其相关反应的能量变化如图所示,已知,则为
A. B. C. D.
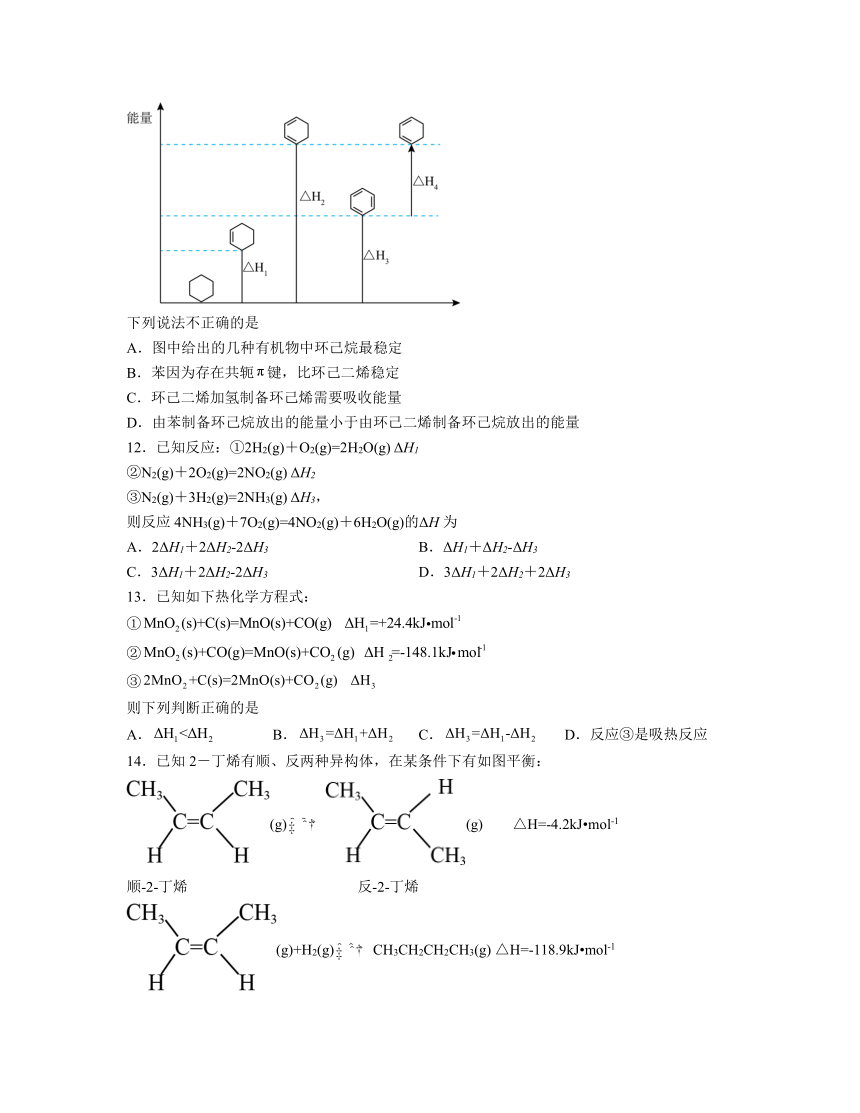
11.相关有机物分别与氢气发生加成反应生成1mol环己烷()的能量变化如图所示:
下列说法不正确的是
A.图中给出的几种有机物中环己烷最稳定
B.苯因为存在共轭键,比环己二烯稳定
C.环己二烯加氢制备环己烯需要吸收能量
D.由苯制备环己烷放出的能量小于由环己二烯制备环己烷放出的能量
12.已知反应:①2H2(g)+O2(g)=2H2O(g) ΔH1
②N2(g)+2O2(g)=2NO2(g) ΔH2
③N2(g)+3H2(g)=2NH3(g) ΔH3,
则反应4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的ΔH为
A.2ΔH1+2ΔH2-2ΔH3 B.ΔH1+ΔH2-ΔH3
C.3ΔH1+2ΔH2-2ΔH3 D.3ΔH1+2ΔH2+2ΔH3
13.已知如下热化学方程式:
①
②
③
则下列判断正确的是
A. B. C. D.反应③是吸热反应
14.已知2-丁烯有顺、反两种异构体,在某条件下有如图平衡:
(g)(g) △H=-4.2kJ mol-1
顺-2-丁烯 反-2-丁烯
(g)+H2(g)CH3CH2CH2CH3(g) △H=-118.9kJ mol-1
下列说法正确的是
A.顺-2-丁烯比反-2-丁烯稳定
B.顺-2-丁烯的燃烧热(△H)比反-2-丁烯的燃烧热(△H)大
C.相同的化学键在不同的物质中键能相同
D.反-2-丁烯氢化的热化学方程式为(g)+H2(g)CH3CH2CH2CH3(g) △H=-114.7kJ mol-1
15.已知:A2(g)+B2(g)2AB(g) △H=-46.6kJ/mol,下列说法正确的是
A.该反应逆反应的活化能Ea一定大于46.6kJ/mol
B.1molA2与1molB2反应生成2molAB(l)时△H>-46.6kJ/mol
C.在密闭容器中,投入1molA2(g)与1molB2(g)进行反应,当反应不再进行时,放出热量为46.6kJ
D.在相同条件下,1molA2(g)与1molB2(g)的能量总和小于2molAB(g)的能量
二、填空题
16.2022年,第24届冬奥会将在中国北京、张家口两地举办。中国绿色碳汇基金会发起“我们的冬奥碳汇林”众筹项目,计划在张家口市崇礼区种植小树。碳汇,是指通过植树造林、森林管理、植被恢复等措施,利用植物光合作用吸收大气中的二氧化碳[],并将其固定在植被和土壤中,从而减少温室气体在大气中浓度的过程、活动或机制。已知利用植物的光合作用每吸收需要吸收的能量约为。请回答下列问题:
(1)碳汇过程中能量的转化形式为_______能转化为_______能;有资料表明,某块林木通过光合作用大约吸收了能量,则吸收的为_______kg。
(2)工业废气中的可用碱液吸收。已知:
① ;
② 。
反应的 H=____kJ mol-1 (用含a、b的代数式表示)。
(3)生产液晶显示器的过程中使用的化学清洗剂和一样,也是一种温室气体,其在大气中能够稳定存在数百年。下表是几种化学键的键能:
化学键
键能(kJ mol-1)
①关于反应,下列说法中不正确的是_______。
A.过程放出能量
B.反应放出能量
C.使用催化剂能减小反应的
②NF3对半导体硅进行蚀刻时,在蚀刻物表面不留任何残留物,试写出蚀刻反应方程式_______。
17.丙烯是一种重要的化工原料,可在催化剂作用下,由丙烷直接脱氢或氧化脱氢制备
反应I(直接脱氢):C3H8(g)=C3H6(g)+H2(g) ΔH1=+125 kJ·mol-1
已知键能:E(C-H)=416kJ/mol E(H-H)=436kJ/mol,由此计算生成1mol碳碳π键放出的能量为_______kJ;
三、计算题
18.依据题中所给信息完成指定问题:
(1)地康法制氯气可按下列催化过程进行:
CuCl2(s)=CuCl(s)+Cl2(g) ΔH1=+83 kJ·mol-1
CuCl(s)+O2(g)=CuO(s)+Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则反应4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=________kJ·mol-1。
(2)用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应测定中和热,实验中测得起始平均温度为20.4℃,反应后最高温度为23.4 ℃,反应后溶液的比热容为4.2 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则中和热ΔH=________;
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下16 g SiH4自燃放出热量750 kJ。SiH4自燃的热化学方程式为___________。
19.甲醇用途广泛,是基础的有机化工原料和优质燃料。由制备甲醇的过程可能涉及如下两个反应。
反应I: ΔH1
反应II: ΔH2
已知有关化学键键能数据如表,由此计算ΔH1_______。
化学键
键能/() 810 343 413 465 436
四、实验题
20.I.反应热的研究对于化学学科发展具有重要意义。
(1)已知反应:①101kPa,2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1
下列结论中正确的是____。
A.碳的燃烧热等于110.5kJ·mol-1
B.稀硫酸与稀NaOH溶液反应的中和热为114.6kJ·mol-1
C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
II.利用如图所示装置测定中和热的实验步骤如图:
①用量筒量取100mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取100mL0.55mol·L-1溶液,并用同一温度计测出其温度;
③将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测混合液最高温度。
(2)仪器a的名称是____;烧杯间填满碎泡沫塑料的作用是____。
(3)配制100mL0.55mol·L-1的氢氧化钠溶液,需要用到的仪器有托盘天平、烧杯、药匙、镊子、玻璃棒、量筒以及____。
(4)实验中改用80mL0.50mol·L-1盐酸跟80mL0.55mol·L-1溶液进行反应,与上述实验相比,所放出的热量____(填“相等”“不相等”)。用Ba(OH)2溶液和硫酸代替上述试剂,所测中和热的数值____。(填“偏大”、“偏小”或“不变”)
(5)倒入NaOH和盐酸溶液的正确操作是____(填字母)。
A.沿玻璃棒缓慢倒入 B.分多次倒入 C.一次迅速倒入
(6)现将一定量稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别与1L1.0mol·L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、ΔH3,则△H1、△H2、△H3的大小关系为____。
【参考答案】
一、选择题
1.D
解析:A.由图可知,,A项错误;
B.由图可知,反应②和③的反应物总能量大于生成物总能量,属于放热反应,B项错误;
C.不是总反应的催化剂 ,C项错误;
D.由图可知,该反应总方程式为,D项正确;
答案选D。
2.A
解析:A.①
②
③
由盖斯定律可知,①+②+③得,则++=,A正确;
B.由盖斯定律可知,等质量的煤通过以上两种途径燃烧放出的热量与途径无关,途径Ⅰ=途径Ⅱ,B错误;
C.由A分析,2①+③得,2+=,则和反应生成放出热量为,C错误;
D.反应放热,焓变为负值,且气态水变为液体水仍要放热,故,D错误;
故选A。
3.C
解析:A.根据题意,氢气与碘单质反应生成碘化氢时,为放热反应,所以反应物的总能量比生成物的总能量高,故A错误;
B.化学反应过程为旧键断裂吸收能量,新键形成放出能量,因为该反应为放热反应,所以断开1molH—H键和1molI—I键所吸收的能量小于形成2molH—I键所放出的能量,而形成2molH—I键所吸收的能量与断裂2molH—I键所放出的能量相等,故B错误;
C.因为该反应为可逆反应,所以向密闭容器中加入2molH2和2molI2,充分反应后生成的碘化氢小于4mol,所以放出的热量小于2akJ,故C正确;
D.设断开1molH—I键所需能量为x kJ,根据反应热=反应物的键能总和-生成物的键能总和=b+c-2x=-a,解得x=(c+b+a)kJ,故D错误;
故选C。
4.D
解析:①;②;③;根据盖斯定律有③=2②+①;所以与和间的关系为;
故答案选D。
5.C
解析:A.,红磷的能量小于白磷,根据能量越低越稳定,白磷稳定性小于红磷,故A错误;
B.1mol燃烧生成气态和液态水,才能表示的燃烧热,故B错误;
C.吸热,等量的和完全燃烧,放热多,由于放热为负,所以,故C正确;
D.由于该反应为可逆反应,题目信息无法确定转化的的量,故其焓变无法确定,故D错误;
选C。
6.D
解析:A.已知红磷比白磷稳定,则等质量的红磷比白磷能量低,A物质是白磷和氯气,A错误;
B. 有的放热反应也需要加热以克服活化能,B→C是放热反应,但红磷在氯气中反应需要先加热, B错误;
C. 磷在氯气中燃烧可以发生的反应为:2P+3Cl22PCl3或2P+5Cl22PCl5,反应更常见的是得到 PCl3或PCl5的混合物,且常温常压下PCl3是液态,C错误;
D.图知所示为31g红磷或白磷分别与等量的生成相同的产物时的能量变化,按盖斯定律,1molP(红磷,s)转化为0.25molP4(白磷,s)时吸收 热量,则可得4P(红磷,s)=P4(白磷,s) ,D正确;
答案选D。
7.C
解析:A.H2O(l)吸收能量后变为H2O(g)是物理变化,分子中氢氧键不断裂,A错误;
B.由题干转化历程图可知,2H2(g)+O2(g)=2H2O(g) =2×436kJ/mol+496kJ/mol-4×463kJ/mol=-484kJ/mol,B错误;
C.由于O2(l)变为O2(g)的过程需要吸收热量,故若2H2(g)+O2(g)=2H2O(g)+Q1;2H2(g)+O2(l)=2H2O(g)+Q2,前者放出的热量大于后者即 Q1>Q2,C正确;
D.由B项分析可知,将2 mol H2O(g)分解成H2(g)和O2(g),吸收484 kJ的热量,D错误;
故答案为:C。
8.C
【分析】根据 ΔH =反应物的键能之和-生成物的键能之和,结合物质结构与能量进行计算。
解析:断裂 1molN H 需要吸收的能量为x kJ,则根据 ΔH =反应物的键能之和-生成物的键能之和可知, 945.6kJ/mol+3×436kJ/mol 2×3×xkJ/mol= 92.4kJ/mol ,解得x=391,即断裂 1molN H 需要吸收的能量为391 kJ;
答案选C。
9.C
【分析】燃烧热指在25℃,100kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
解析:A.由丁烷燃烧热化学方程式可知,常温下正丁烷的燃烧热为2878.0kJ/mol,选项A错误;
B.相同质量的丙烷和正丁烷分别完全燃烧,C3H8(g)消耗氧气的物质的量为×5mol,产生的热量为:×2221.5 kJ,C4H10(g) 消耗氧气的物质的量为×6.5mol,产生的热量为:×2878.0kJ,综合分析可知,前者需要的氧气多,产生的热量也多,选项B错误;
C.常温下,燃烧热为1mol纯物质的反应热,即CO的燃烧热为283.0 kJ/mol,选项C正确;
D.很多能量需要通过化学反应获得,但风能和太阳能、地热能等不需要通过化学反应即能获得,选项D错误;
答案选C。
10.D
解析:由图中能量变化可知:,则,答案选D。
11.C
解析:A.由图可知,物质具有的能量:环己二烯>苯>环己烯>环己烷,物质具有的能量越低越稳定,则图中给出的几种有机物中环己烷最稳定,A正确;
B.物质具有的能量:环己二烯>苯,则苯比环己二烯稳定,其原因是苯存在共轭π键(即大π键),发生反应时需要消耗大量能量,导致苯更稳定,B正确;
C.由图可知,物质具有的能量:环己二烯>环己烯,则己二烯加氢制备环己烯需要放出能量,C错误;
D.由图可知,苯制备环己烷、环己二烯制备环己烷的反应均为放热反应,并且|△H2|>|△H2|,即由苯制备环己烷放出的能量小于由环己二烯制备环己烷放出的能量,D正确;
故答案为:C。
12.C
解析:已知反应:①2H2(g)+O2(g)=2H2O(g) ΔH1
②N2(g)+2O2(g)=2NO2(g) ΔH2
③N2(g)+3H2(g)=2NH3(g) ΔH3,
根据盖斯定律,将①×3+②×2-③×2,整理可得4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的ΔH=3ΔH1+2ΔH2-2ΔH3,故合理选项是C。
13.B
解析:A.①MnO2(s)+C(s)═MnO(s)+CO(g)ΔH1=+24.4kJ mol-1,②MnO(s)+CO(g)═MnO(s)+CO2(g)ΔH2=-148.1kJ mol-1,可知,ΔH1>ΔH2,故A错误;
B.①MnO2(s)+C(s)═MnO(s)+CO(g)ΔH1=+24.4kJ mol-1,②MnO(s)+CO(g)═MnO(s)+CO2(g)ΔH2=-148.1kJ mol-1,盖斯定律计算①+②得到③2MnO2(s)+C(s)═2MnO(s)+CO2(g)ΔH3=ΔH1+ΔH2,故B正确;
C.B的计算分析可知,ΔH3=ΔH1+ΔH2,故C错误;
D.①MnO2(s)+C(s)═MnO(s)+CO(g)ΔH1=+24.4kJ mol-1,②MnO(s)+CO(g)═MnO(s)+CO2(g)ΔH2=-148.1kJ mol-1,盖斯定律计算①+②得到③2MnO2(s)+C(s)═2MnO(s)+CO2(g)ΔH3=ΔH1+ΔH2=(+24.4kJ mol-1)+(-148.1kJ mol-1)=-123.6kJ mol-1,反应③是放热反应,故D错误;
故选:B。
14.D
解析:A.顺 2 丁烯转化为反 2 丁烯放热,说明反 2 丁烯能量低,更稳定,故A错误;
B.等量的顺 2 丁烯具有更高的能量,所以顺 2 丁烯燃烧热更大,但是△H大小相反,故B错误;
C.顺-2-丁烯和反-2-丁烯的能量不一致,说明物质不同,即使同一物质的不同结构,相同的化学键的键能也不同,故C错误;
D.将下式 上式得到反 2 丁烯氢化的热化学方程式,△H= 118.9kJ mol 1 ( 4.2kJ mol 1)= 114.7kJ mol 1,故D正确;
故答案选D。
15.A
解析:A.根据,,所以逆反应的活化能一定大于46.6kJ/mol,A正确;
B.物质从气态变成液态要放出能量,所以1molA2与1molB2反应生成2molAB(l),放出的热量大于46.6kJ,因为为负值,所以,B错误;
C.该反应为可逆反应,1molA2(g)与1molB2(g)不能完全反应,放出的热量小于46.6kJ,C错误;
D.因为该反应为放热反应,所以反应物的总能量大于生成物的总能量,所以1molA2(g)与1molB2(g)的能量总和大于2molAB(g)的能量,D错误;
故选A。
二、填空题
16.(1) 太阳 化学 1760
(2)a 2b
(3) AC 4NF3+3Si=3SiF4+2N2
解析: (1)根据题意,碳汇过程中能量的转化形式为太阳能转化为化学能;某块林木通过光合作用大约吸收了 kJ能量,则吸收的二氧化碳的物质的量为,其质量为;故答案为:太阳;化学;1760。
(2)根据盖斯定律,由得: ;故答案为:a 2b。
(3)①A.为化学键的断裂过程,吸收能量,故A错误;B.反应热反应物的总键能生成物的总键能,则反应的,放出能量,故B正确;C.使用催化剂不能改变反应的,故C错误;综上所述,答案为:AC。
②NF3对半导体硅进行蚀刻时,在蚀刻物表面不留任何残留物,结合所学知识,NF3为气体,因此蚀刻生成物为SiF4和N2,其反应方程式为:4NF3+3Si=3SiF4+2N2;故答案为:4NF3+3Si=3SiF4+2N2。
17.271
解析:反应I中断裂2molC—H键,形成1mol碳碳π键和1molH—H键,故416kJ/mol×2-E(碳碳π键)-436kJ/mol=+125kJ/mol,解得E(碳碳π键)= 271kJ/mol,即生成1mol碳碳π键放出的能量为271kJ。
三、计算题
18. -116 -50.4kJ/mol SiH4(g)+ 2O2(g)= SiO2(s)+ 2H2O(l) ΔH=-1500kJ/mol
解析:(1)已知:① CuCl2(s)=CuCl(s)+Cl2(g) ΔH1=+83 kJ·mol-1
②CuCl(s)+O2(g)=CuO(s)+Cl2(g) ΔH2=-20 kJ·mol-1
③CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
根据盖斯定律,(①+②+③)×2得:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=[(+83 kJ·mol-1)+(-20 kJ·mol-1)+( -121 kJ·mol-1)]×2=-116 kJ·mol-1;
(2) 用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液进行中和反应生成水的物质的量为:0.05L×0.50 mol·L-1 =0.025mol,溶液的质量为:100mL×1g/mL=100g,温度变化值:ΔT=23.4℃-20.4℃=3.0℃,则生成0.025mol水放出的热量为:Q=c·m·ΔT=100g×4.2 J·g-1·℃×3.0℃=1260J=1.260kJ,则生成1mol水时放出的热量为:=50.4kJ,所以实验测得的中和热ΔH=-50.4kJ/mol;
(3) 16 g SiH4的物质的量为:=0.5mol,发生自燃时放出热量750 kJ,则1mol SiH4自燃时放出热量:750 kJ×2=1500kJ,所以SiH4自燃的热化学方程式为:SiH4(g)+ 2O2(g)= SiO2(s)+ 2H2O(l) ΔH=-1500kJ/mol。
19.—49
解析:由反应的反应热的等于反应物的键能之和与生成物键能之和的差值可得反应I的反应热为△H1=(810 kJ/mol×2+436 kJ/mol×3)—(413 kJ/mol×3+343 kJ/mol+465 kJ/mol+465 kJ/mol×2)=—49 kJ/mol,故答案为:—49。
四、实验题
20.(1)C
(2) 环形玻璃搅拌棒 保温、隔热,减少实验过程中的热量损失
(3)100mL容量瓶、胶头滴管
(4) 不相等 偏大
(5)C
(6)△H1=△H2<ΔH3
【分析】酸碱中和反应生成的水越少,放出的热量越少,反之相反;碱稍过量,可保证盐酸完全反应;Ba(OH)2溶液和硫酸反应生成硫酸钡时放热,导致放热增加;
解析:(1)A.燃烧热是1mol可燃物完全燃烧成稳定氧化物所放出的热量,该反应生成CO,没有生成稳定氧化物CO2,因此碳的燃烧热大于110.5 kJ mol-1,故A错误;
B.稀硫酸与稀NaOH溶液反应的中和热为△H=-57.3kJ mol-1,故B错误;
C.含1molNaOH的溶液和盐酸完全反应放出的热量为57.3kJ,20.0gNaOH即0.5molNaOH和盐酸完全反应放出的热量为28.65kJ,故C正确;
故答案为:C;
(2)仪器a的名称是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:环形玻璃搅拌棒;保温、隔热,减少实验过程中的热量损失;
(3)配制100mL 0.55mol/L的氢氧化钠溶液步骤有:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,量筒,故答案为:100mL容量瓶;胶头滴管;
(4)反应放出的热量和所用酸以及碱的量的多少有关,若用80mL 0.50mol/L盐酸跟80mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的物质的量减少,所放出的热量减少;反应过程中NaOH溶液的浓度为0.55mol L-1,不能使用0.50mol L-1NaOH的原因是确保盐酸被完全中和;钡离子和硫酸根离子结合成硫酸钡沉淀时放热,会使会使反应热数值偏大,故答案为:不相等;偏大;
(5)倒入NaOH和盐酸溶液的正确操作是一次迅速倒入,故答案为:C;
(6)只有一水合氨为弱碱,电离吸热,导致中和反应中放出热量减少,强碱与盐酸反应的中和热相同,则△H1、△H2、△H3的大小关系为△H1=△H2<△H3,故答案为:△H1=△H2<△H3;
一、选择题
1.某反应可有效降低汽车尾气污染物的排放,其反应热 kJ mol。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。下列说法正确的是
A.由盖斯定律知: kJ mol
B.三个基元反应中只有③是放热反应
C.与均是总反应的催化剂
D.该过程的总反应为
2.把煤作为燃料可通过下列两种途径。途径Ⅰ: ;
途径Ⅱ: ,
,
。
下列说法正确的是
A.
B.等质量的煤通过以上两种途径燃烧放出的热量:途径Ⅰ<途径Ⅱ
C.和反应生成放出热量为
D.反应的
3.和在一定条件下能发生反应: 已知:(a、b、c均大于零)下列说法正确的是
A.反应物的总能量低于生成物的总能量
B.断开1molH﹣H键和1molI﹣I键所需能量大于断开2molH﹣I键所需能量
C.在该条件下,向密闭容器中加入2mol(g)和2mol(g),充分反应后放出的热量小于2akJ
D.断开1molH﹣I键所需能量为(c+b+a)kJ
4.在、时,已知:
则与和间的关系正确的是
A. B.
C. D.
5.下列关于热化学方程式的叙述正确的是
A.已知,则白磷比红磷稳定
B.将甲醇蒸气转化为氢气的热化学方程式是,则的燃烧热为
C.;,则
D.在、催化下,将和置于密闭容器中充分反应放热,其热化学方程式为
6.已知红磷比白磷稳定。常温常压下,31g红磷或白磷分别与等量的发生反应的能量变化如图所示,下列说法正确的是
A.A物质是红磷和氯气
B.B→C的过程是放热反应,不需要加热
C.C物质一定是PCl3(g)或PCl5(s)中的一种
D.4P(红磷,s)=P4(白磷,s)
7.在生产、生活、科技中,氢能已获得越来越多的关注,是非常重要的能源。已知:
下列推断正确的是
A.H2O(l)吸收能量后,分子中氢氧键断裂而生成H2O(g)
B.2H2(g)+O2(g)=2H2O(g) =-484 kJ
C.若2H2(g)+O2(g)=2H2O(g)+Q1;2H2(g)+O2(l)=2H2O(g)+Q2;则Q1>Q2
D.将2 mol H2O(g)分解成H2(g)和O2(g),吸收4×463 kJ的热量
8.已知:。若生成键、键释放的能量分别为,则断裂键需要吸收的能量为
A. B. C. D.
9.北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷(),悉尼奥运会所用火炬燃料为65%丁烷()和丙烷。
已知:。
丙烷:。
正丁烷:。
异丁烷:。
下列有关说法正确的是
A.常温下,正丁烷的燃烧热为
B.相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气少产生的热量也多
C.常温下,的燃烧热为
D.人类利用的能源都是通过化学反应获得的
10.我国的航空航天事业取得了举世瞩目的成就。碳酰肼类化合物是一种优良的含能材料,可作为火箭推进剂的组分。其相关反应的能量变化如图所示,已知,则为
A. B. C. D.
11.相关有机物分别与氢气发生加成反应生成1mol环己烷()的能量变化如图所示:
下列说法不正确的是
A.图中给出的几种有机物中环己烷最稳定
B.苯因为存在共轭键,比环己二烯稳定
C.环己二烯加氢制备环己烯需要吸收能量
D.由苯制备环己烷放出的能量小于由环己二烯制备环己烷放出的能量
12.已知反应:①2H2(g)+O2(g)=2H2O(g) ΔH1
②N2(g)+2O2(g)=2NO2(g) ΔH2
③N2(g)+3H2(g)=2NH3(g) ΔH3,
则反应4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的ΔH为
A.2ΔH1+2ΔH2-2ΔH3 B.ΔH1+ΔH2-ΔH3
C.3ΔH1+2ΔH2-2ΔH3 D.3ΔH1+2ΔH2+2ΔH3
13.已知如下热化学方程式:
①
②
③
则下列判断正确的是
A. B. C. D.反应③是吸热反应
14.已知2-丁烯有顺、反两种异构体,在某条件下有如图平衡:
(g)(g) △H=-4.2kJ mol-1
顺-2-丁烯 反-2-丁烯
(g)+H2(g)CH3CH2CH2CH3(g) △H=-118.9kJ mol-1
下列说法正确的是
A.顺-2-丁烯比反-2-丁烯稳定
B.顺-2-丁烯的燃烧热(△H)比反-2-丁烯的燃烧热(△H)大
C.相同的化学键在不同的物质中键能相同
D.反-2-丁烯氢化的热化学方程式为(g)+H2(g)CH3CH2CH2CH3(g) △H=-114.7kJ mol-1
15.已知:A2(g)+B2(g)2AB(g) △H=-46.6kJ/mol,下列说法正确的是
A.该反应逆反应的活化能Ea一定大于46.6kJ/mol
B.1molA2与1molB2反应生成2molAB(l)时△H>-46.6kJ/mol
C.在密闭容器中,投入1molA2(g)与1molB2(g)进行反应,当反应不再进行时,放出热量为46.6kJ
D.在相同条件下,1molA2(g)与1molB2(g)的能量总和小于2molAB(g)的能量
二、填空题
16.2022年,第24届冬奥会将在中国北京、张家口两地举办。中国绿色碳汇基金会发起“我们的冬奥碳汇林”众筹项目,计划在张家口市崇礼区种植小树。碳汇,是指通过植树造林、森林管理、植被恢复等措施,利用植物光合作用吸收大气中的二氧化碳[],并将其固定在植被和土壤中,从而减少温室气体在大气中浓度的过程、活动或机制。已知利用植物的光合作用每吸收需要吸收的能量约为。请回答下列问题:
(1)碳汇过程中能量的转化形式为_______能转化为_______能;有资料表明,某块林木通过光合作用大约吸收了能量,则吸收的为_______kg。
(2)工业废气中的可用碱液吸收。已知:
① ;
② 。
反应的 H=____kJ mol-1 (用含a、b的代数式表示)。
(3)生产液晶显示器的过程中使用的化学清洗剂和一样,也是一种温室气体,其在大气中能够稳定存在数百年。下表是几种化学键的键能:
化学键
键能(kJ mol-1)
①关于反应,下列说法中不正确的是_______。
A.过程放出能量
B.反应放出能量
C.使用催化剂能减小反应的
②NF3对半导体硅进行蚀刻时,在蚀刻物表面不留任何残留物,试写出蚀刻反应方程式_______。
17.丙烯是一种重要的化工原料,可在催化剂作用下,由丙烷直接脱氢或氧化脱氢制备
反应I(直接脱氢):C3H8(g)=C3H6(g)+H2(g) ΔH1=+125 kJ·mol-1
已知键能:E(C-H)=416kJ/mol E(H-H)=436kJ/mol,由此计算生成1mol碳碳π键放出的能量为_______kJ;
三、计算题
18.依据题中所给信息完成指定问题:
(1)地康法制氯气可按下列催化过程进行:
CuCl2(s)=CuCl(s)+Cl2(g) ΔH1=+83 kJ·mol-1
CuCl(s)+O2(g)=CuO(s)+Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则反应4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=________kJ·mol-1。
(2)用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应测定中和热,实验中测得起始平均温度为20.4℃,反应后最高温度为23.4 ℃,反应后溶液的比热容为4.2 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则中和热ΔH=________;
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下16 g SiH4自燃放出热量750 kJ。SiH4自燃的热化学方程式为___________。
19.甲醇用途广泛,是基础的有机化工原料和优质燃料。由制备甲醇的过程可能涉及如下两个反应。
反应I: ΔH1
反应II: ΔH2
已知有关化学键键能数据如表,由此计算ΔH1_______。
化学键
键能/() 810 343 413 465 436
四、实验题
20.I.反应热的研究对于化学学科发展具有重要意义。
(1)已知反应:①101kPa,2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1
下列结论中正确的是____。
A.碳的燃烧热等于110.5kJ·mol-1
B.稀硫酸与稀NaOH溶液反应的中和热为114.6kJ·mol-1
C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
II.利用如图所示装置测定中和热的实验步骤如图:
①用量筒量取100mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取100mL0.55mol·L-1溶液,并用同一温度计测出其温度;
③将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测混合液最高温度。
(2)仪器a的名称是____;烧杯间填满碎泡沫塑料的作用是____。
(3)配制100mL0.55mol·L-1的氢氧化钠溶液,需要用到的仪器有托盘天平、烧杯、药匙、镊子、玻璃棒、量筒以及____。
(4)实验中改用80mL0.50mol·L-1盐酸跟80mL0.55mol·L-1溶液进行反应,与上述实验相比,所放出的热量____(填“相等”“不相等”)。用Ba(OH)2溶液和硫酸代替上述试剂,所测中和热的数值____。(填“偏大”、“偏小”或“不变”)
(5)倒入NaOH和盐酸溶液的正确操作是____(填字母)。
A.沿玻璃棒缓慢倒入 B.分多次倒入 C.一次迅速倒入
(6)现将一定量稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别与1L1.0mol·L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、ΔH3,则△H1、△H2、△H3的大小关系为____。
【参考答案】
一、选择题
1.D
解析:A.由图可知,,A项错误;
B.由图可知,反应②和③的反应物总能量大于生成物总能量,属于放热反应,B项错误;
C.不是总反应的催化剂 ,C项错误;
D.由图可知,该反应总方程式为,D项正确;
答案选D。
2.A
解析:A.①
②
③
由盖斯定律可知,①+②+③得,则++=,A正确;
B.由盖斯定律可知,等质量的煤通过以上两种途径燃烧放出的热量与途径无关,途径Ⅰ=途径Ⅱ,B错误;
C.由A分析,2①+③得,2+=,则和反应生成放出热量为,C错误;
D.反应放热,焓变为负值,且气态水变为液体水仍要放热,故,D错误;
故选A。
3.C
解析:A.根据题意,氢气与碘单质反应生成碘化氢时,为放热反应,所以反应物的总能量比生成物的总能量高,故A错误;
B.化学反应过程为旧键断裂吸收能量,新键形成放出能量,因为该反应为放热反应,所以断开1molH—H键和1molI—I键所吸收的能量小于形成2molH—I键所放出的能量,而形成2molH—I键所吸收的能量与断裂2molH—I键所放出的能量相等,故B错误;
C.因为该反应为可逆反应,所以向密闭容器中加入2molH2和2molI2,充分反应后生成的碘化氢小于4mol,所以放出的热量小于2akJ,故C正确;
D.设断开1molH—I键所需能量为x kJ,根据反应热=反应物的键能总和-生成物的键能总和=b+c-2x=-a,解得x=(c+b+a)kJ,故D错误;
故选C。
4.D
解析:①;②;③;根据盖斯定律有③=2②+①;所以与和间的关系为;
故答案选D。
5.C
解析:A.,红磷的能量小于白磷,根据能量越低越稳定,白磷稳定性小于红磷,故A错误;
B.1mol燃烧生成气态和液态水,才能表示的燃烧热,故B错误;
C.吸热,等量的和完全燃烧,放热多,由于放热为负,所以,故C正确;
D.由于该反应为可逆反应,题目信息无法确定转化的的量,故其焓变无法确定,故D错误;
选C。
6.D
解析:A.已知红磷比白磷稳定,则等质量的红磷比白磷能量低,A物质是白磷和氯气,A错误;
B. 有的放热反应也需要加热以克服活化能,B→C是放热反应,但红磷在氯气中反应需要先加热, B错误;
C. 磷在氯气中燃烧可以发生的反应为:2P+3Cl22PCl3或2P+5Cl22PCl5,反应更常见的是得到 PCl3或PCl5的混合物,且常温常压下PCl3是液态,C错误;
D.图知所示为31g红磷或白磷分别与等量的生成相同的产物时的能量变化,按盖斯定律,1molP(红磷,s)转化为0.25molP4(白磷,s)时吸收 热量,则可得4P(红磷,s)=P4(白磷,s) ,D正确;
答案选D。
7.C
解析:A.H2O(l)吸收能量后变为H2O(g)是物理变化,分子中氢氧键不断裂,A错误;
B.由题干转化历程图可知,2H2(g)+O2(g)=2H2O(g) =2×436kJ/mol+496kJ/mol-4×463kJ/mol=-484kJ/mol,B错误;
C.由于O2(l)变为O2(g)的过程需要吸收热量,故若2H2(g)+O2(g)=2H2O(g)+Q1;2H2(g)+O2(l)=2H2O(g)+Q2,前者放出的热量大于后者即 Q1>Q2,C正确;
D.由B项分析可知,将2 mol H2O(g)分解成H2(g)和O2(g),吸收484 kJ的热量,D错误;
故答案为:C。
8.C
【分析】根据 ΔH =反应物的键能之和-生成物的键能之和,结合物质结构与能量进行计算。
解析:断裂 1molN H 需要吸收的能量为x kJ,则根据 ΔH =反应物的键能之和-生成物的键能之和可知, 945.6kJ/mol+3×436kJ/mol 2×3×xkJ/mol= 92.4kJ/mol ,解得x=391,即断裂 1molN H 需要吸收的能量为391 kJ;
答案选C。
9.C
【分析】燃烧热指在25℃,100kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
解析:A.由丁烷燃烧热化学方程式可知,常温下正丁烷的燃烧热为2878.0kJ/mol,选项A错误;
B.相同质量的丙烷和正丁烷分别完全燃烧,C3H8(g)消耗氧气的物质的量为×5mol,产生的热量为:×2221.5 kJ,C4H10(g) 消耗氧气的物质的量为×6.5mol,产生的热量为:×2878.0kJ,综合分析可知,前者需要的氧气多,产生的热量也多,选项B错误;
C.常温下,燃烧热为1mol纯物质的反应热,即CO的燃烧热为283.0 kJ/mol,选项C正确;
D.很多能量需要通过化学反应获得,但风能和太阳能、地热能等不需要通过化学反应即能获得,选项D错误;
答案选C。
10.D
解析:由图中能量变化可知:,则,答案选D。
11.C
解析:A.由图可知,物质具有的能量:环己二烯>苯>环己烯>环己烷,物质具有的能量越低越稳定,则图中给出的几种有机物中环己烷最稳定,A正确;
B.物质具有的能量:环己二烯>苯,则苯比环己二烯稳定,其原因是苯存在共轭π键(即大π键),发生反应时需要消耗大量能量,导致苯更稳定,B正确;
C.由图可知,物质具有的能量:环己二烯>环己烯,则己二烯加氢制备环己烯需要放出能量,C错误;
D.由图可知,苯制备环己烷、环己二烯制备环己烷的反应均为放热反应,并且|△H2|>|△H2|,即由苯制备环己烷放出的能量小于由环己二烯制备环己烷放出的能量,D正确;
故答案为:C。
12.C
解析:已知反应:①2H2(g)+O2(g)=2H2O(g) ΔH1
②N2(g)+2O2(g)=2NO2(g) ΔH2
③N2(g)+3H2(g)=2NH3(g) ΔH3,
根据盖斯定律,将①×3+②×2-③×2,整理可得4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的ΔH=3ΔH1+2ΔH2-2ΔH3,故合理选项是C。
13.B
解析:A.①MnO2(s)+C(s)═MnO(s)+CO(g)ΔH1=+24.4kJ mol-1,②MnO(s)+CO(g)═MnO(s)+CO2(g)ΔH2=-148.1kJ mol-1,可知,ΔH1>ΔH2,故A错误;
B.①MnO2(s)+C(s)═MnO(s)+CO(g)ΔH1=+24.4kJ mol-1,②MnO(s)+CO(g)═MnO(s)+CO2(g)ΔH2=-148.1kJ mol-1,盖斯定律计算①+②得到③2MnO2(s)+C(s)═2MnO(s)+CO2(g)ΔH3=ΔH1+ΔH2,故B正确;
C.B的计算分析可知,ΔH3=ΔH1+ΔH2,故C错误;
D.①MnO2(s)+C(s)═MnO(s)+CO(g)ΔH1=+24.4kJ mol-1,②MnO(s)+CO(g)═MnO(s)+CO2(g)ΔH2=-148.1kJ mol-1,盖斯定律计算①+②得到③2MnO2(s)+C(s)═2MnO(s)+CO2(g)ΔH3=ΔH1+ΔH2=(+24.4kJ mol-1)+(-148.1kJ mol-1)=-123.6kJ mol-1,反应③是放热反应,故D错误;
故选:B。
14.D
解析:A.顺 2 丁烯转化为反 2 丁烯放热,说明反 2 丁烯能量低,更稳定,故A错误;
B.等量的顺 2 丁烯具有更高的能量,所以顺 2 丁烯燃烧热更大,但是△H大小相反,故B错误;
C.顺-2-丁烯和反-2-丁烯的能量不一致,说明物质不同,即使同一物质的不同结构,相同的化学键的键能也不同,故C错误;
D.将下式 上式得到反 2 丁烯氢化的热化学方程式,△H= 118.9kJ mol 1 ( 4.2kJ mol 1)= 114.7kJ mol 1,故D正确;
故答案选D。
15.A
解析:A.根据,,所以逆反应的活化能一定大于46.6kJ/mol,A正确;
B.物质从气态变成液态要放出能量,所以1molA2与1molB2反应生成2molAB(l),放出的热量大于46.6kJ,因为为负值,所以,B错误;
C.该反应为可逆反应,1molA2(g)与1molB2(g)不能完全反应,放出的热量小于46.6kJ,C错误;
D.因为该反应为放热反应,所以反应物的总能量大于生成物的总能量,所以1molA2(g)与1molB2(g)的能量总和大于2molAB(g)的能量,D错误;
故选A。
二、填空题
16.(1) 太阳 化学 1760
(2)a 2b
(3) AC 4NF3+3Si=3SiF4+2N2
解析: (1)根据题意,碳汇过程中能量的转化形式为太阳能转化为化学能;某块林木通过光合作用大约吸收了 kJ能量,则吸收的二氧化碳的物质的量为,其质量为;故答案为:太阳;化学;1760。
(2)根据盖斯定律,由得: ;故答案为:a 2b。
(3)①A.为化学键的断裂过程,吸收能量,故A错误;B.反应热反应物的总键能生成物的总键能,则反应的,放出能量,故B正确;C.使用催化剂不能改变反应的,故C错误;综上所述,答案为:AC。
②NF3对半导体硅进行蚀刻时,在蚀刻物表面不留任何残留物,结合所学知识,NF3为气体,因此蚀刻生成物为SiF4和N2,其反应方程式为:4NF3+3Si=3SiF4+2N2;故答案为:4NF3+3Si=3SiF4+2N2。
17.271
解析:反应I中断裂2molC—H键,形成1mol碳碳π键和1molH—H键,故416kJ/mol×2-E(碳碳π键)-436kJ/mol=+125kJ/mol,解得E(碳碳π键)= 271kJ/mol,即生成1mol碳碳π键放出的能量为271kJ。
三、计算题
18. -116 -50.4kJ/mol SiH4(g)+ 2O2(g)= SiO2(s)+ 2H2O(l) ΔH=-1500kJ/mol
解析:(1)已知:① CuCl2(s)=CuCl(s)+Cl2(g) ΔH1=+83 kJ·mol-1
②CuCl(s)+O2(g)=CuO(s)+Cl2(g) ΔH2=-20 kJ·mol-1
③CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
根据盖斯定律,(①+②+③)×2得:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=[(+83 kJ·mol-1)+(-20 kJ·mol-1)+( -121 kJ·mol-1)]×2=-116 kJ·mol-1;
(2) 用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液进行中和反应生成水的物质的量为:0.05L×0.50 mol·L-1 =0.025mol,溶液的质量为:100mL×1g/mL=100g,温度变化值:ΔT=23.4℃-20.4℃=3.0℃,则生成0.025mol水放出的热量为:Q=c·m·ΔT=100g×4.2 J·g-1·℃×3.0℃=1260J=1.260kJ,则生成1mol水时放出的热量为:=50.4kJ,所以实验测得的中和热ΔH=-50.4kJ/mol;
(3) 16 g SiH4的物质的量为:=0.5mol,发生自燃时放出热量750 kJ,则1mol SiH4自燃时放出热量:750 kJ×2=1500kJ,所以SiH4自燃的热化学方程式为:SiH4(g)+ 2O2(g)= SiO2(s)+ 2H2O(l) ΔH=-1500kJ/mol。
19.—49
解析:由反应的反应热的等于反应物的键能之和与生成物键能之和的差值可得反应I的反应热为△H1=(810 kJ/mol×2+436 kJ/mol×3)—(413 kJ/mol×3+343 kJ/mol+465 kJ/mol+465 kJ/mol×2)=—49 kJ/mol,故答案为:—49。
四、实验题
20.(1)C
(2) 环形玻璃搅拌棒 保温、隔热,减少实验过程中的热量损失
(3)100mL容量瓶、胶头滴管
(4) 不相等 偏大
(5)C
(6)△H1=△H2<ΔH3
【分析】酸碱中和反应生成的水越少,放出的热量越少,反之相反;碱稍过量,可保证盐酸完全反应;Ba(OH)2溶液和硫酸反应生成硫酸钡时放热,导致放热增加;
解析:(1)A.燃烧热是1mol可燃物完全燃烧成稳定氧化物所放出的热量,该反应生成CO,没有生成稳定氧化物CO2,因此碳的燃烧热大于110.5 kJ mol-1,故A错误;
B.稀硫酸与稀NaOH溶液反应的中和热为△H=-57.3kJ mol-1,故B错误;
C.含1molNaOH的溶液和盐酸完全反应放出的热量为57.3kJ,20.0gNaOH即0.5molNaOH和盐酸完全反应放出的热量为28.65kJ,故C正确;
故答案为:C;
(2)仪器a的名称是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:环形玻璃搅拌棒;保温、隔热,减少实验过程中的热量损失;
(3)配制100mL 0.55mol/L的氢氧化钠溶液步骤有:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,量筒,故答案为:100mL容量瓶;胶头滴管;
(4)反应放出的热量和所用酸以及碱的量的多少有关,若用80mL 0.50mol/L盐酸跟80mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的物质的量减少,所放出的热量减少;反应过程中NaOH溶液的浓度为0.55mol L-1,不能使用0.50mol L-1NaOH的原因是确保盐酸被完全中和;钡离子和硫酸根离子结合成硫酸钡沉淀时放热,会使会使反应热数值偏大,故答案为:不相等;偏大;
(5)倒入NaOH和盐酸溶液的正确操作是一次迅速倒入,故答案为:C;
(6)只有一水合氨为弱碱,电离吸热,导致中和反应中放出热量减少,强碱与盐酸反应的中和热相同,则△H1、△H2、△H3的大小关系为△H1=△H2<△H3,故答案为:△H1=△H2<△H3;
