1.1 物质的分类及转化 同步练习题(含解析) 2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1 物质的分类及转化 同步练习题(含解析) 2022-2023学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 290.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-12 09:19:43 | ||
图片预览



文档简介
1.1 物质的分类及转化 同步练习题
一、选择题
1.下表中关于物质分类的正确组合是
选项 酸性氧化物 碱性氧化物 酸 碱 电解质
A Cu
B CO HCl NaOH 大理石
C KOH AgCl
D
A.A B.B C.C D.D
2.随着人们对物质组成和性质研究的深入,物质分类更加多样化。下列有关说法正确的是
A.Na2O2、Al2O3、Fe2O3都是碱性氧化物
B.磁铁矿、盐酸、冰水混合物都是混合物
C.CH3COOH、NH3·H2O、HClO都是弱电解质
D.烧碱、纯碱、熟石灰都是碱
3.下列物质的分类结果正确的是
A.石灰水——碱 B.氢气——化合物
C.纯碱——盐 D.胆矾(CuSO4·H2O)——混合物
4.下列有关物质的分类、胶体特征和性质的说法错误的是
A.、、都是碱
B.硝酸钠、氯化铵、纯碱都是盐
C.胶体区别于溶液和浊液的本质特征是分散质粒子直径在1~100nm之间
D.用激光笔分别照射溶液和胶体时,观察到的现象不同
5.《本草纲目》记载“冬灰,乃冬月灶中所烧薪柴之灰也”,这里的“灰”中含有K2CO3,K2CO3属于
A.酸 B.碱 C.盐 D.氧化物
6.石墨烯纳米颗粒是一种粒子直径介于的材料,将其均匀分散在蒸馏水中,下列有关叙述正确的是
A.将形成一种不稳定的溶液
B.石墨烯和金刚石属于碳的两种同位素
C.可以用过滤的方式将石墨烯颗粒和蒸馏水分离
D.该分散系能使光波发生散射,因此当光束通过时可观察到丁达尔效应
7.下列关于纯净物、混合物、电解质、非电解质的正确组合为
纯净物 混合物 电解质 非电解质
A 液态氯气 铁铜合金 氯化铜 蔗糖
B 矿泉水 FeCl3溶液 NaOH 二氧化硫
C 胆矾 碱石灰 铁 碳酸钙
D 盐酸 冰水混合物 硫酸 干冰
A.A B.B C.C D.D
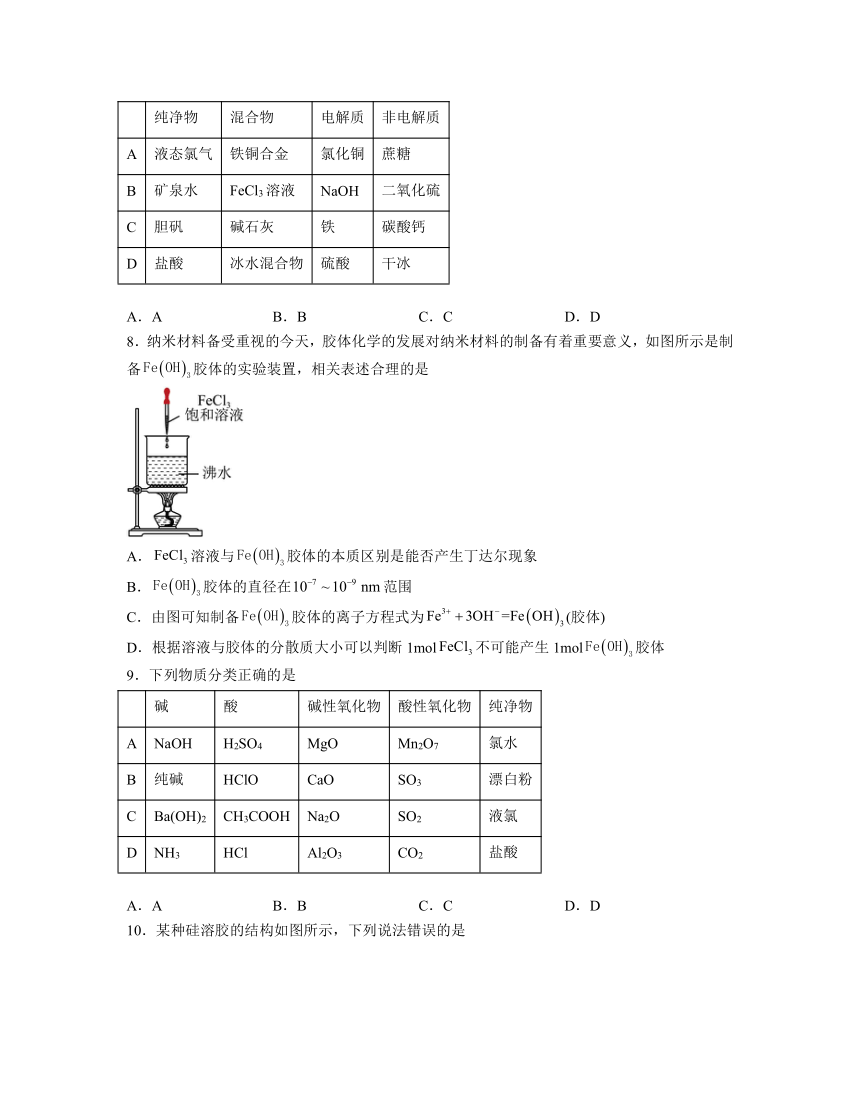
8.纳米材料备受重视的今天,胶体化学的发展对纳米材料的制备有着重要意义,如图所示是制备胶体的实验装置,相关表述合理的是
A.溶液与胶体的本质区别是能否产生丁达尔现象
B.胶体的直径在范围
C.由图可知制备胶体的离子方程式为(胶体)
D.根据溶液与胶体的分散质大小可以判断1mol不可能产生1mol胶体
9.下列物质分类正确的是
碱 酸 碱性氧化物 酸性氧化物 纯净物
A NaOH H2SO4 MgO Mn2O7 氯水
B 纯碱 HClO CaO SO3 漂白粉
C Ba(OH)2 CH3COOH Na2O SO2 液氯
D NH3 HCl Al2O3 CO2 盐酸
A.A B.B C.C D.D
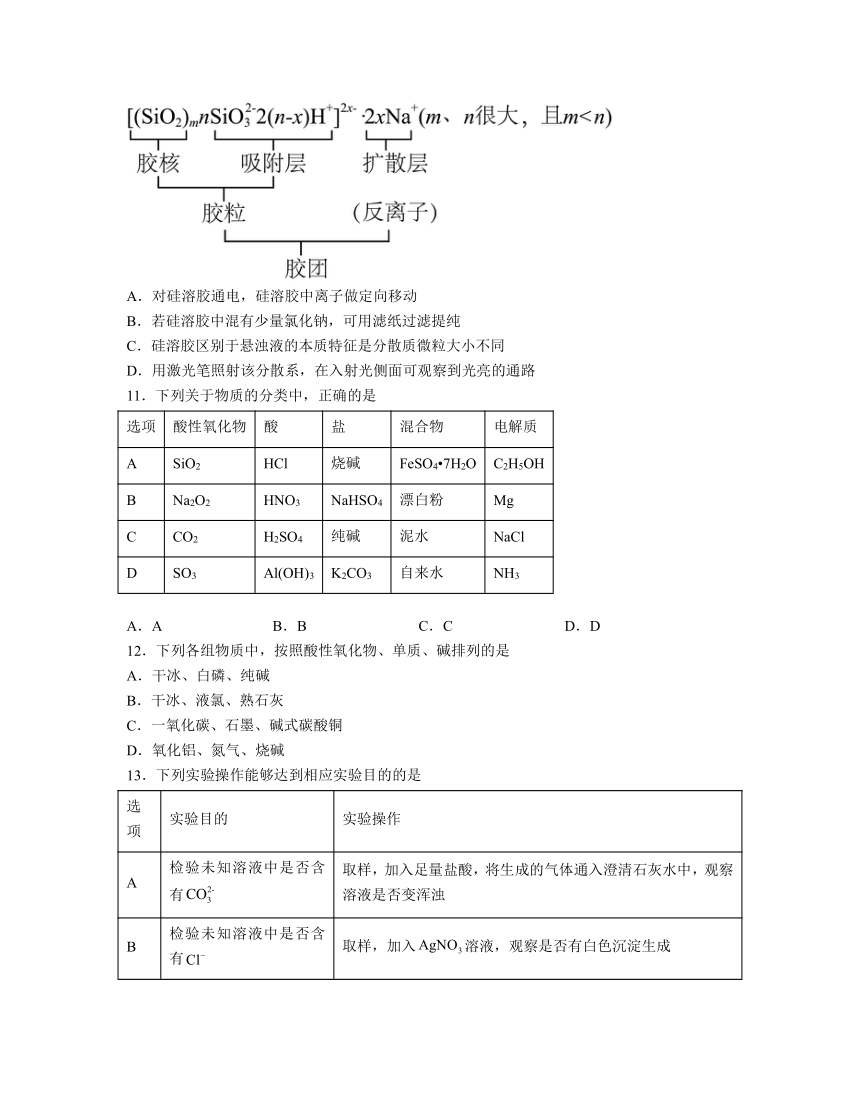
10.某种硅溶胶的结构如图所示,下列说法错误的是
A.对硅溶胶通电,硅溶胶中离子做定向移动
B.若硅溶胶中混有少量氯化钠,可用滤纸过滤提纯
C.硅溶胶区别于悬浊液的本质特征是分散质微粒大小不同
D.用激光笔照射该分散系,在入射光侧面可观察到光亮的通路
11.下列关于物质的分类中,正确的是
选项 酸性氧化物 酸 盐 混合物 电解质
A SiO2 HCl 烧碱 FeSO4 7H2O C2H5OH
B Na2O2 HNO3 NaHSO4 漂白粉 Mg
C CO2 H2SO4 纯碱 泥水 NaCl
D SO3 Al(OH)3 K2CO3 自来水 NH3
A.A B.B C.C D.D
12.下列各组物质中,按照酸性氧化物、单质、碱排列的是
A.干冰、白磷、纯碱
B.干冰、液氯、熟石灰
C.一氧化碳、石墨、碱式碳酸铜
D.氧化铝、氮气、烧碱
13.下列实验操作能够达到相应实验目的的是
选项 实验目的 实验操作
A 检验未知溶液中是否含有 取样,加入足量盐酸,将生成的气体通入澄清石灰水中,观察溶液是否变浑浊
B 检验未知溶液中是否含有 取样,加入溶液,观察是否有白色沉淀生成
C 检验未知溶液中是否含有 取样,加入盐酸酸化的溶液,观察是否有白色沉淀生成
D 鉴别某分散系是否属于胶体 用可见光照射该分散系,从侧面观察是否有光亮的通路
A.A B.B C.C D.D
14.新型冠状病毒可通过咳嗽形成飞沫传播,进入空气中形成的分散系属于气溶胶。下列叙述错误的是
A.该气溶胶可以产生丁达尔现象 B.该气溶胶粒子的直径小于1nm
C.该气溶胶粒子有较大的比表面积 D.勤洗手可以减少新冠病毒的传播
15.下列物质的分类正确的是
酸 碱 盐 酸性氧化物 碱性氧化物
A H2SO4 Na2CO3 CuSO4 SO3 Fe2O3
B HCl NaOH NaCl H2O Na2O
C NaHCO3 Ba(OH)2 Ca(NO3)2 SO2 MgO
D HNO3 KOH Na2CO3 CO2 CaO
A.A B.B C.C D.D
二、填空题
16.同学们自制“盐汽水”,配料如下表所示:
配料 食盐 蔗糖 无水柠檬酸 碳酸氢钠 纯净水
用量 0.3g 10g 1.5g 1.5g 200mL
(1)配料表中属于盐类的物质是碳酸氢钠和___________,配制时产生的气体是___________。
(2)配制过程中用托盘天平称量食盐时,如果指针偏向右边,则可以___________(选填“添加食盐”或“左移游码”)。
(3)如果先将四种固体单独配成溶液,再混合形成“盐汽水”,则取用50mL纯净水___________选填(“能”或“不能”)完全溶解糖(该温度下糖溶解度为204g)。
(4)饮用时感觉整杯饮料的口感一致,说明溶液具有___________性。
17.回答下列问题:
(1)写出下列溶液的颜色
①Na2CO3溶液_______
②CuSO4溶液_______
③FeCl2溶液_______
④I2的CCl4溶液_______
⑤KMnO4溶液_______
⑥FeCl3溶液_______
(2)写出下列物质或离子的化学式
①生石灰_______
②熟石灰_______
③火碱_______
④锰酸钾_______
⑤亚铁离子_______
⑥铝离子_______
⑦硝酸根离子_______
⑧醋酸_______
⑨氢硫酸_______
⑩硫酸铵_______
18.对牙膏的探究要用到许多化学知识。
(1)表中列出了两种牙膏中的摩擦剂,请在表中填写两种摩擦剂所属的物质类别:
X牙膏 Y牙膏
摩擦剂 碳酸钙 二氧化硅
摩擦剂的物质类别(指酸、碱、盐、氧化物) ___ ___
(2)根据你的推测,牙膏摩擦剂在水中的溶解性是___(填“易溶””或“难溶)。
(3)X牙膏中的摩擦剂——碳酸钙可以用石灰石来制备。某学生设计了一种实验室制备碳酸钙的实验方案,其流程如图所示:
ⅰ.请写出上述方案中有关反应的化学方程式:①___;②___;③___。
ⅱ.请结合实验室制备物质的一般原则,对上述制备碳酸钙的方案进行评价。___。
三、元素或物质推断题
19.物质的分类是化学研究的重要方法之一,根据物质的分类回答下列问题。
(1)将碳酸钙、稀盐酸、铁、氧气四种物质名称填写道下面的适当位置。
①_______,②_______,③_______,④_______。
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:___________。
②化合反应:___________。
③置换反应:___________。
④复分解反应:___________。
四、实验题
20.胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室如何制取胶体,请简述操作___________相应的化学方程式是___________,判断胶体制备是否成功,可利用胶体的___________。将制备好的胶体装入如图装置进行实验,接通直流电源一段时间后发现阴极附近的颜色加深,阳极附近的颜色逐渐变浅,上述现象叫做___________
(2)向胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是___________
(3)除去胶体中混有的和的方法是___________
【参考答案】
一、选择题
1.C
解析:A.二氧化硅是酸性氧化物,碳酸钠俗称纯碱,属于盐类,A错误;
B. 一氧化碳不能和碱反应,不属于酸性氧化物,B错误;
C. SO2属于酸性氧化物,Li2O是碱性氧化物,CH3COOH属于酸,KOH属于碱,AgCl熔融状态下能导电,属于电解质,C正确;
D. Mn2O7属于酸性氧化物,D错误;
故选C。
2.C
解析:A.Na2O2属于过氧化物,Al2O3属于两性氧化物,只有Fe2O3属于碱性氧化物,A错误;
B.冰水混合物中仅含有H2O一种微粒,因此属于纯净物,B错误;
C.CH3COOH、NH3·H2O、HClO在水中都只能部分电离,存在电离平衡,主要以电解质分子存在,因此三种物质都是弱电解质,C正确;
D.纯碱是Na2CO3,该物质由金属阳离子和酸根阴离子构成,属于盐,D错误;
故合理选项是C。
3.C
解析:A.石灰水是氢氧化钙的水溶液,属于混合物,Ca(OH)2属于碱,故A错误;
B.氢气属于单质,不属于化合物,故B错误;
C.纯碱为Na2CO3,属于盐,故C正确;
D.胆矾属于纯净物,故D错误;
答案为C。
4.A
解析:A.碱是电离时生成的阴离子全部是的化合物,电离时生成的阴离子有和,不属于碱类,属于盐类,为碱式盐,A项错误;
B.盐是电离出金属阳离子或铵根离子和酸根离子的化合物,硝酸钠、氯化铵、纯碱都属于盐类,B项正确;
C.胶体区别于溶液和浊液的本质特征是分散质粒子的直径在1~100mm之间,溶液的分散质粒子的直径小于1mm,浊液的分散质粒子的直径大于100nm,C项正确;
D.胶体特有的性质为丁达尔效应,用激光笔照射胶体时可看到一条光亮的通路,溶液没有这样的现象,D项正确;
故答案选A。
5.C
解析:K2CO3属于盐,故选C。
6.D
解析:A.根据题意形成了胶体,胶体是一种介稳体系,故A错误;
B.石墨烯和金刚石属于碳的两种单质,互为同素异形体,故B错误;
C.石墨烯纳米颗粒是一种粒子直径介于的材料,能透过滤纸,因此不可以用过滤的方式将石墨烯颗粒和蒸馏水分离,故C错误;
D.该分散系是胶体,胶体能使光波发生散射,因此当光束通过时可观察到丁达尔效应,故D正确。
综上所述,答案为D。
7.A
解析:A.液态氯气属于纯净物,铁铜合金为混合物,氯化铜为盐,属于电解质,蔗糖属于非电解质,故A正确;
B.矿泉水属于混合物,故B错误;
C.铁是金属单质,既不是电解质又不是非电解质,碳酸钙属于电解质,故C错误;
D.盐酸是氯化氢的水溶液,属于混合物,冰水混合物中只含水分子,属于纯净物,故D错误;
故选A。
8.D
解析:A. 溶液与胶体的本质区别是分散质粒子的直径是否在1nm~100nm范围内,故A错误;
B. 胶体粒子的直径在范围,故B错误;
C. 饱和氯化铁溶液第如沸水中加热到红褐色得到氢氧化铁胶体,反应的离子方程式:Fe3++3H2O Fe(OH)3(胶体)+3H+,故C错误;
D. 根据溶液与胶体的分散质大小可以判断1mol不可能产生1mol胶体,胶体的分散质粒子是含有许多分子或离子的粒子集体,故D正确;
故选D。
9.C
解析:A.氯水是氯气的水溶液,属于混合物,故A错误;
B.纯碱是碳酸钠,属于盐;漂白粉是氯化钙和次氯酸钙的混合物,故B错误;
C.Ba(OH)2电离出的阴离子全是氢氧根离子,属于碱;CH3COOH电离出的阳离子全是氢离子,属于酸;Na2O与盐酸反应生成氯化钠和水,Na2O属于碱性氧化物;SO2能与氢氧化钠反应生成亚硫酸钠和水,SO2属于酸性氧化物;液氯中只含Cl2分子,属于纯净物,故C正确;
D.NH3不能电离,NH3是碱性气体不是碱;Al2O3两性氧化物;盐酸是氯化氢的水溶液,属于混合物,故D错误;
选C。
10.B
解析:A.物质导电是因为带电粒子的定向移动,对硅溶胶通电,硅溶胶中离子做定向移动,故A正确;
B.胶体、溶液都能通过滤纸,若硅溶胶中混有少量氯化钠,不能用滤纸过滤提纯,应该用渗析的方法提纯,故B错误;
C.胶体粒子直径在1~100nm之间,悬浊液中粒子直径>100nm,硅溶胶区别于悬浊液的本质特征是分散质微粒大小不同,故C正确;
D.胶体能产生丁达尔效应,用激光笔照射该分散系,在入射光侧面可观察到光亮的通路,故D正确;
选B。
11.C
解析:A.烧碱不是盐,是碱;C2H5OH是非电解质,A错误;
B.Na2O2是过氧化物,不是酸性氧化物;Mg既不是电解质,也不是非电解质,B错误;
C.各项物质都符合,C正确;
D.Al(OH)3是两性氢氧化物,不是酸;NH3是非电解质,D错误;
故选C。
12.B
解析:A.干冰属于酸性氧化物、白磷属于单质、纯碱是碳酸钠属于盐,故A错误;
B.干冰属于酸性氧化物、液氯属于单质、熟石灰是氢氧化钙属于碱,故B正确;
C.一氧化碳不属于酸性氧化物、石墨属于单质、碱式碳酸铜属于碱式盐,故C错误;
D.氧化铝属于两性氧化物、氮气属于单质、烧碱是氢氧化钠属于碱,故D错误;
故选B。
13.D
解析:A.若溶液中含有,也有相同的现象,选项A错误;
B.如果存在,会与Ag+反应生成碳酸银沉淀,干扰检验,选项B错误;
C.如果溶液中含有Ag+,也会产生白色沉淀,选项C错误;
D.有光亮的通路的为胶体,这是丁达尔效应,选项D正确;
答案选D。
14.B
【分析】气溶胶属于胶体的一种,结合胶体的性质分析解答。
解析:A.气溶胶属于胶体,所以可以发生丁达尔效应,A正确;
B.该气溶胶粒子的直径介于1nm-100nm之间,B错误;
C.该气溶胶粒子有较大的比表面积,具有一定的吸附性,C正确;
D.勤洗手可以有效减少新冠病毒的传播途径,D正确;
故选B。
15.D
解析:A.Na2CO3属于盐,不属于碱,故A错误;
B.H2O不属于酸性氧化物,故B错误;
C.NaHCO3属于盐,不属于酸,故C错误;
D.所给物质分类正确,故D正确;
答案为D。
二、填空题
16.(1)食盐 二氧化碳
(2)添加食盐
(3)能
(4)均一稳定
解析:(1)有阴阳离子构成的化合物为盐,故碳酸氢钠和食盐氯化钠都为盐。碳酸氢钠和无水柠檬酸反应生成柠檬酸钠、二氧化碳和水。
(2)用托盘天平称量食盐时,如果指针偏向右边,说明右边的砝码较左边的物体重一些,且称量一定质量的固体,游码不能移动,故应该添加食盐。
(3)糖的溶解度为204g,即100g水中最多溶解204g糖,所以50ml(即50g)水中最多溶解102g糖,故答案为:能。
(4)溶液具有均一稳定性。
17.(1) 无色 蓝色 浅绿色 紫红色 紫红色 棕黄色
(2) CaO Ca(OH)2 NaOH K2MnO4 Fe2+ Al3+ NO CH3COOH H2S (NH4)2SO4
解析:(1)
①Na2CO3溶液为无色;
②CuSO4溶液为蓝色;
③FeCl2溶液为浅绿色;
④I2的CCl4溶液为紫红色;
⑤KMnO4溶液为紫红色;
⑥FeCl3溶液为棕黄色;
(2)
①生石灰的化学式为CaO;
②熟石灰的化学式为Ca(OH)2;
③火碱的化学式为NaOH;
④锰酸钾的化学式为K2MnO4;
⑤亚铁离子的化学式为Fe2+;
⑥铝离子的化学式为Al3+;
⑦硝酸根离子的化学式为NO;
⑧醋酸的化学式为CH3COOH;
⑨氢硫酸的化学式为H2S;
⑩硫酸铵的化学式为(NH4)2SO4。
18.(1) 盐 氧化物
(2)难溶
(3) CaCO3CaO+CO2↑ CaO+H2O=Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 消耗能源多,步骤复杂,反应条件要求高
解析:(1)碳酸钙由金属离子和酸根离子构成,属于盐;二氧化硅由氧和硅两种元素组成,属于氧化物;故答案为:盐;氧化物;
(2)根据推测,牙膏摩擦剂要有坚硬、难溶的性质,在水中的溶解性是难溶。故答案为:难溶;
(3)ⅰ.①碳酸钙高温分解生成氧化钙和二氧化碳,CaCO3CaO+CO2↑;②生石灰和水反应生成氢氧化钙,CaO+H2O=Ca(OH)2;③氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。故答案为:CaCO3CaO+CO2↑;CaO+H2O=Ca(OH)2;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
ⅱ.上述制备碳酸钙的方案,消耗的能源多,产生的温室气体较多,且步骤复杂,需要加热设备。
三、元素或物质推断题
19.(1) 碳酸钙 铁 氧气 稀盐酸
(2) CaCO3 CaO+CO2↑ 3Fe+2O2Fe3O4 Fe+2HCl=FeCl2+H2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑
解析:(1)(1)在题目已知的物质中,碳酸钙仅有一种微粒构成,是纯净物,由于由Ca、C、O三种元素组成,因此碳酸钙属于化合物;
Fe、O2仅有一种元素组成,属于单质,其中铁为金属单质,氧气是非金属单质;稀盐酸是HCl的水溶液,属于混合物,所以①是碳酸钙,②是铁,③是氧气,④是稀盐酸。
(2)①CaCO3在高温下分解产生CaO和CO2,反应方程式为:CaCO3 CaO+CO2↑,反应的基本类型是分解反应;
②Fe与O2在点燃时反应产生Fe3O4,反应方程式为:3Fe+2O2Fe3O4,反应的基本类型是化合反应;
③Fe与稀盐酸反应产生FeCl2和H2,反应方程式为:Fe+2HCl=FeCl2+H2↑,反应的基本类型为置换反应;
④CaCO3与HCl在溶液中发生反应产生CaCl2、H2O、CO2,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,反应类型是复分解反应。
四、实验题
20.(1) 烧杯中盛放25mL蒸馏水,用酒精灯加热煮沸,向沸水中加入5~6滴氯化铁饱和溶液,继续加热至出现红褐色,停止加热 FeCl3+3H2OFe(OH)3(胶体)+3HCl 丁达尔效应 电泳现象
(2)胶体中加入了电解质溶液,胶体出现聚沉
(3)渗析
解析: (1)实验室制取胶体的方法是烧杯中盛放25mL蒸馏水,用酒精灯加热煮沸,向沸水中加入5~6滴氯化铁饱和溶液,继续加热至出现红褐色,停止加热,相应的化学方程式是FeCl3+3H2OFe(OH)3(胶体)+3HCl,用激光笔照射胶体有一条光亮的通路,可以判断胶体制备是否成功,因此利用胶体的丁达尔效应,将制备好的胶体装入如图装置进行实验,接通直流电源一段时间后发现阴极附近的颜色加深,阳极附近的颜色逐渐变浅,上述现象叫做电泳现象;故答案为:烧杯中盛放25mL蒸馏水,用酒精灯加热煮沸,向沸水中加入5~6滴氯化铁饱和溶液,继续加热至出现红褐色,停止加热;FeCl3+3H2OFe(OH)3(胶体)+3HCl;丁达尔效应;电泳现象。
(2)向胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是胶体中加入了电解质溶液,胶体出现聚沉;故答案为:胶体中加入了电解质溶液,胶体出现聚沉。
(3)氯化铁、HCl都能透过半透膜,而氢氧化铁胶体不能透过半透膜,因此除去胶体中混有的和的方法是渗析;故答案为:渗析
一、选择题
1.下表中关于物质分类的正确组合是
选项 酸性氧化物 碱性氧化物 酸 碱 电解质
A Cu
B CO HCl NaOH 大理石
C KOH AgCl
D
A.A B.B C.C D.D
2.随着人们对物质组成和性质研究的深入,物质分类更加多样化。下列有关说法正确的是
A.Na2O2、Al2O3、Fe2O3都是碱性氧化物
B.磁铁矿、盐酸、冰水混合物都是混合物
C.CH3COOH、NH3·H2O、HClO都是弱电解质
D.烧碱、纯碱、熟石灰都是碱
3.下列物质的分类结果正确的是
A.石灰水——碱 B.氢气——化合物
C.纯碱——盐 D.胆矾(CuSO4·H2O)——混合物
4.下列有关物质的分类、胶体特征和性质的说法错误的是
A.、、都是碱
B.硝酸钠、氯化铵、纯碱都是盐
C.胶体区别于溶液和浊液的本质特征是分散质粒子直径在1~100nm之间
D.用激光笔分别照射溶液和胶体时,观察到的现象不同
5.《本草纲目》记载“冬灰,乃冬月灶中所烧薪柴之灰也”,这里的“灰”中含有K2CO3,K2CO3属于
A.酸 B.碱 C.盐 D.氧化物
6.石墨烯纳米颗粒是一种粒子直径介于的材料,将其均匀分散在蒸馏水中,下列有关叙述正确的是
A.将形成一种不稳定的溶液
B.石墨烯和金刚石属于碳的两种同位素
C.可以用过滤的方式将石墨烯颗粒和蒸馏水分离
D.该分散系能使光波发生散射,因此当光束通过时可观察到丁达尔效应
7.下列关于纯净物、混合物、电解质、非电解质的正确组合为
纯净物 混合物 电解质 非电解质
A 液态氯气 铁铜合金 氯化铜 蔗糖
B 矿泉水 FeCl3溶液 NaOH 二氧化硫
C 胆矾 碱石灰 铁 碳酸钙
D 盐酸 冰水混合物 硫酸 干冰
A.A B.B C.C D.D
8.纳米材料备受重视的今天,胶体化学的发展对纳米材料的制备有着重要意义,如图所示是制备胶体的实验装置,相关表述合理的是
A.溶液与胶体的本质区别是能否产生丁达尔现象
B.胶体的直径在范围
C.由图可知制备胶体的离子方程式为(胶体)
D.根据溶液与胶体的分散质大小可以判断1mol不可能产生1mol胶体
9.下列物质分类正确的是
碱 酸 碱性氧化物 酸性氧化物 纯净物
A NaOH H2SO4 MgO Mn2O7 氯水
B 纯碱 HClO CaO SO3 漂白粉
C Ba(OH)2 CH3COOH Na2O SO2 液氯
D NH3 HCl Al2O3 CO2 盐酸
A.A B.B C.C D.D
10.某种硅溶胶的结构如图所示,下列说法错误的是
A.对硅溶胶通电,硅溶胶中离子做定向移动
B.若硅溶胶中混有少量氯化钠,可用滤纸过滤提纯
C.硅溶胶区别于悬浊液的本质特征是分散质微粒大小不同
D.用激光笔照射该分散系,在入射光侧面可观察到光亮的通路
11.下列关于物质的分类中,正确的是
选项 酸性氧化物 酸 盐 混合物 电解质
A SiO2 HCl 烧碱 FeSO4 7H2O C2H5OH
B Na2O2 HNO3 NaHSO4 漂白粉 Mg
C CO2 H2SO4 纯碱 泥水 NaCl
D SO3 Al(OH)3 K2CO3 自来水 NH3
A.A B.B C.C D.D
12.下列各组物质中,按照酸性氧化物、单质、碱排列的是
A.干冰、白磷、纯碱
B.干冰、液氯、熟石灰
C.一氧化碳、石墨、碱式碳酸铜
D.氧化铝、氮气、烧碱
13.下列实验操作能够达到相应实验目的的是
选项 实验目的 实验操作
A 检验未知溶液中是否含有 取样,加入足量盐酸,将生成的气体通入澄清石灰水中,观察溶液是否变浑浊
B 检验未知溶液中是否含有 取样,加入溶液,观察是否有白色沉淀生成
C 检验未知溶液中是否含有 取样,加入盐酸酸化的溶液,观察是否有白色沉淀生成
D 鉴别某分散系是否属于胶体 用可见光照射该分散系,从侧面观察是否有光亮的通路
A.A B.B C.C D.D
14.新型冠状病毒可通过咳嗽形成飞沫传播,进入空气中形成的分散系属于气溶胶。下列叙述错误的是
A.该气溶胶可以产生丁达尔现象 B.该气溶胶粒子的直径小于1nm
C.该气溶胶粒子有较大的比表面积 D.勤洗手可以减少新冠病毒的传播
15.下列物质的分类正确的是
酸 碱 盐 酸性氧化物 碱性氧化物
A H2SO4 Na2CO3 CuSO4 SO3 Fe2O3
B HCl NaOH NaCl H2O Na2O
C NaHCO3 Ba(OH)2 Ca(NO3)2 SO2 MgO
D HNO3 KOH Na2CO3 CO2 CaO
A.A B.B C.C D.D
二、填空题
16.同学们自制“盐汽水”,配料如下表所示:
配料 食盐 蔗糖 无水柠檬酸 碳酸氢钠 纯净水
用量 0.3g 10g 1.5g 1.5g 200mL
(1)配料表中属于盐类的物质是碳酸氢钠和___________,配制时产生的气体是___________。
(2)配制过程中用托盘天平称量食盐时,如果指针偏向右边,则可以___________(选填“添加食盐”或“左移游码”)。
(3)如果先将四种固体单独配成溶液,再混合形成“盐汽水”,则取用50mL纯净水___________选填(“能”或“不能”)完全溶解糖(该温度下糖溶解度为204g)。
(4)饮用时感觉整杯饮料的口感一致,说明溶液具有___________性。
17.回答下列问题:
(1)写出下列溶液的颜色
①Na2CO3溶液_______
②CuSO4溶液_______
③FeCl2溶液_______
④I2的CCl4溶液_______
⑤KMnO4溶液_______
⑥FeCl3溶液_______
(2)写出下列物质或离子的化学式
①生石灰_______
②熟石灰_______
③火碱_______
④锰酸钾_______
⑤亚铁离子_______
⑥铝离子_______
⑦硝酸根离子_______
⑧醋酸_______
⑨氢硫酸_______
⑩硫酸铵_______
18.对牙膏的探究要用到许多化学知识。
(1)表中列出了两种牙膏中的摩擦剂,请在表中填写两种摩擦剂所属的物质类别:
X牙膏 Y牙膏
摩擦剂 碳酸钙 二氧化硅
摩擦剂的物质类别(指酸、碱、盐、氧化物) ___ ___
(2)根据你的推测,牙膏摩擦剂在水中的溶解性是___(填“易溶””或“难溶)。
(3)X牙膏中的摩擦剂——碳酸钙可以用石灰石来制备。某学生设计了一种实验室制备碳酸钙的实验方案,其流程如图所示:
ⅰ.请写出上述方案中有关反应的化学方程式:①___;②___;③___。
ⅱ.请结合实验室制备物质的一般原则,对上述制备碳酸钙的方案进行评价。___。
三、元素或物质推断题
19.物质的分类是化学研究的重要方法之一,根据物质的分类回答下列问题。
(1)将碳酸钙、稀盐酸、铁、氧气四种物质名称填写道下面的适当位置。
①_______,②_______,③_______,④_______。
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:___________。
②化合反应:___________。
③置换反应:___________。
④复分解反应:___________。
四、实验题
20.胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室如何制取胶体,请简述操作___________相应的化学方程式是___________,判断胶体制备是否成功,可利用胶体的___________。将制备好的胶体装入如图装置进行实验,接通直流电源一段时间后发现阴极附近的颜色加深,阳极附近的颜色逐渐变浅,上述现象叫做___________
(2)向胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是___________
(3)除去胶体中混有的和的方法是___________
【参考答案】
一、选择题
1.C
解析:A.二氧化硅是酸性氧化物,碳酸钠俗称纯碱,属于盐类,A错误;
B. 一氧化碳不能和碱反应,不属于酸性氧化物,B错误;
C. SO2属于酸性氧化物,Li2O是碱性氧化物,CH3COOH属于酸,KOH属于碱,AgCl熔融状态下能导电,属于电解质,C正确;
D. Mn2O7属于酸性氧化物,D错误;
故选C。
2.C
解析:A.Na2O2属于过氧化物,Al2O3属于两性氧化物,只有Fe2O3属于碱性氧化物,A错误;
B.冰水混合物中仅含有H2O一种微粒,因此属于纯净物,B错误;
C.CH3COOH、NH3·H2O、HClO在水中都只能部分电离,存在电离平衡,主要以电解质分子存在,因此三种物质都是弱电解质,C正确;
D.纯碱是Na2CO3,该物质由金属阳离子和酸根阴离子构成,属于盐,D错误;
故合理选项是C。
3.C
解析:A.石灰水是氢氧化钙的水溶液,属于混合物,Ca(OH)2属于碱,故A错误;
B.氢气属于单质,不属于化合物,故B错误;
C.纯碱为Na2CO3,属于盐,故C正确;
D.胆矾属于纯净物,故D错误;
答案为C。
4.A
解析:A.碱是电离时生成的阴离子全部是的化合物,电离时生成的阴离子有和,不属于碱类,属于盐类,为碱式盐,A项错误;
B.盐是电离出金属阳离子或铵根离子和酸根离子的化合物,硝酸钠、氯化铵、纯碱都属于盐类,B项正确;
C.胶体区别于溶液和浊液的本质特征是分散质粒子的直径在1~100mm之间,溶液的分散质粒子的直径小于1mm,浊液的分散质粒子的直径大于100nm,C项正确;
D.胶体特有的性质为丁达尔效应,用激光笔照射胶体时可看到一条光亮的通路,溶液没有这样的现象,D项正确;
故答案选A。
5.C
解析:K2CO3属于盐,故选C。
6.D
解析:A.根据题意形成了胶体,胶体是一种介稳体系,故A错误;
B.石墨烯和金刚石属于碳的两种单质,互为同素异形体,故B错误;
C.石墨烯纳米颗粒是一种粒子直径介于的材料,能透过滤纸,因此不可以用过滤的方式将石墨烯颗粒和蒸馏水分离,故C错误;
D.该分散系是胶体,胶体能使光波发生散射,因此当光束通过时可观察到丁达尔效应,故D正确。
综上所述,答案为D。
7.A
解析:A.液态氯气属于纯净物,铁铜合金为混合物,氯化铜为盐,属于电解质,蔗糖属于非电解质,故A正确;
B.矿泉水属于混合物,故B错误;
C.铁是金属单质,既不是电解质又不是非电解质,碳酸钙属于电解质,故C错误;
D.盐酸是氯化氢的水溶液,属于混合物,冰水混合物中只含水分子,属于纯净物,故D错误;
故选A。
8.D
解析:A. 溶液与胶体的本质区别是分散质粒子的直径是否在1nm~100nm范围内,故A错误;
B. 胶体粒子的直径在范围,故B错误;
C. 饱和氯化铁溶液第如沸水中加热到红褐色得到氢氧化铁胶体,反应的离子方程式:Fe3++3H2O Fe(OH)3(胶体)+3H+,故C错误;
D. 根据溶液与胶体的分散质大小可以判断1mol不可能产生1mol胶体,胶体的分散质粒子是含有许多分子或离子的粒子集体,故D正确;
故选D。
9.C
解析:A.氯水是氯气的水溶液,属于混合物,故A错误;
B.纯碱是碳酸钠,属于盐;漂白粉是氯化钙和次氯酸钙的混合物,故B错误;
C.Ba(OH)2电离出的阴离子全是氢氧根离子,属于碱;CH3COOH电离出的阳离子全是氢离子,属于酸;Na2O与盐酸反应生成氯化钠和水,Na2O属于碱性氧化物;SO2能与氢氧化钠反应生成亚硫酸钠和水,SO2属于酸性氧化物;液氯中只含Cl2分子,属于纯净物,故C正确;
D.NH3不能电离,NH3是碱性气体不是碱;Al2O3两性氧化物;盐酸是氯化氢的水溶液,属于混合物,故D错误;
选C。
10.B
解析:A.物质导电是因为带电粒子的定向移动,对硅溶胶通电,硅溶胶中离子做定向移动,故A正确;
B.胶体、溶液都能通过滤纸,若硅溶胶中混有少量氯化钠,不能用滤纸过滤提纯,应该用渗析的方法提纯,故B错误;
C.胶体粒子直径在1~100nm之间,悬浊液中粒子直径>100nm,硅溶胶区别于悬浊液的本质特征是分散质微粒大小不同,故C正确;
D.胶体能产生丁达尔效应,用激光笔照射该分散系,在入射光侧面可观察到光亮的通路,故D正确;
选B。
11.C
解析:A.烧碱不是盐,是碱;C2H5OH是非电解质,A错误;
B.Na2O2是过氧化物,不是酸性氧化物;Mg既不是电解质,也不是非电解质,B错误;
C.各项物质都符合,C正确;
D.Al(OH)3是两性氢氧化物,不是酸;NH3是非电解质,D错误;
故选C。
12.B
解析:A.干冰属于酸性氧化物、白磷属于单质、纯碱是碳酸钠属于盐,故A错误;
B.干冰属于酸性氧化物、液氯属于单质、熟石灰是氢氧化钙属于碱,故B正确;
C.一氧化碳不属于酸性氧化物、石墨属于单质、碱式碳酸铜属于碱式盐,故C错误;
D.氧化铝属于两性氧化物、氮气属于单质、烧碱是氢氧化钠属于碱,故D错误;
故选B。
13.D
解析:A.若溶液中含有,也有相同的现象,选项A错误;
B.如果存在,会与Ag+反应生成碳酸银沉淀,干扰检验,选项B错误;
C.如果溶液中含有Ag+,也会产生白色沉淀,选项C错误;
D.有光亮的通路的为胶体,这是丁达尔效应,选项D正确;
答案选D。
14.B
【分析】气溶胶属于胶体的一种,结合胶体的性质分析解答。
解析:A.气溶胶属于胶体,所以可以发生丁达尔效应,A正确;
B.该气溶胶粒子的直径介于1nm-100nm之间,B错误;
C.该气溶胶粒子有较大的比表面积,具有一定的吸附性,C正确;
D.勤洗手可以有效减少新冠病毒的传播途径,D正确;
故选B。
15.D
解析:A.Na2CO3属于盐,不属于碱,故A错误;
B.H2O不属于酸性氧化物,故B错误;
C.NaHCO3属于盐,不属于酸,故C错误;
D.所给物质分类正确,故D正确;
答案为D。
二、填空题
16.(1)食盐 二氧化碳
(2)添加食盐
(3)能
(4)均一稳定
解析:(1)有阴阳离子构成的化合物为盐,故碳酸氢钠和食盐氯化钠都为盐。碳酸氢钠和无水柠檬酸反应生成柠檬酸钠、二氧化碳和水。
(2)用托盘天平称量食盐时,如果指针偏向右边,说明右边的砝码较左边的物体重一些,且称量一定质量的固体,游码不能移动,故应该添加食盐。
(3)糖的溶解度为204g,即100g水中最多溶解204g糖,所以50ml(即50g)水中最多溶解102g糖,故答案为:能。
(4)溶液具有均一稳定性。
17.(1) 无色 蓝色 浅绿色 紫红色 紫红色 棕黄色
(2) CaO Ca(OH)2 NaOH K2MnO4 Fe2+ Al3+ NO CH3COOH H2S (NH4)2SO4
解析:(1)
①Na2CO3溶液为无色;
②CuSO4溶液为蓝色;
③FeCl2溶液为浅绿色;
④I2的CCl4溶液为紫红色;
⑤KMnO4溶液为紫红色;
⑥FeCl3溶液为棕黄色;
(2)
①生石灰的化学式为CaO;
②熟石灰的化学式为Ca(OH)2;
③火碱的化学式为NaOH;
④锰酸钾的化学式为K2MnO4;
⑤亚铁离子的化学式为Fe2+;
⑥铝离子的化学式为Al3+;
⑦硝酸根离子的化学式为NO;
⑧醋酸的化学式为CH3COOH;
⑨氢硫酸的化学式为H2S;
⑩硫酸铵的化学式为(NH4)2SO4。
18.(1) 盐 氧化物
(2)难溶
(3) CaCO3CaO+CO2↑ CaO+H2O=Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 消耗能源多,步骤复杂,反应条件要求高
解析:(1)碳酸钙由金属离子和酸根离子构成,属于盐;二氧化硅由氧和硅两种元素组成,属于氧化物;故答案为:盐;氧化物;
(2)根据推测,牙膏摩擦剂要有坚硬、难溶的性质,在水中的溶解性是难溶。故答案为:难溶;
(3)ⅰ.①碳酸钙高温分解生成氧化钙和二氧化碳,CaCO3CaO+CO2↑;②生石灰和水反应生成氢氧化钙,CaO+H2O=Ca(OH)2;③氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。故答案为:CaCO3CaO+CO2↑;CaO+H2O=Ca(OH)2;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
ⅱ.上述制备碳酸钙的方案,消耗的能源多,产生的温室气体较多,且步骤复杂,需要加热设备。
三、元素或物质推断题
19.(1) 碳酸钙 铁 氧气 稀盐酸
(2) CaCO3 CaO+CO2↑ 3Fe+2O2Fe3O4 Fe+2HCl=FeCl2+H2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑
解析:(1)(1)在题目已知的物质中,碳酸钙仅有一种微粒构成,是纯净物,由于由Ca、C、O三种元素组成,因此碳酸钙属于化合物;
Fe、O2仅有一种元素组成,属于单质,其中铁为金属单质,氧气是非金属单质;稀盐酸是HCl的水溶液,属于混合物,所以①是碳酸钙,②是铁,③是氧气,④是稀盐酸。
(2)①CaCO3在高温下分解产生CaO和CO2,反应方程式为:CaCO3 CaO+CO2↑,反应的基本类型是分解反应;
②Fe与O2在点燃时反应产生Fe3O4,反应方程式为:3Fe+2O2Fe3O4,反应的基本类型是化合反应;
③Fe与稀盐酸反应产生FeCl2和H2,反应方程式为:Fe+2HCl=FeCl2+H2↑,反应的基本类型为置换反应;
④CaCO3与HCl在溶液中发生反应产生CaCl2、H2O、CO2,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,反应类型是复分解反应。
四、实验题
20.(1) 烧杯中盛放25mL蒸馏水,用酒精灯加热煮沸,向沸水中加入5~6滴氯化铁饱和溶液,继续加热至出现红褐色,停止加热 FeCl3+3H2OFe(OH)3(胶体)+3HCl 丁达尔效应 电泳现象
(2)胶体中加入了电解质溶液,胶体出现聚沉
(3)渗析
解析: (1)实验室制取胶体的方法是烧杯中盛放25mL蒸馏水,用酒精灯加热煮沸,向沸水中加入5~6滴氯化铁饱和溶液,继续加热至出现红褐色,停止加热,相应的化学方程式是FeCl3+3H2OFe(OH)3(胶体)+3HCl,用激光笔照射胶体有一条光亮的通路,可以判断胶体制备是否成功,因此利用胶体的丁达尔效应,将制备好的胶体装入如图装置进行实验,接通直流电源一段时间后发现阴极附近的颜色加深,阳极附近的颜色逐渐变浅,上述现象叫做电泳现象;故答案为:烧杯中盛放25mL蒸馏水,用酒精灯加热煮沸,向沸水中加入5~6滴氯化铁饱和溶液,继续加热至出现红褐色,停止加热;FeCl3+3H2OFe(OH)3(胶体)+3HCl;丁达尔效应;电泳现象。
(2)向胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是胶体中加入了电解质溶液,胶体出现聚沉;故答案为:胶体中加入了电解质溶液,胶体出现聚沉。
(3)氯化铁、HCl都能透过半透膜,而氢氧化铁胶体不能透过半透膜,因此除去胶体中混有的和的方法是渗析;故答案为:渗析
