1.3 氧化还原反应 同步练习 (含解析)2022-2023学年高一上学期人教版(2019)化学必修第一册
文档属性
| 名称 | 1.3 氧化还原反应 同步练习 (含解析)2022-2023学年高一上学期人教版(2019)化学必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 935.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-12 00:00:00 | ||
图片预览



文档简介
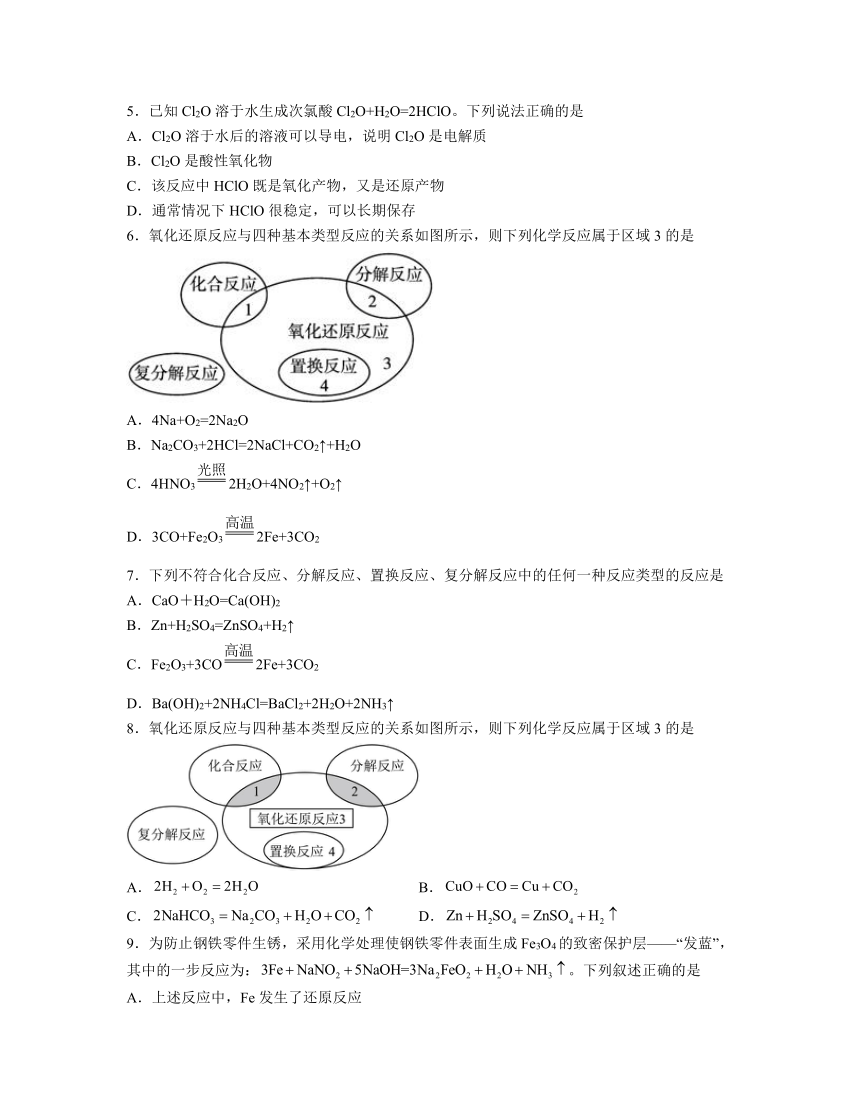
1.3 氧化还原反应 同步练习题
一、选择题
1.水溶液中与S2-在酸化后发生反应: +3S2-+6H+= R-+3S + 3H2O,下列有关推断不正确的是
A.中R呈+5价 B.中R呈+7价
C.微粒中n=l D.R原子最外层有7个电子
2.海水晒盐后精制得到;氯碱工业电解饱和溶液得到和;向海水晒盐得到的卤水中通可制溴;从海水中还能提取镁;海洋中许多藻类植物具有富集碘的能力,从海带中可以提取碘。从海水提取食盐后的母液(含等离子)中提取溴,其流程如下。
下列有关说法不正确的是
A.氧化性:
B.“鼓入热空气”得到粗溴,利用了溴易挥发的性质
C.纯碱溶液吸收的离子反应方程式:
D.控制温度在左右“蒸馏”,既有利于获得溴单质,又可防止水蒸气大量逸出
3.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和、NO的混合气体,这些气体与2.24 L(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则反应中消耗铜的质量是
A.3.2g B.6.4g C.12.8g D.19.2g
4.近日,科学家开发的常压旋转滑行弧实现高效固氮取得进展,如图所示。
下列叙述错误的是
A.该固氮过程均发生氧化还原反应
B.太阳能、风能转化为电能
C.图中反应包括
D.和中的N原子的杂化方式不同
5.已知Cl2O溶于水生成次氯酸Cl2O+H2O=2HClO。下列说法正确的是
A.Cl2O溶于水后的溶液可以导电,说明Cl2O是电解质
B.Cl2O是酸性氧化物
C.该反应中HClO既是氧化产物,又是还原产物
D.通常情况下HClO很稳定,可以长期保存
6.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是
A.4Na+O2=2Na2O
B.Na2CO3+2HCl=2NaCl+CO2↑+H2O
C.4HNO32H2O+4NO2↑+O2↑
D.3CO+Fe2O32Fe+3CO2
7.下列不符合化合反应、分解反应、置换反应、复分解反应中的任何一种反应类型的反应是
A.CaO+H2O=Ca(OH)2
B.Zn+H2SO4=ZnSO4+H2↑
C.Fe2O3+3CO2Fe+3CO2
D.Ba(OH)2+2NH4Cl=BaCl2+2H2O+2NH3↑
8.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是
A. B.
C. D.
9.为防止钢铁零件生锈,采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”,其中的一步反应为:。下列叙述正确的是
A.上述反应中,Fe发生了还原反应
B.NH3是氧化产物
C.当反应中转移6 mol电子时,生成3 molNa2FeO2
D.的氧化性大于的氧化性
10.根据下列反应:(1);(2),判断离子的还原性由强到弱的顺序是
A. B. C. D.
11.下列反应中,氧化剂和还原剂是同种物质的是
A. B.
C. D.
12.通常利用反应Cl2+2NaBr=2NaCl+Br2从海水中提取Br2。该反应属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
13.下列化学反应中,属于氧化还原反应的是
A.Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl B.Zn + H2SO4 = ZnSO4 + H2 ↑
C.Na2CO3 + H2O + CO2 = 2NaHCO3 D.CaCO3 CaO + CO2↑
14.下列离子方程式书写正确的是
A.溶液与足量氨水反应:
B.酸性高锰酸钾溶液与过量的双氧水反应:
C.向溶液中通入过量:
D.水杨酸与过量碳酸钠溶液反应:CO++CO2↑+H2O
15.硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收S,其转化如图所示。下列说法不正确的是
A.过程①生成了HCl,说明酸性:
B.过程②,每溶解1molCuS,转移
C.过程③,氧化剂和还原剂的物质的量之比为1∶4
D.回收S的总反应为
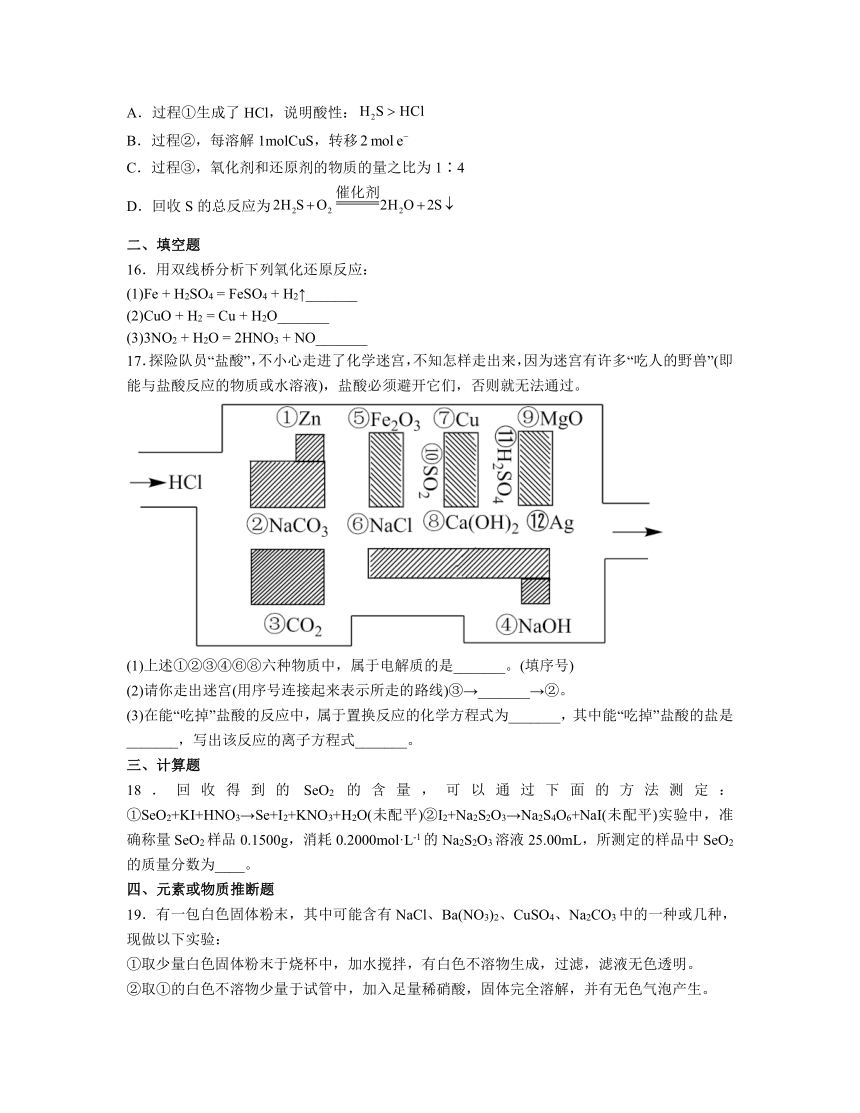
二、填空题
16.用双线桥分析下列氧化还原反应:
(1)Fe + H2SO4 = FeSO4 + H2↑_______
(2)CuO + H2 = Cu + H2O_______
(3)3NO2 + H2O = 2HNO3 + NO_______
17.探险队员“盐酸”,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或水溶液),盐酸必须避开它们,否则就无法通过。
(1)上述①②③④⑥⑧六种物质中,属于电解质的是_______。(填序号)
(2)请你走出迷宫(用序号连接起来表示所走的路线)③→_______→②。
(3)在能“吃掉”盐酸的反应中,属于置换反应的化学方程式为_______,其中能“吃掉”盐酸的盐是_______,写出该反应的离子方程式_______。
三、计算题
18.回收得到的SeO2的含量,可以通过下面的方法测定:①SeO2+KI+HNO3→Se+I2+KNO3+H2O(未配平)②I2+Na2S2O3→Na2S4O6+NaI(未配平)实验中,准确称量SeO2样品0.1500g,消耗0.2000mol·L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为____。
四、元素或物质推断题
19.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①取少量白色固体粉末于烧杯中,加水搅拌,有白色不溶物生成,过滤,滤液无色透明。
②取①的白色不溶物少量于试管中,加入足量稀硝酸,固体完全溶解,并有无色气泡产生。
③取①所得的滤液2 mL于试管中,滴入几滴稀硫酸,有白色沉淀产生。
④另取①得到的无色透明溶液少量于试管中,加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是________________(写化学式,下同),一定不含有的物质是________。
(2)写出各步变化的离子方程式。
①______________________________;
②_______________________________;
③________________________;
(3)查阅资料可知,铜和浓H2SO4共热,发生如下反应:
Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,该反应中氧化剂与还原剂的个数之比为______。
(4)亚硝酸钠易溶于水,水溶液显碱性,有氧化性,也有还原性。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
NaNO2+KI+ H2SO4 → NO↑+I2+K2SO4+Na2SO4+______。
请完成该化学方程式并配平:_____________________________。
五、实验题
20.回答下列问题:
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是_____________(填序号),可作为证据的实验现象是_____________(填字母序号)。
序号 实验 实验现象
1 向5% H2O2溶液中滴加酸性KMnO4溶液 a.溶液紫色褪去;b.有大量气泡产生
2 向5% H2O2溶液中滴加淀粉碘化钾溶液 c.溶液变蓝
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO____H2O2 (填“>”或“<”);当有1个O2生成时,转移电子的个数为_____________。
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。
(3) NaIO3+ NaHSO3—— NaHSO4+ Na2SO4+ I2+ H2O;_____
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下图。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含CuCl2、AlCl3和PbCl2等。
(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是__________(填化学式)。
(5)写出“还原”反应的化学方程式__________。
【参考答案】
一、选择题
1.B
【分析】由电荷守恒得,解得n=1,据此分析解答。
解析:A.根据分析,n=1,则中R呈+5价,A正确;
B.由A分析知,中R呈+5价,B错误;
C.根据分析,n=1,C正确;
D.由R-知,R原子最外层有7个电子,D正确;
故选B。
2.C
【分析】由题给流程可知,向母液中通入氯气将溶液中的溴离子氧化为溴,鼓入热空气将溴吹出得到
粗溴;向粗溴中加入碳酸钠溶液,溴与碳酸钠溶液反应得到含有溴离子和溴酸根离子的混合溶液;向混合溶液中加入稀硫酸,酸性条件下溴离子与溴酸根离子反应生成溴,蒸馏收集得到溴单质。
解析:A.向母液中通入氯气将溶液中的溴离子氧化为溴,根据氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:,故A正确;
B.由分析可知,鼓入热空气将溴吹出得到粗溴,则得到粗溴的操作利用了溴易挥发的性质,故B正确;
C.由分析可知,向粗溴中加入碳酸钠溶液,溴与碳酸钠溶液反应得到含有溴离子和溴酸根离子的混合溶液,逆向配平,中Br元素化合价变化5价,Br-中Br元素化合价变化1价,根据得失电子守恒和电荷守恒配平离子方程式为:,故C错误;
D.控制温度在左右“蒸馏”,既有利于获得溴单质,又可防止水蒸气大量逸出,故D正确;
故选C。
3.C
解析:铜的浓硝酸反应生成硝酸铜和二氧化氮和水,随着反应进行浓硝酸变成稀硝酸,铜和稀硝酸反应生成硝酸铜和一氧化氮和水,铜失去的电子数等于硝酸根生成一氧化氮和二氧化氮得到的电子数,混合气体和氧气反应生成硝酸,一氧化氮和二氧化氮又失去电子生成硝酸,氧气得到电子,可以认为铜失去的电子数等于氧气得到的电子数,则根据氧气计算,标况下2.24升氧气为0.1mol得到0.4mol电子,对应的铜为0.2mol,质量为0.2mol×64g/mol=12.8g。
故选C。
4.A
解析:A.题给转化中,硝酸与氨的反应不是氧化还原反应,故A错误;
B.根据题图可知,太阳能、风能转化成电能,故B正确;
C.和空气中的在水蒸气作用下生成,故C正确;
D.中N原子价电子对数为3,N原子的杂化方式为,分子中N原子的杂化方式为,故D正确;
故答案选A。
5.B
解析:A.Cl2O溶于水后的溶液可以导电,但由于Cl2O溶于水生成了HClO,HClO电离而导电,因此只能说Cl2O是非电解质,故A错误;
B.根据题中Cl2O+H2O=2HClO ,可知Cl2O能与NaOH反应生成NaClO,与碱反应生成盐和水的是酸性氧化物,故B正确;
C.Cl2O+H2O=2HClO,反应中没有化合价变化,因此该反应不是氧化还原反应,故C错误;
D.通常情况下HClO不稳定,见光易分解,因此HClO不能长期保存,故D错误。
综上所述,答案为B。
6.D
【分析】区域3中的反应属于氧化还原反应,但不属于四大基本反应类型。
解析:A.4Na+O2═2Na2O是化合反应,是氧化还原反应,属于区域1,A不符合题意;
B.Na2CO3+2HCl═2NaCl+CO2↑+H2O是复分解反应,不是氧化还原反应,B不符合题意;
C.4HNO32H2O+4NO2↑+O2↑是氧化还原反应,也是分解反应,属于区域2,C不符合题意;
D.3CO+Fe2O32Fe+3CO2是氧化还原反应,不属于四大基本反应类型,D符合题意;
故答案选D。
7.C
解析:A.该反应属于化合反应,故A不选;
B.该反应属于置换反应,故B不选;
C.该反应从物质组成和种类角度不属于四种基本反应类型,故C选;
D.该反应属于复分解反应,故D不选;
故选:C。
8.B
【分析】属于区域3的反应属于氧化还原反应,但不属于化合、分解、置换反应。
解析:A.属于氧化还原反应,也属于化合反应,故A错误;
B.属于氧化还原反应,但不属于化合、分解、置换反应,故B正确;
C.属于氧化还原反应,也属于分解反应,故C错误;
D.属于氧化还原反应,也属于置换反应,故D错误;
综上所述,答案选B。
9.C
解析:A.Fe元素化合价由反应前Fe单质的0价变为反应后Na2FeO2中的+2价,化合价升高,失去电子被氧化,发生氧化反应,A错误;
B.N元素化合价由反应前NaNO2中的+3价变为反应后NH3中的-3价,化合价降低,得到电子被还原,所以NH3是还原产物,B错误;
C.根据反应方程式可知:每反应产生3 molNa2FeO2,反应过程中会转移6 mol电子,C正确;
D.在氧化还原反应中氧化性:氧化剂>氧化产物。在该反应中,氧化剂是NaNO2,氧化产物是Na2FeO2,所以氧化性:<,D错误;
故合理选项是C。
10.C
解析:还原性还原剂大于还原产物;①中碘离子为还原剂、亚铁离子为还原产物,则还原性碘离子大于亚铁离子;②中亚铁离子为还原剂、溴离子为还原产物,则还原性亚铁离子大于溴离子;
故选C。
11.A
解析:A.根据反应方程式,氯气中部分氯元素化合价由0→+5价,化合价升高,部分氯元素化合价由0→-1价,化合价降低,氯气既是氧化剂又是还原剂,故A符合题意;
B.Fe的化合价由0→+2价,化合价升高,作还原剂,Cu的化合价由+2→0价,化合价降低,作氧化剂,故B不符合题意;
C.氯元素的化合价由0→-1价,化合价降低,氯气作氧化剂,碘元素的化合价由-1→0价,化合价升高,NaI作还原剂,故C不符合题意;
D.SO2中S的化合价由+4→0价,化合价降低,二氧化硫作氧化剂,H2S中S的化合价由-2→0,化合价升高,硫化氢作还原剂,故D不符合题意;
答案为A。
12.C
解析:该反应是一种单质和一种化合物,反应生成另一种单质和另一种化合物,这样的反应为置换反应;答案选C。
13.B
【分析】氧化还原反应的特征是元素化合价发生变化;
解析:A.该反应是复分解反应,没有元素化合价发生变化,A项不属于氧化还原反应;
B.该反应属于置换反应,Zn单质中锌元素由0价升高到+2价,硫酸中的氢元素由+1价降到0价,由元素化合价发生变化,B项属于氧化还原反应;
C.该反应属于化合反应,没有元素化合价发生变化,C项不属于氧化还原反应;
D.该反应属于分解反应,没有元素化合价发生变化,D项不属于氧化还原反应;
答案选B。
14.B
解析:A.AgNO3 溶液中加入过量氨水反应的离子方程式为:Ag++3NH3·H2O=Ag(NH3)+OH-+2H2O+NH,故A错误;
B.酸性高锰酸钾溶液与过量的双氧水反应生成氧气和硫酸锰,离子方程式为:,故B正确;
C.向溶液中通入过量生成碳酸氢钙,故C错误;
D.水杨酸中含有羧基可以和过量碳酸钠溶液反应生成碳酸氢钠,不能生成二氧化碳,故D错误;
故选B。
15.A
【分析】由图可知,①中发生H2S+Cu2+=CuS↓+2H+,②中发生CuS+2Fe3+=S+2Fe2++Cu2+,③中发生4Fe2++O2+4H+=4Fe3++2H2O。
解析:A. 过程①生成了HCl,H2S+Cu2+=CuS↓+2H+反应能进行是因为生成了更难电离的CuS,不能说明酸性:,故A错误;
B. 过程②,每溶解1molCuS,生成1molS,转移,故B正确;
C. 过程③中发生4Fe2++O2+4H+=4Fe3++2H2O,氧化剂O2和还原剂Fe2+的物质的量之比为1∶4,故C正确;
D. 由分析①×2+②×2+③得:回收S的总反应为,故D正确;
故选A。
二、填空题
16.(1)
(2)
(3)
解析:(1)根据化合价升降:
(2)根据化合价升降:
(3)根据化合价升降:
17.(1)②④⑥⑧
(2)③→⑥→⑩→⑦→ →
(3) Zn+2HCl=ZnCl2+H2↑ Na2CO3 CO+2H+=H2O+CO2↑
解析:(1)①是Zn,是金属单质,既不属于电解质,也不属于非电解质;
②是Na2CO3,是盐,属于化合物,在水中或熔融状态下能够发生电离而导电,属于电解质;
③是CO2,由分子构成的化合物,在水溶液中和熔融状态下都不能因自身发生电离而导电,属于非电解质;
④是NaOH,是碱,属于化合物,在水中或熔融状态下能够发生电离而导电,属于电解质;
⑥是NaCl,是盐,属于化合物,在水中或熔融状态下能够发生电离而导电,属于电解质;
⑧是Ca(OH)2,是碱,属于化合物,在水中或熔融状态下能够发生电离而导电,属于电解质;
故在上述①②③④⑥⑧六种物质中,属于电解质的是②④⑥⑧;
答案为:②④⑥⑧
(2)由于盐酸不能和CO2、NaCl、SO2、Cu、H2SO4、Ag发生反应,则盐酸通过不反应的物质时可通过,则路线为盐酸③→⑥→⑩→⑦→ → ;
答案为:③→⑥→⑩→⑦→ →
(3)在能“吃掉”盐酸的化学反应中,属于置换反应的可以是HCl与Zn反应产生ZnCl2、H2,反应方程式为:Zn+2HCl=ZnCl2+H2↑;能够与HCl反应的盐是Na2CO3,两种物质发生反应产生NaCl、H2O、CO2,发生该反应的离子方程式为:CO+2H+=H2O+CO2↑。
答案为Zn+2HCl=ZnCl2+H2↑;Na2CO3;CO+2H+=H2O+CO2↑。
三、计算题
18.50%或0.9250
解析:在反应①中:SeO2~Se~4e-,在反应②中:Na2S2O3~Na2S4O6~e-,根据氧化还原反应中转移电子数相等,则有如下关系式:SeO2~4Na2S2O3,n(SeO2)=×0.2000mol/L×0.025L=1.25×10-3mol,m(SeO2)=1.25×10-3mol×111g/mol=0.13875g,样品中SeO2质量分数为×100%=92.50%。
四、元素或物质推断题
19.(1) Ba(NO3)2、Na2CO3、NaCl CuSO4
(2) Ba2++CO=BaCO3↓ BaCO3+2H+=Ba2++H2O+CO2↑ Ba2++SO=BaSO4↓
(3)1:1
(4)2NaNO2+2KI+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O
【分析】白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种;
①取少量白色固体粉末于烧杯中,加水搅拌,有白色不溶物生成,过滤,滤液无色透明,说明不含硫酸铜,则含有硝酸钡和碳酸钠,硝酸钡和碳酸钠生成碳酸钡白色沉淀;
④另取①得到的无色透明溶液少量于试管中,加入足量AgNO3溶液,产生白色沉淀,说明样品含有氯化钠,氯化钠和硝酸银生成氯化银白色沉淀。
解析:(1)由分析可知,原白色粉末中一定含有的物质是Ba(NO3)2、Na2CO3、NaCl,一定不含有的物质是CuSO4;
(2)①硝酸钡和碳酸钠生成碳酸钡白色沉淀,Ba2++CO=BaCO3↓;
②碳酸钡和稀盐酸生成氯化钡、水、二氧化碳气体,BaCO3+2H+=Ba2++H2O+CO2↑;
③硝酸钡和稀硫酸生成硫酸钡沉淀和盐酸,Ba2++SO=BaSO4↓;
(3)该反应中2分子硫酸中有1分子发生还原反应生成二氧化硫,硫酸为氧化剂;铜化合价升高发生氧化反应生成硫酸铜,为还原剂;故氧化剂与还原剂的个数之比为1:1;
(4)反应中氮元素化合价由+3变为+2,碘元素化合价由-1变为0,根据电子守恒、质量守恒配平为:2NaNO2+2KI+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O。
五、实验题
20.(1) 1 ab
(2) > 2
(3)2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(4)SbCl3
(5)3SbCl5+2Sb=5SbCl3
解析:(1)实验1中酸性高锰酸钾是强氧化剂,酸性高锰酸钾溶液遇到过氧化氢紫色褪去、有大量气泡产生(从反应物价态看,气体只能是氧气),说明过氧化氢被氧化,过氧化氢体现还原性,故证明H2O2具有还原性的实验是1,可作为证据的实验现象是ab;
(2)84消毒液与H2O2消毒剂混用,导致消毒能力降低甚至消失,池水变绿,是因为反应生成的氧气促进藻类的疯长,该反应的化学反应方程式为NaClO+H2O2=NaCl+O2↑+ H2O,说明氧化性:NaC1O>H2O2;当有1 gO2生成时,转移电子的数目是2个;
(3)在该反应中,I元素化合价由反应前NaIO3中的+5价降低为I2中的0价,化合价降低5×2=10价;S元素化合价由反应前NaHSO3中的+4价升高为反应后Na2SO4、NaHSO4中的+6价,升高2价,化合价升降最小公倍数是10,所以结合得失电子守恒,配平为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O;
(4)“浸出“时,Sb2S5在溶液中和SbCl5发生氧化还原反应,生成单质S和SbCl3,反应的化学方程式为:Sb2S3+3SbCl5=5SbCl3+3S,其中Sb从+ 6价降低到+ 3价,则还原产物是SbCl3;
(5)“还原”时Sb和SbCl5反应生成SbCl3,根据电子守恒、原子守恒,可得该反应的化学方程式为:3SbCl5+2Sb=5SbCl3
一、选择题
1.水溶液中与S2-在酸化后发生反应: +3S2-+6H+= R-+3S + 3H2O,下列有关推断不正确的是
A.中R呈+5价 B.中R呈+7价
C.微粒中n=l D.R原子最外层有7个电子
2.海水晒盐后精制得到;氯碱工业电解饱和溶液得到和;向海水晒盐得到的卤水中通可制溴;从海水中还能提取镁;海洋中许多藻类植物具有富集碘的能力,从海带中可以提取碘。从海水提取食盐后的母液(含等离子)中提取溴,其流程如下。
下列有关说法不正确的是
A.氧化性:
B.“鼓入热空气”得到粗溴,利用了溴易挥发的性质
C.纯碱溶液吸收的离子反应方程式:
D.控制温度在左右“蒸馏”,既有利于获得溴单质,又可防止水蒸气大量逸出
3.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和、NO的混合气体,这些气体与2.24 L(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则反应中消耗铜的质量是
A.3.2g B.6.4g C.12.8g D.19.2g
4.近日,科学家开发的常压旋转滑行弧实现高效固氮取得进展,如图所示。
下列叙述错误的是
A.该固氮过程均发生氧化还原反应
B.太阳能、风能转化为电能
C.图中反应包括
D.和中的N原子的杂化方式不同
5.已知Cl2O溶于水生成次氯酸Cl2O+H2O=2HClO。下列说法正确的是
A.Cl2O溶于水后的溶液可以导电,说明Cl2O是电解质
B.Cl2O是酸性氧化物
C.该反应中HClO既是氧化产物,又是还原产物
D.通常情况下HClO很稳定,可以长期保存
6.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是
A.4Na+O2=2Na2O
B.Na2CO3+2HCl=2NaCl+CO2↑+H2O
C.4HNO32H2O+4NO2↑+O2↑
D.3CO+Fe2O32Fe+3CO2
7.下列不符合化合反应、分解反应、置换反应、复分解反应中的任何一种反应类型的反应是
A.CaO+H2O=Ca(OH)2
B.Zn+H2SO4=ZnSO4+H2↑
C.Fe2O3+3CO2Fe+3CO2
D.Ba(OH)2+2NH4Cl=BaCl2+2H2O+2NH3↑
8.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是
A. B.
C. D.
9.为防止钢铁零件生锈,采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”,其中的一步反应为:。下列叙述正确的是
A.上述反应中,Fe发生了还原反应
B.NH3是氧化产物
C.当反应中转移6 mol电子时,生成3 molNa2FeO2
D.的氧化性大于的氧化性
10.根据下列反应:(1);(2),判断离子的还原性由强到弱的顺序是
A. B. C. D.
11.下列反应中,氧化剂和还原剂是同种物质的是
A. B.
C. D.
12.通常利用反应Cl2+2NaBr=2NaCl+Br2从海水中提取Br2。该反应属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
13.下列化学反应中,属于氧化还原反应的是
A.Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl B.Zn + H2SO4 = ZnSO4 + H2 ↑
C.Na2CO3 + H2O + CO2 = 2NaHCO3 D.CaCO3 CaO + CO2↑
14.下列离子方程式书写正确的是
A.溶液与足量氨水反应:
B.酸性高锰酸钾溶液与过量的双氧水反应:
C.向溶液中通入过量:
D.水杨酸与过量碳酸钠溶液反应:CO++CO2↑+H2O
15.硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收S,其转化如图所示。下列说法不正确的是
A.过程①生成了HCl,说明酸性:
B.过程②,每溶解1molCuS,转移
C.过程③,氧化剂和还原剂的物质的量之比为1∶4
D.回收S的总反应为
二、填空题
16.用双线桥分析下列氧化还原反应:
(1)Fe + H2SO4 = FeSO4 + H2↑_______
(2)CuO + H2 = Cu + H2O_______
(3)3NO2 + H2O = 2HNO3 + NO_______
17.探险队员“盐酸”,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或水溶液),盐酸必须避开它们,否则就无法通过。
(1)上述①②③④⑥⑧六种物质中,属于电解质的是_______。(填序号)
(2)请你走出迷宫(用序号连接起来表示所走的路线)③→_______→②。
(3)在能“吃掉”盐酸的反应中,属于置换反应的化学方程式为_______,其中能“吃掉”盐酸的盐是_______,写出该反应的离子方程式_______。
三、计算题
18.回收得到的SeO2的含量,可以通过下面的方法测定:①SeO2+KI+HNO3→Se+I2+KNO3+H2O(未配平)②I2+Na2S2O3→Na2S4O6+NaI(未配平)实验中,准确称量SeO2样品0.1500g,消耗0.2000mol·L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为____。
四、元素或物质推断题
19.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①取少量白色固体粉末于烧杯中,加水搅拌,有白色不溶物生成,过滤,滤液无色透明。
②取①的白色不溶物少量于试管中,加入足量稀硝酸,固体完全溶解,并有无色气泡产生。
③取①所得的滤液2 mL于试管中,滴入几滴稀硫酸,有白色沉淀产生。
④另取①得到的无色透明溶液少量于试管中,加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是________________(写化学式,下同),一定不含有的物质是________。
(2)写出各步变化的离子方程式。
①______________________________;
②_______________________________;
③________________________;
(3)查阅资料可知,铜和浓H2SO4共热,发生如下反应:
Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,该反应中氧化剂与还原剂的个数之比为______。
(4)亚硝酸钠易溶于水,水溶液显碱性,有氧化性,也有还原性。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
NaNO2+KI+ H2SO4 → NO↑+I2+K2SO4+Na2SO4+______。
请完成该化学方程式并配平:_____________________________。
五、实验题
20.回答下列问题:
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是_____________(填序号),可作为证据的实验现象是_____________(填字母序号)。
序号 实验 实验现象
1 向5% H2O2溶液中滴加酸性KMnO4溶液 a.溶液紫色褪去;b.有大量气泡产生
2 向5% H2O2溶液中滴加淀粉碘化钾溶液 c.溶液变蓝
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO____H2O2 (填“>”或“<”);当有1个O2生成时,转移电子的个数为_____________。
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。
(3) NaIO3+ NaHSO3—— NaHSO4+ Na2SO4+ I2+ H2O;_____
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下图。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含CuCl2、AlCl3和PbCl2等。
(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是__________(填化学式)。
(5)写出“还原”反应的化学方程式__________。
【参考答案】
一、选择题
1.B
【分析】由电荷守恒得,解得n=1,据此分析解答。
解析:A.根据分析,n=1,则中R呈+5价,A正确;
B.由A分析知,中R呈+5价,B错误;
C.根据分析,n=1,C正确;
D.由R-知,R原子最外层有7个电子,D正确;
故选B。
2.C
【分析】由题给流程可知,向母液中通入氯气将溶液中的溴离子氧化为溴,鼓入热空气将溴吹出得到
粗溴;向粗溴中加入碳酸钠溶液,溴与碳酸钠溶液反应得到含有溴离子和溴酸根离子的混合溶液;向混合溶液中加入稀硫酸,酸性条件下溴离子与溴酸根离子反应生成溴,蒸馏收集得到溴单质。
解析:A.向母液中通入氯气将溶液中的溴离子氧化为溴,根据氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:,故A正确;
B.由分析可知,鼓入热空气将溴吹出得到粗溴,则得到粗溴的操作利用了溴易挥发的性质,故B正确;
C.由分析可知,向粗溴中加入碳酸钠溶液,溴与碳酸钠溶液反应得到含有溴离子和溴酸根离子的混合溶液,逆向配平,中Br元素化合价变化5价,Br-中Br元素化合价变化1价,根据得失电子守恒和电荷守恒配平离子方程式为:,故C错误;
D.控制温度在左右“蒸馏”,既有利于获得溴单质,又可防止水蒸气大量逸出,故D正确;
故选C。
3.C
解析:铜的浓硝酸反应生成硝酸铜和二氧化氮和水,随着反应进行浓硝酸变成稀硝酸,铜和稀硝酸反应生成硝酸铜和一氧化氮和水,铜失去的电子数等于硝酸根生成一氧化氮和二氧化氮得到的电子数,混合气体和氧气反应生成硝酸,一氧化氮和二氧化氮又失去电子生成硝酸,氧气得到电子,可以认为铜失去的电子数等于氧气得到的电子数,则根据氧气计算,标况下2.24升氧气为0.1mol得到0.4mol电子,对应的铜为0.2mol,质量为0.2mol×64g/mol=12.8g。
故选C。
4.A
解析:A.题给转化中,硝酸与氨的反应不是氧化还原反应,故A错误;
B.根据题图可知,太阳能、风能转化成电能,故B正确;
C.和空气中的在水蒸气作用下生成,故C正确;
D.中N原子价电子对数为3,N原子的杂化方式为,分子中N原子的杂化方式为,故D正确;
故答案选A。
5.B
解析:A.Cl2O溶于水后的溶液可以导电,但由于Cl2O溶于水生成了HClO,HClO电离而导电,因此只能说Cl2O是非电解质,故A错误;
B.根据题中Cl2O+H2O=2HClO ,可知Cl2O能与NaOH反应生成NaClO,与碱反应生成盐和水的是酸性氧化物,故B正确;
C.Cl2O+H2O=2HClO,反应中没有化合价变化,因此该反应不是氧化还原反应,故C错误;
D.通常情况下HClO不稳定,见光易分解,因此HClO不能长期保存,故D错误。
综上所述,答案为B。
6.D
【分析】区域3中的反应属于氧化还原反应,但不属于四大基本反应类型。
解析:A.4Na+O2═2Na2O是化合反应,是氧化还原反应,属于区域1,A不符合题意;
B.Na2CO3+2HCl═2NaCl+CO2↑+H2O是复分解反应,不是氧化还原反应,B不符合题意;
C.4HNO32H2O+4NO2↑+O2↑是氧化还原反应,也是分解反应,属于区域2,C不符合题意;
D.3CO+Fe2O32Fe+3CO2是氧化还原反应,不属于四大基本反应类型,D符合题意;
故答案选D。
7.C
解析:A.该反应属于化合反应,故A不选;
B.该反应属于置换反应,故B不选;
C.该反应从物质组成和种类角度不属于四种基本反应类型,故C选;
D.该反应属于复分解反应,故D不选;
故选:C。
8.B
【分析】属于区域3的反应属于氧化还原反应,但不属于化合、分解、置换反应。
解析:A.属于氧化还原反应,也属于化合反应,故A错误;
B.属于氧化还原反应,但不属于化合、分解、置换反应,故B正确;
C.属于氧化还原反应,也属于分解反应,故C错误;
D.属于氧化还原反应,也属于置换反应,故D错误;
综上所述,答案选B。
9.C
解析:A.Fe元素化合价由反应前Fe单质的0价变为反应后Na2FeO2中的+2价,化合价升高,失去电子被氧化,发生氧化反应,A错误;
B.N元素化合价由反应前NaNO2中的+3价变为反应后NH3中的-3价,化合价降低,得到电子被还原,所以NH3是还原产物,B错误;
C.根据反应方程式可知:每反应产生3 molNa2FeO2,反应过程中会转移6 mol电子,C正确;
D.在氧化还原反应中氧化性:氧化剂>氧化产物。在该反应中,氧化剂是NaNO2,氧化产物是Na2FeO2,所以氧化性:<,D错误;
故合理选项是C。
10.C
解析:还原性还原剂大于还原产物;①中碘离子为还原剂、亚铁离子为还原产物,则还原性碘离子大于亚铁离子;②中亚铁离子为还原剂、溴离子为还原产物,则还原性亚铁离子大于溴离子;
故选C。
11.A
解析:A.根据反应方程式,氯气中部分氯元素化合价由0→+5价,化合价升高,部分氯元素化合价由0→-1价,化合价降低,氯气既是氧化剂又是还原剂,故A符合题意;
B.Fe的化合价由0→+2价,化合价升高,作还原剂,Cu的化合价由+2→0价,化合价降低,作氧化剂,故B不符合题意;
C.氯元素的化合价由0→-1价,化合价降低,氯气作氧化剂,碘元素的化合价由-1→0价,化合价升高,NaI作还原剂,故C不符合题意;
D.SO2中S的化合价由+4→0价,化合价降低,二氧化硫作氧化剂,H2S中S的化合价由-2→0,化合价升高,硫化氢作还原剂,故D不符合题意;
答案为A。
12.C
解析:该反应是一种单质和一种化合物,反应生成另一种单质和另一种化合物,这样的反应为置换反应;答案选C。
13.B
【分析】氧化还原反应的特征是元素化合价发生变化;
解析:A.该反应是复分解反应,没有元素化合价发生变化,A项不属于氧化还原反应;
B.该反应属于置换反应,Zn单质中锌元素由0价升高到+2价,硫酸中的氢元素由+1价降到0价,由元素化合价发生变化,B项属于氧化还原反应;
C.该反应属于化合反应,没有元素化合价发生变化,C项不属于氧化还原反应;
D.该反应属于分解反应,没有元素化合价发生变化,D项不属于氧化还原反应;
答案选B。
14.B
解析:A.AgNO3 溶液中加入过量氨水反应的离子方程式为:Ag++3NH3·H2O=Ag(NH3)+OH-+2H2O+NH,故A错误;
B.酸性高锰酸钾溶液与过量的双氧水反应生成氧气和硫酸锰,离子方程式为:,故B正确;
C.向溶液中通入过量生成碳酸氢钙,故C错误;
D.水杨酸中含有羧基可以和过量碳酸钠溶液反应生成碳酸氢钠,不能生成二氧化碳,故D错误;
故选B。
15.A
【分析】由图可知,①中发生H2S+Cu2+=CuS↓+2H+,②中发生CuS+2Fe3+=S+2Fe2++Cu2+,③中发生4Fe2++O2+4H+=4Fe3++2H2O。
解析:A. 过程①生成了HCl,H2S+Cu2+=CuS↓+2H+反应能进行是因为生成了更难电离的CuS,不能说明酸性:,故A错误;
B. 过程②,每溶解1molCuS,生成1molS,转移,故B正确;
C. 过程③中发生4Fe2++O2+4H+=4Fe3++2H2O,氧化剂O2和还原剂Fe2+的物质的量之比为1∶4,故C正确;
D. 由分析①×2+②×2+③得:回收S的总反应为,故D正确;
故选A。
二、填空题
16.(1)
(2)
(3)
解析:(1)根据化合价升降:
(2)根据化合价升降:
(3)根据化合价升降:
17.(1)②④⑥⑧
(2)③→⑥→⑩→⑦→ →
(3) Zn+2HCl=ZnCl2+H2↑ Na2CO3 CO+2H+=H2O+CO2↑
解析:(1)①是Zn,是金属单质,既不属于电解质,也不属于非电解质;
②是Na2CO3,是盐,属于化合物,在水中或熔融状态下能够发生电离而导电,属于电解质;
③是CO2,由分子构成的化合物,在水溶液中和熔融状态下都不能因自身发生电离而导电,属于非电解质;
④是NaOH,是碱,属于化合物,在水中或熔融状态下能够发生电离而导电,属于电解质;
⑥是NaCl,是盐,属于化合物,在水中或熔融状态下能够发生电离而导电,属于电解质;
⑧是Ca(OH)2,是碱,属于化合物,在水中或熔融状态下能够发生电离而导电,属于电解质;
故在上述①②③④⑥⑧六种物质中,属于电解质的是②④⑥⑧;
答案为:②④⑥⑧
(2)由于盐酸不能和CO2、NaCl、SO2、Cu、H2SO4、Ag发生反应,则盐酸通过不反应的物质时可通过,则路线为盐酸③→⑥→⑩→⑦→ → ;
答案为:③→⑥→⑩→⑦→ →
(3)在能“吃掉”盐酸的化学反应中,属于置换反应的可以是HCl与Zn反应产生ZnCl2、H2,反应方程式为:Zn+2HCl=ZnCl2+H2↑;能够与HCl反应的盐是Na2CO3,两种物质发生反应产生NaCl、H2O、CO2,发生该反应的离子方程式为:CO+2H+=H2O+CO2↑。
答案为Zn+2HCl=ZnCl2+H2↑;Na2CO3;CO+2H+=H2O+CO2↑。
三、计算题
18.50%或0.9250
解析:在反应①中:SeO2~Se~4e-,在反应②中:Na2S2O3~Na2S4O6~e-,根据氧化还原反应中转移电子数相等,则有如下关系式:SeO2~4Na2S2O3,n(SeO2)=×0.2000mol/L×0.025L=1.25×10-3mol,m(SeO2)=1.25×10-3mol×111g/mol=0.13875g,样品中SeO2质量分数为×100%=92.50%。
四、元素或物质推断题
19.(1) Ba(NO3)2、Na2CO3、NaCl CuSO4
(2) Ba2++CO=BaCO3↓ BaCO3+2H+=Ba2++H2O+CO2↑ Ba2++SO=BaSO4↓
(3)1:1
(4)2NaNO2+2KI+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O
【分析】白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种;
①取少量白色固体粉末于烧杯中,加水搅拌,有白色不溶物生成,过滤,滤液无色透明,说明不含硫酸铜,则含有硝酸钡和碳酸钠,硝酸钡和碳酸钠生成碳酸钡白色沉淀;
④另取①得到的无色透明溶液少量于试管中,加入足量AgNO3溶液,产生白色沉淀,说明样品含有氯化钠,氯化钠和硝酸银生成氯化银白色沉淀。
解析:(1)由分析可知,原白色粉末中一定含有的物质是Ba(NO3)2、Na2CO3、NaCl,一定不含有的物质是CuSO4;
(2)①硝酸钡和碳酸钠生成碳酸钡白色沉淀,Ba2++CO=BaCO3↓;
②碳酸钡和稀盐酸生成氯化钡、水、二氧化碳气体,BaCO3+2H+=Ba2++H2O+CO2↑;
③硝酸钡和稀硫酸生成硫酸钡沉淀和盐酸,Ba2++SO=BaSO4↓;
(3)该反应中2分子硫酸中有1分子发生还原反应生成二氧化硫,硫酸为氧化剂;铜化合价升高发生氧化反应生成硫酸铜,为还原剂;故氧化剂与还原剂的个数之比为1:1;
(4)反应中氮元素化合价由+3变为+2,碘元素化合价由-1变为0,根据电子守恒、质量守恒配平为:2NaNO2+2KI+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O。
五、实验题
20.(1) 1 ab
(2) > 2
(3)2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(4)SbCl3
(5)3SbCl5+2Sb=5SbCl3
解析:(1)实验1中酸性高锰酸钾是强氧化剂,酸性高锰酸钾溶液遇到过氧化氢紫色褪去、有大量气泡产生(从反应物价态看,气体只能是氧气),说明过氧化氢被氧化,过氧化氢体现还原性,故证明H2O2具有还原性的实验是1,可作为证据的实验现象是ab;
(2)84消毒液与H2O2消毒剂混用,导致消毒能力降低甚至消失,池水变绿,是因为反应生成的氧气促进藻类的疯长,该反应的化学反应方程式为NaClO+H2O2=NaCl+O2↑+ H2O,说明氧化性:NaC1O>H2O2;当有1 gO2生成时,转移电子的数目是2个;
(3)在该反应中,I元素化合价由反应前NaIO3中的+5价降低为I2中的0价,化合价降低5×2=10价;S元素化合价由反应前NaHSO3中的+4价升高为反应后Na2SO4、NaHSO4中的+6价,升高2价,化合价升降最小公倍数是10,所以结合得失电子守恒,配平为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O;
(4)“浸出“时,Sb2S5在溶液中和SbCl5发生氧化还原反应,生成单质S和SbCl3,反应的化学方程式为:Sb2S3+3SbCl5=5SbCl3+3S,其中Sb从+ 6价降低到+ 3价,则还原产物是SbCl3;
(5)“还原”时Sb和SbCl5反应生成SbCl3,根据电子守恒、原子守恒,可得该反应的化学方程式为:3SbCl5+2Sb=5SbCl3
