2023年中考化学复习 专题四 探究性实验题 课件
文档属性
| 名称 | 2023年中考化学复习 专题四 探究性实验题 课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-12 00:00:00 | ||
图片预览





文档简介
(共24张PPT)
课时精练
专题四 探究性实验题
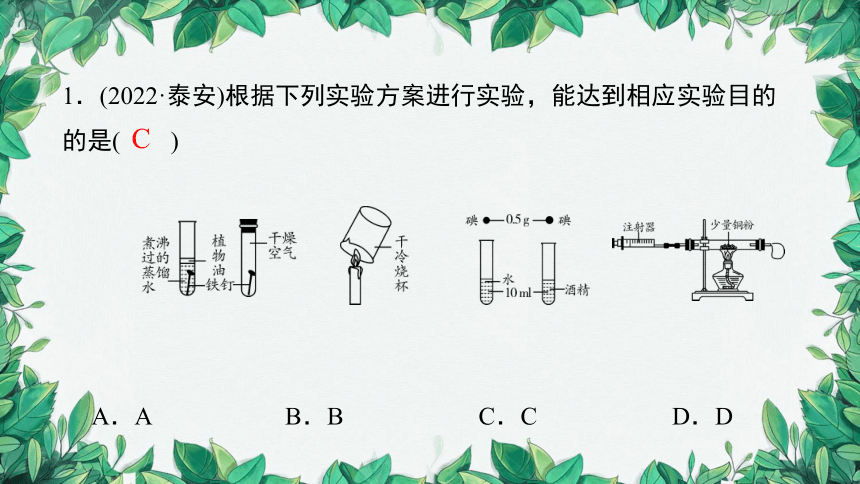
1.(2022·泰安)根据下列实验方案进行实验,能达到相应实验目的的是( )
A.A B.B C.C D.D
C
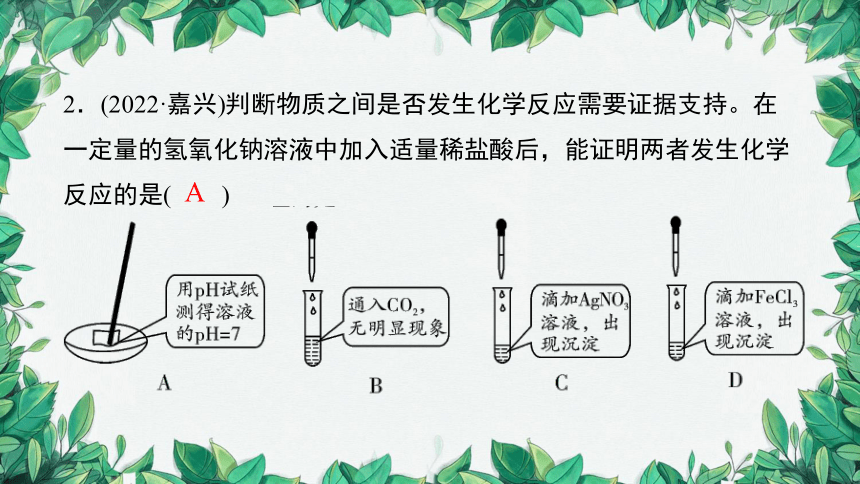
2.(2022·嘉兴)判断物质之间是否发生化学反应需要证据支持。在一定量的氢氧化钠溶液中加入适量稀盐酸后,能证明两者发生化学反应的是( )
A
3.(2022·济宁)某白色固体是由NaCl、MgCl2、BaCl2和NaOH中的一种或几种物质组成。为确定其成分,进行实验:取样品放入烧杯,加入足量的水,搅拌、静置,烧杯底部有白色不溶物;取上层清液,滴加足量稀硫酸,出现白色沉淀,滴加稀硝酸后,沉淀未溶解。
下面对白色固体混合物组成的判断,正确的是( )
A.一定同时含有NaCl、MgCl2、BaCl2、NaOH
B.一定含有MgCl2、BaCl2、NaOH,不含有NaCl
C.一定含有MgCl2、BaCl2、NaOH,可能含有NaCl
D.一定含有MgCl2、BaCl2,可能含有NaCl、NaOH
C
4.(2020·广东) 某兴趣小组在学习碳(C)的化学性质时,了解到高温下C与CuO反应生成CO2,C还能使CO2转变成CO,于是对过量木炭还原CuO的气体产物中是否含有CO进行了探究。
【猜想与假设】C还原CuO时产生的CO2与C进一步反应生成CO,化学方程式是____________________________________。
【查阅资料】CO不与NaOH、Ca(OH)2及H2SO4反应。
【实验方案】取研细和干燥后的木炭(0.3g)和CuO(2.0g),混合均匀并装入试管,连接装置,高温反应,检验气体。
CO2+C 2CO
高温
【实验过程】
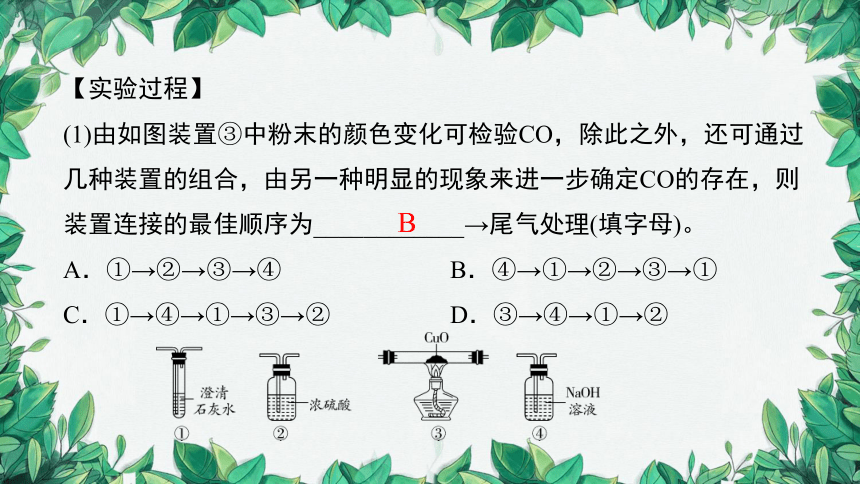
(1)由如图装置③中粉末的颜色变化可检验CO,除此之外,还可通过几种装置的组合,由另一种明显的现象来进一步确定CO的存在,则装置连接的最佳顺序为____________→尾气处理(填字母)。
A.①→②→③→④ B.④→①→②→③→①
C.①→④→①→③→② D.③→④→①→②
B
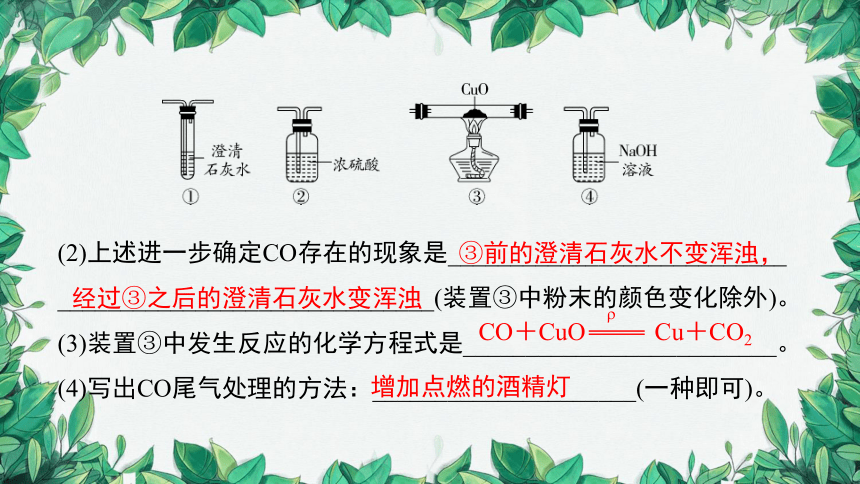
(2)上述进一步确定CO存在的现象是___________________________
______________________________(装置③中粉末的颜色变化除外)。
(3)装置③中发生反应的化学方程式是_________________________。
(4)写出CO尾气处理的方法:_____________________(一种即可)。
③前的澄清石灰水不变浑浊,经过③之后的澄清石灰水变浑浊
CO+CuO Cu+CO2
增加点燃的酒精灯
【实验结论】高温下,过量木炭还原CuO的气体产物中有CO。
【延伸应用】冬天,室内用炭火取暖时,应注意____________。
通风
5.(2022·梧州)使用茶垢清洁剂可以轻松将茶垢除去。小吴按照说明书将适量茶垢清洁剂放入有茶垢的杯子中,加入热水浸没茶垢,立即产生大量气泡,一段时间后冲洗茶杯,茶杯光亮如新。
【提出问题1】产生的气体是什么?
【查阅资料】茶垢清洁剂的主要成分为过碳酸钠(Na2CO4)。
【猜想与假设】同学们对该气体的成分提出了三种猜想。
猜想1:只有O2;
猜想2:____________;
猜想3:既有O2又有CO2。
只有CO2
【实验验证】小吴按如图装置对猜想进行如下验证:
操作 现象 结论
检查气密性后,向A中加入热水,将生成的气体依次通过B、C,向D中插入带火星的木条 观察到B中________________,D中木条复燃 猜想1正确
【拓展实验】小周改用冷水重复上述实验,观察到锥形瓶中有持续的小气泡缓慢放出,带火星的木条没有复燃。该木条不复燃的原因是__________________________________________________________。
无明显现象
温度低时反应缓慢,氧气浓度过低
【交流与讨论】老师提示,茶垢清洁剂是利用过碳酸钠与水反应产生具有强氧化性的活性氧,使茶垢分解、剥离、脱落。所以,使用茶垢清洁剂时,加入______________的水,效果更好。
【提出问题2】过碳酸钠与热水反应后所得溶液E中溶质的成分是什么?
【猜想与假设】同学们查阅资料后,作出三种猜想。
猜想1:只有Na2CO3; 猜想2:只有NaOH;
猜想3:既有Na2CO3又有NaOH。
温度较高
【实验验证】小施从下列试剂中选择合适的试剂完成探究:稀盐酸、饱和Ca(OH)2溶液、
CaCl2溶液、酚酞溶液、Ba(OH)2溶液。
操作 现象 结论
步骤1:取少量溶液E,滴加_______ 有气泡产生 溶液中一定有Na2CO3,猜想2不正确。
步骤2:另取少量溶液E,滴加CaCl2溶液至不再产生沉淀为止,向上层清液中加入________________。 无明显现象 溶液中无NaOH,猜想3不正确,猜想1正确。
稀盐酸
酚酞溶液
【交流与讨论】步骤2中选用CaCl2而不用Ca(OH)2的原因是_______________________________________________________。
Ca(OH)2与Na2CO3反应生成NaOH,干扰后续NaOH的检验
【总结提升】(1)根据过碳酸钠的性质,保存茶垢清洁剂应注意____________________________。
(2)过氧化钠(Na2O2)常用作供氧剂,其与水反应的历程与过碳酸钠类似,即先与水反应生成过氧化氢和一种碱,之后过氧化氢迅速分解。请写出过氧化钠与水反应的总反应方程式___________________________________________。
密封、防潮、避免高温
2Na2O2+2H2O===4NaOH+O2↑
6.(2022·烟台)学习完金属的化学性质,兴趣小组进行了如图所示的实验。
【查阅资料】硝酸铜溶液呈蓝色,硝酸亚铁溶液呈浅绿色,硝酸锌溶液呈无色。
【实验一】同学们进行如图一所示的实验,验证铁、锌、铜、银四种金属活动性强弱。
(1)试管①中观察到的实验现象是____________________________________。
试管③中反应的化学方程式是________________________________。
(2)你认为通过上述图一所示的三个实验能否验证铁、锌、铜、银四种金属在溶液中的活动性强弱____________(填“能”或“不能”)。
有红色固体生成,溶液由蓝色变为浅绿色
Cu+2AgNO3===Cu(NO3)2+2Ag
能
【实验二】同学们将试管①②③内反应后的物质都倒入废液缸中(如图二)。小组同学对废液缸中混合物的成分产生了探究兴趣。待混合物充分反应后,过滤,得到滤渣和浅绿色滤液。
(3)小明将铁丝放入浅绿色滤液中,一段时间后,铁丝表面没有发生变化。由此判断滤液中含有的溶质是________________________(填化学式)。
Zn(NO3)2、Fe(NO3)2
(4)探究滤渣的成分
【提出问题】滤渣的成分是什么?
【作出猜想】小明的猜想:银、铜、铁、锌;
你的猜想:猜想Ⅰ:__________; 猜想Ⅱ:银、铜、铁
【分析思考】同学们认为小明的猜想不正确,结合上述的实验现象分析,小明的猜想不正确的原因是_______________________。
银、铜
锌与硝酸亚铁不能共存
【进行实验】实验证明猜想Ⅱ正确,请你完成下列实验方案。
实验步骤 实验现象 结论
取少量滤渣样品,加入_________________________。 ____________________________ 猜想Ⅱ正确
【反思交流】在分析反应后所得物质的成分时,除了考虑生成物外,还需要考虑____________________________________。
加入稀盐酸(合理即可)
有气泡生成(合理即可)
反应物是否有剩余
7.(2022·贵港改编)铜制品长期露置在潮湿的空气中会因锈蚀生成“铜绿”[化学式为Cu2(OH)2CO3]而使其表面变成绿色。
(1)小花同学根据铜绿成分做出猜想:金属铜锈蚀的条件除了有氧气和水外,还必须有二氧化碳,为了证明“必须有二氧化碳”,需要进行下列实验中的__________(选填实验编号)。
bd
(2)小花和同学们利用废旧品中锈蚀严重的废铜屑为原料(假设不含其他杂质)设计了两个方案回收铜。
【查阅资料】a.Cu2(OH)2CO3 2CuO+CO2↑+H2O
b.Cu2(OH)2CO3+2H2SO4===2CuSO4+CO2↑+3H2O
【分析评价】
①X为碳的氧化物时,步骤Ⅱ中发生反应的化学方程式为______________________________________。
②步骤Ⅴ过程中观察到的实验现象为____________________________________________。
③以上两个方案中,你认为哪一个方案更优越并说明理由__________________________________________(理由写一点)。
CuO+CO Cu+CO2
有气泡产生,溶液逐渐由无色变为浅绿色
方案二更优越,因为它安全、节能、环保
【拓展探究】(3)小金在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成分,进行了如下的探究:
【查阅资料】Cu和Cu2O均为红色固体,且Cu2O+H2SO4===Cu+CuSO4+H2O。
【提出猜想】红色固体是:Ⅰ.Cu Ⅱ.Cu2O Ⅲ._______________。
Cu 和Cu2O
【进行实验】
操作 现象 结论
①取灼烧后的红色固体1.44 g于试管中,加入足量稀硫酸,加热并充分振荡,静置。 溶液由无色变蓝色, 固体减少。
1.44g红色固体一定有____________
②过滤、洗涤、干燥。 得红色固体
Cu2O
【结论分析】①据上述实验现象,小金认为猜想Ⅲ正确。但有同学认为小金的判断不严谨,因为猜想____________也有相同现象。
②氧化铜高温灼烧由黑色变成红色的化学方程式为______________________________________。
③如要确定1.44 g红色固体成分,还需要补充的操作是______________________________,再通过__________得出结论。
Ⅱ
4CuO 2Cu2O+O2↑
高温
称量最后得到的红色固体质量
计算
课时精练
专题四 探究性实验题
1.(2022·泰安)根据下列实验方案进行实验,能达到相应实验目的的是( )
A.A B.B C.C D.D
C
2.(2022·嘉兴)判断物质之间是否发生化学反应需要证据支持。在一定量的氢氧化钠溶液中加入适量稀盐酸后,能证明两者发生化学反应的是( )
A
3.(2022·济宁)某白色固体是由NaCl、MgCl2、BaCl2和NaOH中的一种或几种物质组成。为确定其成分,进行实验:取样品放入烧杯,加入足量的水,搅拌、静置,烧杯底部有白色不溶物;取上层清液,滴加足量稀硫酸,出现白色沉淀,滴加稀硝酸后,沉淀未溶解。
下面对白色固体混合物组成的判断,正确的是( )
A.一定同时含有NaCl、MgCl2、BaCl2、NaOH
B.一定含有MgCl2、BaCl2、NaOH,不含有NaCl
C.一定含有MgCl2、BaCl2、NaOH,可能含有NaCl
D.一定含有MgCl2、BaCl2,可能含有NaCl、NaOH
C
4.(2020·广东) 某兴趣小组在学习碳(C)的化学性质时,了解到高温下C与CuO反应生成CO2,C还能使CO2转变成CO,于是对过量木炭还原CuO的气体产物中是否含有CO进行了探究。
【猜想与假设】C还原CuO时产生的CO2与C进一步反应生成CO,化学方程式是____________________________________。
【查阅资料】CO不与NaOH、Ca(OH)2及H2SO4反应。
【实验方案】取研细和干燥后的木炭(0.3g)和CuO(2.0g),混合均匀并装入试管,连接装置,高温反应,检验气体。
CO2+C 2CO
高温
【实验过程】
(1)由如图装置③中粉末的颜色变化可检验CO,除此之外,还可通过几种装置的组合,由另一种明显的现象来进一步确定CO的存在,则装置连接的最佳顺序为____________→尾气处理(填字母)。
A.①→②→③→④ B.④→①→②→③→①
C.①→④→①→③→② D.③→④→①→②
B
(2)上述进一步确定CO存在的现象是___________________________
______________________________(装置③中粉末的颜色变化除外)。
(3)装置③中发生反应的化学方程式是_________________________。
(4)写出CO尾气处理的方法:_____________________(一种即可)。
③前的澄清石灰水不变浑浊,经过③之后的澄清石灰水变浑浊
CO+CuO Cu+CO2
增加点燃的酒精灯
【实验结论】高温下,过量木炭还原CuO的气体产物中有CO。
【延伸应用】冬天,室内用炭火取暖时,应注意____________。
通风
5.(2022·梧州)使用茶垢清洁剂可以轻松将茶垢除去。小吴按照说明书将适量茶垢清洁剂放入有茶垢的杯子中,加入热水浸没茶垢,立即产生大量气泡,一段时间后冲洗茶杯,茶杯光亮如新。
【提出问题1】产生的气体是什么?
【查阅资料】茶垢清洁剂的主要成分为过碳酸钠(Na2CO4)。
【猜想与假设】同学们对该气体的成分提出了三种猜想。
猜想1:只有O2;
猜想2:____________;
猜想3:既有O2又有CO2。
只有CO2
【实验验证】小吴按如图装置对猜想进行如下验证:
操作 现象 结论
检查气密性后,向A中加入热水,将生成的气体依次通过B、C,向D中插入带火星的木条 观察到B中________________,D中木条复燃 猜想1正确
【拓展实验】小周改用冷水重复上述实验,观察到锥形瓶中有持续的小气泡缓慢放出,带火星的木条没有复燃。该木条不复燃的原因是__________________________________________________________。
无明显现象
温度低时反应缓慢,氧气浓度过低
【交流与讨论】老师提示,茶垢清洁剂是利用过碳酸钠与水反应产生具有强氧化性的活性氧,使茶垢分解、剥离、脱落。所以,使用茶垢清洁剂时,加入______________的水,效果更好。
【提出问题2】过碳酸钠与热水反应后所得溶液E中溶质的成分是什么?
【猜想与假设】同学们查阅资料后,作出三种猜想。
猜想1:只有Na2CO3; 猜想2:只有NaOH;
猜想3:既有Na2CO3又有NaOH。
温度较高
【实验验证】小施从下列试剂中选择合适的试剂完成探究:稀盐酸、饱和Ca(OH)2溶液、
CaCl2溶液、酚酞溶液、Ba(OH)2溶液。
操作 现象 结论
步骤1:取少量溶液E,滴加_______ 有气泡产生 溶液中一定有Na2CO3,猜想2不正确。
步骤2:另取少量溶液E,滴加CaCl2溶液至不再产生沉淀为止,向上层清液中加入________________。 无明显现象 溶液中无NaOH,猜想3不正确,猜想1正确。
稀盐酸
酚酞溶液
【交流与讨论】步骤2中选用CaCl2而不用Ca(OH)2的原因是_______________________________________________________。
Ca(OH)2与Na2CO3反应生成NaOH,干扰后续NaOH的检验
【总结提升】(1)根据过碳酸钠的性质,保存茶垢清洁剂应注意____________________________。
(2)过氧化钠(Na2O2)常用作供氧剂,其与水反应的历程与过碳酸钠类似,即先与水反应生成过氧化氢和一种碱,之后过氧化氢迅速分解。请写出过氧化钠与水反应的总反应方程式___________________________________________。
密封、防潮、避免高温
2Na2O2+2H2O===4NaOH+O2↑
6.(2022·烟台)学习完金属的化学性质,兴趣小组进行了如图所示的实验。
【查阅资料】硝酸铜溶液呈蓝色,硝酸亚铁溶液呈浅绿色,硝酸锌溶液呈无色。
【实验一】同学们进行如图一所示的实验,验证铁、锌、铜、银四种金属活动性强弱。
(1)试管①中观察到的实验现象是____________________________________。
试管③中反应的化学方程式是________________________________。
(2)你认为通过上述图一所示的三个实验能否验证铁、锌、铜、银四种金属在溶液中的活动性强弱____________(填“能”或“不能”)。
有红色固体生成,溶液由蓝色变为浅绿色
Cu+2AgNO3===Cu(NO3)2+2Ag
能
【实验二】同学们将试管①②③内反应后的物质都倒入废液缸中(如图二)。小组同学对废液缸中混合物的成分产生了探究兴趣。待混合物充分反应后,过滤,得到滤渣和浅绿色滤液。
(3)小明将铁丝放入浅绿色滤液中,一段时间后,铁丝表面没有发生变化。由此判断滤液中含有的溶质是________________________(填化学式)。
Zn(NO3)2、Fe(NO3)2
(4)探究滤渣的成分
【提出问题】滤渣的成分是什么?
【作出猜想】小明的猜想:银、铜、铁、锌;
你的猜想:猜想Ⅰ:__________; 猜想Ⅱ:银、铜、铁
【分析思考】同学们认为小明的猜想不正确,结合上述的实验现象分析,小明的猜想不正确的原因是_______________________。
银、铜
锌与硝酸亚铁不能共存
【进行实验】实验证明猜想Ⅱ正确,请你完成下列实验方案。
实验步骤 实验现象 结论
取少量滤渣样品,加入_________________________。 ____________________________ 猜想Ⅱ正确
【反思交流】在分析反应后所得物质的成分时,除了考虑生成物外,还需要考虑____________________________________。
加入稀盐酸(合理即可)
有气泡生成(合理即可)
反应物是否有剩余
7.(2022·贵港改编)铜制品长期露置在潮湿的空气中会因锈蚀生成“铜绿”[化学式为Cu2(OH)2CO3]而使其表面变成绿色。
(1)小花同学根据铜绿成分做出猜想:金属铜锈蚀的条件除了有氧气和水外,还必须有二氧化碳,为了证明“必须有二氧化碳”,需要进行下列实验中的__________(选填实验编号)。
bd
(2)小花和同学们利用废旧品中锈蚀严重的废铜屑为原料(假设不含其他杂质)设计了两个方案回收铜。
【查阅资料】a.Cu2(OH)2CO3 2CuO+CO2↑+H2O
b.Cu2(OH)2CO3+2H2SO4===2CuSO4+CO2↑+3H2O
【分析评价】
①X为碳的氧化物时,步骤Ⅱ中发生反应的化学方程式为______________________________________。
②步骤Ⅴ过程中观察到的实验现象为____________________________________________。
③以上两个方案中,你认为哪一个方案更优越并说明理由__________________________________________(理由写一点)。
CuO+CO Cu+CO2
有气泡产生,溶液逐渐由无色变为浅绿色
方案二更优越,因为它安全、节能、环保
【拓展探究】(3)小金在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成分,进行了如下的探究:
【查阅资料】Cu和Cu2O均为红色固体,且Cu2O+H2SO4===Cu+CuSO4+H2O。
【提出猜想】红色固体是:Ⅰ.Cu Ⅱ.Cu2O Ⅲ._______________。
Cu 和Cu2O
【进行实验】
操作 现象 结论
①取灼烧后的红色固体1.44 g于试管中,加入足量稀硫酸,加热并充分振荡,静置。 溶液由无色变蓝色, 固体减少。
1.44g红色固体一定有____________
②过滤、洗涤、干燥。 得红色固体
Cu2O
【结论分析】①据上述实验现象,小金认为猜想Ⅲ正确。但有同学认为小金的判断不严谨,因为猜想____________也有相同现象。
②氧化铜高温灼烧由黑色变成红色的化学方程式为______________________________________。
③如要确定1.44 g红色固体成分,还需要补充的操作是______________________________,再通过__________得出结论。
Ⅱ
4CuO 2Cu2O+O2↑
高温
称量最后得到的红色固体质量
计算
同课章节目录
