6.1化学能与电能第一课时课件(共40张PPT)高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1化学能与电能第一课时课件(共40张PPT)高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 833.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-12 19:53:23 | ||
图片预览





文档简介
(共40张PPT)
化学能与电能
第一课时 化学能转化为电能
格林太太有两颗假牙,一颗是黄金的——这是她财富的标志;另一颗是不锈钢的——这是一次车祸留下的痕迹。令人百思不解的是自从那可怕的车祸后,格林太太就经常头疼、夜间失眠、心情烦躁。四处求医也没能治好 ,后来一位年轻化学家上门了解了一下情况很快的解决了问题。
请你当回医生
风能,水能,煤炭,石油,天然气
直接从自然界取得的能源称为一次能源
一次能源经加工、转换得到的能源称为二次能源
电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称为电力。
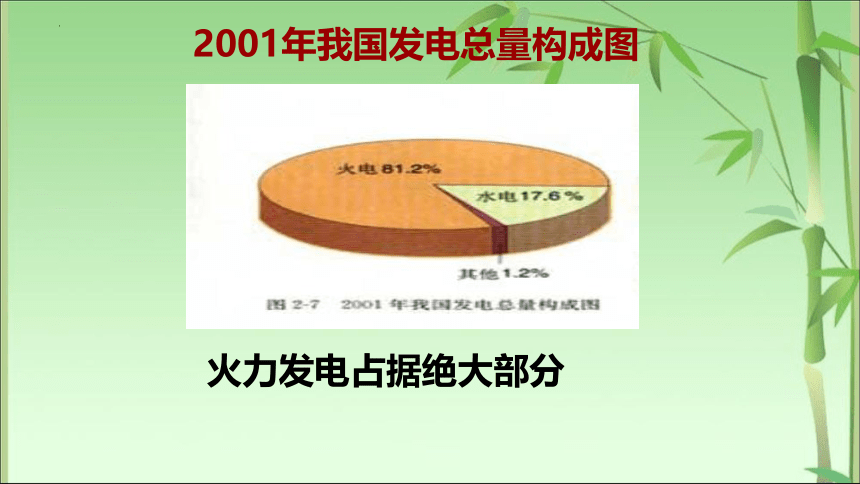
2001年我国发电总量构成图
火力发电占据绝大部分
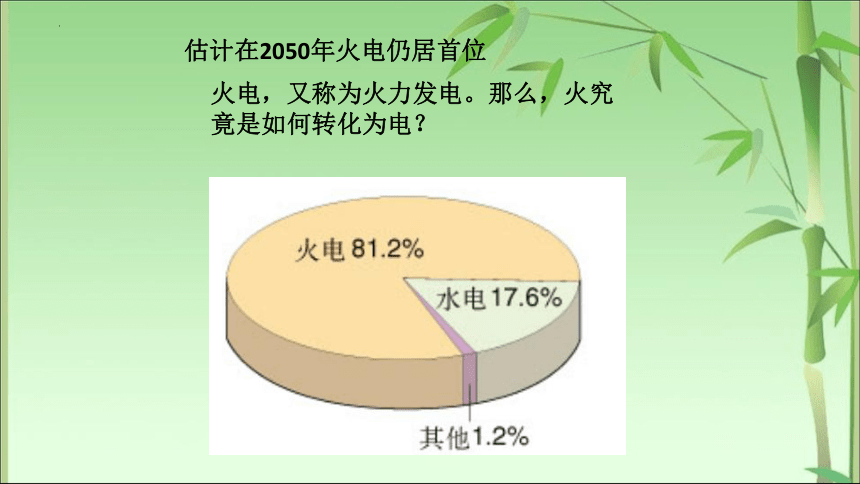
估计在2050年火电仍居首位
火电,又称为火力发电。那么,火究竟是如何转化为电?
一、化学能与电能的相互转化
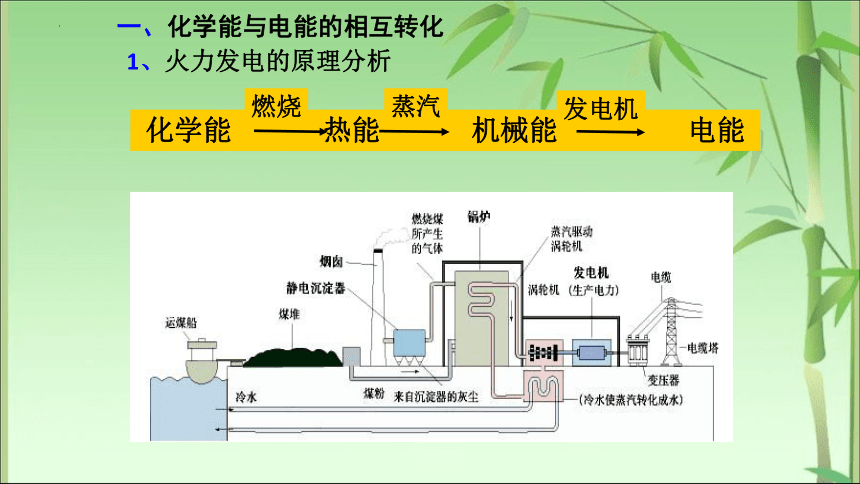
1、火力发电的原理分析
化学能 热能 机械能 电能
燃烧
蒸汽
发电机
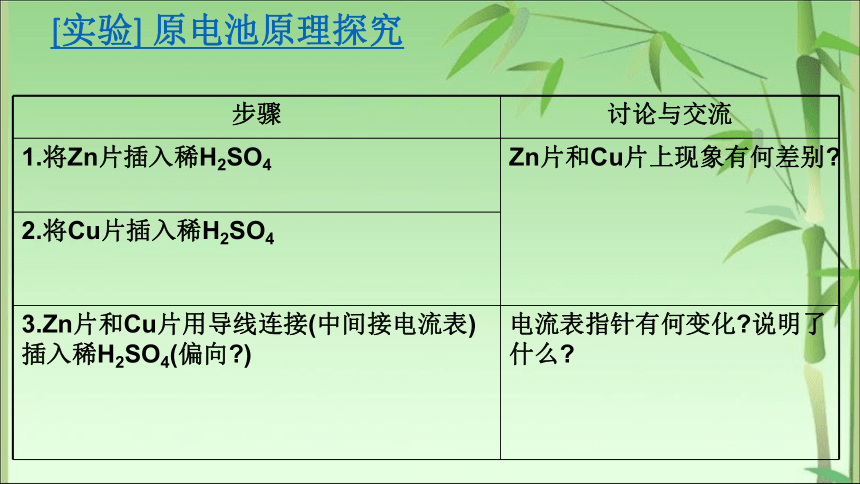
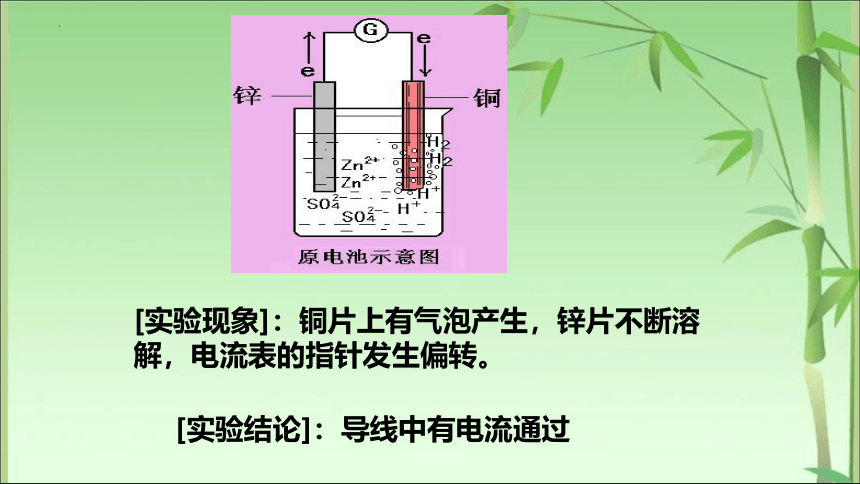
[实验] 原电池原理探究
步骤 讨论与交流
1.将Zn片插入稀H2SO4 Zn片和Cu片上现象有何差别
2.将Cu片插入稀H2SO4 3.Zn片和Cu片用导线连接(中间接电流表)插入稀H2SO4(偏向 ) 电流表指针有何变化 说明了什么
[实验现象]:铜片上有气泡产生,锌片不断溶
解,电流表的指针发生偏转。
[实验结论]:导线中有电流通过
1、定义:把化学能直接转换为电能的装置,叫做原电池。
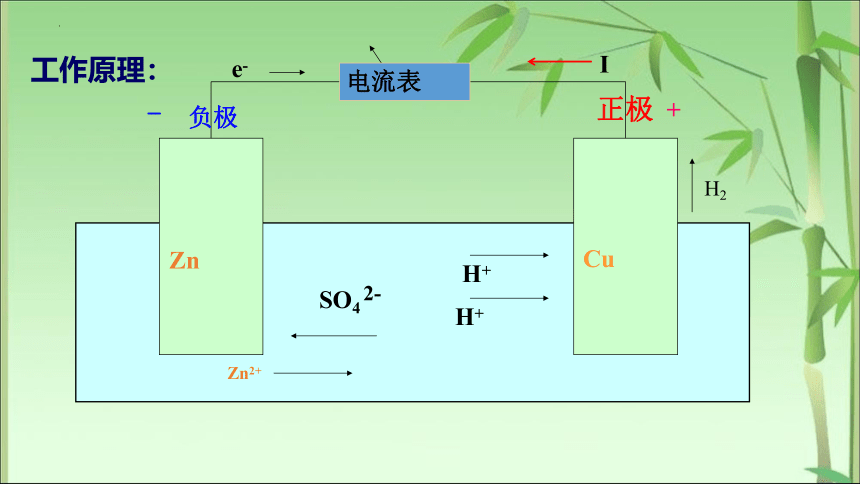
2、原电池的两极及工作原理
电极 电极材料 反应类型 电子流动方向
负极 金属性较强的 氧化反应(失电子) 电子流出(流向正极)的一极
正极 金属性较弱的(或碳棒) 还原反应(得电子) 电子流入(来自负极)的一极
Zn2+
+
负极
正极
-
Zn
Cu
电流表
SO4
2-
H+
H+
e-
I
H2
工作原理:
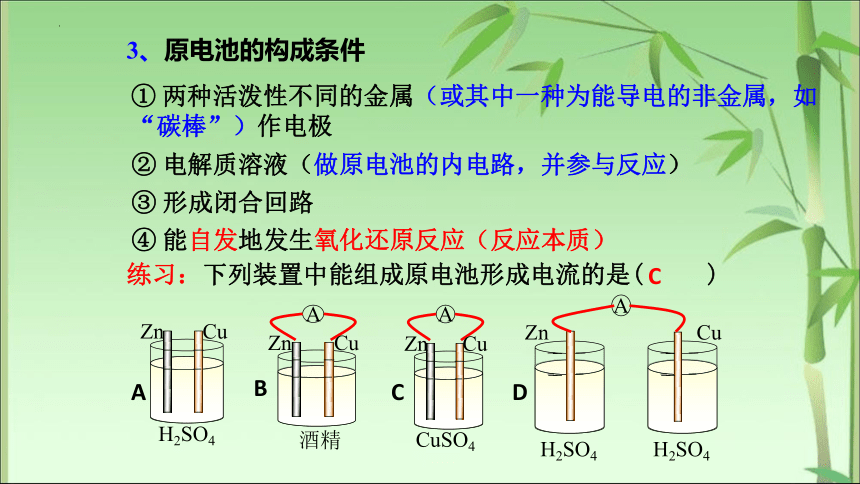
3、原电池的构成条件
① 两种活泼性不同的金属(或其中一种为能导电的非金属,如“碳棒”)作电极
② 电解质溶液(做原电池的内电路,并参与反应)
③ 形成闭合回路
④ 能自发地发生氧化还原反应(反应本质)
练习:下列装置中能组成原电池形成电流的是( )
Zn
Cu
H2SO4
A
Zn
Cu
酒精
A
Zn
Cu
CuSO4
Zn
H2SO4
A
Cu
H2SO4
C
D
B
A
C
4、判断原电池正、负极的方法
①由组成原电池的两极材料判断:
一般是活泼的金属为负极;
活泼性较弱的金属或能导电的非金属为正极
②根据电流方向或电子流动方向判断:
外电路电流由正极流向负极;电子由负极流向正极。
③根据原电池两极发生的变化来判断:
负极总是失电子发生氧化反应;
正极总是得电子发生还原反应。
④根据电解质溶液中的离子流向判断
阴离子移向的一极为负极;
阳离子移向的一极为正极。
⑤根据电极反应现象判断
不断溶解,质量减少为负极;
有气体产生或质量增加或不变为正极。
【练习】
1、下列三个装置中,导线中的电子由左边一极流向右边一极的是( )
B
稀硫酸
Zn
Fe
A
Fe
C
A
稀硫酸
稀硫酸
C
Zn
A
A
B
C
2、如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( )
A
C
A
B
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
D
+
-
-
+
-
+
-
+
5)电极反应
A
H2SO4
-
+
负极:
Zn – 2e- = Zn2+ (氧化反应)
正极:
2H+ +2e- = H2↑ (还原反应)
6)总反应式(电池反应-两个电极反应之和)
Zn + 2H+ = Zn2+ + H2↑
Zn + H2SO4(稀) = ZnSO4 + H2↑
负极:
正极:
Cu2++2e- = Cu
Fe-2e- = Fe2+
总反应:
Fe+Cu2+ = Fe2++Cu
Fe+CuCl2 = FeCl2+Cu
CuCl2
Cu
Fe
A
-
+
【练习】
电极材料 现象 电子得失 原电池的电极 反应类型
总的离子反应方程式(电池反应) 失
得
Zn -2e-= Zn2+
(不是“→”表示)
2H+ + 2e-= H2↑
(不是“→”表示)
负极
正极
Zn+ 2H+ = Zn2+ + H2↑
产生气体
Zn片溶解
Zn片
Cu片
电极反应
氧化反应
还原反应
【实验结论】
导线中有电子通过形成了电流,化学能转变成了电能.
【小结】
5、原电池的应用1)制作化学电源:锌锰电池锂电池氧化银电池2)加快反应速率:例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。ZnCuH2SO4溶液ZnH2SO4溶液Cu、Zn相连,金属之间的电阻远远小于锌与溶液接触部分。故电子顺导线到达Cu表面,H+从Cu表面得到电子变成H2逸出。铜锌之间有电流出现,也就形成了一个电场铜锌之间就有电压,这个电压相当于加速器,加速了电子的得失。3)判断金属活动性的强弱较活泼金属为负极,较不活泼金属(或非金属)为正极先判断原电池的正、负极,金属性:负极>正极2、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )A.a > b > c > d B.a > c > d > bC.c > a > b .> d D.b > d > c > aB【练习】1、X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>XC作业:
(有难度)请根据反应:2Fe3+ + Fe = 3Fe 2+设计原电池,画出装置图、指出正负极、写出电极反应式。
(简单)请根据反应:Fe + CuSO4 = FeSO4+Cu设计原电池,画出装置图、指出正负极、写出电极反应式。
①写出总反应方程式或总反应离子方程式
Fe + CuSO4 = FeSO4+Cu
②将总反应分为氧化反应和还原反应
氧化反应:
还原反应:
Fe-2e- = Fe2+
Cu2++2e- = Cu
③氧化反应发生在负极上;还原反应发生在正极上
负极:
正极:
Fe-2e- = Fe2+
Cu2++2e- = Cu
④验证:两电极反应相加所得式子是否与总反应相同
⑤画出装置图
CuSO4
Cu
Fe
A
-
+
负极 正极 电解质溶液
Fe
Cu、C、Ag
CuSO4
(简单)请根据反应:Fe + CuSO4 = FeSO4+Cu设计原电池,画出装置图、指出正负极、写出电极反应式。
请根据反应:2Fe3++ Fe = 3Fe2+设计原电池,画出装置图、指出正负极、写出电极反应式。1、写电极反应式①写出总反应方程式或总反应离子方程式2Fe3++ Fe = 3Fe2+②将总反应分为氧化反应和还原反应氧化反应:Fe-2e-= Fe2+还原反应:2Fe3++2e-= 2Fe2+③氧化反应发生在负极上;还原反应发生在正极上负极正极④验证:两电极反应相加所得式子是否与总反应相同2、画装置图FeCl3CuFeA-+负极正极电解质溶液FeCu C AgFeCl3Fe(NO3)3Fe2(SO4)3化学能与电能
第二课时 发展中的化学电源
【知识回顾】一、化学能与电能的转换1、原电池1)定义:将化学能转变为电能的装置3)原电池的构成条件①两种活泼性不同的金属作电极(或其中一种为能导电的非金属,如“碳棒”)较活泼金属为负极,较不活泼金属(或非金属)为正极②电解质溶液(做原电池的内电路,并参与反应)③形成闭合回路④能自发地发生氧化还原反应负极失电子、发生氧化反应;正极得电子、发生还原反应。电子从负极经外电路流向正极,从而产生电流,使化学能转变成电能。2)原电池反应原理4)判断原电池正、负极的方法
①由组成原电池的两极材料判断:
一般是活泼性较强的金属为负极;
活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断:
外电路电流由正极流向负极;
电子由负极流向正极。
③根据原电池两极发生的变化来判断:
负极总是失电子发生氧化反应;
正极总是得电子发生还原反应。
CuCl2
Cu
Fe
A
-
+
④根据电解质溶液中的离子流向判断
阴离子移向的一极为负极;
阳离子移向的一极为正极。
⑤根据电极反应现象判断
不断溶解,质量减少为负极;
有气体产生或质量增加或不变为正极。
5)电极反应
A
H2SO4
-
+
负极:
Zn – 2e- = Zn2+ (氧化反应)
正极:
2H+ +2e- = H2↑ (还原反应)
6)总反应式(电池反应-两个电极反应之和)
Zn + 2H+ = Zn2+ + H2↑
Zn + H2SO4(稀) = ZnSO4 + H2↑
负极:
正极:
Cu2++2e- = Cu
Fe-2e- = Fe2+
总反应:
Fe+Cu2+ = Fe2++Cu
Fe+CuCl2 = FeCl2+Cu
CuCl2
Cu
Fe
A
-
+
【练习】
7)原电池原理的应用:
①制作化学电源
②加快反应速率:
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
练习:把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
二、发展中的化学电源
1、干电池–锌锰电池
1)普通锌锰电池–一次性电池
负极材料:
锌筒(Zn)
正极材料:
碳棒(C)
电解质:
NH4Cl糊
负极:
正极:
Zn - 2e- = Zn2+
2NH4+ + 2e- =2NH3 + H2
H2 + 2MnO2 = 2MnO(OH)
碱式氧化锰
总反应:
Zn + 2MnO2 + 2NH4+ = 2MnO(OH) + 2NH3 + Zn2+
Ⅰ.电池的构造:
Ⅱ.电极反应:
Ⅲ.缺点:
普通锌锰干电池用久了锌外壳会变薄,最后内部电解质会泄漏出来,使电器腐蚀
2)碱性锌锰电池–一次性电池
将普通锌锰干电池中的NH4Cl换成KOH或NaOH
负极:
正极:
Zn - 2e-+ 2OH- = Zn(OH)2
2MnO2+2H2O+2e-=2MnO(OH)+2OH-
总反应:
2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)2
Ⅰ.电极反应:
Ⅱ.优点:
延长了锌锰电池的使用寿命与性能
2、充电电池–二次电池
放电时,原电池工作,发生氧化还原反;
充电时,氧化还原反应逆向进行。
1)铅蓄电池
Ⅰ.电池的构造:
负极材料:
正极材料:
电解质:
Pb
PbO2
H2SO4溶液
负极:
正极:
总反应:
Ⅱ.电极反应:
Pb + SO42-- 2e- = PbSO4
PbO2 + 4H+ +SO42- +2e- = PbSO4 + 2H2O
Pb + PbO2 + 4H+ +2SO42- =2PbSO4 + 2H2O
充电
放电
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
Ⅲ.特点:
铅蓄电池的工作电压平稳、使用温度及使用电流范围宽、能充放电数百个循环、贮存性能好、造价较低,因而应用广泛。但是比能量(单位重量所蓄电能)小,对环境腐蚀性强。
2)镍镉电池
负极材料:
正极材料:
电解质:
Cd
NiO(OH)
KOH
负极:
正极:
Cd - 2e-+2OH-=Cd(OH)2
2NiO(OH)+2e- +2H2O=2Ni(OH)2+2OH-
使用寿命比铅蓄电池长,体积小,但会严重污染环境
3、燃料电池
它是一种将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能的高效、环境友好的发电装置
燃料电池由3个主要部分组成:
燃料电极(负极) ;电解液 ;空气/氧气电极(正极)
1)氢氧燃料电池
工作时向负极供给燃料(H2),向正极供给氧化剂(空气/O2).H2在负极分解成H+和电子e-。H+进入电解液中,而电子则沿外部电路移向正极。在正极上,O2得电子。
电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等
Ⅰ.电解液为碱性溶液(如KOH)
2H2 + 4OH-- 4e-= 4H2O
O2 + 2H2O + 4e-= 4OH-
负极:
正极:
总反应:
2H2 + O2 = 2H2O
Ⅱ.电解液为酸性溶液(如H2SO4)
负极:
正极:
总反应:
2H2 - 4e-=4H+
O2 + 4H+ +4e-= 2H2O
2H2 + O2 = 2H2O
2)氢氧燃料电池的特点
①能量转化效率高
②污染很小
③燃料适用范围广
④需要持续供应反应物
KOH溶液
H2
O2
H2O
a b
1、写出甲烷燃料电池(电解质溶液为氢氧化钾溶液)的电极反应式及总方程式:
【练习】
负极:CH4 + 10OH--8e- =CO32- + 7H2O
正极:2O2 + 8e- + 4H2O = 8OH-
总反应: CH4+2O2+2OH-=CO32-+3H2O
2、1969年美国“阿波罗11号”登月成功。飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。
1、a是 极,
b是 极
2、电极反应式分别为:
负
正
正极: O2+ 4e- + 2H2O = 4OH-
负极: 2H2 - 4e- + 4OH-= 4H2O
4)揭示金属腐蚀的原因及防止金属的腐蚀。(个人觉得可以选修4再讲)钢铁中含有碳,C与Fe若接触电解质溶液,可组成原电池,发生原电池反应而使钢铁遭到腐蚀。①金属的腐蚀Ⅰ.定义:金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。Ⅱ.分类:化学腐蚀:金属跟接触到的物质直接发生氧化还原反应而引起的腐蚀。这类腐蚀不普遍。电化学腐蚀:不纯金属或合金跟电解质溶液接触时,因发生原电池反应所引起的腐蚀。金属的腐蚀主要是电化学腐蚀。②钢铁的腐蚀电化学腐蚀主要包括吸氧腐蚀和析氢腐蚀Ⅰ.钢铁的析氢腐蚀FeC电解质溶液FeC电解质溶液钢铁在干燥的空气里长时间不易腐蚀,但潮湿的空气中却很快就会腐蚀。原来,在潮湿的空气里,钢铁的表面吸附了一层薄薄的水膜,这层水膜里含有少量的氢离子与氢氧根离子,还溶解了O2、CO2等气体,结果在钢铁表面形成了一层电解质溶液,它跟钢铁里的铁和少量的碳恰好形成无数微小的原电池。酸性较强弱酸性或中性负极(Fe):Fe - 2e-=Fe2+正极(C):2H++ 2e-= H2↑Ⅱ.钢铁的吸氧腐蚀负极(Fe):2Fe - 4e-= 2Fe2+正极(C):2H2O + O2+ 4e-= 4OH-总反应:2Fe + O2+ 2H2O =2Fe(OH)24Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3=Fe2O3+3H2O钢铁制品在大气中的腐蚀主要是吸氧腐蚀③金属的防腐Ⅰ.改变金属的内部结构例如制造各种耐腐蚀的合金,如在普通钢铁中加入铬、镍等制成不锈钢Ⅱ.在金属表面覆盖保护层a.在钢铁制件表面涂上机油、凡士林、油漆或覆盖搪瓷、塑料等耐腐蚀的非金属材料。b.用电镀、热镀、喷镀等方法,在钢铁表面镀上一层不易被腐蚀的金属,如锌、锡、铬、镍等。c.用化学方法使钢铁表面生成致密的氧化膜。如在机器零件、枪炮表面形成一层细密的Fe3O4薄膜等。Ⅲ.电化学保护法将活泼金属(如锌或锌的合金)连接在被保护的金属上,当发生电化腐蚀时,这种活泼金属作为负极发生氧化反应,因而减小或防止被保护金属的腐蚀。在钢铁的表面焊接比Fe更活泼的金属(如Zn),组成原电池后,使Fe成为原电池的正极而得到保护。【练习】1.下列实验室制取少量气体的方法最好的是( )A、加热高锰酸钾溶液制取氧气B、用碳酸钙和稀硫酸制取二氧化碳C、用纯锌和稀硫酸制取氢气D、用粗锌和稀硫酸制取氢气D2.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是()A、SnB、ZnC、CuD、AgB3.对于锌-铜-稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )①锌片溶解了32.5g ②锌片增加了32.5g③铜片上析出1g氢气 ④铜片上析出2 g氢气A.①和③B.①和④C.②和③D.②和④A
化学能与电能
第一课时 化学能转化为电能
格林太太有两颗假牙,一颗是黄金的——这是她财富的标志;另一颗是不锈钢的——这是一次车祸留下的痕迹。令人百思不解的是自从那可怕的车祸后,格林太太就经常头疼、夜间失眠、心情烦躁。四处求医也没能治好 ,后来一位年轻化学家上门了解了一下情况很快的解决了问题。
请你当回医生
风能,水能,煤炭,石油,天然气
直接从自然界取得的能源称为一次能源
一次能源经加工、转换得到的能源称为二次能源
电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称为电力。
2001年我国发电总量构成图
火力发电占据绝大部分
估计在2050年火电仍居首位
火电,又称为火力发电。那么,火究竟是如何转化为电?
一、化学能与电能的相互转化
1、火力发电的原理分析
化学能 热能 机械能 电能
燃烧
蒸汽
发电机
[实验] 原电池原理探究
步骤 讨论与交流
1.将Zn片插入稀H2SO4 Zn片和Cu片上现象有何差别
2.将Cu片插入稀H2SO4 3.Zn片和Cu片用导线连接(中间接电流表)插入稀H2SO4(偏向 ) 电流表指针有何变化 说明了什么
[实验现象]:铜片上有气泡产生,锌片不断溶
解,电流表的指针发生偏转。
[实验结论]:导线中有电流通过
1、定义:把化学能直接转换为电能的装置,叫做原电池。
2、原电池的两极及工作原理
电极 电极材料 反应类型 电子流动方向
负极 金属性较强的 氧化反应(失电子) 电子流出(流向正极)的一极
正极 金属性较弱的(或碳棒) 还原反应(得电子) 电子流入(来自负极)的一极
Zn2+
+
负极
正极
-
Zn
Cu
电流表
SO4
2-
H+
H+
e-
I
H2
工作原理:
3、原电池的构成条件
① 两种活泼性不同的金属(或其中一种为能导电的非金属,如“碳棒”)作电极
② 电解质溶液(做原电池的内电路,并参与反应)
③ 形成闭合回路
④ 能自发地发生氧化还原反应(反应本质)
练习:下列装置中能组成原电池形成电流的是( )
Zn
Cu
H2SO4
A
Zn
Cu
酒精
A
Zn
Cu
CuSO4
Zn
H2SO4
A
Cu
H2SO4
C
D
B
A
C
4、判断原电池正、负极的方法
①由组成原电池的两极材料判断:
一般是活泼的金属为负极;
活泼性较弱的金属或能导电的非金属为正极
②根据电流方向或电子流动方向判断:
外电路电流由正极流向负极;电子由负极流向正极。
③根据原电池两极发生的变化来判断:
负极总是失电子发生氧化反应;
正极总是得电子发生还原反应。
④根据电解质溶液中的离子流向判断
阴离子移向的一极为负极;
阳离子移向的一极为正极。
⑤根据电极反应现象判断
不断溶解,质量减少为负极;
有气体产生或质量增加或不变为正极。
【练习】
1、下列三个装置中,导线中的电子由左边一极流向右边一极的是( )
B
稀硫酸
Zn
Fe
A
Fe
C
A
稀硫酸
稀硫酸
C
Zn
A
A
B
C
2、如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( )
A
C
A
B
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
D
+
-
-
+
-
+
-
+
5)电极反应
A
H2SO4
-
+
负极:
Zn – 2e- = Zn2+ (氧化反应)
正极:
2H+ +2e- = H2↑ (还原反应)
6)总反应式(电池反应-两个电极反应之和)
Zn + 2H+ = Zn2+ + H2↑
Zn + H2SO4(稀) = ZnSO4 + H2↑
负极:
正极:
Cu2++2e- = Cu
Fe-2e- = Fe2+
总反应:
Fe+Cu2+ = Fe2++Cu
Fe+CuCl2 = FeCl2+Cu
CuCl2
Cu
Fe
A
-
+
【练习】
电极材料 现象 电子得失 原电池的电极 反应类型
总的离子反应方程式(电池反应) 失
得
Zn -2e-= Zn2+
(不是“→”表示)
2H+ + 2e-= H2↑
(不是“→”表示)
负极
正极
Zn+ 2H+ = Zn2+ + H2↑
产生气体
Zn片溶解
Zn片
Cu片
电极反应
氧化反应
还原反应
【实验结论】
导线中有电子通过形成了电流,化学能转变成了电能.
【小结】
5、原电池的应用1)制作化学电源:锌锰电池锂电池氧化银电池2)加快反应速率:例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。ZnCuH2SO4溶液ZnH2SO4溶液Cu、Zn相连,金属之间的电阻远远小于锌与溶液接触部分。故电子顺导线到达Cu表面,H+从Cu表面得到电子变成H2逸出。铜锌之间有电流出现,也就形成了一个电场铜锌之间就有电压,这个电压相当于加速器,加速了电子的得失。3)判断金属活动性的强弱较活泼金属为负极,较不活泼金属(或非金属)为正极先判断原电池的正、负极,金属性:负极>正极2、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )A.a > b > c > d B.a > c > d > bC.c > a > b .> d D.b > d > c > aB【练习】1、X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>XC作业:
(有难度)请根据反应:2Fe3+ + Fe = 3Fe 2+设计原电池,画出装置图、指出正负极、写出电极反应式。
(简单)请根据反应:Fe + CuSO4 = FeSO4+Cu设计原电池,画出装置图、指出正负极、写出电极反应式。
①写出总反应方程式或总反应离子方程式
Fe + CuSO4 = FeSO4+Cu
②将总反应分为氧化反应和还原反应
氧化反应:
还原反应:
Fe-2e- = Fe2+
Cu2++2e- = Cu
③氧化反应发生在负极上;还原反应发生在正极上
负极:
正极:
Fe-2e- = Fe2+
Cu2++2e- = Cu
④验证:两电极反应相加所得式子是否与总反应相同
⑤画出装置图
CuSO4
Cu
Fe
A
-
+
负极 正极 电解质溶液
Fe
Cu、C、Ag
CuSO4
(简单)请根据反应:Fe + CuSO4 = FeSO4+Cu设计原电池,画出装置图、指出正负极、写出电极反应式。
请根据反应:2Fe3++ Fe = 3Fe2+设计原电池,画出装置图、指出正负极、写出电极反应式。1、写电极反应式①写出总反应方程式或总反应离子方程式2Fe3++ Fe = 3Fe2+②将总反应分为氧化反应和还原反应氧化反应:Fe-2e-= Fe2+还原反应:2Fe3++2e-= 2Fe2+③氧化反应发生在负极上;还原反应发生在正极上负极正极④验证:两电极反应相加所得式子是否与总反应相同2、画装置图FeCl3CuFeA-+负极正极电解质溶液FeCu C AgFeCl3Fe(NO3)3Fe2(SO4)3化学能与电能
第二课时 发展中的化学电源
【知识回顾】一、化学能与电能的转换1、原电池1)定义:将化学能转变为电能的装置3)原电池的构成条件①两种活泼性不同的金属作电极(或其中一种为能导电的非金属,如“碳棒”)较活泼金属为负极,较不活泼金属(或非金属)为正极②电解质溶液(做原电池的内电路,并参与反应)③形成闭合回路④能自发地发生氧化还原反应负极失电子、发生氧化反应;正极得电子、发生还原反应。电子从负极经外电路流向正极,从而产生电流,使化学能转变成电能。2)原电池反应原理4)判断原电池正、负极的方法
①由组成原电池的两极材料判断:
一般是活泼性较强的金属为负极;
活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断:
外电路电流由正极流向负极;
电子由负极流向正极。
③根据原电池两极发生的变化来判断:
负极总是失电子发生氧化反应;
正极总是得电子发生还原反应。
CuCl2
Cu
Fe
A
-
+
④根据电解质溶液中的离子流向判断
阴离子移向的一极为负极;
阳离子移向的一极为正极。
⑤根据电极反应现象判断
不断溶解,质量减少为负极;
有气体产生或质量增加或不变为正极。
5)电极反应
A
H2SO4
-
+
负极:
Zn – 2e- = Zn2+ (氧化反应)
正极:
2H+ +2e- = H2↑ (还原反应)
6)总反应式(电池反应-两个电极反应之和)
Zn + 2H+ = Zn2+ + H2↑
Zn + H2SO4(稀) = ZnSO4 + H2↑
负极:
正极:
Cu2++2e- = Cu
Fe-2e- = Fe2+
总反应:
Fe+Cu2+ = Fe2++Cu
Fe+CuCl2 = FeCl2+Cu
CuCl2
Cu
Fe
A
-
+
【练习】
7)原电池原理的应用:
①制作化学电源
②加快反应速率:
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
练习:把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
二、发展中的化学电源
1、干电池–锌锰电池
1)普通锌锰电池–一次性电池
负极材料:
锌筒(Zn)
正极材料:
碳棒(C)
电解质:
NH4Cl糊
负极:
正极:
Zn - 2e- = Zn2+
2NH4+ + 2e- =2NH3 + H2
H2 + 2MnO2 = 2MnO(OH)
碱式氧化锰
总反应:
Zn + 2MnO2 + 2NH4+ = 2MnO(OH) + 2NH3 + Zn2+
Ⅰ.电池的构造:
Ⅱ.电极反应:
Ⅲ.缺点:
普通锌锰干电池用久了锌外壳会变薄,最后内部电解质会泄漏出来,使电器腐蚀
2)碱性锌锰电池–一次性电池
将普通锌锰干电池中的NH4Cl换成KOH或NaOH
负极:
正极:
Zn - 2e-+ 2OH- = Zn(OH)2
2MnO2+2H2O+2e-=2MnO(OH)+2OH-
总反应:
2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)2
Ⅰ.电极反应:
Ⅱ.优点:
延长了锌锰电池的使用寿命与性能
2、充电电池–二次电池
放电时,原电池工作,发生氧化还原反;
充电时,氧化还原反应逆向进行。
1)铅蓄电池
Ⅰ.电池的构造:
负极材料:
正极材料:
电解质:
Pb
PbO2
H2SO4溶液
负极:
正极:
总反应:
Ⅱ.电极反应:
Pb + SO42-- 2e- = PbSO4
PbO2 + 4H+ +SO42- +2e- = PbSO4 + 2H2O
Pb + PbO2 + 4H+ +2SO42- =2PbSO4 + 2H2O
充电
放电
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
Ⅲ.特点:
铅蓄电池的工作电压平稳、使用温度及使用电流范围宽、能充放电数百个循环、贮存性能好、造价较低,因而应用广泛。但是比能量(单位重量所蓄电能)小,对环境腐蚀性强。
2)镍镉电池
负极材料:
正极材料:
电解质:
Cd
NiO(OH)
KOH
负极:
正极:
Cd - 2e-+2OH-=Cd(OH)2
2NiO(OH)+2e- +2H2O=2Ni(OH)2+2OH-
使用寿命比铅蓄电池长,体积小,但会严重污染环境
3、燃料电池
它是一种将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能的高效、环境友好的发电装置
燃料电池由3个主要部分组成:
燃料电极(负极) ;电解液 ;空气/氧气电极(正极)
1)氢氧燃料电池
工作时向负极供给燃料(H2),向正极供给氧化剂(空气/O2).H2在负极分解成H+和电子e-。H+进入电解液中,而电子则沿外部电路移向正极。在正极上,O2得电子。
电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等
Ⅰ.电解液为碱性溶液(如KOH)
2H2 + 4OH-- 4e-= 4H2O
O2 + 2H2O + 4e-= 4OH-
负极:
正极:
总反应:
2H2 + O2 = 2H2O
Ⅱ.电解液为酸性溶液(如H2SO4)
负极:
正极:
总反应:
2H2 - 4e-=4H+
O2 + 4H+ +4e-= 2H2O
2H2 + O2 = 2H2O
2)氢氧燃料电池的特点
①能量转化效率高
②污染很小
③燃料适用范围广
④需要持续供应反应物
KOH溶液
H2
O2
H2O
a b
1、写出甲烷燃料电池(电解质溶液为氢氧化钾溶液)的电极反应式及总方程式:
【练习】
负极:CH4 + 10OH--8e- =CO32- + 7H2O
正极:2O2 + 8e- + 4H2O = 8OH-
总反应: CH4+2O2+2OH-=CO32-+3H2O
2、1969年美国“阿波罗11号”登月成功。飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。
1、a是 极,
b是 极
2、电极反应式分别为:
负
正
正极: O2+ 4e- + 2H2O = 4OH-
负极: 2H2 - 4e- + 4OH-= 4H2O
4)揭示金属腐蚀的原因及防止金属的腐蚀。(个人觉得可以选修4再讲)钢铁中含有碳,C与Fe若接触电解质溶液,可组成原电池,发生原电池反应而使钢铁遭到腐蚀。①金属的腐蚀Ⅰ.定义:金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。Ⅱ.分类:化学腐蚀:金属跟接触到的物质直接发生氧化还原反应而引起的腐蚀。这类腐蚀不普遍。电化学腐蚀:不纯金属或合金跟电解质溶液接触时,因发生原电池反应所引起的腐蚀。金属的腐蚀主要是电化学腐蚀。②钢铁的腐蚀电化学腐蚀主要包括吸氧腐蚀和析氢腐蚀Ⅰ.钢铁的析氢腐蚀FeC电解质溶液FeC电解质溶液钢铁在干燥的空气里长时间不易腐蚀,但潮湿的空气中却很快就会腐蚀。原来,在潮湿的空气里,钢铁的表面吸附了一层薄薄的水膜,这层水膜里含有少量的氢离子与氢氧根离子,还溶解了O2、CO2等气体,结果在钢铁表面形成了一层电解质溶液,它跟钢铁里的铁和少量的碳恰好形成无数微小的原电池。酸性较强弱酸性或中性负极(Fe):Fe - 2e-=Fe2+正极(C):2H++ 2e-= H2↑Ⅱ.钢铁的吸氧腐蚀负极(Fe):2Fe - 4e-= 2Fe2+正极(C):2H2O + O2+ 4e-= 4OH-总反应:2Fe + O2+ 2H2O =2Fe(OH)24Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3=Fe2O3+3H2O钢铁制品在大气中的腐蚀主要是吸氧腐蚀③金属的防腐Ⅰ.改变金属的内部结构例如制造各种耐腐蚀的合金,如在普通钢铁中加入铬、镍等制成不锈钢Ⅱ.在金属表面覆盖保护层a.在钢铁制件表面涂上机油、凡士林、油漆或覆盖搪瓷、塑料等耐腐蚀的非金属材料。b.用电镀、热镀、喷镀等方法,在钢铁表面镀上一层不易被腐蚀的金属,如锌、锡、铬、镍等。c.用化学方法使钢铁表面生成致密的氧化膜。如在机器零件、枪炮表面形成一层细密的Fe3O4薄膜等。Ⅲ.电化学保护法将活泼金属(如锌或锌的合金)连接在被保护的金属上,当发生电化腐蚀时,这种活泼金属作为负极发生氧化反应,因而减小或防止被保护金属的腐蚀。在钢铁的表面焊接比Fe更活泼的金属(如Zn),组成原电池后,使Fe成为原电池的正极而得到保护。【练习】1.下列实验室制取少量气体的方法最好的是( )A、加热高锰酸钾溶液制取氧气B、用碳酸钙和稀硫酸制取二氧化碳C、用纯锌和稀硫酸制取氢气D、用粗锌和稀硫酸制取氢气D2.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是()A、SnB、ZnC、CuD、AgB3.对于锌-铜-稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )①锌片溶解了32.5g ②锌片增加了32.5g③铜片上析出1g氢气 ④铜片上析出2 g氢气A.①和③B.①和④C.②和③D.②和④A
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
