第一章第一节反应热第1课时课件(共19张PPT)高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 第一章第一节反应热第1课时课件(共19张PPT)高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-12 19:57:31 | ||
图片预览






文档简介
(共19张PPT)
第一节 反应热(第1课时)
第一章 化学反应的热效应
一、导入新课
热量的释放或吸收是化学反应中能量变化的常见形式。
那么,在实际应用中,人们如何定量地描述化学反应过程中释放或吸收的热量呢?
一、导入新课
化学反应的本质
从物质的角度:
从微粒的角度:
从化学键的角度:
从能量的角度:
有新物质生成
原子重新组合的过程
旧键的断裂和新键的形成
释放或贮存能量的过程
二、讲授新课
为什么化学反应中会有能量的变化?
宏观:
反应物和生成物所具有的能量不同;
微观:
从化学键的角度看化学反应是怎样发生的?与能量有什么关系?
知识回顾
化学反应与热能
二、讲授新课
(1)微观
化学反应的实质
旧键断裂 新键形成
吸收能量 放出能量
E吸
E放
E吸>E放:化学反应为吸热反应
E吸(2)宏观
化学反应的实质
反应物 生成物
自身能量
E反
E生
E反>E生:化学反应为放热反应
E反反应能量变化的主要原因
物质自身能量越低,越稳定
二、讲授新课
1.宏观上,反应物和生成物的总能量通常不相等,当反应物的总能量大于生成物的总能量时,化学能转化为其他形式的能量释放出来。当反应物的总能量小于生成物的总能量时,化学反应将其他形式的能量转化为化学能储存起来。所以化学反应过程中总会伴随着能量的变化。
2.微观上,化学键的角度看化学反应包含两个过程:旧的化学键断裂和新的化学键形成。断开的化学键需要吸收能量,形成的化学键需要释放能量,断开化学键吸收的能量和形成化学键释放的能量通常不相等。
讨论交流
二、讲授新课
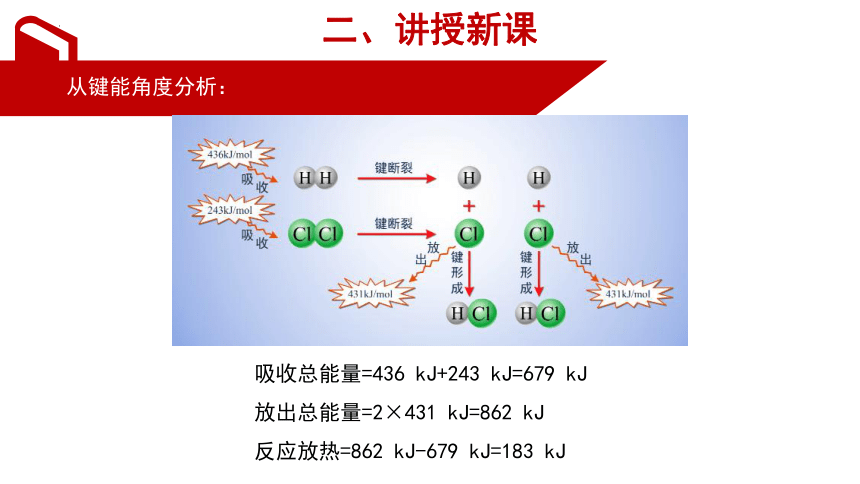
从键能角度分析:
吸收总能量=436 kJ+243 kJ=679 kJ
放出总能量=2×431 kJ=862 kJ
反应放热=862 kJ-679 kJ=183 kJ
二、讲授新课
1.反应热:
在一定的温度下进行的反应所释放或吸收的热量称为该反应在此温度下的热效应,简称为反应热。
符号:△H
单位:kJ/mol
反应热、焓变
2.焓变:
H称为“焓”,是与物质内能有关的物理量,生成物与反应物的焓值差△H称为“焓变”,数值上等于某反应恒压条件下的反应热。
二、讲授新课
焓是与物质的内能有关的一个物理量,但它又不同于物质的内能。单位为kJ/mol,不可以测量。化学研究表明,对于在等压条件下进行的化学反应,如果反应中物质的能量变化全部转化为热能(同时可能伴随着反应体系体积的改变),而没有转化为电能、光能等其他形式的能,则该反应的反应热就等于反应前后物质的焓的变化,即焓变。因此,可用焓变代替反应热。
二、讲授新课
提示:把化学反应中的反应物和生成物称为反应体系,而把除它们之外的物质称为环境。
放热反应:体系 环境
△H<0 Q>0
吸热反应:体系 环境
△H> 0 Q<0
二、讲授新课
放热反应:
吸热反应:
ΔH<0或 ΔH 为“-”
ΔH>0 或ΔH 为“+”
二、讲授新课
化学反应过程中既有物质变化,同时又总是伴随着能量的变化。在我们以前所学的化学反应中有哪些是放热反应?有哪些是吸热反应?
(1)放热反应
①物质与O2的氧化反应(燃烧,生锈等)
②中和反应(酸碱)
③金属与水或酸的反应
④绝大多数化合反应(CaO与H2O)
⑤铝热反应,如:2Al + Fe2O3 Al2O3 + 2Fe
高温
⑥少数分解反应,如:2H2O2 2H2O + O2↑
MnO2
二、讲授新课
(2)吸热反应
①绝大多数分解反应,如:NH4Cl NH3↑+HCl↑
②少数化合反应,如:C + CO2 2CO
高温
③Ba(OH)2·8H2O与NH4Cl晶体的反应
④C + H2O(g) CO + H2
高温
注意:一个化学反应是吸热反应还是放热反应,与反应条件(如点燃、加热、高温等)没有直接关系
二、讲授新课
化学反应是放热还是吸热到底取决于什么呢?
讨论交流
宏观上:所有反应物和生成物的总能量的相对大小;
微观上:所有断键吸收的总能量与所有新键形成放出总能量的相对大小。
吸、放热反应的两种判断方法
(1)定性判断(宏观):
若反应物的总能量>生成物的总能量,则为放热反应;反之,则为吸热反应。
(2)定量计算(微观):
△H=反应物的键能之和生成物的键能之和
当△H<0时为放热反应,△H>0时为吸热反应。
二、讲授新课
【思考交流】已知:H2+F2=2HF H2+Cl2=2HCl
预测当生成2 mol HF和2 mol HCl时,哪个反应放出的热量多?
化学键 H-H F-F Cl-Cl H-F H-Cl
键能/(kJ/mol) 436 155 243 565 431
因为F2 比Cl2 活泼,能量高,生成HF放出的热量多,并且HF比HCl稳定,具有的能量低。
三、课堂练习
1.下列反应属于吸热反应的是( )
A. C6H12O6 + 6O2 6CO2 + 6H2O
B. CH3COOH+ KOH=CH3COOK+ H2O
C. A+B=C+D H<0
D.破坏生成物全部化学键所需要的能量小于破坏反应物全部化学键所需要的能量
酶
D
三、课堂练习
2.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(单位:kJ·mol-1):P-P:198;P-O:360;O=O:498。则反应P4(s,白磷)+3O2(g)=P4O6(s)的焓变 H为( )
A.-1638 kJ·mol-1 B.+1638 kJ·mol-1 C.-126 kJ·mol-1 D.+126 kJ·mol-1
A
四、课堂小结
反应热
焓变
概念
符号
单位
表示方法
判断方法
定 义
再 见
第一节 反应热(第1课时)
第一章 化学反应的热效应
一、导入新课
热量的释放或吸收是化学反应中能量变化的常见形式。
那么,在实际应用中,人们如何定量地描述化学反应过程中释放或吸收的热量呢?
一、导入新课
化学反应的本质
从物质的角度:
从微粒的角度:
从化学键的角度:
从能量的角度:
有新物质生成
原子重新组合的过程
旧键的断裂和新键的形成
释放或贮存能量的过程
二、讲授新课
为什么化学反应中会有能量的变化?
宏观:
反应物和生成物所具有的能量不同;
微观:
从化学键的角度看化学反应是怎样发生的?与能量有什么关系?
知识回顾
化学反应与热能
二、讲授新课
(1)微观
化学反应的实质
旧键断裂 新键形成
吸收能量 放出能量
E吸
E放
E吸>E放:化学反应为吸热反应
E吸
化学反应的实质
反应物 生成物
自身能量
E反
E生
E反>E生:化学反应为放热反应
E反
物质自身能量越低,越稳定
二、讲授新课
1.宏观上,反应物和生成物的总能量通常不相等,当反应物的总能量大于生成物的总能量时,化学能转化为其他形式的能量释放出来。当反应物的总能量小于生成物的总能量时,化学反应将其他形式的能量转化为化学能储存起来。所以化学反应过程中总会伴随着能量的变化。
2.微观上,化学键的角度看化学反应包含两个过程:旧的化学键断裂和新的化学键形成。断开的化学键需要吸收能量,形成的化学键需要释放能量,断开化学键吸收的能量和形成化学键释放的能量通常不相等。
讨论交流
二、讲授新课
从键能角度分析:
吸收总能量=436 kJ+243 kJ=679 kJ
放出总能量=2×431 kJ=862 kJ
反应放热=862 kJ-679 kJ=183 kJ
二、讲授新课
1.反应热:
在一定的温度下进行的反应所释放或吸收的热量称为该反应在此温度下的热效应,简称为反应热。
符号:△H
单位:kJ/mol
反应热、焓变
2.焓变:
H称为“焓”,是与物质内能有关的物理量,生成物与反应物的焓值差△H称为“焓变”,数值上等于某反应恒压条件下的反应热。
二、讲授新课
焓是与物质的内能有关的一个物理量,但它又不同于物质的内能。单位为kJ/mol,不可以测量。化学研究表明,对于在等压条件下进行的化学反应,如果反应中物质的能量变化全部转化为热能(同时可能伴随着反应体系体积的改变),而没有转化为电能、光能等其他形式的能,则该反应的反应热就等于反应前后物质的焓的变化,即焓变。因此,可用焓变代替反应热。
二、讲授新课
提示:把化学反应中的反应物和生成物称为反应体系,而把除它们之外的物质称为环境。
放热反应:体系 环境
△H<0 Q>0
吸热反应:体系 环境
△H> 0 Q<0
二、讲授新课
放热反应:
吸热反应:
ΔH<0或 ΔH 为“-”
ΔH>0 或ΔH 为“+”
二、讲授新课
化学反应过程中既有物质变化,同时又总是伴随着能量的变化。在我们以前所学的化学反应中有哪些是放热反应?有哪些是吸热反应?
(1)放热反应
①物质与O2的氧化反应(燃烧,生锈等)
②中和反应(酸碱)
③金属与水或酸的反应
④绝大多数化合反应(CaO与H2O)
⑤铝热反应,如:2Al + Fe2O3 Al2O3 + 2Fe
高温
⑥少数分解反应,如:2H2O2 2H2O + O2↑
MnO2
二、讲授新课
(2)吸热反应
①绝大多数分解反应,如:NH4Cl NH3↑+HCl↑
②少数化合反应,如:C + CO2 2CO
高温
③Ba(OH)2·8H2O与NH4Cl晶体的反应
④C + H2O(g) CO + H2
高温
注意:一个化学反应是吸热反应还是放热反应,与反应条件(如点燃、加热、高温等)没有直接关系
二、讲授新课
化学反应是放热还是吸热到底取决于什么呢?
讨论交流
宏观上:所有反应物和生成物的总能量的相对大小;
微观上:所有断键吸收的总能量与所有新键形成放出总能量的相对大小。
吸、放热反应的两种判断方法
(1)定性判断(宏观):
若反应物的总能量>生成物的总能量,则为放热反应;反之,则为吸热反应。
(2)定量计算(微观):
△H=反应物的键能之和生成物的键能之和
当△H<0时为放热反应,△H>0时为吸热反应。
二、讲授新课
【思考交流】已知:H2+F2=2HF H2+Cl2=2HCl
预测当生成2 mol HF和2 mol HCl时,哪个反应放出的热量多?
化学键 H-H F-F Cl-Cl H-F H-Cl
键能/(kJ/mol) 436 155 243 565 431
因为F2 比Cl2 活泼,能量高,生成HF放出的热量多,并且HF比HCl稳定,具有的能量低。
三、课堂练习
1.下列反应属于吸热反应的是( )
A. C6H12O6 + 6O2 6CO2 + 6H2O
B. CH3COOH+ KOH=CH3COOK+ H2O
C. A+B=C+D H<0
D.破坏生成物全部化学键所需要的能量小于破坏反应物全部化学键所需要的能量
酶
D
三、课堂练习
2.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(单位:kJ·mol-1):P-P:198;P-O:360;O=O:498。则反应P4(s,白磷)+3O2(g)=P4O6(s)的焓变 H为( )
A.-1638 kJ·mol-1 B.+1638 kJ·mol-1 C.-126 kJ·mol-1 D.+126 kJ·mol-1
A
四、课堂小结
反应热
焓变
概念
符号
单位
表示方法
判断方法
定 义
再 见
