2022-2023学年鲁科版高中化学必修二 微项目 海带提碘与海水提溴(共19张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学必修二 微项目 海带提碘与海水提溴(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 00:00:00 | ||
图片预览



文档简介
(共19张PPT)
鲁科版必修第二册
第1章 原子结构 元素周期律
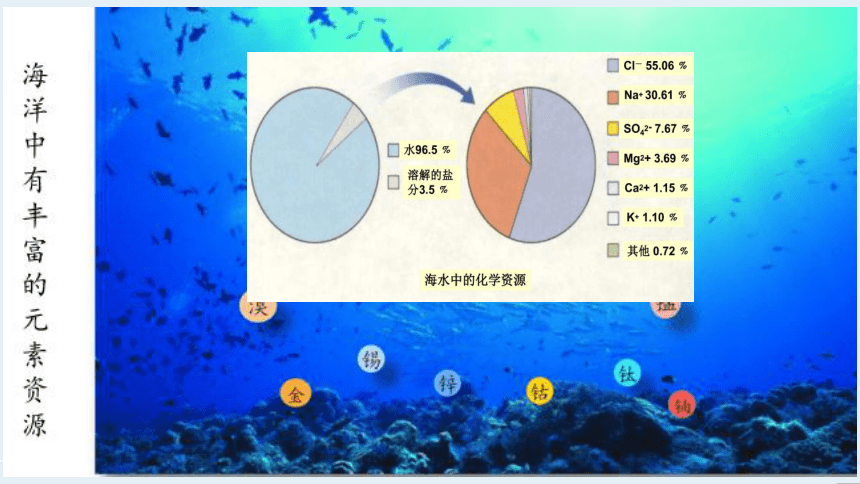
微项目 海带提碘与海水提溴
——体验元素性质递变规律的实际应用
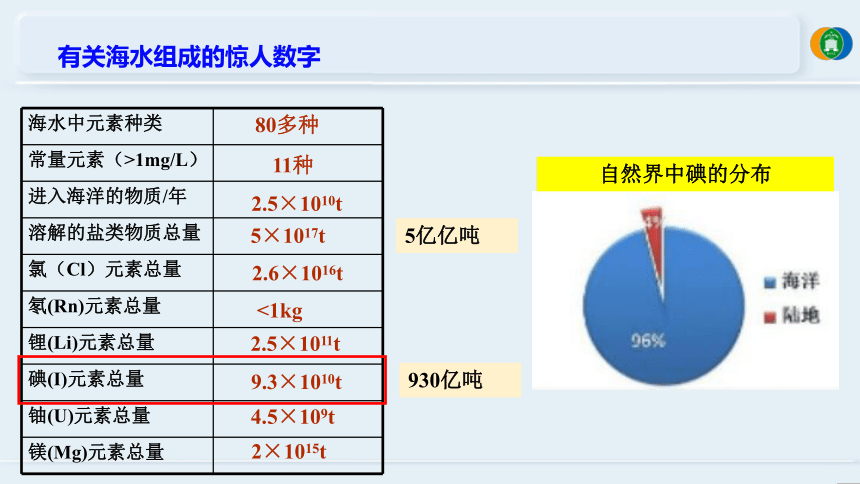
有关海水组成的惊人数字
海水中元素种类
常量元素(>1mg/L)
进入海洋的物质/年
溶解的盐类物质总量
氯(Cl)元素总量
氡(Rn)元素总量
锂(Li)元素总量
碘(I)元素总量
铀(U)元素总量
镁(Mg)元素总量
80多种
11种
2.5×1010t
5×1017t
2.6×1016t
<1kg
2.5×1011t
9.3×1010t
4.5×109t
2×1015t
自然界中碘的分布
5亿亿吨
930亿吨
我们身边的碘
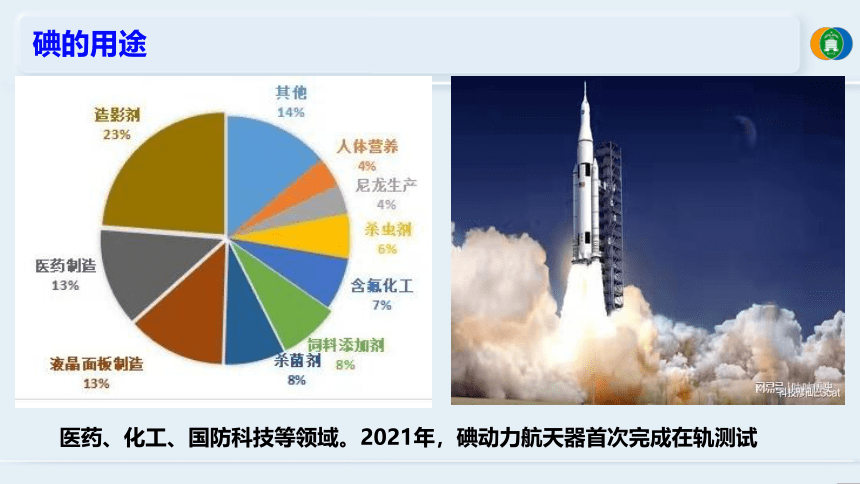
碘的用途
医药、化工、国防科技等领域。2021年,碘动力航天器首次完成在轨测试
元素 氯 溴 碘
总量 26000万亿吨 95万亿吨 930亿吨
元素 氯 溴 碘
总量 19.10g/kg 67mg/L 0.06mg/L
海洋中的总量
海水中的浓度
海水 卤水 鱿鱼 带鱼 干紫菜 干海带
Cl-的浓度 0.06mg/L 6mg/L 0.56mg/Kg 1.84mg/Kg 18.2mg/Kg 816mg/Kg
总量大 浓度低
各物质中碘的含量
海带就是著名的采碘能手,一般干海带中含碘量可达0.3%~0.5%,有的甚至高达1%约是海水中碘浓度的10万倍,因此从海带中提取碘是目前工业上获取碘的重要途径。
项目一:寻找提取碘原料
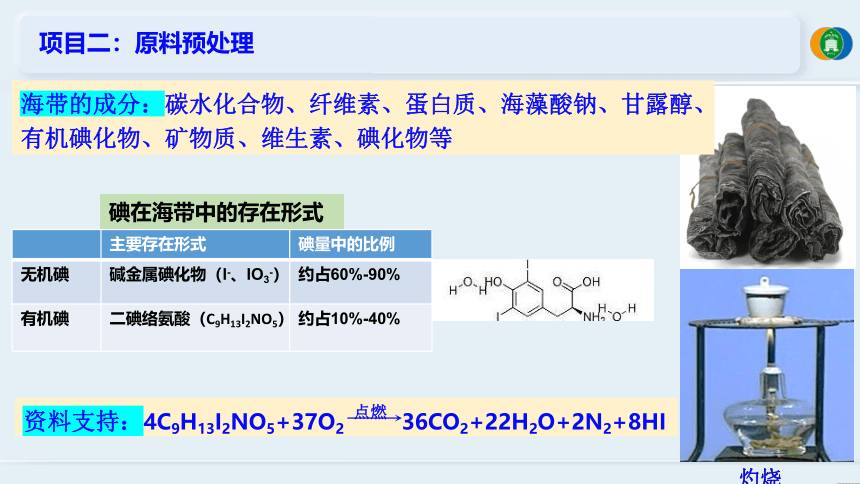
海带的成分:碳水化合物、纤维素、蛋白质、海藻酸钠、甘露醇、有机碘化物、矿物质、维生素、碘化物等
项目二:原料预处理
主要存在形式 碘量中的比例
无机碘 碱金属碘化物(I-、IO3-) 约占60%-90%
有机碘 二碘络氨酸(C9H13I2NO5) 约占10%-40%
碘在海带中的存在形式
资料支持:4C9H13I2NO5+37O2 36CO2+22H2O+2N2+8HI
点燃
灼烧
项目二:原料预处理
思考:请用流程图的形式设计实验方案,海带灰 含I2的溶液
海带灰
试剂
操作
物质
含I2的溶液
……
试剂
操作
试剂
操作
I2的水溶液
干海带
酒精浸泡
灼烧
溶解煮沸
过滤
含I-的溶液
氧化剂
海带灰
实验方案设计
项目三:物质的转化
I-
氧化剂
I2
思考:如何选择氧化剂将碘离子转化为碘单质?
常用氧化剂 价格(元/吨) 氧化原理/氧化性强弱
Cl2 600 Cl2+2KI=I2+2KCl(少量氯气)
5Cl2+I2+6H2O=2HIO3+10HCl(过量氯气)
酸性KMnO4 34000 氧化性:KMnO4(H+)>Cl2>H2O2
H2O2 3500 H2O2+2KI+H2SO4=I2+K2SO4+2H2O
资料支持: 氧化剂的选择
稀H2SO4(3mol/L,10滴)
15%H2O2(2mL)
实验方案设计
项目三:物质的转化
思考:能否将碘水直接蒸干得到单质碘?如果不能,怎么将碘水浓度进一步提高?
思考:如何检验氧化后的溶液中含有I2?
I2的水溶液
干海带
酒精浸泡
灼烧
溶解煮沸
过滤
含I-的溶液
海带灰
稀H2SO4(3mol/L,10滴)
15%H2O2(2mL)
实验方案设计
项目三:物质的转化
I2的水溶液
干海带
酒精浸泡
灼烧
溶解煮沸
过滤
含I-的溶液
海带灰
加入CCl4
萃取分液
I2的CCl4溶液
注意事项
①振荡时,要不时的旋开活塞放气,以防止分液漏斗内压强过大引起危险
②分液时,要将漏斗下端管口紧贴烧杯内壁,使液体顺利流下
③下层液体要从下口放出,恰好流尽时及时关闭活塞,防止上层液体流出
④上层液体要从上口倒出,保证上层液体尽量少地沾附下层液体
实验操作
稀H2SO4(3mol/L,10滴)
15%H2O2(2mL)
I2的
水溶液
含I-
的溶液(20mL)
加入CCl4(10mL)
萃取分液
I2的
CCl4溶液
项目三:物质的转化
资料支持:1.四氯化碳的沸点76.7℃,碘的沸点184.4℃。
2.蒸馏:分离沸点不同的液态混合物。
项目四:物质的分离提纯
思考:如何从四氯化碳的溶液中分离出I2?
蒸馏烧瓶
蒸馏法淡化海水
查阅资料:单质碘45℃左右开始升华,77℃几乎完全升华
资料支持:1.四氯化碳的沸点76.7℃,碘的沸点184.4℃。
2.蒸馏:分离沸点不同的液态混合物。
项目四:物质的分离提纯
思考:如何从四氯化碳的溶液中分离出I2?
蒸馏烧瓶
查阅资料:单质碘45℃左右开始升华,77℃几乎完全升华
改进优化:
1.寻找低沸点萃取剂,如乙醚34.6℃
2.减压蒸馏(10-15mmHg 30℃)
3.反萃取
在仔细分析《肘后备急方》中将青蒿“绞汁”用药的经验,悟及可能青蒿中的有效成分忌高温或酶解等性质,改用沸点比乙醇低的乙醚提取,经多次实验,才最终分离获得对鼠疟原虫的抑制率为的100%样品
2015年诺贝尔奖获得者屠呦呦
项目四:物质的分离提纯
实验改进优化
加入浓NaOH溶液
反萃取
I2的CCl4溶液
45%H2SO4
过滤
水层
I2
反萃取法:利用化学转化法使被萃取物重新富集在水中的方法。
6NaOH+3I2=5NaI+NaIO3+3H2O
5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+3H2O
稀H2SO4(3mol/L,10滴)
15%H2O2(2mL)
I2的水溶液
干海带
酒精浸泡
灼烧
溶解煮沸
过滤
含I-的溶液
海带灰
加入CCl4
萃取分液
I2的CCl4溶液
项目四:物质的分离提纯
含碘原料液的富集转化方法主要有氧化还原法、空气吹出法、离子交换法、活性炭吸附法、溶剂萃取法、浮选法和液膜法等,方法各有优劣,其中空气吹出法和离子交换法是当今使用最为广泛的技术。
【思维模型】 自然资源 产品
自然
资源
原料预处理
灼烧、浸取、过滤
中间产物
物质转化
试剂的选择
目标产物
分离提纯
富集 萃取分液 反萃取 蒸馏
产品
体现化学学科价值
发展化学学科思维
科学探究与创新意识
元素周期律 功能价值
谢 谢!
鲁科版必修第二册
第1章 原子结构 元素周期律
微项目 海带提碘与海水提溴
——体验元素性质递变规律的实际应用
有关海水组成的惊人数字
海水中元素种类
常量元素(>1mg/L)
进入海洋的物质/年
溶解的盐类物质总量
氯(Cl)元素总量
氡(Rn)元素总量
锂(Li)元素总量
碘(I)元素总量
铀(U)元素总量
镁(Mg)元素总量
80多种
11种
2.5×1010t
5×1017t
2.6×1016t
<1kg
2.5×1011t
9.3×1010t
4.5×109t
2×1015t
自然界中碘的分布
5亿亿吨
930亿吨
我们身边的碘
碘的用途
医药、化工、国防科技等领域。2021年,碘动力航天器首次完成在轨测试
元素 氯 溴 碘
总量 26000万亿吨 95万亿吨 930亿吨
元素 氯 溴 碘
总量 19.10g/kg 67mg/L 0.06mg/L
海洋中的总量
海水中的浓度
海水 卤水 鱿鱼 带鱼 干紫菜 干海带
Cl-的浓度 0.06mg/L 6mg/L 0.56mg/Kg 1.84mg/Kg 18.2mg/Kg 816mg/Kg
总量大 浓度低
各物质中碘的含量
海带就是著名的采碘能手,一般干海带中含碘量可达0.3%~0.5%,有的甚至高达1%约是海水中碘浓度的10万倍,因此从海带中提取碘是目前工业上获取碘的重要途径。
项目一:寻找提取碘原料
海带的成分:碳水化合物、纤维素、蛋白质、海藻酸钠、甘露醇、有机碘化物、矿物质、维生素、碘化物等
项目二:原料预处理
主要存在形式 碘量中的比例
无机碘 碱金属碘化物(I-、IO3-) 约占60%-90%
有机碘 二碘络氨酸(C9H13I2NO5) 约占10%-40%
碘在海带中的存在形式
资料支持:4C9H13I2NO5+37O2 36CO2+22H2O+2N2+8HI
点燃
灼烧
项目二:原料预处理
思考:请用流程图的形式设计实验方案,海带灰 含I2的溶液
海带灰
试剂
操作
物质
含I2的溶液
……
试剂
操作
试剂
操作
I2的水溶液
干海带
酒精浸泡
灼烧
溶解煮沸
过滤
含I-的溶液
氧化剂
海带灰
实验方案设计
项目三:物质的转化
I-
氧化剂
I2
思考:如何选择氧化剂将碘离子转化为碘单质?
常用氧化剂 价格(元/吨) 氧化原理/氧化性强弱
Cl2 600 Cl2+2KI=I2+2KCl(少量氯气)
5Cl2+I2+6H2O=2HIO3+10HCl(过量氯气)
酸性KMnO4 34000 氧化性:KMnO4(H+)>Cl2>H2O2
H2O2 3500 H2O2+2KI+H2SO4=I2+K2SO4+2H2O
资料支持: 氧化剂的选择
稀H2SO4(3mol/L,10滴)
15%H2O2(2mL)
实验方案设计
项目三:物质的转化
思考:能否将碘水直接蒸干得到单质碘?如果不能,怎么将碘水浓度进一步提高?
思考:如何检验氧化后的溶液中含有I2?
I2的水溶液
干海带
酒精浸泡
灼烧
溶解煮沸
过滤
含I-的溶液
海带灰
稀H2SO4(3mol/L,10滴)
15%H2O2(2mL)
实验方案设计
项目三:物质的转化
I2的水溶液
干海带
酒精浸泡
灼烧
溶解煮沸
过滤
含I-的溶液
海带灰
加入CCl4
萃取分液
I2的CCl4溶液
注意事项
①振荡时,要不时的旋开活塞放气,以防止分液漏斗内压强过大引起危险
②分液时,要将漏斗下端管口紧贴烧杯内壁,使液体顺利流下
③下层液体要从下口放出,恰好流尽时及时关闭活塞,防止上层液体流出
④上层液体要从上口倒出,保证上层液体尽量少地沾附下层液体
实验操作
稀H2SO4(3mol/L,10滴)
15%H2O2(2mL)
I2的
水溶液
含I-
的溶液(20mL)
加入CCl4(10mL)
萃取分液
I2的
CCl4溶液
项目三:物质的转化
资料支持:1.四氯化碳的沸点76.7℃,碘的沸点184.4℃。
2.蒸馏:分离沸点不同的液态混合物。
项目四:物质的分离提纯
思考:如何从四氯化碳的溶液中分离出I2?
蒸馏烧瓶
蒸馏法淡化海水
查阅资料:单质碘45℃左右开始升华,77℃几乎完全升华
资料支持:1.四氯化碳的沸点76.7℃,碘的沸点184.4℃。
2.蒸馏:分离沸点不同的液态混合物。
项目四:物质的分离提纯
思考:如何从四氯化碳的溶液中分离出I2?
蒸馏烧瓶
查阅资料:单质碘45℃左右开始升华,77℃几乎完全升华
改进优化:
1.寻找低沸点萃取剂,如乙醚34.6℃
2.减压蒸馏(10-15mmHg 30℃)
3.反萃取
在仔细分析《肘后备急方》中将青蒿“绞汁”用药的经验,悟及可能青蒿中的有效成分忌高温或酶解等性质,改用沸点比乙醇低的乙醚提取,经多次实验,才最终分离获得对鼠疟原虫的抑制率为的100%样品
2015年诺贝尔奖获得者屠呦呦
项目四:物质的分离提纯
实验改进优化
加入浓NaOH溶液
反萃取
I2的CCl4溶液
45%H2SO4
过滤
水层
I2
反萃取法:利用化学转化法使被萃取物重新富集在水中的方法。
6NaOH+3I2=5NaI+NaIO3+3H2O
5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+3H2O
稀H2SO4(3mol/L,10滴)
15%H2O2(2mL)
I2的水溶液
干海带
酒精浸泡
灼烧
溶解煮沸
过滤
含I-的溶液
海带灰
加入CCl4
萃取分液
I2的CCl4溶液
项目四:物质的分离提纯
含碘原料液的富集转化方法主要有氧化还原法、空气吹出法、离子交换法、活性炭吸附法、溶剂萃取法、浮选法和液膜法等,方法各有优劣,其中空气吹出法和离子交换法是当今使用最为广泛的技术。
【思维模型】 自然资源 产品
自然
资源
原料预处理
灼烧、浸取、过滤
中间产物
物质转化
试剂的选择
目标产物
分离提纯
富集 萃取分液 反萃取 蒸馏
产品
体现化学学科价值
发展化学学科思维
科学探究与创新意识
元素周期律 功能价值
谢 谢!
